1. Introducción
La industria curtidora se encarga de transformar la piel de animales, ya sea bovinos, ovinos y porcinos, en cuero terminado (Padilla-Rizo et al., 2018). El proceso de curtido de la piel incluye, de forma general, las etapas de: 1) ribera, donde se recibe la piel verde salada o en sangre, se hidrata, se quita el pelo y la endodermis y se eliminan impurezas presentes; 2) el curtido, se encarga de estabilizar el colágeno de la piel, utilizando agentes curtientes vegetales (taninos) o minerales (sales de cromo o aluminio); 3) el postcurtido proporciona suavidad, elasticidad, llenura y cuerpo al cuero y, 4) el acabado imparte las características específicas al producto final como color, grabado o brillo (Instituto Nacional de Ecología (INE), 1999). Durante estos procesos se genera una cantidad considerable de residuos, los cuales están clasificados como peligrosos (Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT), 2006; INE, 1999).En promedio, cada tonelada de piel cruda produce entre 200 a 300 kg de cuero acabado y el resto son residuos sólidos, ricos en proteínas como queratina, colágeno y elástica (INE, 1999; Padilla-Rizo et al., 2018; Sundar, Gnanamani, Muralidharan, Chandrababu & Mandal, 2011). Lamentablemente, la mayoría de estos subproductos, entre los que se encuentra el pelo residual, se aprovechan poco y, generalmente, tienen como disposición final, el relleno sanitario. Esto causa diversas afectaciones ambientales. Así mismo, genera un costo económico a las empresas curtidoras, para su debida disposición final. Derivado de ello, es necesario implementar acciones que coadyuven a mejorar la gestión ambiental de dichos subproductos, ya sea reduciendo la fuente que los origina, reutilizándolos en el proceso mismo u otra actividad, o reciclándolos para generar nuevos productos (Padilla-Rizo et al., 2018).
2. Marco teórico
Tanto el pelo (animal o humano), como otros residuos industriales similares, como las plumas de aves, cuernos, picos de aves, pezuñas y lana de oveja, son ricos en queratina (Bautista-Díaz, 2016). Esta proteína de tipo fibroso, está formada por aminoácidos unidos mediante enlaces peptídicos, lo cual genera un alto grado de entrecruzamiento por puentes disulfuro y le confiere gran estabilidad térmica, alta resistencia y baja solubilidad en la mayoría de los solventes (Brebu y Spiridon, 2011; Galarza, Garro, Cavello, Hours & Cantera, 2007; Horvath, 2009). Estas propiedades hacen atrayentes a las materias primas ricas en queratina, para diversas aplicaciones industriales. Algunos estudios realizados destacan su aplicación en el campo de elaboración de materiales compuestos (Chojnacka, Górecka, Michalak & Górecki, 2011; Song, Lee, Al-Mijan & Song , 2014; Sánchez-Olivares et al., 2017); cosmética (Bayramoglu, Yorgancioglu, Yeldiyar & Onem, 2014; Sundar et al., 2011); medicina (Zhang et al., 2015); fertilizantes y composta (Barrena, Pagans, Artola, Vázquez & Sánchez, 2007; Chojnacka et al., 2011, Sundar et al., 2011); producción de enzimas industriales (Galarza et al., 2007; Vázquez, Aguilera, Prado-Barragán & Aguilar, 2008) y, en años más recientes, en alimentos para animales (Chojnacka et al., 2011; Coward-Kelly, Agbogbo y Holtzapple, 2005; Sundar et al., 2011). Su inclusión, en este último sector, se ha ido dando paulatinamente, como resultado de la búsqueda de nuevas fuentes proteicas y de menor costo, que coadyuven a solventar los requerimientos nutritivos necesarios para la alimentación, principalmente, de los animales de crianza, las fuentes más demandadas por la población (González, Romero, Valdivié & Ponce, 2014).
Según lo reportado por Brebu y Spiridon (2011) y Horvath (2009), el pelo animal puede contener entre 65-95 % de proteína. Esto lo hace comparable a otras fuentes proteicas comerciales de origen animal, como la harina de plumas de ave, harina de pescado o harina de sangre, que pueden contener entre 60-90 % de proteína ( et al., 2009; Fundación Española para el Desarrollo de la Nutrición Animal (FEDNA), 2018; Wiltafsky et al., 2016). Además, su alto valor proteico es superior al valor de algunas proteínas vegetales como la harina de soya, la harina de canola o la harina de girasol (31-44 %) y otros insumos vegetales como el maíz, trigo, arroz, mijo o avena (5-18 %) (Rostagno et al., 2017; Wiltafsky et al., 2016), los cuales son algunos de los insumos más utilizados dentro de la alimentación animal. Esto permite entrever el pelo bovino como una posible fuente de nutrientes (proteína/aminoácidos), que puede recuperarse, transformarse y ser utilizada para alimentación animal.
En este contexto, la mayoría de los estudios realizados para obtención de concentrados proteicos son a partir de plumas de aves (Bautista-Díaz, 2016; Chojnacka et al., 2011; Karthikeyan, Balaji & Shegal, 2007). En ellos, reportan procesos que consisten en: lavado de las plumas, hidrolizar parcialmente las plumas con una soluciónalcalina (NaOH; KOH; 70-80°C; 0.1-0.3 M, ajuste a pH 9) o térmicamente con agua/vapor, 100-150 °C, 1.5-4.0 atm, 60-90 min; después se pulverizan mecánicamente y se procede a una proteólisis enzimática a 40-60°C/ pH 7.5-9/4-12 h y, opcionalmente, se puede adicionar peróxido de hidrógenopara eliminar los sulfuros, decolorar con carbón activado, concentrar, fraccionar o secar, dependiendo del tipo de plumas de ave utilizadas (Bautista-Díaz, 2016).
Respecto al pelo animal, en España, Esteban, García, Ramos y Márquez (2010), hidrolizaron pelo porcino con agua vía subcrítica. Mientras que, en Estados Unidos, Coward-Kelly et al., (2005), hidrolizaron pelo de vaca con Ca (OH)2 a 100 °C. Ambos, para obtención de aminoácidos en medio acuoso.
Bayramoglu et al., (2014), en Turquía, obtuvieron una emulsión rica en queratina y caléndula, a partir de pelo de cabras domésticas. Para ello, el pelo fue lavado con NaOH 0.5 M e hidrolizado con H2O2; después fue filtrado y la queratina fue precipitada con HCl 0.5 M, secada a 45°C por 2 días y pulverizada.
Derivado de la poca información reportada en la bibliografía sobre la valorización de este residuo como potencial insumo rico en nutrientes para alimentación animal, este trabajo investigó la composición química, nutrimental y toxicológica del pelo bovino residual en su forma cruda e hidrolizado hidrotérmicamente, como propuesta para su reciclado.
3. Metodología
3.1 Reactivos
Todos los reactivos utilizados fueron grado analítico. Agua desionizada 18.2 MΩ-cm (Elix). Hexano (cas:110-54-3), acetona (cas:67-64-1), hidróxido de sodio (cas:1310-73-2), éter de petróleo (cas:8032-32-4) y peróxido de hidrógeno (7722-84-1), de Karal. Pepsina de mucosa gástrica bovina (cas:9001-75-6), albúmina sérica bovina (cas:9048-46-8), agar triptona extracto de levadura (17221), ácido nítrico (cas:7697-37-2), ácido clorhídrico (cas:7647-01-0), ácido sulfúrico (7664-93-9), fosfato de sodio dibásico (cas:7558-79-4), pentaóxido de vanadio (cas:1314-62-1), metanol (cas: 67-56-1), etanol (64-17-5), trietilamina (cas:121-44-8) y acetonitrilo (75-05-8), de Sigma-Aldrich. Caldo lactosado (B02-155-06, Britania). Caldo tetrationato (BX-211683) y agar hierro triple azúcar (BX-211400), de Bioxon. Caldo urea (51463), tierra diatomácea (91053-39-3), caldo selenito cistina (107709), agar xilosa lisina desoxicolato (105287), agar verde brillante (70134) y agar sulfito de bismuto (95388), de Merck. Antisuero polivalente somático (Microkit). Kit de L-aminoácidos, estándar certificado, con mezcla de 17 aminoácidos en HCl 0.1 mol/L (79248, Supelco). Helio y argón ultrapuros (Praxair).
3.2 Preparación de la muestra
El pelo bovino residual fue recolectado en una curtiduría en León, Guanajuato, México; donde curten pieles bovinas, mediante el curtido al cromo. Posteriormente, fue lavado con agua de grifo (60 °C, 3 min), secado (40 °C), molido (con licuadora marca KitchenAid,1.5 HP) y tamizado a un tamaño de partícula menor 0.84 mm.
3.3 Hidrólisis hidrotérmica
El tratamiento hidrotérmico aplicado se hizo con base en lo reportado por Fernández (2014), con ligeras modificaciones y consistió en pesar 50 g de muestra de pelo bovino residual en frascos de 250 ml, agregar 50 ml de agua destilada, cerrar los frascos y colocar en una autoclave marca LabTech Modelo LAC-5060 SD a 130 °C y 2.0 atm durante 90 min. Después fue prensado de forma manual y secado a 40 °C, durante dos días. Posteriormente, el pelo bovino crudo e hidrolizado fue caracterizado en diferentes parámetros: fisicoquímicos, nutrimentales y toxicológicos.A la par, una muestra de pelo bovino natural (sin tratamiento de hidrólisis) fue analizada para su comparación.
3.4 Caracterización física
Con la finalidad de observar los cambios ocurridos en la estructura de la fibra (cutícula) del pelo bovino residual recolectado y evaluar su diámetro, una muestra de pelo bovino natural y otra de pelo bovino residual (previamente lavados) fueron cortadas en trozos pequeños de 2 mm de longitud. Después, se colocaron en un microscopio triocular modelo LX400, con óptica corregida al infinito y plana de la imagen, con el objetivo plano cromático 40x/0.65 retráctil y cámara modelo iVu 1500 Digital Camera Module.
3.5 Análisis termogravimétrico
La estabilidad térmica fue determinada mediante análisis termogravimétrico (TGA), midiendo la cantidad y rapidez del cambio en peso en el pelo analizado, en función de la temperatura, en una atmósfera controlada de gas inerte. Esto permitió obtener información acerca de los efectos de la temperatura sobre algunas propiedades físicas del pelo bovino. El análisis se realizó en un equipo TGA Q500 V6.3 Build 189. Para ello, se pesaron 15.707 mg de pelo bovino crudo, los cuales fueron colocados en la charola del horno del equipo y se analizaron a una velocidad de calentamiento de 5 °C/min en un intervalo de temperatura de 30 a 700 °C, en una atmósfera inerte de nitrógeno.
3.6 Análisis de contenido elemental
La composición elemental fue determinada utilizando un analizador elemental, modelo Flash 2000 de Thermo Scientific. Para ello se pesaron 5 mg de pentaóxido de vanadio y 1 mg de muestra de pelo en cápsulas de estaño de 30 mm, entonces fueron cerradas y colocadas en el horno del equipo para su análisis. Las condiciones instrumentales de operación del equipo fueron las siguientes: temperatura del reactor de 950 °C y en el horno de 65 °C; tiempo de inyección de oxígeno de 5 s; presión de 250 kPa para el helio y 300 kPa para el oxígeno. El flujo de helio como gas de acarreo fue de 140 ml/min y el de oxígeno como gas de combustión de 250 ml/min, con un tiempo de corrida de 720 s. Para asegurar la calidad de los resultados, los análisis se hicieron por triplicado y como estándar de verificación se utilizó el aminoácido de metionina.
3.7 Análisis proximal
El análisis proximal fue realizado en los parámetros de interés, de acuerdo con la FAO (2011): la humedad fue determinada calentando a 103±2 °C durante 4 h; la materia seca se obtuvo por diferencia con el peso total de la muestra; el contenido de cenizafue evaluado por calcinación en mufla a 550±20 °C por 3 h; la proteína bruta se obtuvo mediante la determinación denitrógeno por el método Kjeldahl y multiplicado por el factor proteico de 6.25; el extracto etéreo fue evaluado mediante extracción soxhlet durante 4 h, para lo cual se utilizó éter de petróleo. Todos los análisis se realizaron por triplicado.La energía metabolizable fue calculada mediante el sistema Atwater.
3.8 Determinación de metales pesados y minerales
La determinación de metales pesados como plomo, cadmio, mercurio, arsénico y cromo, y algunos minerales como calcio, potasio, fósforo, cobre, hierro, magnesio, manganeso, selenio y zinc se realizó de la siguiente manera:se pesaron 300 mg de las muestras de pelo en viales de vidrio de 15 ml, se añadieron 3 ml de ácido nítrico concentrado y 500 ml de peróxido de hidrógeno y se dejaron en digestión a 105 °C por 4 horas. Después se filtraron en papel Whatman No. 41 y se ajustaron a 25 ml con agua desionizada. Una alícuota fue diluida adecuadamente y analizada utilizando un espectrómetro de emisión atómica acoplado inductivamente a plasma (ICP-AES) marca Thermo Scientific, Mod. iCAP 6500 a las longitudes de onda adecuada para cada elemento. Para asegurar la calidad de los resultados, en este análisis, se utilizó la solución multielemental QCS-19 ICP 19 Element Quality Standard que contiene Sb, As, Be, Cd, Ca, Cr, Co, Fe, Pb, Mg, Mn, Mo, Ni, Se, Ti, V y Zn en una concentración de 100 µg/ml a la dilución adecuada (EPA, 2007). Todos los análisis se realizaron por triplicado.
3.9 Análisis microbiológico
El análisis microbiológico se realizó de acuerdo con lo reportado por la FDA (2001) como una forma de evaluar la calidad microbiológica en el pelo bovino tanto en su forma cruda, como después de ser hidrolizado. Se evalúo el crecimiento de microorganismos mesófilos aerobios, mediante cuenta en placa, en agar triptona extracto de levadura, como medio de cultivo. Para ello, se pesaron 10 g de pelo (crudo e hidrolizado) en un recipiente estéril y se adicionaron 90 ml de agua desionizada. Seis diluciones decimales fueron realizadas a la muestra e inoculadas en cajas petri estériles. Después, se agregaron 15 ml del medio de cultivo preparado, se mezclaron adecuadamente hasta lograr una completa incorporación del inóculo en el medio y se dejaron solidificar. De forma seguida, las cajas petri se incubaron en posición invertida a 35±2 °C por 48±2 h utilizando una Incubadora New Brunswick Scientific, Classic Series. Finalmente, se procedió a la cuenta de colonias, en placas que contenían entre 25 a 250 UFC (unidades formadoras de colonias). Se reportó el número de colonias encontradas por dilución. Los análisis se realizaron por duplicado.
La detección de Salmonella spp se realizó de la siguiente manera: i) Preenriquecimiento, para ello, se mezclaron 25 g de muestra con 225 ml de caldo lactosado, se ajustó pH a 6.8, se agitó y se incubó por 24 ± 2 h a 35 °C. ii) Enriquecimiento selectivo: se tomó 1 ml de la mezcla anterior y se agregó a un tubo con 10 ml de caldo tetrationato; después, otro 1 ml de la mezcla se agregó a un tubo con 10 ml de caldo selenito cistina y se incubó por 24 h a 35 °C. iii) Selección en medios sólidos, se agitó el tubo con caldo selenito cistina y se estrió en agar xilosa lisina desoxicolato, agar verde brillante y una tercera caja con agar sulfito de bismuto. Se realizó el mismo procedimiento para el tubo con caldo tetrationato y se incubó a 35 °C por 24 ± 2 h. Después se procedió a la identificación de los cultivos de salmonella spp aplicando la serotipicación para eliminación de los cultivos falsos (FDA, 2001).
3.10 Digestibilidad en pepsina
La disponibilidad de nutrientes en el pelo bovino fue estimada evaluando su digestibilidad proteica in vitro en pepsina, de acuerdo con la FAO (2011), con modificaciones. Para ello, se pesó 1 g de cada muestra de pelo bovino, previamente desengrasada con acetona, en un frasco, al cual se le agregaron 150 ml de disolución de pepsina al 0.02 % en HCl 0.075 mol/l. El frasco fue colocado en una incubadora con agitación a 25 rpm y 45 °C por 16 h. Después, se filtró utilizando filtros de fibra de vidrio 934-AH y la parte no digerida, fue evaluada en el contenido de nitrógeno mediante el método Kjeldhal. Los análisis se realizaron por triplicado.
3.11 Evaluación del contenido de aminoácidos
El perfil de aminoácidos fue determinado mediante el procedimiento reportado por Bidlingmeyer, Cohen y Tarvin (1984) con modificaciones, el cual se basa en la formación de derivados feniltiocarbamil de los aminoácidos. Para ello, se pesó 1.0 g de pelo en viales de digestión de 15 ml, a los cuales se les añadió 3 ml de HCl 6 mol/l y se hidrolizaron a 150 °C por 1 hora en un digestor marca Hanna Instruments. Después, un volumen del hidrolizado (equivalente a 0.5 µg) fue secado al vacío utilizando un equipo marca Labcondo. Los estándares fueron preparados adecuadamente en agua o en HCl 0.1 mol/l a una concentración de 1.0 mg/ml. A continuación, a todas las muestras se les agregó un volumen de la solución etanol-agua-trietilamina (2:2:1), nuevamente se secaron al vacío y se derivatizaron con la solución etanol-trietilamina-agua-feniltiocarbamil (7:1:1:1) antes del análisis cromatográfico. La separación/detección se realizó en un cromatógrafo de líquidos de alta resolución marca Agilent Technologies modelo 1100 utilizando una columna Pico Tag Water (15 cm x 3.9 mm) con detección por UV a 254 nm y utilizando como fase móvil acetonitrilo:agua (60:40) a un flujo de 1.0 ml/min. Para asegurar la calidad de los resultados, se utilizó el estándar certificado de Sigma-Aldrich conteniendo 17 L-aminoácidos a una concentración de 2.5 mmol/l (excepto la cisteína a 1.25 mmol/l) en HCl 0.1 mol/l. Los análisis se realizaron por triplicado.
4. Resultados y discusión
La Figura 1 muestra las imágenes obtenidas en el microscopio para el pelo bovino natural crudo (PBNC) y el pelo bovino residual crudo (PBRC), recolectado en la tenería. Se puede observar un ligero daño ocasionado en la fibra (cutícula) de PBRC, tanto en la textura como en el color, con respecto a PBNC. Este daño es ocasionado cuando el pelo es retirado de la piel, en la etapa de ribera; ya que es práctica común utilizar químicos agresivos como sulfuro y sulfhidrato de sodio, cal y enzimas para retirar el pelo (INE, 1999).
Por otra parte, el diámetro estimado fue de 70-100 µm; estos valores son similares a lo reportado para cabello humano de 54-96 µm (Horvath, 2009; Popescu y Höcker, 2007) y de 16-80 µm para pelo de res (Sánchez-Olivares et al., 2017).

Figura 1 Imágenes obtenidas en el microscopio: (a) PBNC y (b) PBRC Figure 1. Images obtained under the microscope: (a) PBNC and (b) PBRC
Inicialmente, el PBRC recolectado en la tenería presentó grumos de pelo, grasa, sangre, agua residual (con pH 9-13), polvo y olor desagradable (Figura 2a). Con el acondicionamiento aplicado en la preparación de muestra, en la Figura 2b y 2c se pueden observar algunos de los cambios ocurridos. PBRC mejoró notablemente, algunas propiedades organolépticas como el olor y color; su textura fue más homogénea (tamaño de partícula <0.84 mm) y suave al tacto: renovó, de esta manera, su presentación física.

Figura 2 Imágenes del pelo (a) recolectado en la tenería, (b) lavado y (c) molido. Figure 2. Images of the hair (a) collected in the tannery, (b) washed, and (c) milled.
La estabilidad térmica del pelo bovino se puede observar en la Figura 3. Se aprecian tres pérdidas de masa: El primer cambio se presenta a una temperatura máxima (Tmáx) de 66.66 °C con una rapidez de pérdida de masa de 0.122 %/°C correspondiente al proceso de deshidratación (perdida de agua) y representa un valor de 8.086 % (1.270 mg). El segundo cambio se presenta a una Tmáx de 285.40 °C con una rapidez de pérdida de masa 0.487 %/°C, lo cual representa el proceso de descomposición del componente principal del pelo, es decir, la queratina, con un 52.44 % (8.236 mg) de pérdida de masa. El tercer cambio se observó a una Tmáx de 636.23 °C con una rapidez de pérdida de masa de 0.096 %/°C, con un 6.235 % (0.9794 mg), lo cual puede significar la oxidación de algunos de los componentes. Como residuo en este análisis, se consideró la materia inorgánica insoluble, con una cantidad de 4.318 mg que representa el 27.49 % de la masa inicial en el pelo bovino (15.7070 mg). La parte proporcional de 5.748 % (0.903 mg) corresponde a compuestos volatilizados durante el proceso de análisis y la cual fue calculada por diferencia de masa. Es observable que la queratina del pelo bovino presenta alta estabilidad térmica, pues empieza a degradarse a temperaturas mayores a los 170 °C. Comportamiento similar fue obtenido por Brebu y Spiridon (2011), quienes reportan temperaturas iniciales de descomposición para la queratina de 150 °C en pelo humano, 155 °C en plumas de aves y de 180 °C en lana. Sánchez-Olivares et al., (2017) reportan una temperatura cercana a 185 °C para pelo de res. Estas ligeras variaciones pueden deberse a las diferentes condiciones de análisis empleadas y al material analizado.
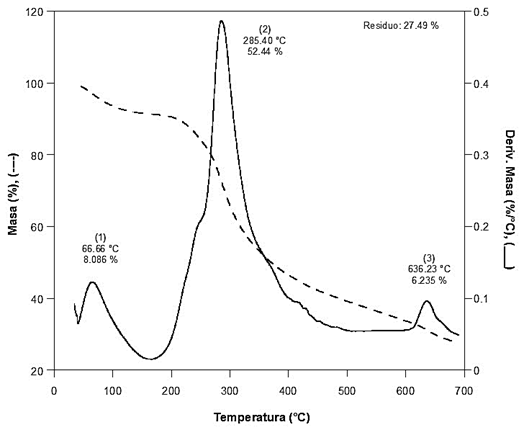
Figura 3 Termograma de TGA obtenido para el pelo bovino. Figure 3. TGA thermogram obtained for bovine hair.
En el Cuadro 1, se presentan los valores promedio obtenidos en la composición elemental para PBNC, PBRC y PBRH. Se puede observar poca variación en los parámetros evaluados entre PBRC y PBNC, lo cual da información sobre el daño sufrido por PBRC, cuando es retirado de la piel antes de que sea curtida y concuerda con lo mostrado en la Figura 1. La variación más notable se aprecia en el contenido de azufre, pues PBNC presenta un contenido de 3.79±0.12 %, con respecto a PBRC de 2.25±0.09 %. Este decremento se debe al rompimiento de algunos enlaces disulfuro, en la molécula de la queratina del pelo. Valores similares en el contenido de nitrógeno (11-15 %) han sido reportados para pelo bovino crudo (Brebu y Spiridion, 2011; Galarza et al., 2007; Sánchez-Olivares et al., 2017) y de 15.07 % en pelo porcino crudo (Esteban et al., 2010).Para cabello humano, valores entre 14-16 % de nitrógeno, 49-50 % de carbono, 5-7 % de hidrógeno, 3-5 % de azufre y 22-30 % de oxígeno (Brebu y Spiridion, 2011; Horvath, 2009; Popescu y Höcker, 2007) han sido reportados. Mientras que para otras fuentes de queratina, como las plumas de pollo crudas, Tesfaye, Sithole, Ramjugernath y Chunilall (2017) obtuvieron un contenido de nitrógeno, carbono, oxígeno y azufre de 10.41, 64.47, 22.34 y 2.64 %, respectivamente. Es importante recordar que tanto el pelo en humanos como en animales no es homogéneo y puede variar dependiendo de la fuente (Popescu & Hocker, 2007), es decir, de la raza, edad, crianza, lugar o alimentación, entre otros factores, lo cual puede afectar la composición de sus componentes.
Por otro parte, PBRH con el proceso hidrotérmico aplicado provoca un mayor rompimiento de diversos enlaces moleculares (azufre, hidrógeno o salinos). Esto genera una ligera disminución (2-11.1 %) en su contenido elemental, con respecto a lo obtenido en PBRC. Sin embargo, visto de otra manera, destruir algunos de los enlaces que brindan resistencia y estabilidad térmica a la queratina del pelo puede contribuir a mejorar la disponibilidad de sus nutrientes.
Cuadro 1. Composición elemental para el pelo bovino (en materia natural)
| Parámetro | Unidad | PBNC | PBRC | PBRH |
|---|---|---|---|---|
| Nitrógeno | % | 14.30 ± 0.31 | 14.12 ± 0.11 | 13.80 ± 0.61 |
| Carbono | % | 45.02 ± 0.33 | 47.35 ± 0.61 | 46.23 ± 1.18 |
| Hidrógeno | % | 6.43 ± 0.12 | 6.81 ± 0.52 | 6.28 ± 0.22 |
| Azufre | % | 3.79 ± 0.12 | 2.25 ± 0.09 | 2.00 ± 0.13 |
| Otros* (oxígeno + materia inorgánica) | % | 30.46 ± 0.93 | 29.39 ± 0.93 | 31.6 ± 1.08 |
*Estimado por diferencia.
El Cuadro 2 muestra los resultados obtenidos en la evaluación del análisis proximal, para PBNC, PBRC y PBRH, comparados con la harina de plumas de aves hidrolizada (HPAH). Se observa que los valores son muy similares entre sí, con muy ligeras variaciones. También se puede apreciar que, el componente mayoritario es el contenido de proteína bruta, la cual representa 87.5±1.2 % para PBNC y 87.3±2.5 % para PBRC. Estos valores son muy cercanos a lo reportado por Vázquez et al. (2008), de 87.8 % para pelo de cerdo crudo y Tesfaye et al., (2017) de 82.36 % en plumas de pollo crudas. En su forma hidrolizada, con el proceso propuesto, se obtuvo para PBRH un 85.2±2.5 % de proteína bruta. Este valor es comparable con otros insumos proteicos de queratina hidrolizados, como lo es la harina de plumas de ave, para la cual reportan valores de proteína bruta variables (74-85 %) ( et al., 2010; FEDNA, 2012; Rostagno et al., 2017; Wiltafsky et al., 2016).
Es importante evaluar este parámetro, pues conocer el contenido proteico de un insumo alimenticio provee información sobre la calidad del aporte nutrimental. Esto coadyuva a definir, si es un producto de alta o baja calidad, y de ello dependerá el posible valor agregado que puede adjudicársele, en comparación con otros productos proteicos. Actualmente, algunos insumos proteicos hidrolizados como las harinas de pescado, harinas de plumas de aves, harinas de carne y hueso o harina de soya presentan un contenido de proteína bruta de entre 45-85 % (FEDNA, 2012; Rostagno et al., 2017; Wiltafsky et al., 2016). Y es común encontrarlas, en el mercado comercial, con precios entre $150-600 USD por tonelada. El precio suele variar, pues depende de diversos factores como el tipo de harina, su presentación y contenido de proteína. Considerando esto, el PBRH obtenido en este trabajo podría competir con estos insumos proteicos y obtener un valor comercial similar, lo cual favorecía su reciclado y valorización.
Por otro lado, el contenido de humedad en el pelo bovino (crudo e hidrolizado) fue menor al 10 %. Esto representa una ventaja, pues este parámetro es un indicador para prolongar su vida de anaquel; ya que tiene implicaciones importantes para su procesamiento, almacenamiento y transportación, lo que evita su concerniente deterioro. Además, un contenido alto de humedad puede provocar interferencias en la calidad del producto final, incrementar su peso (y costo) o deteriorar el producto en menor tiempo, debido a la generación de microorganismos (Tesfaye et al., 2017). Valores similares fueron reportados por Vázquez et al., (2008) para pelo porcino de 3.2 %. Mientras que, Tesfaye et al., (2017) reportaron un 12.33 % para plumas de pollo cruda y en harina de plumas hidrolizadas, Rostagno et al., (2017) y FEDNA (2012) reportaron 8.20 y 6.8 %, respectivamente.
El contenido de extracto etéreo se refiere al contenido de grasa total presente en un tejido, que puede incluir los triglicéridos y otros lípidos como los ésteres, aldehídos, pigmentos, terpenos o esteroides (Tesfaye et al., 2017). El valor determinado en este parámetro fue muy similar entre las muestras de pelo bovino y HPAH, se observó en el intervalo de 4.3 a 5.2 %. Sin embargo, difieren con lo reportado por Vázquez et al. (2008) y Esteban et al. (2010) de 7.3 % y 0.85 % respectivamente, para pelo porcino. Tal diferencia puede deberse a la procedencia del pelo analizado y, así mismo, a la forma en que fue preparada la muestra.
El extracto libre de nitrógeno (ELN) se refiere al contenido de almidón y azúcares presentes en un alimento. Se pueden observar cantidades despreciables (0.17-0.29 %) en el pelo bovino. Esto es normal, pues al ser de origen animal, no contiene celulosa, hemicelulosa y lignina. Valores ligeramente mayores (1.02-1.34 %) fueron reportados para las plumas de aves (FEDNA, 2012; Rostagno et al., 2017; Tesfaye et al., 2017; Wiltafsky et al., 2016).
El contenido de ceniza en un alimento es el residuo inorgánico remanente después de ser incinerado. Aquí, podemos encontrar impurezas, sales y minerales presentes en el alimento. En este contexto, el valor obtenido para PBNC, PBRC y PBRH se encontró en el intervalo 2.09-2.20 %. Mientras que, para pelo porcino crudo, valores de 0.73-1.14 % (Esteban et al., 2010; Vázquez et al., 2008) y para harina de plumas de aves (cruda e hidrolizada), se reportan valores comprendidos entre 1.49-2.66 % (FEDNA, 2012; Rostagno et al., 2017; Tesfaye et al., 2017). Esto es bueno, pues según la FEDNA (2012), valores mayores a 3.4 %, serían indicativo de presencia de arena o adulterantes inorgánicos.
Cuadro 2. Composición química del pelo bovino (% en materia natural)
| Parámetro evaluado | Unidad | PBNC | PBRC | PBRH | HPAHa |
|---|---|---|---|---|---|
| Análisis proximal | . | . | . | . | |
| Materia seca (MS) | % | 94.25±1.2 | 93.75±1.4 | 92.47±2.5 | 91.8 |
| Humedad (H) | % | 5.75±0.1 | 6.25±0.2 | 7.53±0.2 | 8.20 |
| Proteína bruta (PB) | % | 87.5±1.2 | 86.7±3.1 | 85.2±2.5 | 83.1 |
| Extracto etéreo (EE) | % | 4.37±0.2 | 4.75±0.1 | 4.90±0.4 | 4.70 |
| Ceniza | % | 2.09±0.1 | 14±0.1 | 2.20±0.1 | 2.66 |
| Extracto libre de nitrógeno (ELN)* | % | 0.29±0.01 | 0.16±0.02 | 0.17±0.01 | 1.34 |
| Materia orgánica (MO)* | % | 92.2±2.80 | 91.6±2.5 | 90.3±5.2 | 89.1 |
| Energía metabolizable (EM)* | kcal/kg | 3 905±176 | 3902±182 | 3 856±193 | 3801 |
| Contenido de minerales | . | . | |||
| Calcio total | % | 0.43±0.020 | 0.45±0.020 | 0.46±0.002 | 0.33 |
| Potasio | % | 0.23±0.003 | 0.23±0.025 | 0.21±0.009 | 0.27 |
| Fósforo total | % | 0.27±0.032 | 0.33±0.029 | 0.32±0.036 | 0.47 |
| Magnesio | % | 0.05±0.002 | 0.07±0.018 | 0.06±0.003 | - |
| Manganeso | mg/kg | < 0.02 | < 0.02 | < 0.02 | - |
| Hierro | mg/kg | 174±0.35 | 185±0.39 | 184±33 | - |
| Cobre | mg/kg | 10.7±0.86 | 13.0±0.95 | 12.7±1.03 | - |
| Zinc | mg/kg | 19.6±0.92 | 18.6±0.52 | 18.3±0.87 | - |
| Selenio | mg/kg | < 0.10 | < 0.10 | < 0.10 | - |
| Cromo | mg/kg | No detectado | No detectado | No detectado | - |
| Metales pesados | |||||
| Mercurio, arsénico y cadmio | % | No detectados | No detectados | No detectados | - |
| Plomo | % | < 0.000 1 | < 0.000 1 | < 0.000 1 | - |
| Calidad microbiológica | |||||
| Microorganismos mesófilos aerobios | UFC/g | 880 000±57 200 | 550 000±48 000 | 160±8 | - |
| Digestibilidad en pepsina | % | 49.36±1.2 | 51.55±2.1 | 71.36±2.9 | - |
a Obtenidos de Rostagno et al. (2017).
*Valores estimados: ELN=100-(H+PC+EE+Ceniza); MO=MS-Ceniza; EM=(PB x 4)+(EE x 9)+(ELN x 4).
No se detectaron metales pesados, salvo el plomo en concentraciones menores 0.0001 %. Fue determinada la presencia de macro minerales como calcio, potasio, fósforo y magnesio (0.05 a 0.46 %) y micro minerales como hierro, cobre y zinc (< 200 mg/kg) (Cuadro 2). En este contexto, existe poca información reportada en la bibliografía sobre el contenido, tanto de minerales como de metales pesados para el pelo bovino, pues la mayoría de los trabajos hacen referencia al pelo humano, y reportan concentraciones traza para elementos como Ba, Ca, Cr, Cu, Fe, Mn, Ni, Pb, Ti y Zn (Horvath, 2009). Galarza et al. (2007) reportó 2-3 % de calcio y 1-2 % de sodio en pelo bovino. Para HPAH, Rostagno et al. (2017) reportaron 0.33, 0.27 y 0.47 %; FEDNA (2012), valores de 0.23, 0.20 y 0.60 % y Wiltafsky et al. (2016) de 0.40, 0.16, 0.29 %, para calcio, potasio y fósforo, respectivamente.
La calidad microbiológica evaluada en PBNC, PBRC y PBRH (Cuadro 2) muestra ausencia de salmonella spp. Así mismo, se aprecia una disminución significativa en el crecimiento de microorganismos. De 550 000±48 000 UFC observados inicialmente en PBRC, se redujo a sólo 160±8 UFC en PBRH. Esto es indicativo de que el proceso de hidrólisis hidrotérmico aplicado al pelo bovino coadyuva a esterilizarlo y mejorar su calidad microbiológica como producto final.
Por otro lado, al hidrolizar pelo bovino, la digestibilidad de la proteína mejora. En el Cuadro 2, se observa que PBNC presentó una digestibilidad in vitro (en pepsina-HCl) de 49.36±1.2 % y PBRC de 51.55±2.1 %. Sin embargo, al ser hidrolizado PBRC, la digestibilidad se incrementó un38.43 % (PBRH). De acuerdo con el informe de la FEDNA (2012), “niveles de digestibilidad en pepsina-HCl comprendidos entre 66 y 80 % se consideran adecuados, mientras que, valores inferiores a 65 % indican que la hidrólisis ha sido insuficiente”, lo cual puede ocasionar una menor biodisponibilidad de los nutrientes, para el organismo consumidor. Niveles por arriba del 80 % indican un procesado excesivo y pueden provocar la pérdida de algunos nutrientes.
Con respecto a la nutrición animal, la mayoría de las investigaciones coinciden en que los aminoácidos de importancia, en específico para aves y cerdos (FEDNA, 2012; Rostagno et al., 2017; Wiltafsky et al., 2016), son la lisina, metionina, treonina, valina, triptófano, isoleucina, arginina, glicina, serina, leucina, cisteína, histidina y fenilalanina. La alteración en el contenido de alguno de ellos puede repercutir en la calidad del insumo alimenticio y, de igual manera, en su costo al restarle valor agregado.
En este contexto, en el Cuadro 3 se presenta el perfil de aminoácidos totales para PBRC y lo obtenido para PBRH, con hidrólisis hidrotérmica (130°C, 2 atm, 90 min). Se puede observar que PBRH, a las condiciones de hidrólisis propuestas en este trabajo, conserva una distribución similar de aminoácidos con respecto a lo obtenido en PBRC. La recuperación lograda fue por arriba del90 % para la mayoría de los aminoácidos, excepto para el triptófano, el cual se destruye completamente y la histidina, que sólo se recuperó un 65.3 %. Se atisba un ligero incremento (1-10 %) para la leucina, isoleucina, fenilalanina, alanina, tirosina y glicina. Así mismo, el perfil de aminoácidos en PBRH es parecido a lo reportado por Rostagno et al. (2017) para HPAH, se diferencia en que ésta sí contiene el triptófano (0.66 %). La arginina, tirosina y prolina fueron más altas en PBRH (37-60 %), con respecto a HPAH. et al. (2010), por su parte, reportan concentraciones de lisina (2.13 %), arginina (5.41 %), metionina (0.58 %), treonina (3.68 %) y triptófano (0.67 %) en harina de plumas, utilizada para alimentación de pollos broiler, con inclusión en un 5 %.
Cuadro 3. Contenido total de aminoácidos en el pelo bovino (% en materia natural).
| Aminoácido | Unidad | PBRC | PBRH | HPAHa |
|---|---|---|---|---|
| Lisina | % | 3.01 ± 0.12 | 2.98 ± 0.10 | 2.45 |
| Metionina | % | 0.93 ± 0.02 | 0.87 ± 0.03 | 0.71 |
| Treonina | % | 5.84 ± 0.20 | 5.64 ± 0.22 | 3.79 |
| Triptófano | % | - | - | 0.66 |
| Arginina | % | 7.02 ± 0.23 | 7.73 ± 0.25 | 5.62 |
| Valina | % | 5.13 ± 0.46 | 4.83 ± 0.16 | 5.86 |
| Isoleucina | % | 4.37 ± 0.11 | 4.45 ± 0.17 | 3.61 |
| Leucina | % | 5.28 ± 0.17 | 5.40 ± 0.17 | 6.95 |
| Histidina | % | 2.13 ± 0.08 | 1.39 ± 0.05 | 1.16 |
| Fenilalanina | % | 4.26 ± 0.11 | 4.45 ± 0.14 | 3.96 |
| Alanina | % | 2.76 ± 0.05 | 2.80 ± 0.06 | 4.33 |
| Cisteína | % | 2.29 ± 0.09 | 2.24 ± 0.08 | 3.92 |
| Tirosina | % | 5.98 ± 0.19 | 6.31 ± 0.29 | 2.50 |
| Glicina | % | 4.49 ± 0.28 | 4.52 ± 0.18 | 6.69 |
| Serina | % | 7.28 ± 0.94 | 6.68 ± 0.24 | 9.37 |
| Prolina | % | 11.4 ± 0.85 | 11.2 ± 0.42 | 7.12 |
| Ácidoglutámico | % | 5.18 ± 0.21 | 4.90 ± 0.21 | 5.74 |
| Ácido aspártico | % | 3.87 ± 0.31 | 3.74 ± 0.15 | 3.76 |
a Reportado por Rostagno et al. (2017) para harina de plumas hidrolizada.
Por otra parte, comparando con lo obtenido por Esteban et al. (2010), existen diferencias significativas con respecto al PBRH. En primera instancia, obtuvieron un hidrolizado acuoso, mediante la hidrólisis de pelo porcino vía subcrítica (200-300 °C, 15-360 min). El producto final presentó una notoria variabilidad en el perfil de aminoácidos y recuperaciones menores al 60 %. Pérdidas significativas (> 95 %) para la treonina, serina, ácido aspártico y ácido glutámico, con respecto a su forma cruda. De forma similar, Coward-Kelly et al. (2005) consiguieron un producto soluble, deficiente en aminoácidos esenciales para animales domésticos monogástricos, al hidrolizar pelo de vaca, en medio alcalino.
Esto nos lleva a considerar la importancia en la selección del método y las condiciones de procesado (hidrólisis) para cualquier insumo alimenticio, ya que puede afectar positiva o negativamente el contenido de los nutrientes en el producto final.
5. Conclusiones
Este trabajo provee información sobre la composición física, química, toxicológica y nutricional del pelo bovino en su forma cruda e hidrolizada hidrotérmicamente. La información obtenida muestra que el acondicionamiento del pelo bovino residual fue una parte fundamental para mejorar su presentación física en algunos parámetros organolépticos. Por otro lado, algunas ventajas que aportó el proceso de hidrólisis hidrotérmico empleado fueron: es poco agresivo, lo cual permitió una recuperación de nutrientes (proteína/aminoácidos) mayor al 90 % y coadyuvó a incrementar su digestibilidad proteica en pepsina un 38.4 %, con respecto a su forma cruda. Así mismo, la inocuidad en el producto final (pelo bovino hidrolizado) fue observada, por la ausencia de metales pesados, salmonella spp y microorganismos mesófilos aerobios. Con base en esta información, el pelo bovino residual puede ser reciclado en las condiciones propuestas, para su transformación en un producto alimenticio alternativo, que provee nutrientes esenciales (proteína/aminoácidos), para la alimentación animal.
6. Ética y conflicto de intereses
Las personas autoras declaran que han cumplido totalmente con todos los requisitos éticos y legales pertinentes, tanto durante el estudio como en la producción del manuscrito. Que no hay conflictos de intereses de ningún tipo. Que todas las fuentes financieras se mencionan completa y claramente en la sección de agradecimientos y que están totalmente de acuerdo con la versión final editada del artículo.












 uBio
uBio 


