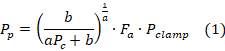INTRODUCCIÓN
El estrés fisiológico en plantas es la respuesta a la exposición de condiciones adversas que alteran el desarrollo de la planta, tales como variaciones de temperatura, presión atmosférica, régimen hídrico, salinidad o una combinación de los factores anteriores (Valverde y Arias, 2020). Estos pueden generar daños temporales o permanentes en el organismo: afectan el crecimiento, procesos reproductivos y sobrevivencia de la planta (Beyer et al., 2014; Paulus et al., 2014). En el caso específico del estrés hídrico, generalmente se refiere al déficit de agua por periodos prolongados (Gautier et al., 2000), aspecto que genera una reacción inmediata en la planta: reducción de la tasa de crecimiento producto de la reducción del volumen celular y aumento de solutos orgánicos que inciden en daños mecánicos en la planta (Farooq et al., 2009; Moreno, 2009). Además, combinado con un desbalance entre la transpiración y absorción de agua, se generan daños físicos en el organismo (Ortuño et al., 2006; Varone et al., 2012).
El estrés hídrico puede generar tres niveles de afectación al desarrollo de la planta, según mencionan Ma et al. (2014); Boogar & Salehi (2020) y Chen et al. (2020): i) mínimo, se genera pérdida de turgencia celular, reducción de la tasa de expansión celular, disminución de la síntesis de pared celular y limitaciones en la síntesis de proteínas; ii) moderado, incide en aumentos del ácido abscísico (ABA) y cierre estomático parcial o total; y iii) máximo, en el que la planta produce cavitación de los elementos del xilema, caída de la hoja, acumulación de solutos orgánicos, hasta llegar al punto de marchitez de la planta. Conforme el periodo de exposición de estrés se aumente, la afectación a la planta se incrementa. Estudios desarrollados por Miyazawa et al. (2014) mencionan que los daños en los procesos fisiológicos de especies tropicales pueden ser permanentes, si la exposición a estrés hídrico es prolongada, y afectar la turgencia foliar, traspiración y capacidad fotosintética de forma permanente.
Estudios desarrollados por Kaya et al. (2019) han determinado que periodos intermedios de sequía pueden generar daños en los procesos de fotosíntesis de las plantas, específicamente en el fotosistema II (PSII); en exposiciones cortas el daño puede ser temporal con reducción en la capacidad de fotosíntesis y genera problemas de adaptabilidad lumínica por parte de la planta. Con periodos de estrés hídrico prolongados, la afectación puede ser permanente, con incapacidad en desarrollo optimizado de la fotosíntesis e ineficiencia en los productos de los procesos de fotosíntesis, debido a procesos de fotooxidación y fotoinhibición que evitan que la planta desarrolle fotosíntesis en condiciones de déficit hídrico; esto, como estrategia de prevención de pérdida de turgencia foliar (Jiménez et al., 2010; Wakamori et al., 2020).
En conjunto con la variación de la capacidad fotosintética de las plantas, el estrés genera cambios en la reflectancia y fluorescencia de las plantas (Díaz-Barradas et al., 2020). Producto de la afectación del PSII, se dan procesos de oxidación de moléculas de clorofila, lo cual genera que las plantas estresadas reduzcan sus concentraciones de clorofila y, con ello, la capacidad fotosintética disminuya ( Di Vaio et al., 2013; Ortuño et al., 2006). Además, el estrés genera el incremento en la actividad del ciclo de las xantofilas, el cual consiste en una disminución de grupos epoxi de las xantofilas de las plantas y formación de grupos del carotenoides que inciden en la coloración amarillenta de las hojas. El incremento del ciclo de las xantofilas es una evidencia de daños moderados del PSII y de la conservación de energía por parte de la planta (Holst et al., 2004), esto se evidencia en cambios en la reflectancia entre los 500 y 600 nm (Fournier & Andrieu, 1998). A nivel de fluorescencia se generan cambios susceptibles en los indicadores de clorofila a, debido al incremento de las concentraciones de zeaxantina (Sánchez-Costa et al., 2015).
Otro de los efectos del estrés hídrico en las plantas se denota en la hidráulica foliar; estudios desarrollados por Valverde y Arias (2020), con especies tropicales, han determinado que el estrés hídrico genera pérdidas de turgencia foliar entre el 10 y 15 %, aspecto que incide en que el equilibrio entre la transpiración y absorción de agua de la planta se vea afectado y, por ende, la planta deba reducir la traspiración con cierre de estomas como medida de conservación hídrica, lo cual genera que la turgencia foliar se vea disminuida como mecanismo de reducción a la formación de embolismo en el tallo. Según Huzsvai & Rajkai (2009), en especies tropicales es muy común, debido a la poca variabilidad de la temperatura en el año y periodos secos definidos en varias regiones del trópico, además repercute en que muchas especies reduzcan al máximo la turgencia con caída de hojas como mecanismo de preservación hídrica.
En el caso específico de Gmelina arborea Roxb, es una especie arbórea originaria del sureste asiático, se caracteriza por tener una alta tasa de crecimiento, adaptabilidad de suelos arcillosos, con deficiencias nutricionales menores y con buen sistema de drenaje (Tenorio et al., 2016). Es una especie ampliamente reforestada en Costa Rica, debido a su facilidad de adaptación a condiciones de plantaciones mixtas o puras (Adekunle et al., 2011) y su madera presenta excelentes propiedades físicas y mecánicas, lo cual permite que sea ampliamente utilizada en sectores como la construcción, mueblería y tarimas (Moya et al., 2017). El proceso de establecimiento de plantaciones de G. arborea es una de las etapas de mayor relevancia para el cultivo; factores ambientales como temperatura, precipitación, humedad relativa y viento pueden afectar la sobrevivencia de las platas al generar procesos de estrés hídrico (Eby et al., 2017). Sin embargo, son limitados los estudios disponibles que den caracterizaciones de la especie, que muestren su comportamiento en periodos de sequía moderados a extensos. Entre estos destaca el de Rojas et al. (2012), que analizó el comportamiento fisiológico y químico de plántulas, arboles jóvenes y maduros de G. arborea en condiciones de sequía y encontró que la transpiración disminuye conforme aumente la edad de la planta; las concentraciones de clorofila y carotenoides se incrementan conforme mayor sea la edad de la plántula.
Ante la ausencia de estudios sobre la capacidad de respuesta al estrés hídrico de la especie G. arborea, se estableció como objetivo caracterizar la fluorescencia, reflectancia y respuesta fisiológica al estrés hídrico en plántulas de Gmelina arborea Roxb, manteniendo la hipótesis de que el estrés hídrico genera una reducción fisiológica significativa en las plantas, lo cual se evidencia en cambios en los patrones de fotosíntesis, fluorescencia y reflectancia de la especie.
METODOLOGÍA
Especie y condiciones del estudio
Se seleccionaron 60 plántulas de Gmelina arborea, las cuales procedían de un mismo clon, esto con el fin de uniformizar las variables genéticas del experimento. Las plántulas se seleccionaron por tener la misma edad de seis semanas, tener una homogeneidad en cuanto altura, diámetro en la base y cantidad de hojas. El material procedió de una colección clonal especializada para la producción de madera comercial ubicada en Santa Clara, San Carlos Costa Rica (10°21'43,82" N y 84°30'38,30" O).
Las plántulas se plantaron en bandejas plásticas con compartimentos de 4,5 x 4,5 cm y 15 cm de profundidad; a las bandejas se les colocó suelo procedente de una finca productiva de Gmelina arbórea con fines maderables. El sustrato franco arcilloso, con un pH de 5,2, con niveles nutricionales de nitrógeno, fósforo y potasio óptimos para el crecimiento de la especie. Posterior a tres semanas de aclimatación, las bandejas de plántulas se trasladaron al sitio de estudio en Cartago, Costa Rica.
El estudio se desarrolló en el Laboratorio de Ecofisiología Forestal y Aplicaciones Ecosistémicas (ECOPLANT) del Tecnológico de Costa Rica (9°50’57,91” N; 83°54’37,27” O), Cartago, Costa Rica. Situado a una altitud de 1392 m, con una temperatura controlada promedio de 25 °C y humedad relativa del 70 %. Durante todo el experimento se controlaron las condiciones ambientales, la temperatura no varió más de ±2 °C y la humedad relativa ±10 %. El área de estudio presentó una taza de luz fotosintética activa homogénea de 20 µmol m-2s-1, con un fotoperiodo de 12 horas definido de las 05:00 a 17:00 (GMT-6 América Central). Antes del inicio del experimento las plántulas se aclimatizaron al sitio de estudio, para lo cual se les aplicó una dosis diaria de 20 ml de agua por planta; el proceso fue automatizado, mediante una bomba automática con aspersores por goteo.
Condiciones de estrés hídrico implementadas
Se implementaron dos tratamientos: control (testigo) y estrés hídrico máximo. A las plantas testigo (30 plántulas) se les aplicó una dosis constante de agua durante todo el experimento, se les aplicaron 20 ml de agua cada dos días. En caso de las plantas con estrés hídrico máximo (30 plántulas), durante los primeros 5 días del experimento solo se les aplicaron 5 ml de agua cada dos días; posterior a dicho periodo, las plantas no recibieron agua en el tiempo restante del experimento. El estudio se desarrolló con un diseño simple aleatorio.
Acumulación de biomasa
Se analizó la acumulación de biomasa tanto al inicio como final del experimento, para lo cual se cosecharon ocho plantas por tratamiento; cada individuo se seccionó en tallo, raíz y hojas, esto con el fin de analizar la biomasa de cada órgano por aparte. Seguidamente la muestra se secó por un periodo de 72 horas a 105 °C y se pesó en condición seca para estimar la biomasa seca.
Variables fisiológicas evaluadas
A cada planta de G. arborea se le seleccionó una hoja de edad intermedia, libre de defectos (daños por patógenos, mecánicos producidos por manejo de las plantas o deformidades genéticas) para valorar los siguientes parámetros: tasa fotosintética neta (An), conductancia estomática (Gs), contenido relativo de clorofila (SPAD) y turgencia foliar (Pp). Las curvas de An se desarrollaron al inicio (día 0) y el día final de la prueba (día 31), mientras An máximo, Gs, SPAD y Pp se evaluaron cada siete días. Las mediciones se realizaron entre las 09:00 y 11:00 (GMT-6 Central América); se llevó control de la temperatura, humedad relativa y luminosidad, con el fin de verificar que su variabilidad no infiriera en los datos obtenidos. A continuación, se especifica el procedimiento realizado para cada parámetro:
i. Tasa fotosintética neta (An): se utilizó un medidor de intercambio gaseoso CIRAS-II (PP Systems ®, USA). El CIRAS-II que se calibró con un flujo constante de CO2 de 380 ppm y se programó para realizar las curvas de asimilación fotosintética de 0 a 2000 μmol (quanta) m-2 s-1, en intervalos de 250 μmol (quanta) m-2 s-1, en un área estándar de 2,5 cm2 de la hoja.
ii. Conductividad estomática: se implementó un Leaf Porometer CS-1 (Degacon Devices, Inc®) que cuenta con una cámara de apertura de medición de 6,35 mm de diámetro.
iii. Valor del contenido relativo de clorofila en las hojas: las mediciones del contenido potencial de clorofila se realizaron con un SPAD-502 (Konica Minolta®) que cuenta con un área efectiva de valoración de 5 mm2.
iv. Turgencia Foliar: se estimó mediante unidades ZIM-probe (Yara®) de 82 mm2 de cobertura, programada para tomar los datos cada 15 minutos según recomienda la metodología de Zimmermann et al. (2008); los valores de turgencia foliar (Pp) son generados a partir del principio de la ecuación 1.
Donde a y b son constantes, Fa es el factor de atenuación específico de la hoja y Pclamp es un factor de atenuación del sensor
Medición de reflectancia
La evaluación hiperespectral, específicamente de la reflectancia, se desarrolló con un espectro radiómetro portable de PP System, tipo UniSpec SC. Se trabajó con un rango de 310 a 1100 nm (espectro visible e infrarrojo cercano), con un intervalo de medición de 10 nm y tiempo de medición programado de 4 ms. El sensor implementado contó con una certificación estándar “SMA 905 conectors”, acorde para este tipo de instrumentación, con un área efectiva de 3 mm2. El sensor se colocó perpendicular a la superficie mediante un compartimento cerrado, con el fin de evitar sesgos en la medición por efecto de la luz externa. Todas las mediciones se desarrollaron en un sitio con una luminosidad homogénea de 600 lux.
Medición de fluorescencia
Para la determinación de la fluorescencia se implementó un flurómetro modelo FluoroMax de quinta generación con una luz de 150 W de xenón libre de ozono, con un tiempo te integración de 0,1 segundos y con un rango de operabilidad del espectro de 185 a 850 nm. Las hojas utilizadas en el fluorómetro se condicionaron en fase oscura 30 minutos antes del estudio, posterior a ello se realizó un muestreo en las áreas relacionadas a la clorofila a (420 y 690 nm) y clorofila b (453 y 642 nm).
Análisis estadístico
Se implementó un diseño experimental simple aleatorio, en el cual se evaluó, si existen diferencias significativas entre los tratamientos de estrés hídrico en cada fecha de medición, para lo cual se implementó un análisis de varianza de una vía (One way ANDEVA) y a las variables que mostraron diferencias se les aplicó prueba de Tukey con una significancia de 0,05. Los análisis se realizaron con en el programa STATISTICA 9.0 y ORIGIN Pro 2020. En cada análisis se verificaron los supuestos de normalidad de los residuales y la homogenización de las varianzas.
RESULTADOS
Acumulación de biomasa
En la tabla 1 se presenta la acumulación de biomasa presente en plantas testigo y con estrés hídrico tanto al inicio (día 0) como final (día 31) del experimento. En el inicio del experimento no se encontraron diferencias significativas entre los tratamientos, con una biomasa total promedio de 1,190 g, presente en un 62 % en las hojas, 28 % en la raíz y 10 % en el tallo. Patrón que a los 31 días cambió, y las plantas testigo fueron las que mostraron una acumulación de biomasa significativamente mayor (1,648 g), en comparación con las plantas en estrés hídrico (1,204 g); el estancamiento de las plantas con estrés fue del 26, 9% y las hojas el órgano mostraron la mayor diferenciación con las plantas testigo (del 29,1 %), mientas que el tallo y raíz mostraron la menor diferenciación (16,3 % y 27,4 % respectivamente).
Tabla 1 Biomasa acumulada al inicio (día 0) y final (día 31) del experimento en plantas de G. arborea expuestas en condiciones de estrés hídrico
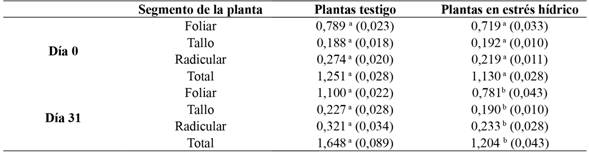
Nota. Letras distintas muestran diferencias significativas al 0,05. Valores en paréntesis corresponden a desviación estándar.
Curvas fotosintéticas
En la Figura 1 se presentan las curvas fotosintéticas de G. arborea al inicio y final del experimento. El comportamiento indiferentemente del día del experimento o el tratamiento fue el mismo, una curva logística, con un aumento de la An, conforme al PPFD se incrementó hasta llegar un punto de An máximo en donde se estabilizó la fotosíntesis. En el día cero la An máxima de la plantas llegó a ser de 9,56 µmol m-2 s-1 con una estabilización de la curva a los 1750 µmol fotón m-2 s-1 y sin presentar diferencias entre los tratamientos,: este aspecto varió en el día 31; donde la An fue mayor en las plantas testigo, al obtener un An máximo de 14,6 µmol m-2 s-1, con una estabilización de la curva a los 1500 µmol fotón m-2 s-1. Mientras que las plantas con estrés hídrico presentaron una disminución de la capacidad fotosintética con un An máximo de 5,8 µmol m-2 s-1, con estabilización de la curva a los 1 250 µmol fotón m-2 s-1, lo cual significó una reducción del 40 % de la capacidad fotosintética de las plantas en comparación al día 0 y del 60,1 % con respecto a las plantas testigo en el mismo periodo de tiempo.
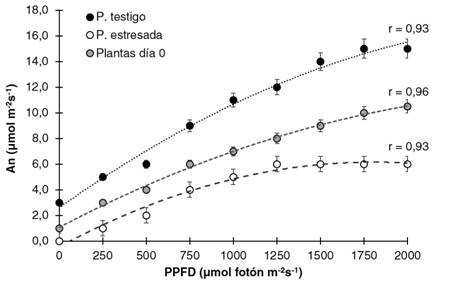
Figura 1 Curvas de asimilación fotosintética neta (An) con respecto a la densidad de flujo fotónico fotosintético (PPFD), obtenida en día 0 y día 31 en plantas de G. arborea expuestas a condiciones de estrés hídrico.
Caracterización fisiológica
Se determinó que en la asimilación fotosintética máxima (figura 2a), las plantas testigo presentaron un valor promedio de 12,6 µmol m-2 s-1 durante todo el experimento; mientras las plantas en estrés hídrico presentaron una disminución de An max durante los primeros 14 días del 52 % y obtuvieron un valor de 5,4 µmol m-2 s-1; posterior del día 14 hasta el final del experimento la An max se mantuvo con pocas variaciones con un valor promedio de 5,6 µmol m-2 s-1. En el caso de la conductividad estomática (Figura 2b), las plantas testigo mostraron poca variación, con una conductancia promedio de 256 mmol m-2 s-1; en cambio las plantas con estrés hídrico en los primeros 14 días presentaron una reducción del 60 % de la conductancia estomática, con un valor de 109 mmol m-2 s-1, comportamiento que se mantuvo con leves decrecimientos de la conductancia hasta el final del experimento que fue de 65 mmol m-2 s-1, un diferencial del 75 % con respecto a la planta testigo.
En el caso de la turgencia foliar (figura 2c), posterior de siete días de exposición a estrés hídrico, se dieron diferencias significativas entre ambos tratamientos: en las plantas testigo la turgencia mantuvo un comportamiento homogéneo, con un valor promedio de 210 kPa en los 31 días del experimento; caso distinto a las plantas con estrés hídrico que en los primeros 21 días presentaron una pérdida de la turgencia foliar en un 76 %, con valores promedio de 48 kPa, es posterior al día 21 cuando se da una estabilización de la turgencia en los 45 kPa hasta el final del experimento. Finalmente, con el contenido relativo de nitrógeno (Figura 2d) en plantas testigo el valor SPAD promedio fue de 32,6 el cual mostró poca variación en los 31 días; caso contrario a las plantas con estrés hídrico que presentaron un constante decrecimiento del valor SPAD conforme el tiempo de estrés hídrico se incrementó, alcanzó, al día 31, una diferencia del 26 %, con valores promedio de 23,7.
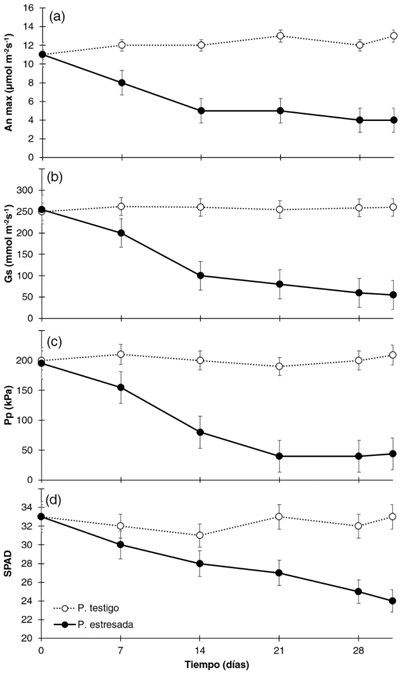
Figura 2 Variabilidad de la asimilación fotosintética máxima (An max), conductividad estomática (Gs), turgencia foliar (Pp) y contenido relativo de clorofila (SPAD) en función al tiempo en plantas de G. arborea expuestas a condiciones de estrés hídrico. Las barras de error corresponden a la desviación estándar.
Análisis de la fluorescencia
Con respecto a la fluorescencia (Figura 3), se determinó en el rango de 400 a 550 nm. Las plantas con estrés hídrico presentaron un nivel de fluorescencia significativamente mayor en comparación con las plantas testigo, los puntos de diferenciación se identificaron a los 453 nm (punto se desarrolla la clorofila b), 474 nm, 485 nm y 494 nm (figura 3a), a diferencia en la florescencia entre ambos tratamientos fue del 15 a 32 %. En cambio, de los 600 a 725 nm (figura 3b), las plantas testigo fueron las que presentaron una fluorescencia significativamente mayor en comparación con las plantas estresadas, donde fue a los 682 nm el punto de mayor diferenciación de la fluorescencia y cercano al área de representación de la clorofila a (generalmente a los 690 nm), la distancia de fluorescencia entre ambos tratamientos fue en promedio del 19 %.
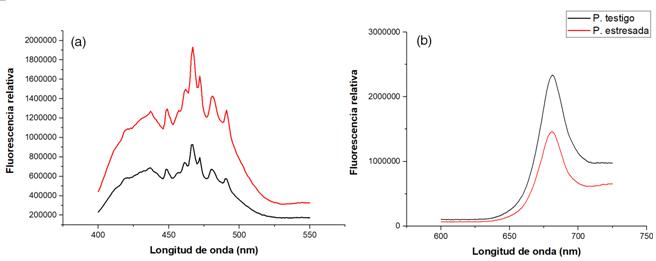
Figura 3 Fluorescencia de los 400 a 550 nm (a) y de 600 a 725 nm (b) en plántulas con distintos niveles en plantas de G. arborea expuestas a condiciones de estrés hídrico.
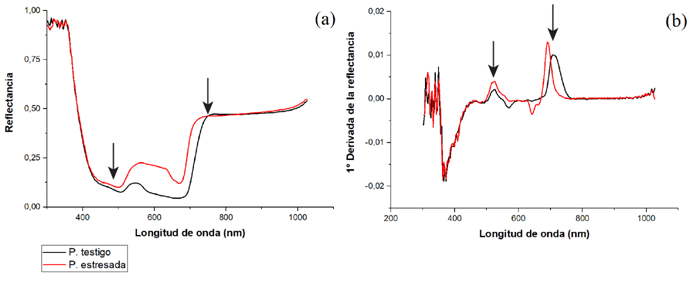
Análisis de reflectancia
Se determinó la gráfica representativa de la reflectancia y la primera derivada de la reflectancia para las plantas testigo y en condición de estrés hídrico al día 31 (Figura 4), de los 310 a 460 nm no se encontraron diferencias significativas entre ambos tratamientos (ver flechas en las figuras). Además, no se encontró una diferencia significativa entre los 775 y 1150 nm, resultó similar el comportamiento de reflectancia entre ambos tratamientos. En el rango de los 460 a 770 nm se obtuvo una variación entre tratamientos (figura 4a): las plantas en condición de estrés hídrico presentaron una reflectancia significativamente mayor, del 10 al 30 % superior en comparación con las testigo. Al analizar el rango con la primera derivada (Figura 4b), se obtuvieron dos puntos diferenciadores que fueron a los 490 nm y 700 nm, puntos en los que se desarrolla la clorofila a, y fue la planta condición de estrés la que presentó la mayor excitación de reflectancia.
DISCUSIÓN
La reducción de biomasa obtenida en las plantas con estrés es la respuesta mecánica a la reducción hídrica como mecanismo de ahorro energético (Hsiao, 1931; Valverde y Arias, 2020), las plantas detienen el crecimiento de los meristemos cuando se producen desequilibrios entre la absorción y traspiración de agua, como un mecanismo de regulación (Pollastrini et al., 2010), en especial, se da una reducción en la formación de nuevas láminas foliares, debido al alto costo energético e hídrico que tienen para la planta. Estudios desarrollaros por Dell’Amico et al. (2012) muestran que el desarrollo de láminas foliares representan para la planta un 26 % de su recurso hídrico y 20 % de su recurso energético, por lo que su estancamiento es una medida inmediata de ahorro energético. El comportamiento obtenido es similar al reportado por Valverde y Arias (2020) con la especie Gliricidia sepium, pues encontraron, en 98 días, una diferencia del 60 % de la biomasa entre plantas de control y con estrés lineal, y la reducción foliar fue de un 70 %. Esto se argumentó como la respuesta de la planta a la producción de ABA, como mecanismos que retardan el crecimiento, reducen la cobertura foliar y promueve solutos orgánicos en las hojas, con el fin de mitigar la pérdida hídrica en la planta (Bader et al., 2015).
Otro aspecto que se evidenció en las plantas con estrés fue la reducción de la fotosíntesis; como resultado de la menor disponibilidad de agua en el sistema, las plantas comienzan a cerrar estomas, lo que afecta la entrada de CO2 y desarrollo de la fotosíntesis. Boogar & Salehi (2020) mencionan que es un parámetro altamente sensible en especies tropicales, que se puede ver disminuido en menos de una semana de estrés moderado. La reducción de transpiración y disminución de los procesos metabólicos de la planta inciden en que la fotosíntesis se reduzca, aspecto que Paulus et al. (2014) mencionan que puede ser promotor de procesos de daños fotofoliares en la planta, debido a la acumulación de solutos orgánicos, diminución de intercambio gaseoso y calentamiento de la lámina foliar, lo cual incide en daños del PSII y PSI (fotosistema I). Eby et al. (2017) mencionan que la fotosíntesis, al verse reducida afecta directamente la capacidad de formación de azúcares y encimas primarias para la planta, incidiendo, en una menor capacidad de recuperación del embolismo o capacidad de respuesta a daños mecánicos.
La afectación de la fotosíntesis se vincula con el cierre de estomas (en caso del estudio, superior al 60 %), pérdida de clorofila y turgencia foliar. Maatallah et al. (2010) indican que el cierre de estomas es una acción inmediata a la pérdida de turgencia en las hojas cuando hay déficit moderado o severo en la planta. Al no tener suficiente agua, la lámina foliar tiende a perder humedad, lo cual afecta su angulación con respecto al sol y su espesor, aspectos que inciden en que el organismo tienda a cerrar estomas para aumentar su regulación y permitir que la planta pueda recuperar la turgencia en el corto plazo. Agam et al. (2013) mencionan que en especies tropicales el cambio de angulación de las hojas, producto de la reducción de la turgencia, tiende a ser una estrategia de reducción de la fotosíntesis y de disipación calórica; esto, debido que la hoja, al tener menos agua, le será más difícil disipar el calor, lo que resulta en daños a las células de la hoja. Ello puede evidenciarse en aperturas involuntarias de estomas, disminución de la resistencia estomática e inestabilidad fotosintética (De la Rosa et al., 2015).
Las reducciones de las variables fisiológicas inciden en cambios en la fluorescencia y reflectancia de las hojas; en el caso de la fluorescencia los daños generados en el PSII, la reducción de la clorofila producto de la oxidación de moléculas y el aumento del ciclo de las xantofilas (Vilfan et al., 2016) repercutieron en que la concentración de la clorofila a y b cambiara, aspecto que generó que la fluorescencia en el rango de la clorofila a aumentara y en el rango de la clorofila b disminuyera. Esto, debido a que la clorofila a es susceptible al calor y su degradación es más simple en comparación a la clorofila b (Li et al., 2020), aspecto que incidió en que con mayor facilidad se aumentara la fluorescencia con menor intensidad de luz, lo cual Zhu et al. (2015) mencionan como producto de la fotoxidación y fotorreceptibilidad de la planta.
En el caso de la reflectancia, el cambio obtenido de los 500 y 600 nm se debe al amarillamiento de las hojas producto a la disminución de grupos epoxi de las xantofilas de las plantas y formación de grupos del carotenoides (Sonobe et al., 2018). En conjunto con los daños generados al PSII, los que inciden en que la planta no tenga el mismo patrón de reflectancia por la oxidación de la clorofila y variación de la concentración de la clorofila a y b (Naumann et al., 2008). Marín-Ortiz et al. (2020) mencionan se pueden dar incrementos de reflectancia entre el 15 y 25 % en plantas con estrés hídrico elevado, por las variaciones de clorofila y efectos de la reducción de la turgencia foliar, que afecta en un calentamiento de la lámina foliar, lo que genera daños en las estructuras vegetales, en las cuales, en muchos casos, se evidencia un aclaramiento de la lámina foliar y aumento de su reflectancia.
CONCLUSIONES
La biomasa en plantas con estrés se redujo en un 26,9 % y fue la cobertura foliar la que mostró mayor afectación (promedio de 29,1 %). Con respecto a la fotosíntesis, la reducción fue del 60,1 % (5,8 µmol m-2 s-1) en relación con la planta testigo (14,6 µmol m-2 s-1). Con la conductancia estomática, turgencia y contenido relativo de clorofila se presentó una disminución de sus valores en el tiempo, con una contracción del 20 al 60 %. En el caso de la fluorescencia, se determinaron dos patrones: de los 400 a 550 nm la fluorescencia se incrementó en las plantas estresadas; mientras de los 600 a 725 nm fueron las plantas testigo las que presentaron mayor excitación, en ambos rangos se presentaron valores máximos en los puntos correspondientes a clorofila a y b. Finalmente, la reflectancia mostró una diferenciación entre los 460 y 770 nm y las plantas en condiciones de estrés resultaron ser las que presentaron una reflectancia mayor.
DECLARACIÓN DE LA CONTRIBUCIÓN DE LOS AUTORES
Se reconoce una distribución de la participación de la publicación de la siguiente manera: J.C.V. 40%, D.A. 20 %, E.M. 20 % y D.G. 20 %, J.C.V. desarrolló las mediciones fisiológicas en el experimento y análisis estadísticos del trabajo, D.A. desarrolló el diseño experimental, E.M. y D.G. participaron en las mediciones de reflectancia del estudio. Todos los autores colaboraron en la redacción y correcciones del manuscrito.
DECLARACIÓN DE DISPONIBILIDAD DE LOS DATOS
Los datos científicos que respaldan el estudio serán puestos a disposición por el autor J.C.V, los datos estarán disponibles mediante solicitudes específicas por parte del interesado vía dirección electrónica que se encuentra inscrita en el manuscrito.