Introducción
El síndrome respiratorio agudo severo CoV2 es producido por un virus de RNA monocatenario en sentido positivo, el cual se encuentra cubierto por una núcleo proteína que le confiere pasar desapercibido en las primeras horas de inoculación evitando activar el sistema inmune y el complejo principal de histocompatibilidad del individuo susceptible recién infectado; así mismo hacia su cápside o envoltura presenta una proteína de membrana, proteína de envoltura, proteína hemaglutinin esterasa y la glicoproteína de superficie o espiga que es el epítopo de superficie del virus (1).
Dentro del espectro biológico de afección al organismo en las manifestaciones clínicas se ha relacionado al compromiso del sistema respiratorio ya que la mayoría de los pacientes afectados presentan una neumonía grave; sin embargo, es importante mencionar que la afección no es exclusiva de este sistema por el contrario el virus produce una alteración multiorgánica que compromete las funciones vitales del paciente infectado (1,2).
En este sentido es importante evaluar la evidencia que implica a la cavidad bucal como uno de los epitelios más frecuentes de inoculación por el SARS CoV2, como sitio anatómico de especialidad de la estomatología y las consideraciones del personal de la salud.
Estructura genómica del virus
Presenta una forma pleomórfica siendo más oval de 80 a 120 nm, su genoma es voluminoso y largo llegando a tener entre 26.4 a 31.7 kb en su estructura completa, constituido por una cadena simple de RNA monocatenario en sentido de polaridad positiva; La cápside está conformada por 4 proteínas estructurales la primera es la glicoproteína de superficie o espiga S que actúa como receptor de unión a la célula huésped, la segunda es la glicoproteína de membrana M la cual funge como esqueleto del virus, en tercer lugar la proteína E se encuentra en menor proporción y se le ha conferido la capacidad de conformar y madurar el virión, el cuarto sitio lo ocupa la núcleo proteína la cual le da protección al RNA viral (1,2) Figura 1.
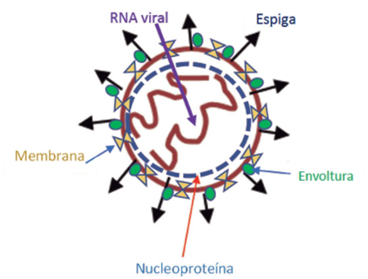
Figura 1 Estructura SARS CoV2 proteínas estructurales, espiga, envoltura, membrana y nucleoproteína; RNA viral.
Sistema renina angiotensina aldosterona
El sistema renina angiotensina aldosterona, que es un importante regulador de la presión arterial y el volumen extracelular, cuando detecta una hipoperfusión renal mediante la macula densa del aparato yuxtaglomerular activa esta vía secretando renina en primer instancia que interactúa con e angiotensinógeno que es producido por el hígado para convertirlo en Angiotensina I; una vez conformada esta angiotensina I será convertida por medio de la Enzima Convertidora de Angiotensina en el endotelio vascular pulmonar en Angiotensina 2; una vez conformada esta angiotensina 2 tendrá diferentes funciones biológicas dentro de las más importantes será la estimulación de la hormona antidiurética en el lóbulo posterior de la hipófisis que favorecerá la absorción de agua mediante pequeños canales provenientes del túbulo colector; a nivel arteriolar estimulará los receptores AT1 para realizar vasoconstricción y aumento de la presión sanguínea, a nivel de la corteza suprarrenal en la glándula estimula la secreción de aldosterona que a su vez tiene como principal función la reabsorción de sodio y cloro, la excreción de potasio y la retención de agua en el túbulo colector (3).
Rceptores de la enzima convertidora de angiotensina 2
Existen cuatro receptores de la ECA2 de los cuales los más importantes son los dos primeros ya que se desconoce a ciencia cierta la función del tercero y cuarto. El receptor AT1 se encuentra localizado en el cromosoma 3 brazo largo y locus 22; presenta 7 dominios de transmembrana y esta constituido por 359 aminoácidos con un peso aproximado de 41kD. Lo encontramos en todos los tejidos adultos específicamente en la membrana plasmática de las células, citoplasma y núcleo por internalización de un complejo peptídico; dentro de sus principales funciones realiza vasoconstricción, liberación de aldosterona, filtración glomerular y proliferación celular. Por el contrario, el receptor AT2 se encuentra localizado en el cromosoma X es decir en un gonosoma, esta constituido por 7 dominios de transmembrana y compuesto por 363 aminoácidos, 44 kD a diferencia del AT1 lo encontramos en tejidos fetales específicamente en la membrana plasmática y de manera paradójica tiene funciones antagonistas con el primero ya que favorece la vasodilatación, la anti-proliferación celular por apoptosis y la diferenciación celular. Es importante considerar que si estos genes los encontramos insertos en los cromosomas son constitutivos del genoma humano (3,4).
Expresión génica de ECA2 en otros órganos
Una vez que se ha demostrado que estos receptores son constitutivos por lo tanto se expresan no solo en el endotelio pulmonar de manera exclusiva si no en la mayoría de órganos teniendo como común denominador el epitelio glandular o de cubierta; de tal forma que se han realizado revisiones como la de Hao Xu et al; donde por medio de secuenciación del transcriptoma completo o secuenciación masiva se ha comprobado que existe expresión génica de ECA2 en diferentes órganos; se analizó una cohorte de 695 tejidos normales obtenidos del FANTOM5 CAGE (Archivo Funcional del Análisis de Expresión Génica del Genoma de Mamíferos), correspondientes 51 de intestino, 129 de riñón, 35 de estómago, 9 de conducto biliar, 50 de hígado, 32 de la cavidad bucal, 110 de pulmón, 59 de tiroides, 11 de esófago, 19 de vejiga, 113 de mama, 25 de útero y 52 de próstata de los cuales una vez realizada la secuenciación del transcriptoma se identificó una mayor expresión en intestino con 9.50, seguido por el riñón con 9.20, estómago 8.25, conducto biliar 7.23, hígado 6.86, cavidad oral 6.23 hasta la próstata con la menor cantidad de expresión génica de 4.35 (5).
Expresión de ECA2 rn cavidad bical por aréa anatómica
Después de realizar la evaluación del transcriptoma completo por órganos se aislaron las muestras de la cavidad bucal para realizar un análisis de expresión por área anatómica intra oral donde se pudo evidenciar que el sitio con mayor expresión génica son las células escamosas de la mucosa bucal que recubren la lengua con mayor número de receptores, posteriormente el piso de boca, seguido por la base de la lengua y por ultimo otros sitio en donde ubicamos las glándulas salivales; posterior a este análisis se llevó a cabo la evaluación individual de células en donde es posible observar una mayor expresión en las células epiteliales, seguido por las células T, fibroblastos, células B, macrófagos, células endoteliales y mastocitos (5,6,11).
Cavidad bucal como ruta de entrada del SARS COV2 E inoculación
Ya que se ha expuesto la evidencia de la expresión génica de receptores de ECA2 en las células que recubren la mucosa de la lengua y otras áreas de la cavidad bucal; es posible extrapolar que la vía de inoculación se da mediante el flujo de aire con pequeños viriones suspendidos que ingresan a la cavidad bucal; una vez expuestos a la cavidad bucal la glicoproteína de superficie o proteína espiga buscara el receptor de la enzima convertidora de angiotensina ECA2 para realizar el acoplamiento y el ensamblaje; posterior a esto y por medio de la activación de fenómenos de glicosilación y a la activación por algunas proteasas como la TMPRSS2 será la llave de entrada para que el virón ingrese a la célula huésped; ya en el citoplasma el virión realizará un des ensamblaje eliminando su cápside y núcleo proteína protectora liberando el RNA viral; a diferencia de otros virus que necesitan llegar al núcleo de la célula huésped para insertar su secuencia de aminoácidos como si fuese un plásmido extra cromosómico SARS CoV2 no necesita buscar el núcleo basta con liberar el RNA viral y localizar los ribosomas de la célula huésped en donde en conjunto y ayuda de las enzimas como la replicasa iniciara su ciclo de replicación, transcripción y traducción formando una gran cantidad de proteínas tanto estructurales como accesorias que permitirán el ensamblaje de un virión inmaduro por medio de una vesícula, hasta conformarlo por completo y por medio de exocitosis llevarlo al exterior de la célula huésped donde se replicó para inocular otros tejidos o ser potencialmente infeccioso en la saliva o aerosoles para poder infectar a otros individuos susceptibles (6,7) Figura 2.
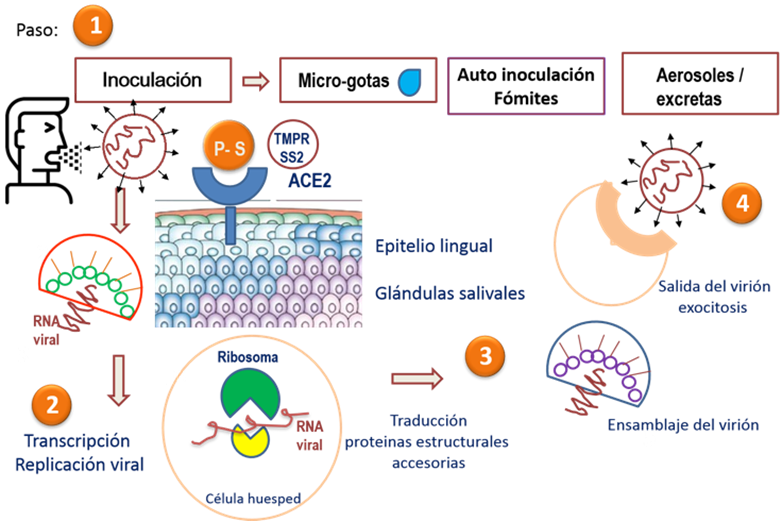
Figura 2 Vía de entrada e inoculación por cavidad bucal del virión de SARS CoV2 que a través de su glicoproteína de superficie o espiga busca el receptor de la enzima convertidora de angiotensina 2 para que por activación de la proteasa TMPRSS2 ingrese a la célula huésped se desnude y deje su RNA viral en el citoplasma e inicie su replicación y elaboración de proteínas virales por medio de los ribosomas, conformando un virión que es expulsado del medio intracelular por exocitosis para infectar otros órganos o individuos susceptibles.
Disminución de la carga viral de SARS COV2 en la cavidad bucal
Es necesario que una vez explicado el proceso de inoculación en cavidad bucal, consideremos que pueden existir una cantidad importante de viriones en la saliva proveniente de las glándulas salivales o bien de las células de la mucosa de recubrimiento lingual que pueden estar llevando acabó la exocitosis del virión recién replicado; en este sentido la literatura menciona que las gotas de saliva menores a 60 micras tiene posibilidad de infectar a corta distancia siendo aún más complejas las menores a 10 micras que permiten suspensión en aerosol e infección a larga distancia una vez que se rompe su núcleo y deja expuesto el virión per se dando como resultado una alta posibilidad de infectar a otros individuos que llegan a aspirar o inocular el virus a través de los epitelios de la cavidad oral, nasal o conjuntival (7,8).
En este sentido se ha evidenciado que la carga viral en la cavidad bucal puede disminuirse significativamente mediante colutorios de yodopovidona bucofaríngea 0.2% y/o peróxido de hidrogeno 1% antes de manipular la cavidad bucal por mínimo invasivo que sea el procedimiento por un minuto; así mismo es importante considerar que el núcleo y viabilidad de estas gotas estará condicionado a otros factores locales como son el flujo de aire, las condiciones de humedad, calor y deshidratación lo que permitirá una eliminación acelerada de las mismas. De esta manera es importante tomar en cuenta que el personal de salud especialista en el área de estomatología debe tomar en cuenta la interacción del virus y la cavidad bucal como vía de entrada e inoculación extremando al máximo las medidas de disminución de carga viral, las barreras de protección universal tanto para el operador mediante la utilización de overol impermeable, bata, gorro, botas, guantes desechables, lentes de protección, mascarilla N95 y careta de protección así mismo el protocolo de desinfección de la unidad dental y ergonomía del consultorio mediante agentes químicos como hipoclorito de sodio 0.1% en todas las superficies o fómites potenciales así como implementar la logística de recepción de pacientes a intervalos adecuados para que no exista espera ni conglomerados de personas en la sala del consultorio (9,10).