Introducción
La queilitis actínica (QA) es una lesión potencialmente maligna del labio inducida por la exposición regular y prolongada a la luz ultravioleta (UV), que afecta principalmente al bermellón del labio inferior de personas adultas y de piel clara (1-4).
A nivel histológico, en la QA ocurren alteraciones en el epitelio y el tejido conectivo. En los estadíos tempranos de la QA el epitelio se observa con hiperqueratosis, ya sea orto o paraqueratosis, atrofia epitelial, hiperplasia y en estadíos posteriores se presentan diversos grados de displasia intraepitelial 5.
En el tejido conectivo se observa siempre la presencia de elastosis (en distintos grados), que corresponde a una degeneración basófila de la matriz extracelular (MEC) la cual es reemplazada por fibras elásticas amorfas producidas por fibroblastos residentes 6,7. Además, en la mayoría de las lesiones de QA se observa infiltrado inflamatorio crónico de distinta intensidad y la aparición de vasos sanguíneos telangiectásicos (5). Dentro de este infiltrado inflamatorio se ha descrito un aumento significativo de mastocitos (MCs), que son células del sistema inmune que se ubican en las zonas de interfase con el medio ambiente. Los MCs se localizan especialmente alrededor de las zonas de elastosis y en la zona subepitelial, por lo que se ha postulado un rol preponderante de esta célula en las alteraciones de la MEC y del epitelio en la QA 8.
Patogénesis de la elastosis actínica
Grimbaldeston y cols. 9 midieron como marcador de piel fotoenvejecida la acumulación y diámetro de las fibras elásticas (teñidas con Verhoeff y tinción de Van Gieson), encontrando que la piel expuesta al sol presentaba mayor grado de elastosis. Otros estudios en piel fotodañada han reportado un aumento de la proporción de fibras elásticas en comparación con las fibras colágenas 10.
Sgarbi y cols. 11 reportaron que el porcentaje de fibras de colágeno fue significativamente mayor en los pacientes del grupo control que en los pacientes con QA, pero no observaron diferencias significativas en relación con el porcentaje de fibras elásticas, sin embargo, en este estudio los controles se realizaron con mucosa labial y no con el bermellón del labio inferior. Por su parte Boza y cols. 12 observaron un aumento significativo en la densidad de fibras elásticas en QA en comparación con labio normal (LN), así como, un aumento en la proporción de fibras elásticas en relación a las colágenas en QA comparado con LN. Sin embargo, no observaron diferencias en la densidad de fibras colágenas entre QA y LN, lo que sugiere que el cambio en la composición de la MEC se debe principalmente al aumento en el depósito de fibras elásticas y una disminución de los espacios entre ellas, ocupados en condiciones normales por vasos sanguíneos y la sustancia fundamental.
Se ha observado que en piel fotoenvejecida los principales cambios ocurren en la dermis superficial (unión de la dermis con la epidermis o zona papilar), donde se produce una reducción y/o reorganización de las fibras oxitalánicas, las cuales pierden su verticalidad y pasan a engrosar la red de tejido elastótico 13. Boza y cols. 12 observaron en las lesiones de QA que las fibras elásticas en el área papilar no sólo eran más numerosas y gruesas sino que perdían su verticalidad, y en el área reticular tendían a hipertrofiarse formando masas de material elastótico acelular.
Se ha propuesto que la elastosis actínica se produce tanto por procesos degenerativos como de síntesis anormal de fibras elásticas por parte de fibroblastos con daño solar, lo que va acompañado de cambios morfológicos del colágeno 14. Se ha descrito una fuerte correlación negativa entre fibras elásticas y colágenas lo que sugeriría que en QA el colágeno es reemplazado por elastina
12, el contenido de elastina refleja cambios en la matriz extracelular en QA y carcinoma de células escamosas (CCE) de labio 15.
Diversos estudios in vivo e in vitro han mostrado que la luz UV altera significativamente el funcionamiento de los fibroblastos 16-22. Los principales cambios descritos incluyen efecto inhibidor de la proliferación de fibroblastos con un incremento en la expresión y activación de ciclooxigenasa (COX)-2 22, disminución del tamaño de los fibroblastos y aumento de la producción de colágeno tipo III en relación al colágeno tipo I 23,24. Además se ha descrito mayor expresión de RNA mensajero (RNAm) para fibrilina y elastina en fibroblastos dañados por luz UV (20), así como mayor producción de fibras elásticas amorfas, proteoglicanos y glicosaminoglicanos 25.
Estudios sugieren que las metaloproteinasas de la matriz (MMP) podrían afectar el comportamiento biológico de QA y CCE de labio en la medida en que podrían participar en el desarrollo y la progresión de lesiones premalignas a lesiones malignas 26-27. Poulopoulos y cols. (27) encontraron inmunotinción abundante para MMP-12 en las áreas de elastosis en QA y no encontraron ninguna inmunoreactividad en LN, lo que sugiere que MMP-12 puede desempeñar un papel importante en la remodelación del tejido conectivo durante la exposición a largo plazo a la luz solar en las lesiones de QA. Onihshi y cols. 28 encontraron un aumento significativo de la expresión de MMPs -1, -2 y -3 en áreas de elastosis de piel con daño actínico en relación a piel no expuestas a radiación UV, postulando al fibroblasto como el principal productor de estas MMPs.
A pesar de que el fibroblasto tendría un rol preponderante en la formación de la elastosis actínica, diversos estudios sugieren que otros tipos celulares como el MC también contribuirían en forma significativa al daño actínico de la MEC 29-31.
Participación del mastocito en la patogénesis de la elastosis actínica
Grimbaldeston y cols. 9 evaluaron en voluntarios australianos la prevalencia de MCs en piel expuesta y no expuesta al sol en el mismo paciente, encontrando un aumento en el número de MCs en piel fotoexpuesta.
Diversos estudios han demostrado que los MCs son importantes efectores del daño actínico del tejido conectivo 32. González y cols. 30 han mostrado que animales deficientes en MCs, expuestos a la luz UV no desarrollan las alteraciones inflamatorias y de tejido conectivo asociados a la exposición crónica a la luz UV. En piel irradiada con luz UV, los MCs producen una serie de mediadores inflamatorios y de proteasas que pueden contribuir al daño actínico 33. De acuerdo al contenido de proteasas los MCs se clasifican en MCT si contienen sólo triptasa, y en MCTC si contienen ambas triptasa y quimasa 33,34.
Tanto triptasa como quimasa se encuentran aumentadas significativamente en las áreas de elastosis de la QA (8).
Triptasa es reconocida por sus propiedades pro-angiogénicas y más recientemente por su actividad tipo gelatinasa 35-36. Triptasa también tiene la capacidad de estimular la proliferación de fibroblastos, y aumentar la síntesis de colágeno tipo I 37. Por otra parte, la triptasa activa colagenasas en forma indirecta, a través de la activación de estromelisina, la cual tiene además características elastolíticas, por lo que participa activamente en la degradación de la MEC 25.
Quimasa tiene un rol preponderante en la regulación de la activación de colagenasas en el proceso de degradación y aposición de MEC 38,40, se ha demostrado que la quimasa disminuye la producción de colágeno en fibroblastos, además de aumentar la degradación del colágeno mediante la activación de colagenasas (33).
Se han descrito diferencias significativas en las subpoblaciones de MCs en el proceso de carcinogénesis del labio (8,41. Tanto en QA como labio normal el fenotipo predominante es el MCT sobre el MCTC, sin embargo, en el cáncer de labio ambas subpoblaciones están significativamente aumentadas, con un predominio de los MCTC en el frente de avance tumoral (8,41).
En las zonas de elastosis de la QA, además del incremento de MCT, hay un número elevado de MCTC en relación a labio normal (41). Los MCTC, además de quimasa y triptasa, contienen enzimas que han sido asociadas al proceso de elastosis como la catepsina G, la carboxipeptidasa y las gelatinasas A y B (33,42,43.
Rojas y cols. 44 encontraron un aumento significativo de co-expresión epitelial de COX2 y receptor activado por proteinasa (PAR)-2, así como elevada densidad subepitelial de MCT en QA en comparación con el labio normal, sus resultados sugieren que la triptasa puede contribuir a la regulación positiva de la COX-2 mediante la activación epitelial de PAR-2 durante la carcinogénesis temprana del labio.
Se ha descrito que en piel irradiada con luz UV, los MCs producen una serie de mediadores inflamatorios, entre ellos la histamina y el TNF-α (32) y que histamina tiene un efecto proliferativo sobre fibroblastos favoreciendo la liberación de FGF-7 45. Artuc y cols. (45) encontraron que fibroblastos dérmicos humanos estimulados con triptasa o histamina, liberaban factores de crecimiento fibroblásticos (FGF-2 y FGF-7). En el caso de la histamina, este efecto era mediado por la estimulación de receptores H1 en los fibroblastos (45).
En otro estudio Rojas y cols. 46 mostraron que los fibroblastos están aumentados en la QA y están asociados con la densidad de los MCs, la expresión epitelial de p53 y COX-2 y la elastosis actínica. También se encontró una correlación positiva entre la densidad de fibroblastos y MCs. Además la densidad de ambos tipos celulares se correlacionó positivamente con la densidad de fibras elásticas. Esto sugiere un rol significativo de ambos tipos celulares en la formación de elastosis en el labio. Similares resultados fueron encontrados por Grimbaldeston y cols. (9) donde la piel expuesta al sol presentaba mayor grado de elastosis que además se correlacionaba positivamente con la densidad de MCs y con la edad, sugiriendo que la patogénesis de la elastosis en la piel es similar a la del labio y también involucraría la participación de MCs.
Resumiendo en un modelo el rol significativo de los fibroblastos y los MCs en la formación de elastosis en el labio (Figura 1), se diría que en respuesta a la exposición crónica a la luz UV los MCs interactúan con fibroblastos residentes en el bermellón del labio estimulando la degradación del colágeno y la formación de elastosis en la QA. Las alteraciones en la función del fibroblasto inducidas por luz UV podrían estar mediadas por las proteasas derivadas de MC triptasa y quimasa, MMPs, citoquinas pro-inflamatorias y otros mediadores.
Asociación a carcinogénesis o a un efecto protector
De Santana y cols. 47 encontraron que el grado de displasia en QA no se asoció estadísticamente con el sexo, la edad, el origen étnico, la exposición ocupacional a la luz solar ni la apariencia clínica. Este estudio proporciona cierto apoyo a la hipótesis de que las características clínico-patológicas de la QA no están relacionadas con el grado de displasia epitelial. En los últimos años se ha demostrado que el proceso de carcinogénesis no solo requiere la transformación maligna de las células del parénquima de un órgano o tejido, sino que también requiere una participación activa del estroma tumoral 48.
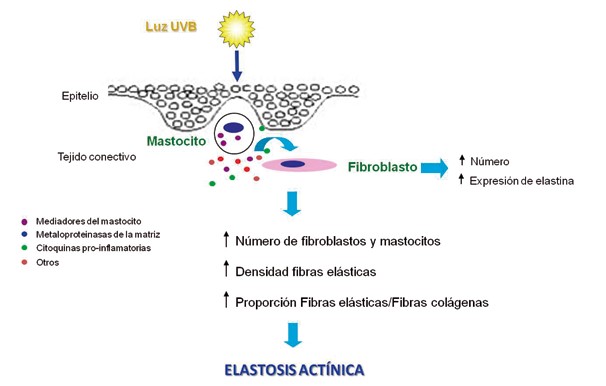
Figura 1 Modelo de patogénesis de la elastosis actínica mediada por la interacción de mastocito-fibroblasto en queilitis actínica.
La elastosis es la consecuencia de un aumento del infiltrado inflamatorio y por ende de la producción de oxidantes, proteasas y citoquinas pro-inflamatorias. Todos estos componentes también se asocian con la promoción, progresión e invasión tumoral (48-49). Hallazgos indican que la activación de receptores del factor de crecimiento endotelial vascular (VEGFR1 y VEGFR2) en células epiteliales e inflamatorias parece ser un evento temprano en la carcinogénesis de los labial 50. Otros han demostrado que las muestras de cáncer labial con presencia de elastosis tenían un mejor pronóstico 51.
Por lo tanto, una mejor caracterización del estroma de las lesiones de QA podría contribuir a una mejor evaluación del pronóstico de las lesiones labiales premalignas y malignas.
Aplicaciones terapéuticas
Los enfoques terapéuticos para la QA buscan principalmente controlar clínicamente la malignización de la lesión. Se han utilizado diversos métodos terapéuticos en el manejo de la QA y éstos pueden ser no quirúrgicos o quirúrgicos 52. Según Van der Waal 53, las biopsias están indicadas según los aspectos clínicos de la lesión, con el objetivo de monitorear una posible transformación maligna. Esta debe realizarse después del fracaso del tratamiento conservador o si hay sospecha clínica de malignidad. La extirpación de la lesión es la terapia más común para queratosis actínicas individuales, siempre debe considerarse para lesiones aisladas o presentaciones tempranas 54.
La terapia fotodinámica (TFD) es un procedimiento que utiliza ácido 5-aminolevulínico tópico o aminolevulinato de metilo para tratar las queratosis en piel. Chaves y cols. 55 reportaron un 62,5% respuesta clínica completa en QA posterior a la TFD. En el análisis histopatológico de las lesiones tratadas con TFD no se encontraron cambios estadísticos significativos en la expresión de marcadores asociados a actividad neoplásica, Ki-67 y p53, antes y después del tratamiento.
Imiquimod es un modificador de la respuesta inmune tópica y es eficaz para el tratamiento de los cánceres de piel de tipo no melanoma. Recientemente, Oyama y cols. 56 demostraron que el número de MCs en la dermis se incrementó en las lesiones de queratosis actínica efectivamente tratadas con imiquimod. Este resultado sugiere que los MCs podrían tener un rol dual en la carcinogénesis labial y también contribuir con un efecto antitumoral en respuesta a Imiquimod.
Un solo tipo de tratamiento a pesar de mostrar buenos resultados clínicos no es suficiente para eliminar completamente los signos del daño actínico crónico y por lo tanto el riesgo de cáncer. Se debe dar seguimiento continuo a largo plazo, además se debe alentar a los pacientes a usar protectores solares en los labios, sombreros de ala ancha, sombrillas y evitar la exposición a la radiación solar durante las horas punta.
Conclusiones
Las lesiones QA tienen un estroma complejo, caracterizado por una mayor densidad de fibroblastos y mastocitos que están asociados con degradación de la MEC y formación de elastosis. Por lo tanto, se deben impulsar más estudios destinados a determinar los mediadores específicos que regulan la interacción mastocitofibroblasto, con el objetivo de poder modular la formación de elastosis en labios fotodañados.
Conflicto de intereses
Ninguno declarado.














