1. Introducción
Desde la revolución tecnológica a finales del siglo XVIII, la matriz energética mundial cambió, sustituyendo la biomasa por combustibles fósiles que todavía son los más usados en la actualidad, ocasionando un incremento desmedido en las concentraciones de CO2 en la atmósfera [1], por lo que, actualmente se requiere de fuentes de energía sostenibles y amigables con el ambiente [2].
La biomasa lignocelulósica, como materia prima para obtención de etanol, se ha presentado como una posible solución para las iniciativas mundiales de mitigación de cambio climático y reducción de consumo de combustibles fósiles [3]. Este tipo de biomasa está compuesta principalmente por celulosa, hemicelulosa y lignina [4], siendo esta estructura una barrera física y química que limita la conversión biológica, dificultando los procesos de hidrólisis de celulosa y hemicelulosa a azúcares fermentables [5]. Por tal motivo, para la conversión de celulosa antes de un proceso enzimático, se requiere de un pretratamiento previo del material lignocelulósico [6].
Los tres procesos enzimáticos que han sido más estudiados para la obtención de etanol a partir de biomasa lignocelulósica son: sacarificación y fermentación separada (SHF), sacarificación y fermentación simultaneas (SSF) y bioprocesamiento consolidado (CBP, también conocido como conversión microbiana directa o DMC). En SHF, la hidrólisis del sustrato pretratado y la fermentación de azúcares se llevan a cabo en diferentes reactores, cada uno en condiciones óptimas. Además, la configuración SHF da facilidad de recuperación de la levadura [7]. En un proceso por SSF, la hidrólisis y fermentación se llevan a cabo en el mismo reactor y a pesar de que el proceso no se lleve en condiciones óptimas, debido a que las condiciones de la hidrólisis difieren de la fermentación, lo atractivo de SSF es su alta tasa de conversión de azúcares a etanol al reducir la acumulación de azúcares en la fermentación [8]. Además, la SSF reduce el requerimiento de equipos, debido a que se emplea un solo recipiente para el proceso.
Los procesos que conllevan hidrólisis de biomasa lignocelulósica requieren de cocteles enzimáticos enriquecidos de celulasas y hemicelulasas actuando en conjunto. Esto se consigue mediante la combinación de preparaciones enzimáticas comerciales como Cellic® Ctec2/Cellic® Htec2 y Celluclast 1.5 L/Viscozyme L, las cuales son producidas por Novozymes. Los enzimas Cellic® Ctec2/Cellic® Htec2 son específicas para la sacarificación de biomasa lignocelulósica, en cambio, las enzimas Celluclast 1.5 L/Viscozyme L fueron diseñadas para aplicaciones alimentarias y son menos costosos [9].
La Jatropha curcas es una planta que se encuentra ampliamente distribuida en bosques silvestres o semi cultivados en América Latina, África, India y el sudeste asiático [10]. En Ecuador, la Jatropha curcas es conocida como “Piñón” y es usada como cercas vivas en áreas rurales agrícolas de la zona costera, principalmente en la provincia de Manabí, donde se dispone de aproximadamente 7000 km de cercas vivas de Jatropha curcas que pueden producir entre una a diez toneladas de semilla dependiendo de la edad de las plantas, las condiciones del suelo y el uso del riego [11]. Desde 2008, el gobierno nacional ha impulsado la recolección del fruto de piñón proveniente de las cercas vivas para producir aceite de piñón y utilizarlo como sustituto del diésel para la generación eléctrica en las Islas Galápagos [12]. De la extracción del aceite de Jatropha curcas solo en Manabí, se produjeron aproximadamente 200.000 kg de desechos en 2018, los cuales consisten en cáscara del fruto de Jatropha curcas y torta prensada de semillas pos extracción de aceite. En 2020, se recolectaron 300.000 kg de fruto de piñón seco [13] en la provincia de Manabí, estimándose una generación de 116.160 kg de cáscara, considerando que la cáscara representa el 38,72 % del fruto seco [14]. Ni la cáscara, ni la torta de semillas tienen un mecanismo de gestión de eliminación actual, lo que lleva a problemas de gestión de residuos [11].
En varias ocasiones, se ha estudiado el uso de la Jatropha curcas como materia prima para la obtención de energía. El aceite de Jatropha curcas se ha utilizado como combustible en mezclas con diésel o como materia prima para la obtención de biodiesel. Además, la cáscara del fruto de Jatropha curcas ha sido estudiada para la producción de pellets en mezcla con biocarbón [11] y para producción de etanol de segunda generación por medio de pretratamiento ácido [15] o alcalino [16].
El propósito del siguiente trabajo es evaluar el rendimiento de etanol obtenido a partir de cáscara de Jatropha curcas, pretratada con agua caliente a 200°C con un tiempo de residencia de 15 minutos, empleando un proceso SSF a diferentes condiciones (cargas enzimáticas, medios estériles y tamaños de ensayo). El objetivo de la investigación es determinar las mejores condiciones de SSF para tener un máximo rendimiento de etanol y a su vez, identificar posibles ahorros de recursos en un proceso a mayor escala siendo una alternativa de revalorización de un residuo poco utilizado en el Ecuador.
2.1 Materia prima para la experimentación
La cáscara de Jatropha curcas (JCS) fue recolectada manualmente en el proceso de descascarado del fruto, realizado en la Planta de Extracción de aceite localizada en la Estación Experimental del INIAP (Portoviejo, Manabí, Ecuador). La JCS se sometió a un proceso de reducción de tamaño empleando un molino de martillos (Indecom, Quito, Ecuador) equipado con una malla de 5 mm. La biomasa obtenida fue recolectada para ser llevada al proceso de pretratamiento hidrotérmico con agua caliente
2.2 Pretratamiento hidrotémico de la cáscara
El pretratamiento hidrotérmico se llevó a cabo en un reactor de tanque agitado de 3 litros de volumen de reacción (diseñado por el Instituto de Investigación Geológico y Energético, Quito, Ecuador), calentado por un sistema de resistencias eléctricas. El pretratamiento fue desarrollado a 200 °C con un tiempo de residencia de 15 min, utilizando una relación de biomasa/agua de 1:10. El lodo (slurry) obtenido fue filtrado para recuperar la biomasa pretratada o torta, empleando un sistema de filtrado de laboratorio, compuesto de un kitasato de 500 ml, un embudo büchner de 90 mm de diámetro, y una bomba de vacío (Boeco, Hamburgo, Alemania).
Posteriormente, se pesó la torta húmeda obtenida y se lavó por tres ocasiones con una solución de 0,03 mol/l de citrato de sodio pH 5,0 conteniendo 0,002 % p/p de azida sódica. Para el pretratamiento hidrotérmico y preparación de soluciones se utilizó agua destilada que en el presente trabajo corresponde a agua de grado tipo I, según la norma ASTM D1193-06 [17].
2.3 Métodos analíticos de laboratorio
El contenido de humedad, carbohidratos estructurales y lignina en la cáscara de Jatropha curcas bruta y en el material pretratado, así como la determinación de subproductos de hidrólisis enzimática y fermentación se basaron en los procedimientos analíticos de The National Renewable Energy Laboratory (NREL). La humedad se determinó por medio de un analizador halógeno automático (Mettler Toledo, Columbus, OH, EE. UU.) a 105 °C [18]. La determinación de carbohidratos estructurales y lignina se realizó por medio de un proceso que consta de una hidrólisis de dos pasos para fraccionar la biomasa en fragmentos más fácilmente cuantificables. En este método, la lignina se divide en un material ácido insoluble y material ácido soluble [19]. La fracción ácido insoluble fue determina gravimétricamente, mientras que la fracción ácido soluble se determinó por medio de un espectrómetro UV-VIS (HACH, Loveland, CO, EE. UU.). Los azúcares provenientes del método de carbohidratos estructurales y lignina, así como también los subproductos de hidrólisis enzimática y fermentación, fueron cuantificados en un HPLC equipado con un detector de índice de refracción-RID (Agilent Technologies, Santa Clara, CA, EE. UU.). La separación de azúcares y subproductos de hidrólisis enzimática y fermentación se realizaron con una columna Rezex 00D-0223-K0 (Phenomenex, Torrance, CA, EE. UU.) a 30 °C, utilizando una fase móvil de 0,005 mol/l de ácido sulfúrico a un flujo de 0,5 ml/min.
2.4 Determinación de la actividad enzimática
La actividad enzimática en unidades de papel filtro por mililitro (UPF/ml) se determinó empleando una tira de 50 mg de papel de filtro Whatman No. 1, el cual fue colocado dentro de un tubo de ensayo (13x100 mm) con 1 ml de solución tampón de 0,05 mol/l de citrato de sodio (pH 5) y 0,5 ml de enzima diluida en la solución tampón. Esta mezcla fue incubada a 50 °C por 1 h [20]. La cuantificación de azúcares reductores y el cálculo de la actividad enzimática se realizó acorde al procedimiento descrito por Adney y Baker [20]. La enzima utilizada (Cellic CTec 2) es una mezcla comercial compuesta de celulasa, ß-glucosidasa, y hemicelulasa (Sigma-Aldrich, Saint Louis, MO, EE. UU.) y se determinó una actividad enzimática de 164 UPF/ml.
2.5 Preparación de inóculo
En un matraz de 250 ml de capacidad nominal, manteniendo una relación del volumen de inóculo con respecto al volumen total de 1:5, se inoculó una levadura comercial Saccharomyces cerevisiae YCS2 (Sigma-Aldrich, San Luis, MO, EE. UU) con medio de cultivo esterilizado compuesto de glucosa (25,00 g/l), extracto de levadura (4,00 g/l), NH4SO4 (2,00 g/l), KH2PO4 (1,00 g/l) y MgSO4.7H2O (0,30 g/l) [21]. El inóculo se incubó en un baño térmico (Fungilab, Nueva York, NY, EE. UU) a 36 °C por 5 h.
2.6 Sacarificación y fermentación simultánea
En un matraz de 50 ml, se preparó 24 ml de una mezcla que contiene enzima (5 UPF/g biomasa seca), levadura inoculada (1 mg/ml), cáscara de Jatropha curcas pretratada (5 % p/p) y medio esterilizado con nutrientes compuesto de solución tampón de 0,1 mol/l de citrato de sodio pH 5,0 con extracto de levadura (4,00 g/l), NH4SO4 (2,00 g/l), KH2PO4 (1,00 g/l), MgSO4.7H2O (0,30 g/l) [22]. Al matraz se le agregó una trampa de aire y se colocó en un agitador orbital (Neuation Technologies, Guyarat, India) a 36 °C y 14,24 rad/s por 48 h. Cada ensayo se hizo por triplicado. Se repitió el procedimiento variando la carga enzimática en 10, 15 y 20 UPF/g biomasa seca (CUADRO II).
Con la finalidad de evaluar el proceso de SSF a mayor escala e identificar mecanismos que disminuyan costos en el proceso, se seleccionó el ensayo realizado a nivel matraz con mayor rendimiento y se realizaron pruebas SSF para volúmenes de reacción de 2500 ml y 4000 ml, empleando un biorreactor agitado por paletas de 5 litros de capacidad nominal (New Brunswick, Hamburgo, Alemania), a 36 °C y 14,24 rad/s por 48 h. En este caso, se mantuvo constantes la carga de biomasa (5 % p/p) y la dosificación de enzima (15 UPF/g biomasa seca) y se varió el medio estéril y el inóculo. Así, en primer lugar, se sustituyó la solución tampón de citrato con nutrientes por agua destilada (agua de grado tipo I, según la norma ASTM D1193-06) y, en segundo lugar, se inoculó la levadura a 36 °C durante 15 minutos (CUADRO V). Este inóculo se utilizó para todos los ensayos indicados en el CUADRO V.
2.7 Análisis estadístico
Se realizó un análisis de varianzas (ANOVA) de los datos experimentales de rendimiento de etanol para determinar si existen diferencias significativas, empleando la herramienta de análisis de datos de Microsoft Excel 2013, con un nivel de confianza del 95 % (α = 0,05). Los datos tendrían diferencias significativas si p ≤ 0,05 [23].
3. Resultados y discusión
3.1 Composición química de la cáscara de Jatropha curcas
Las composiciones de carbohidratos estructurales de la JCS pretratada y sin pretratar se indican en el CUADRO I. El valor de celulosa de la JCS concuerda con los valores reportados en otras investigaciones (13,10 - 42,80 %) [24]. El contenido de celulosa en la JCS pretratada (48,70 %) es más alto que el contenido en la JCS sin pretratar (42,17 %), debido a la degradación de la hemicelulosa y lignina causada por el pretratamiento hidrotérmico [25]. El contenido de hemicelulosa en la JSC pretratada presenta un leve incremento (16,34 %) en comparación a la JSC sin pretratar (16,14 %), mientras que la concentración de lignina incrementa notablemente de 25,94 % en la JCS a 34,20 % en la JCS pretratada. Esta variación se debe, principalmente, a la solubilización de ciertos compuestos presentes en la JSC, considerados como extractivos, durante el pretratamiento, haciendo que los carbohidratos estructurales se concentren.
Cuadro I Composición química de la cáscara de Jatropha Curcas
| Componente | Componente | Material pretratado |
| - | Contenido promedio, %p/p | Contenido promedio, %p/p |
| Celulosa | 42,17 (± 0,61) | 48,70 (± 0,31) |
| Hemicelulosa | 16,14 (± 0,53) | 16,34 (± 0,24) |
| Lignina | 25,93 (± 0,83) | 34,20 (± 1,33) |
Pretratamiento realizado a 200 °C por 15 minutos. Los datos corresponden a base seca
3.2 Sacarificación y Fermentación simultánea
Todos los experimentos SSF fueron realizados a 36 °C y 48 h, sin embargo, durante la investigación, se observó que el máximo de concentración de etanol es alcanzado a las 24 h, lo que está acorde con los estudios desarrollados, donde mencionan que la conversión total de glucosa a etanol se encuentra entre 12 – 24 h [16].
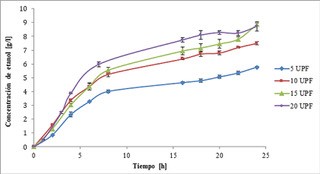
Fig. 1 SSF de la cascara de Jatropha curcas usando 5 % de sólidos, solución tampón de 0,1 mol/l de citrato de sodio con extracto de levadura, NH4SO4, KH2PO4, MgSO4.7H2O, y diferente carga de enzima.
En la Fig. 1 se indica la tasa de generación de etanol bajo diferentes cargas enzimáticas. Se observa que con 20 UPF/g biomasa seca, entre las 8 h y 20 h, se obtiene la mayor tasa de generación de etanol, sin embargo, a las 24 h se produce una concentración máxima de etanol (8,72 g/l) similar a la obtenida con 15 UPF (8,84 g/l). En el caso de la SSF realizada con 5 UPF y 10 UPF, se observaron tasas de conversión menores que las obtenidas con 15 UPF y 20 UPF, alcanzando una concentración máxima de etanol de 5,76 g/l y 7,50 g/l, respectivamente.
En el CUADRO II, se puede observar los rendimientos de etanol obtenidos con diferentes dosis de enzima. Con los experimentos de 15 UPF y 20 UPF se alcanzaron los mejores rendimientos y son estadísticamente similares (p > 0,05) acorde a los resultados del CUADRO VI. En este caso, al emplearse menor cantidad de enzima en el experimento realizado con 15 UPF/g biomasa seca, se considera que son las condiciones óptimas para alcanzar el mayor rendimiento de producción de etanol (0,177 g etanol/ g biomasa seca) y la mayor conversión de celulosa (63,90 %).
La conversión de celulosa indica el grado de trasformación de la cantidad teórica de glucano disponible en la biomasa a glucosa (1,11 g glucosa/g glucano) y la fermentación de esta glucosa a etanol (0,51 g etanol/g glucosa) [16] [26] mediante la cual se puede evaluar la eficiencia del proceso. En el CUADRO III, se presentan diferentes valores de conversión de celulosa reportados en otras investigaciones de SSF con biomasa lignocelulósica. Para la cáscara de Jatropha curcas, Visser et al. [16] reporta una conversión de celulosa de (40,43 % - 41,03 %) para un proceso de SSF empleando cáscara pretratada en medio ácido o alcalino a 121 °C por 1 h, siendo un rendimiento menor al obtenido para el presente trabajo. Esto indica que el pretratamiento hidrotérmico empleado en el presente trabajo para la JCS es más recomendable que el pretratamiento ácido o alcalino en las condiciones indicadas para la obtención de etanol mediante SSF. Sin embargo, para otras investigaciones de SSF realizadas con otros tipos de biomasa, pretratamientos y cepas de microrganismos, se reportan valores superiores de conversión. Para el caso de la paja de arroz pretratada en medio ácido, se indica una conversión de celulosa superior (73,58 %) cuando se emplea en la fermentación Rhizopus oryzae en lugar de Saccharomyces cerevisiae [27]. Con biomasa de álamo pretratada por explosión de vapor, Ballesteros et al. [26] reporta una conversión de 71,2 % para SSF empleando Kluyveromyces marxianus. La conversión de celulosa reportada para otros tipos de biomasa pretratada por explosión de vapor es similar a la obtenida en el presente trabajo para 15 UPF/g.
Cuadro II SSF de cáscara de Jatropha Curcaspretratada usando diferentes condiciones
| Carga de Sólidos (JSC pretratada seca) | Carga de enzima | Dosificación de levadura | Concentración de etanol | Concentración de etanol | Conversión de celulosa |
| % p/p | UPF/ g JSC pretratada seca | mg/ml | g/l | g etanol/g biomasa seca | % p/p |
| 5 | 5 | 1 | 5,76 (± 0,06) | 0,099 (± 0,001) | 35,83 (± 0,46) |
| 5 | 10 | 1 | 7,50 (± 0,12) | 0,124 (± 0,002) | 44,69 (± 0,83) |
| 5 | 15 | 1 | 8,84 (± 0,16) | 0,177 (± 0,003) | 63,90 (± 1,14) |
| 5 | 20 | 1 | 8,72 (± 0,34) | 0,174 (± 0,007) | 63,06 (± 2,49) |
Todos los ensayos descritos en el CUADRO II fueron desarrollados usando el mismo medio estéril (solución tampón de 0,1 mol/l de citrato de sodio con extracto de levadura, NH4SO4, KH2PO4, MgSO4.7H2O) y un volumen de 24 ml. Los experimentos fueron realizados por triplicado por lo que, en el cuadro se muestran los promedios ± la desviación estándar.
Cuadro III Comparación del porcentaje de conversión de celulosa reportado en trabajos de SSF similares
| Materia prima | Carga de sólidos, % p/p | Carga de enzima, UPF/g de sustrato | Tipo de pretratamiento | Microorganismo para fermentación | Conversión de celulosa, % | Referencia |
| Cáscara de Jatropha curcas | 5 | 15 | Hidrotérmico con agua caliente | Saccharomyces cerevisiae | 63,90 (± 1,14) | Este estudio |
| Cáscara de Jatropha curcas | 7,5 | 15 | Ácido diluido | Saccharomyces cerevisiae | 40,43 | [16] |
| Cáscara de Jatropha curcas | 7,5 | 15 | Alcalino | Saccharomyces cerevisiae | 41,03 | [16] |
| Paja de arroz | 5 | 15 | Ácido diluido | Saccharomyces cerevisiae | 60,77 (± 2,20) | [27] |
| Paja de arroz | 5 | 15 | Ácido diluido | Mucor indicus | 67,62 (± 2,38) | [27] |
| Paja de arroz | 5 | 15 | Ácido diluido | Rhizopus oryzae | 73,58 (± 2,68) | [27] |
| Álamo | 10 | 15 | Explosión de vapor | Kluyveromyces marxianus | 71,2 | [26] |
| Eucalipto | 10 | 15 | Explosión de vapor | Kluyveromyces marxianus | 62,5 | [26] |
| Paja de trigo | 10 | 15 | Explosión de vapor | Kluyveromyces marxianus | 62,5 | [26] |
Las mejores condiciones para la SSF de la JSC a un volumen de 24 ml (5 % de carga de sólidos, 15 UPF/ g JSC pretratada y 1 mg/ml de levadura) fueron escaladas a un tamaño de 2500 ml (CUADRO V) para determinar la afectación de incrementar 100 veces el volumen de reacción en el rendimiento de etanol. Además, en este caso, se sustituyó la solución tampón por agua destilada con y sin nutrientes (extracto de levadura, NH4SO4, KH2PO4, y MgSO4.7H2O), con el fin de identificar posibles oportunidades de reducción de costos en cuanto a insumos químicos para el escalamiento del proceso, en razón de que uno de los campos que también involucra el escalamiento es el económico. En la experimentación a escala de laboratorio, por lo general, las implicaciones de tiempo y costo de un experimento no son tan relevantes como en un escenario de producción a mayor escala [28].
Cuadro IV Resultados del análisis de varianza (α = 0,05)
| Comparación | F calculado | Probabilidad (p) | Valor crítico para F |
| AB | 0,283998832 | 0,622323157 | 7,708647422 |
| AC | 33,65577995 | 0,004390906 | 7,708647422 |
| CDE | 1,118509557 | 0,386494688 | 5,14325285 |
A: 5 %, 15 UPF, 24 ml; B: 5 %, 20 UPF, 24 ml; C: 5 %, 15 UPF, 2500 ml (con sales); D: 5 %, 15 UPF, 2500 ml (sin sales); E: 5 %, 15 UPF, 4000 ml (sin sales).
Los resultados del análisis estadístico (CUADRO VI) mostraron que los rendimientos de etanol y conversiones de celulosa son similares (p > 0,05) entre los ensayos realizados con y sin adición de nutrientes a una escala mayor (CUADRO V), indicando que podría existir un ahorro de recursos en el proceso a mayor escala. Una vez verificado eso, el mismo ensayo (5 % de carga de sólidos, 15 UPF/g JSC pretratada con agua destilada sin nutrientes) fue escalado a 4000 ml, con el fin de identificar si existen cambios en el rendimiento al aumentar el volumen de reacción de 2500 ml a 4000 ml.
Si bien los resultados del escalamiento presentan rendimientos similares (CUADRO V), con y sin nutrientes, se evidencia por medio del análisis de varianza (CUADRO IV) que los ensayos a mayor escala presentan rendimientos de etanol con diferencias significativas (0,160 - 0,164 g etanol/g biomasa seca) con respecto al obtenido para un volumen de 24 ml (0,177 g etanol/g biomasa seca) (p < 0,05). Esta disminución del rendimiento está entre el 7,34 % y 9,60 % y podría deberse, principalmente, al cambio de instrumentos y manipulación propia del escalado, pudiendo ser uno de los factores el sistema de agitación, ya que a mayor escala se dificulta obtener una distribución homogénea para el accionar de las enzimas y levaduras [29]. Con los resultados obtenidos en el escalamiento, se evidencia la necesidad de realizar ajustes en las condiciones del proceso SSF, como pueden ser el tamaño de partícula, velocidad de agitación, carga de sólido o dosificación de enzima con el fin de conseguir incrementar la conversión de celulosa, dado que en el escalamiento de procesos se requiere mantener la tasa de producción [30]. El incremento de la dosis de enzima podría mejorar el proceso de SFF, sin embargo, se debe tomar en cuenta las implicaciones económicas que esto podría conllevar a una mayor escala [26].
Cuadro V SSF de cáscara de Jatropha Curcas pretratada en diferentes volúmenes de ensayo
| Volumen | Concentración de etanol | Rendimiento de etanol | Conversión de celulosa | Medio |
| ml | g/l | g etanol/ g biomasa seca | % p/p | - |
| 2500 | 7,98 (± 0,20) | 0,160 (± 0,004) | 57,71 (± 1,46) | Agua destilada con nutrientes |
| 2500 | 8,13 (± 0,18) | 0,163 (± 0,004) | 58,77 (± 1,33) | Agua destilada sin nutrientes |
| 4000 | 8,21 (± 0,20) | 0,164 (± 0,004) | 59,41 (± 1,43) | Agua destilada sin nutrientes |
Los nutrientes se refieren a extracto de levadura, NH4SO4, KH2PO4, y MgSO4.7H2O. Todos los ensayos de este cuadro se desarrollaron utilizando una carga de 5 % de sólidos y 15 UPF/g biomasa seca. Los experimentos fueron realizados por triplicado, por lo que, en el cuadro, se muestran los promedios ± la desviación estándar.
En todos los experimentos del presente trabajo, se utilizó Saccharomyces cerevisiae para la fermentación de la glucosa obtenida en la hidrólisis enzimática realizada con Cellic CTec2. Este coctel enzimático, al tener hemicelulasas, es capaz de degradar la hemicelulosa de la biomasa para obtener xilosa [27], sin embargo, la levadura mencionada no tiene la capacidad de transformar este tipo de azúcar a etanol. Por lo tanto, los resultados de rendimiento de etanol, obtenidos a partir de la cáscara de Jatropha curcas, se podrían incrementar utilizando microorganismos que puedan fermentar hexosas y pentosas a etanol, como es el caso de las cepas de Mucor indicus y Rhizopus oryzae [27]. Además de lo antes mencionado, el proceso SSF podría ser mejorado empelando cepas de microorganismos termotolerantes para la fermentación, como la cepa de la levadura Kluyveromyces marxianus CECT 10875 utilizada por Ballesteros et al. [26]. De esta manera, se podría trabajar a temperaturas mayores a 36 °C, acercándose más a la temperatura óptima de operación de la enzima Cellic CTec2 que es de 50 °C [31]. Este incremento en la temperatura permitiría también evitar riesgos de contaminación en SSF [26]. Adicionalmente, el rendimiento de etanol se podría mejorar incrementando la carga de sólido y empleando surfactantes como aditivos para el proceso de SFF, como en el estudio desarrollado por Nogueira et al. [32] en el cual se alcanzó un alto rendimiento de celulosa a etanol (89,8 %) mediante SSF de fibras de coco sin pretratar.
Conclusiones
La presente investigación evaluó la cáscara de Jatropha curcas pretratada con agua caliente en procesos SSF, con el fin de determinar la carga enzimática que maximice el rendimiento de etanol. Los resultados indican que, con 5 % p/p de sólidos, 15 UPF /g, y 1 mg/ml de levadura se alcanza el máximo rendimiento de etanol (0,160 - 0,177 g Etanol/g biomasa) y conversión de celulosa (57,71 - 63,90 %).
Replicando el ensayo de máxima concentración de etanol obtenido para 24 ml, a mayores volúmenes, se tiene un rendimiento de etanol ligeramente menor, sin embargo, los resultados indican que el medio estéril de 0,1 mol/l de citrato de sodio (pH 5,0) con nutrientes puede ser reemplazado por agua destilada, sin afectar al rendimiento de etanol, lo que permitiría bajar costos de producción en procesos SSF a mayores escalas de producción.
Estudios posteriores podrían considerar emplear cepas de microorganismos capaces de fermentar glucosa y xilosa a etanol, con el fin de incrementar el rendimiento del proceso SSF con cáscara de Jatropha curcas. De igual manera, se requiere mejorar las condiciones del escalamiento para mantener la tasa de producción de etanol.















