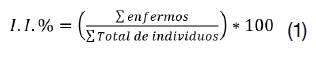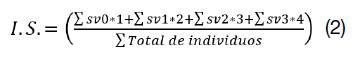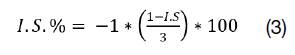Introducción
A partir de los años noventa se han implementado en Costa Rica diversas iniciativas ligadas al mejoramiento genético de especies forestales. Dicho proceso inicio con huertos semilleros, para luego enfocar esfuerzos hacia una silvicultura clonal actualizada y sistematizada en paquetes tecnológicos para el establecimiento y manejo intensivo de sistemas de producción forestal (1, 2, 3). Lo anterior en función tanto del uso como la conservación de los genotipos mejor adaptados a condiciones específicas de sitio, o resistentes a enfermedades, y, con ello, que los distintos sistemas registren indicadores productivos y financieros lo suficientemente atractivos que incentiven su uso a escala comercial (4, 5, 6).
Distintos autores han generado un amplio espectro de conocimiento científico acerca de la especie Gmelina arborea Roxb, desde técnicas de propagación hasta sistemas novedosos para su cultivo intensivo en sitios específicos (7, 8, 3, 9, 10, 11). A partir de ello se ha logrado la reducción de costos de producción y garantizar material clonal de la calidad y cantidad requeridas para el mercado (12, 13, 14); así como la determinación de periodos óptimos de enraizamiento de la especie, tomando en cuenta diámetro y altura de los esquejes (15) y la evaluación del área foliar adecuada para maximizar el enraizamiento de la melina (16).
A pesar de dichos esfuerzos, aún existen vacíos de información en la reproducción clonal vegetativa de la especie, por ejemplo, la selección de genotipos resistentes a enfermedades, variabilidad genética y selección de controladores químicos y/o biológicos eficaces para distintas enfermedades, entre otros (15). Estas carencias adquieren suma importancia en la estandarización del proceso, máxime ante el rol que, hoy en día, ha asumido para la industria de la multiplicación de plantas de alta calidad.
En Costa Rica, G. arborea se ha convertido en una de las especies forestales que más se establece con fines comerciales debido a su rápido crecimiento, gran adaptabilidad a diferentes sitios, y madera muy versátil para la elaboración de productos primarios y secundarios (17, 18, 19, 20). Sin embargo, ningún proceso tendiente a generar altos rendimientos está exento de riesgos y situaciones de mejora, y la silvicultura clonal no es la excepción. Por ejemplo, problemas fitosanitarios, causados por patógenos inherentes o los que puedan desarrollar la capacidad de infectarla, son parte de los riesgos que pueden causar la muerte parcial o total del individuo, o afectar la calidad del producto (20, 21, 22). (23) apunta que, la propagación asexual a partir de brotes tiernos o estacas predispone a las especies a presentar problemas fitopatológicos. Es precisamente la etapa de plántula la más delicada, donde se reportan la mayor parte de los ataques por hongos (8).
No obstante, distintos autores concuerdan que, la incidencia de plagas y enfermedades es más influenciada por las condiciones del vivero, el comportamiento del insecto o patógeno, las condiciones medio-ambientales e inclusive la excesiva cantidad de plantas en cada bandeja o contenedor, que propiamente si el material proviene de semilla (sexual) o reproducido mediante estacas (25). Sin embargo, el desarrollo de problemas fitosanitarios en viveros de melina, que parecen haber ocasionado serios danos en plantación, se han visto incrementados grandemente con el uso de la reproducción vegetativa. Es decir, un material salido de vivero endeble, afectado por alteraciones morfológicas y fisiológicas como lesiones acuosas, clorosis, marchitamiento y podredumbre, causadas por agentes patógenos impactaría negativamente el desempeño de la plantación forestal (26, 20, 22); además propiciaría quedar expuesto al ataque de otros patógenos como Nectria sp. una vez establecido en campo (27, 28).
Para atender lo anterior, es trascendental tener claro que la administración de riesgos depende en gran medida de conocerlos y comprenderlos (29). Para el caso en estudio, una vez identificado un problema fitosanitario, se debe entender y cuantificar con la mayor prontitud posible, para luego controlarlo; de tal manera que, no haya una interferencia significativa en el crecimiento de los individuos. Lo anterior se debe aplicar tanto en vivero como en campo, para lo cual se puede recurrir ya sea a agentes de control químico o biológico (30), o de ser posible mediante un manejo integrado de la situación. Adicionalmente, la susceptibilidad o tolerancia de los distintos genotipos hacia agentes patógenos debe ser tomada en cuenta como un aspecto primordial en el mejoramiento de los procesos.
El Instituto de Investigación y Servicios Forestales de la Universidad Nacional (INISEFOR) posee y multiplica una colección de nueve genotipos de melina. En los últimos ciclos de producción vegetativa se han registrado entre un 5 % y 10 % de las plantas que presentan una pudrición en la base del tallo de las plantas, precedida por distintos síntomas y signos que se considera es imprescindible registrar e identificar cuanto antes. Lo anterior en concordancia con (31), los cuales llaman la atención sobre el peligro que representan las enfermedades fungosas en vivero, y más aún, si se identifican materiales genéticos más sensibles que podrían llegar a ser devastados. Es por ello, y todo lo anteriormente apuntado, que el presente trabajo se planteó el objetivo de determinar si existen diferencias entre genotipos de melina en cuanto a su tolerancia o susceptibilidad al ataque de la enfermedad aquí denominada “Pudrición del tallo”, registrada en plántulas de melina clonal en fase de vivero. Los resultados generados en este estudio servirán como un insumo para el mejoramiento del paquete de reproducción clonal vegetativa aplicado a la especie, el cual debe evolucionar permanentemente en la búsqueda de producir material vegetal de alta calidad y sanidad.
Materiales y métodos
Área de estudio y material evaluado
La investigación se desarrolló en el vivero de reproducción vegetativa “La Amapola” del INISEFOR, ubicado en la provincia Puntarenas, cantón Golfito, distrito Puerto Jiménez y localidad La Palma (coordenadas geográficas N 8°36´49” y W 83°26´10”). La precipitación media anual del sitio varía entre 3500 mm y 4000 mm, se encuentra en el piso basal tropical, con una temperatura media anual que varía entre 24 °C y 28 °C (32) y en la zona de vida Bosque muy húmedo premontano transición a basal (33).
Las plantas evaluadas en la presente investigación fueron reproducidas a partir de la colección clonal de melina del INISEFOR, la cual consta de nueve genotipos utilizados en el establecimiento de sistemas de producción forestal y agroforestal. Los individuos fueron evaluados en dos distintas etapas, según la metodología requerida en cada uno.
Construcción de la escala diagramática
La metodología empleada para el desarrollo de la escala diagramática se basó, inicialmente, en la experiencia adquirida por parte de los investigadores a cargo del vivero. Lo anterior debido a que, la patología muy temprana de la enfermedad corresponde a la presencia de manchas claras, puntos y/o estrías pequeñas, así como necrosis basal, los cuales resultan apenas visibles. (31) recalcan la necesidad que este tipo de observaciones preliminares se conviertan en ensayos científicamente planificados.
Con el recuento de los primeros indicios de la enfermedad como punto de partida, se evaluaron cuatro mil plantas provenientes de tres producciones distintas de material clonal; todas en la etapa del proceso de reproducción vegetativa denominada aclimatación, es decir, inmediatamente después de salir de los túneles de enraizamiento y antes de la etapa de endurecimiento para salir a campo. En este momento las plantas se encuentran en jiffy colocadas en bandejas a nivel del suelo, a 3 m sobre ellas tienen un sarán de 75% de sombra que filtra la luz que penetra el plástico del invernadero y una altura promedio de 10 cm por encima del sustrato. Se revisaron, una por una, todas las plantas, y se seleccionaron aquellas que presentaron algún posible síntoma del inicio de la enfermedad.
Posteriormente, se clasificaron y agruparon según síntomas y grado de afectación similar. Finalmente, se dejaron en grupos de al menos 15 plantas por indicio temprano y grado de afectación de la enfermedad. De la misma manera, se seleccionaron 5 grupos de plantas que no registraron ningún síntoma, en apariencia sana, como testigo del ensayo experimental.
Todo el material se colocó en bandejas separadas y se dio seguimiento diario a la evolución de los eventuales síntomas iniciales identificados, y con ello determinar cuál de ellos desencadenaban en la etapa final de la enfermedad, que necesariamente debía corresponder al tope máximo de la posible escala diagramática, es decir, la pudrición del tallo y consecuente muerte del individuo. La Figura 1 presenta tres distintas imágenes que corresponden a ese grado final de la enfermedad. Según (22) y (34), se trataría de un patógeno que se caracteriza por presentar síntomas necróticos. Con base en la evolución de los síntomas iniciales identificados se generó la escala, mediante la cual se determina el nivel de afectación que registra cada individuo que sea evaluado.
Figure 1. Symptoms of Stem rot advanced stage.
Determinación del Índice de Incidencia y Severidad entre genotipos del conjunto genético evaluado
Una vez generada la escala, se reprodujeron y evaluaron 100 plantas de cada uno de los nueve clones que comprenden la colección genética. El total de 900 plantas se colocaron en 10 bloques de 90 individuos cada uno, que corresponden a 10 plantas de cada genotipo.
La evaluación sobre cada rameto se basó en las siguientes variables dependientes:
1. Índice de Incidencia (I.I. %): Corresponde a la presencia o ausencia de la enfermedad (valorado con 1 o 0, respectivamente), a partir de lo que se obtendrá el porcentaje de plantas que registraron síntomas por cada clon, similar a la metodología empleada por (10) (ver ecuación 1).
2. Índice de Severidad (I.S.): Se determinó a partir de la aplicación de la escala desarrollada y mediante una modificación a la fórmula planteada por (10). Con base en esta variable, se evidenciaron las posibles diferencias entre genotipos en cuanto al daño provocado por la enfermedad (ver ecuación 2). Para facilidad de análisis e interpretación, el valor obtenido por medio de la escala (valores absolutos entre 0 y 3) se transformará en una escala porcentual positiva de “0 a 100” (ver ecuación 3).
Donde:
Σsv= Es la sumatoria del valor de severidad de cada uno de los grados de severidad
I.S.= Es el resultado arrojado por el índice de severidad
Dichas variables fueron evaluadas al finalizar la etapa de endurecimiento, es decir, aproximadamente a la semana seis posterior a haberse colocado el material en el túnel de enraizamiento, justo cuando están listas para ir a campo. En esa etapa las plantas reciben toda la luz que penetra el plástico del invernadero, tienen riego restringido según el protocolo para generar cierto nivel de estrés que las prepare para las posibles condiciones de campo y registran una altura promedio entre 15 cm y 20 cm. Es en este momento que se clasificaron los clones en tolerancia alta, media y baja a la enfermedad.
Finalmente, a la información recopilada sobre incidencia y severidad por clon (variables dependientes) se le realizo un Análisis de Varianza y Prueba de Medias de Tuckey mediante el software InfoStat/L (35), con base en las cuales se identificaron las diferencias estadísticamente significativas entre genotipos (p<0,05).
Resultados y discusión
Sistematizar la información obtenida de la evaluación de las plantas de melina clonal permitió organizar secuencialmente la sintomatología de la enfermedad, para posteriormente ser esquematizados en la escala de severidad propuesta. En términos generales, el 7 % (280) de las cuatro mil plantas evaluadas para la construcción de la escala diagramática, presento alguno de los síntomas iniciales de la enfermedad. Este valor se encuentra en el rango observado previamente por los investigadores a cargo del proceso de reproducción vegetativa de la melina en el vivero La Amapola. El valor de incidencia se considera bajo, si se compara con el 30 % reportado por (25), para la enfermedad de ruptura de la base del tallo en melina clonal asociada a Sclerotium sp. en la India. Se registró el porcentaje de aparición de cada uno de los indicios de la enfermedad, solo o combinados (Figura 2).
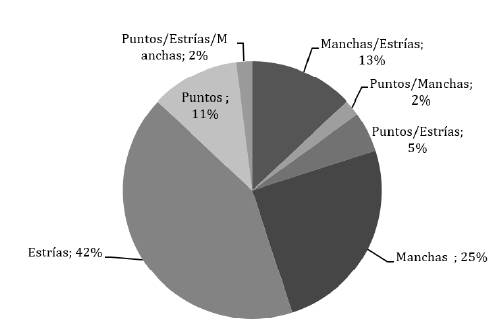
Figura 2 Porcentaje de los síntomas de la enfermedad presentados en la población evaluada de Gmelina arborea Roxb.
Figure 2. Percentage of symptoms of the disease presented in the evaluated population of Gmelina arborea Roxb.
En esas 280 plantas, el síntoma que más se repitió fue la presencia de estrías, seguido por manchas de color marrón claro a oscuro y puntos de diversos tamaños (42 %, 24 % y 11 %, respectivamente). Asimismo, se presentó la combinación de síntomas, 13 % de las plantas registraron estrías y manchas de color marrón, 4 % con la presencia de puntos y estrías, y finalmente en un 2 % la aparición de los tres principales síntomas (puntos-estrías-manchas). Estos síntomas concuerdan con lo reportado por (8) para la enfermedad del cuello de la raíz en plantas entre uno y dos meses de edad y además para un tipo de antracnosis en individuos de cuatro meses, ambas en melina y en vivero.
A partir de lo observado, la evolución sintomatológica parte de cambios en la coloración del tejido epidérmico, así como puntuaciones y/o estrías longitudinales. La Figura 3 presenta la escala diagramática generada para determinar el grado de avance de la enfermedad, de manera que se pueda determinar la severidad en cada individuo evaluado. En la mayoría de las plantas evaluadas los síntomas inicialmente aparecen en los primeros 2 cm por debajo de la parte superior del Jiffy, esto resulta de suma importancia conocerlo, evidencia la necesidad de revisar el tallo de la planta inclusive por debajo del sustrato para asegurar que no haya síntomas. Por otra parte, en sus inicios, la afectación del patógeno es superficial, por lo que en su primera etapa no compromete la rigidez del tallo.
Según la escala generada y presentada en la Figura 3, en la primera etapa de afectación (Grado 1), las manchas tienen una forma asimétrica de coloración café claro que no cubre más de un tercio de la circunferencia del tallo. Por lo general, en este primer nivel aún no se presentan estrías, ya sean longitudinales o forma de punto. No obstante, en caso de presentarse, estas tienden a ser de un color oscuro y no más largas a 0,5 cm. La estría longitudinal abarca un tamaño que no supera más de un tercio de la circunferencia del tallo. Las estrías con forma de punto tienden a ser muy pequeñas, con un diámetro igual o inferior a 0,1 cm. En caso de presentarse alguna de las estrías descritas, estas no tienen secreción de líquidos a simple vista o con lupa (30x).

Figura 3 Escala diagramática del avance de la “Pudrición del tallo” en plántulas de melina clonal en el vivero del INISEFOR en La Palma de Puerto Jiménez, Pacifico Sur de Costa Rica.
Figure 3. Diagrammatic scale of the progress of “Stem Rot” in clonal melina seedlings at the INISEFOR nursery in La Palma, Puerto Jimenez, South Pacific of Costa Rica.
El Grado 2 de la enfermedad se caracteriza por una zona de afectación que se extiende hasta abarcar dos terceras partes de la circunferencia del tallo; las zonas necrosadas pueden avanzar tanto en sentido longitudinal como radial. En este punto no se encuentran indicios aislados, sino que aparecen combinaciones de dos o inclusive los tres síntomas reportados. Asimismo, en la zona afectada se puede observar la secreción de un líquido claro como respuesta del árbol ante las heridas sufridas, las cuales registran una mayor profundidad del daño y causan la afectación en la rigidez del tallo.
En la etapa final (Grado 3), la infección compromete en su totalidad la zona basal del tallo, por lo que cede y se quiebra, con lo que finalmente se genera el deceso de la planta. La coloración de la zona varía entre marrón oscuro a negro. Los individuos infectados no presentaron, en ninguna de las fases anotadas, danos o cambios en la composición, coloración o estructura tanto de las hojas como de las raíces del individuo, aun en este último nivel. Este resultado sugiere la necesidad de no basar la evaluación de sanidad de plantas de melina clonal en solo la observación de su follaje, con lo que resulta indispensable revisarlas en la base de los tallos y un poco más abajo, antes de colocarlas en las cajas donde serán transportadas al sitio de plantación.
El Cuadro 1 presenta los distintos niveles de la enfermedad, sistematizados mediante la escala diagramática generada en la evaluación de 4 000 plántulas de melina clonal. El Grado 0 correspondió a un esqueje completamente sano, es decir, sin ningún tipo de evidencia de daño; mientras que el Grado 3 corresponde a una plántula con el tallo totalmente podrido, lo que desencadena la ruptura y muerte.
Cuadro 1 Escala diagramática para categorizar la severidad de la pudrición del tallo en plántulas de melina clonal.

(10) mencionan que, al proponer una escala, la misma debe coincidir sintomatológicamente con las características expresadas por la enfermedad. Adicionalmente, los mismos autores agregan que debe ser objetiva, funcional y de fácil utilización. Al respecto, la generada en esta investigación logra registrar y entender el progreso de la enfermedad, y con ello evaluar el grado de severidad que provoca la pudrición del tallo en plántulas de melina clonal, con lo que se cumple con lo expresado por dichos autores. Además, en principio, la aplicación de la escala no depende del paquete tecnológico empleado en la reproducción vegetativa de la especie, el cual puede ser altamente tecnificado o un poco más artesanal, con lo que su ámbito de utilización sería muy amplio.
Una vez verificada la empleabilidad de la escala, se procedió a aplicarla sobre 100 plantas de cada uno de los nueve clones multiplicados por el INISEFOR.
Las diferencias en susceptibilidad en la aparición de la enfermedad entre genotipos se presentan en el Cuadro 1. En él se muestra que, ocho de los nueve clones evaluados registraron la presencia de síntomas iniciales de la enfermedad (incidencia) en menos del 30 % de sus plantas, únicamente el clon 1 presento un valor superior.
Se encontraron diferencias estadísticamente significativas en la susceptibilidad de la aparición de la enfermedad entre clones. Los resultados sugieren tres grupos que se podrían catalogar como de baja, media y alta incidencia. Los clones 16 y 8 registraron los menores porcentajes de incidencia (10 % cada uno), además de solo presentar plantas en los niveles 0 y 1 de la escala, por lo que se podrían denominar como de baja susceptibilidad a la aparición de la enfermedad. Caso contrario el 15 y 1, presentaron la mayor presencia de la enfermedad, con incidencia de 29 % y 38 %, respectivamente; por tal motivo son estadísticamente diferentes al 16 y 8, y adicionalmente catalogados como de alta susceptibilidad.
Los restantes cinco genotipos (12, 2, 9, 6 y 3) registraron valores de incidencia muy similares entre sí, por lo que se agrupan como de susceptibilidad media. El anterior resultado es de suma importancia al identificar que únicamente los clones 1 y 3 registraron plantas en el grado 3 de la escala, lo que apunta a dos posibilidades: la primera seria tener mayores cuidados y atención sobre su reproducción vegetativa, o la segunda, eliminarlos al menos momentáneamente de la colección clonal que se multiplica con fines de reforestación comercial. Al respecto, (29) apuntan la necesidad de ser muy cuidadosos con la producción de plantas que serán utilizadas en sistemas de producción forestal, al ser un posible foco en campo para que se esparzan distintos tipos de enfermedades, por lo que es indispensable tener un mayor entendimiento de los microorganismos, las posibles causas de patologías y su manejo.
Como es de esperar en un proceso patológico, la mayor parte de las plántulas que presentaron síntomas correspondientes a la presencia de la enfermedad se encontraron en el grado de severidad 1, donde resalta la aparición de estrías, puntos y/o manchas, que envuelven menos de un tercio de la circunferencia del tallo. A pesar de encontrarse plantas de seis clones catalogadas como de grado 2, fueron hasta un máximo de 3 individuos por cada 100 plantas evaluadas, lo que brinda posibilidades de actuar antes que las mismas migren a grado 3. Tanto (36) como (31) concuerdan en que el comportamiento mostrado en el ensayo es normal, al obtener un porcentaje de incidencia general para la población de 19 %, lo que los autores catalogan como relativamente bajo. Lo anterior se ratifica al comparar dicho resultado con el 30 % de incidencia del patógeno Sclerotium sp reportado por (25).
Esto por ser altamente resistente a condiciones desfavorables, con lo que consigue persistir en determinados momentos para posteriormente desarrollar la enfermedad (24).
Situación similar a la registrada en incidencia se presentó en la evaluación de la severidad (Cuadro 1). Los clones con el menor valor, es decir el resultado más favorable, son el 16, 8 y 12. Situación contraria para el 15 y 1, lo que es congruente con la incidencia descrita anteriormente. Los restantes cuatro genotipos registraron valores muy cercanos al promedio poblacional, lo que representa una ventana abierta de posibilidades para manejar con ellos esta situación. Se deben tomar decisiones cuanto antes con dichos clones, para que no se presente un 60 % de severidad del ataque del hongo Sclerotium sp. sobre material clonal en vivero, según lo reportado por (26). El hecho que se registraran resultados similares entre clones en la evaluación, tanto de la incidencia como de la severidad, le da gran fortaleza a la investigación, principalmente en el aspecto del conocimiento generado para la toma de decisiones con base en datos científicamente obtenidos. (37) ratifica lo anterior al concluir que, una correcta identificación del patógeno, así como la determinación de la naturaleza e intensidad del daño es esencial para adoptar estrategias de manejo adecuadas, con el fin de evitar un aumento en el precio, producto de la perdida de plantas en vivero.
Conclusiones y recomendaciones
La escala diagramática desarrollada resulto efectiva para identificar y categorizar desde los rasgos iniciales de la enfermedad (puntos, manchas y estrías) hasta su evolución final con la quebradura del tallo producto de su pudrición. Lo anterior se ratificó en su validación al aplicarla sobre los nueve genotipos. A pesar de registrarse valores de incidencia y severidad relativamente bajos, se debe poner especial énfasis en identificar el patógeno para determinar formas de evitar su aparición o en su defecto controlarlo.
Los análisis estadísticos sugieren un efecto genético en cuanto a la susceptibilidad de la aparición de la patología. Se identifican, por un lado, a los clones 16 y 8 y por el otro al 15 y 1 como los de susceptibilidad baja y alta a la enfermedad, respectivamente. Por lo tanto, no se recomienda seguir multiplicando el clon 1 para establecimiento de sistemas de producción, al menos hasta que se identifique el agente causante de la enfermedad y su mecanismo de control.