Introducción
En Costa Rica, el estado ha promovido el establecimiento de plantaciones forestales y otras modalidades de producción, con el objetivo de garantizar el consumo nacional de madera. Hasta el año 2015, se registraron 105 000 ha reforestadas con especies como Gmelina arborea (Roxb.ex Sm.), Tectona grandis (L. f.), Vochysia spp., Cupressus lusitanica (Mill.), Acacia mangium (Willd.), Alnus acuminata (Kunth), Hyeronima alchorneoides (Allemão) y Cordia alliodora ((Ruiz & Pav.) Oken) (1). Además, se ha iniciado el establecimiento de cobertura arbórea para protección de cuencas, corredores biológicos y urbanos, arboricultura, etc. (2), (3), (4), (5). Para el 2012, se contabilizan en el país 37 viveros, produciendo aproximadamente 6 682 416 plantas (6).
Los viveros representan una fase fundamental de la ordenación de los recursos forestales, al ser el sitio de la producción intensiva de plantas, en la cantidad y calidad requeridas, para ser trasplantadas en campo. Tomando en cuenta que las plantas van a ser distribuidas en casi todo el territorio nacional, estas deben salir libres de cualquier problema fitosanitario. Es por ello que, para minimizar estos daños, es fundamental detectar adecuadamente en los viveros, plagas y enfermedades, con el objetivo de aplicar las medidas de manejo correspondientes (7), (8), (9). Dentro de las metodologías del control de calidad de plantas en viveros forestales, se debe incluir como parámetro el estado fitosanitario (46).
En el año 2007, (45) menciona problemas en plantas producidas por plagas y enfermedades forestales en Costa Rica, entre las principales plagas indica Gryllus assimilis (Gryllidae, Orthoptera) devorando plantas de Cupressus lusitanica (Mill.), Eucalyptus saligna (Sm.), Pinus caribaea (Morelet) y Pochota fendleri (Seem. W.S. Alverson & M.C. Duarte) y Agrotis sp. (Noctuidae, Lepidoptera) cortando tallos de plantas de Cordia alliodora (Ruiz & Pav.), P. caribaea y P. fendleri; en cuanto a los principales patógenos registra Phomopsis sp. (Diaporthales, Diaporthaceae) generando quema en ápices de Alnus acuminata (Kunth), Gmelina arborea (Roxb. ex Sm.) y Tectona grandis (L. f.) y Fusarium sp. (Nectriaceae, Hypocreales) causando lesiones necróticas en plantas de A. cuminata, T. grandis y Schizolobium parahyba (Vell. S.F. Blake).
Con el fin de garantizar plantas de calidad en los diferentes procesos de reforestación y arborización, se realizó el presente estudio, con el objetivo de elaborar el diagnóstico de problemas fitosanitarios en viveros forestales en Costa Rica.
Materiales y métodos
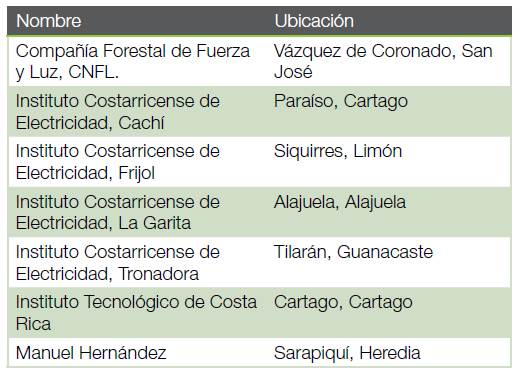
Durante el periodo comprendido entre los años 2011-2018, se realizó el diagnóstico fitosanitario en siete viveros forestales en Costa Rica (Cuadro 1).
En cada vivero se evaluó el estado fitosanitario de las plantas en producción. Se describieron los daños y los síntomas de los individuos enfermos y se recolectó el material representativo necesario para los análisis de laboratorio. Se transportaron plantas completas con el recipiente de producción, o partes de las plantas en bolsas plásticas transparentes; para las plagas insectiles o de ácaros, los materiales se introdujeron en cajas de plástico. Los análisis de identificación de patógenos y las actividades de crianza de insectos fueron realizados en el Laboratorio de Sanidad Forestal del Instituto Tecnológico de Costa Rica en Cartago.
Los insectos inmaduros causantes de daños fueron criados hasta la obtención de los adultos, los cuales fueron montados de acuerdo a las normas técnicas de montaje de insectos (10), (11), (12) y llevados a identificar por expertos al Instituto de Biodiversidad (INBio) y al Museo Nacional de Costa Rica.
Para la identificación de microorganismos patógenos como hongos y bacterias, se siguieron los procedimientos tradicionales de diagnóstico de enfermedades fitopatológicas, se observaron síntomas y signos bajo lupa estereoscópica, se colocaron las muestras en cámara húmeda y se realizaron aislamientos de síntomas y/o signos a medio de cultivo Papa Dextrosa Agar (PDA).
La caracterización morfológica de los aislados se realizó directamente desde los signos o desde las colonias creciendo en medio PDA incubados a 25°C durante siete días (13), (14), (15). Para la caracterización de estructuras fúngicas microscópicas, se colocaron fracciones de micelio obtenidas desde diferentes posiciones de la colonia, en portaobjetos con tinción de rojo congo o azul de lactofenol y en un microscopio de luz se realizaron observaciones de ascos, ascosporas y conidias. Para realizar la clasificación a nivel de género y especie se utilizaron las claves morfológicas de hongos imperfectos y Ascomycetes (43), (44).
Resultados
Se presentan a continuación los problemas fitosanitarios diagnosticados en viveros forestales en Costa Rica, de acuerdo al tipo de agente causal, la parte de la planta afectada y el síntoma o daño producido (Cuadro 2). Se identificaron 15 especies de insectos, 44 de patógenos y 5 de ácaros, en 80 especies forestales bajo producción.
Ver pdf Tabla 2. Problemas fitosanitarios en viveros forestales en Costa Rica.
Table 2. Phytosanitary problems in forest nurseries in Costa Rica.

Figura 1 Apiospora sp. en Tabebuia ochracea ((Cham.) Standl.). A. Necrosis producida en el follaje; B. Masas de ascosporas (color amarillo) emergiendo de estroma.
Figure 1. Apiospora sp. in Tabebuia ochracea ((Cham.) Standl.). A. Necrosis produced in the foliage; B. Ascospore masses (yellow color) emerging from stroma.

Figura 2 Plagas de ácaros en viveros. Erinosis en el envés de la lámina foliar por A. Aceria sp. en Quercus costaricensis (Liebm.) y B. Nothopoda sp. en Terminalia amazonia ((J.F. Gmel.) Exell). C. Tetranychus sp. en Tectona grandis (L. f.).
Figure 2. Nursery mite pests. Erinosis on the underside of the leaf by A. Aceria sp. in Quercus costaricensis (Liebm.) y B. Nothopoda sp. in Terminalia amazonia ((J.F. Gmel.) Exell). C. Tetranychus sp. in Tectona grandis (L. f.).
Principales problemas
Ápices
Los problemas en los ápices son de gran importancia, ya que van a producir deformaciones y bifurcaciones del tallo y los árboles afectados no pueden ser utilizados para programas de reforestación. El “barrenador de los brotes de las meliáceas” (Hypsipyla grandella) (Pyralidae, Lepidoptera) es la principal afectación en la reproducción y desarrollo de especies de esta familia; las larvas, en su segundo instar, barrenan el brote principal de su hospedero, hacen un túnel por el centro y al ser árboles tan pequeños, se genera destrucción total del hospedero (figura 3.A) (8), (16), (17), (18). Individuos obreros de especies de Trigona sp. (Apidae, Hymenoptera), hacen cortes en ramillas, tallos y ocasionalmente trozan ápices con el fin de recolectar las resinas y gomas que, junto a otros materiales vegetales, utilizan para elaborar propóleo, uno de los principales materiales en la construcción y desinfección de sus nidos (19), (20).

Figura 3 Plagas insectiles en viveros forestales. A. Daño por Hypsipyla grandella (Zeller) en Cedrela odorata (L.); B. Larva de Terastia meticulosalis (Guenee) sobre brotes de Erythrina poeppigiana ((Walp.) O.F. Cook); C. Individuos de Mastigimas sp. en Cedrela odorata (L.); D. Larva de Mimallo amilia (Cramer) en Psidium sartorianum ((O. Berg) Nied.); E. Larvas de Terastia meticulosalis (Guenee) en Erythrina poeppigiana ((Walp.) O.F. Cook).
Figure 3. Insect pests in forest nurseries. A. Damage by Hypsipyla grandella (Zeller) in Cedrela odorata (L.); B. Larvae of Terastia meticulosalis (Guenee) on outbreaks of Erythrina poeppigiana ((Walp.) O.F. Cook); C. Mastigimas sp. in Cedrela odorata (L.); D. Larvae de Mimallo amilia (Cramer) in Psidium sartorianum ((O. Berg) Nied.); E. Larvae of Terastia meticulosalis (Guenee) in Erythrina poeppigiana ((Walp.) O.F. Cook).
Como patógenos, los daños más comunes y severos son ocasionados por los hongos Botrytis sp. (Sclerotiniaceae, Leotiomycetes), Cylindrocladium sp. (Nectriaceae, Sordariomycetes) (figura 4.A) y Phomopsis sp. (Diaporthaceae, Sordariomycetes) (figura 4.B); este último se ha presentado con más frecuencia en los últimos años, el daño se caracteriza por una necrosis de los tejidos corticales de las plantas, que en algunas especies como Ceiba pentandra ((L.) Gaertn.), Sapindus saponaria (L.), T. grandis y Vochysia guatemalensis (Donn. Sm.), la infección inicia en el meristemo apical y puede descender hasta alcanzar más del 50 % del tallo (16), (18), (21), (22).

Figura 4 Enfermedades en viveros forestales. A. Hojas secas por Cylindrocladium sp. en Eucalyptus deglupta (Blume); B. Tallo necrosado de Sapindus saponaria (L.) por Phomopsis sp. en C. Tizones en acículas de Pinus caribaea (Morelet) por Dothistroma septosporum ((Dorog.) M. Morelet); D. Quema en Cornus disciflora (DC.) por Elsinoë sp; E. Agallas por Agrobacterium tumefaciens (Smith & Townsend) en Eucalyptus deglupta (Blume); F. Manchas por Ascochyta sp. en Hymenaea courbaril (L.); G. Manchas por Macrophoma sp. en Croton niveus (Jacq.); H. Necrosis por Pestalotia sp. en Virola koschny (Warb.); I. Manchas por Phyllachora sp. en Simarouba amara (Aubl.); J. Manchas por Pleospora sp. en Gliricidia sepium ((Jacq.) Kunth ex Walp.).
Figure 4. Diseases in forest nurseries. A. Dried leaves by Cylindrocladium sp. in Eucalyptus deglupta (Blume); B. Necrotic stem of Sapindus saponaria (L.) by Phomopsis sp. C. Pinus caribaea (Morelet) needle blots by Dothistroma septosporum ((Dorog.) M. Morelet); D. Burning in Cornus disciflora (DC.) by Elsinoë sp; E. Galls by Agrobacterium tumefaciens (Smith & Townsend) in Eucalyptus deglupta (Blume); F. Stains by Ascochyta sp. In Hymenaea courbaril (L.); G. Stains by acrophoma sp. in Croton niveus (Jacq.); H. Necrosis due to Pestalotia sp. at Virola koschny (Warb.); I. Spots by Phyllachora sp. in Simarouba amara (Aubl.); J. Stains by Pleospora sp. in Gliricidia sepium ((Jacq.) Kunth ex Walp.).
Follaje
En el follaje se presentó la mayor cantidad de afecciones. Los defoliadores que han producido daños considerables cuando no se interviene son Eulepte concordalis (Crambidae, Lepidoptera), el cual es un plegador-defoliador de los foliolos de Tabebuia rosea ((Bertol.) DC.) (23), (24) y “la chinche de encaje”, Dictyla monotropidia (Tingidae, Hemiptera) en C. alliodora; las colonias de ninfas y adultos se encuentran en la superficie abaxial de las hojas, donde succionan la savia, por lo que inicialmente en el haz de la hoja se observan punciones cloróticas, aparentemente inyectan una toxina que causa un área necrótica negruzca en la parte central de la lámina foliar y paulatinamente, el resto se torna de color amarillo hasta caer (25), (26), (27).
Las enfermedades de mayor importancia encontradas en viveros son Dothistroma septosporum (Mycosphaerellaceae, Dothideomycetes), Phyllachora balansae (Phyllachoraceae, Sordariomycetes), Oidium sp. (Erysiphaceae, Leotiomycetes) y Colletotrichum sp. (Glomerellaceae, Sordariomycetes); el “tizón de las agujas del pino”, producidas por el patógeno D.septosporum, forma bandas necróticas o cloróticas alrededor de las acículas del pino causando muerte y caída del follaje, muy común en viveros debido a las temperaturas cálidas, alta humedad y regímenes de producción densos, lo que favorece la proliferación del patógeno (figura 4.C) (28), (29).
La “mancha puntual del cedro” es causada por el patógeno P. balansae, el cual, provoca pequeños estromas negros y compactos sobre manchas circulares amarillas y marrones, que afecta las hojas maduras y los peciolos, generalmente sobre plantas en etapa de vivero de Cedrela odorata (L.), Cedrela tonduzii (C. DC.) y Swietenia macrophylla (King); cuando el daño es muy severo, causa defoliación y reducción de su vigor (figura 5) (16), (18), (30). La “cenicilla polvorienta” generada por Oidium sp., desarrolla un micelio blanquecino sobre la lámina foliar y origina grandes cantidades de esporas del mismo color que dan la apariencia de polvo; mediante haustorios absorbe la savia de los tejidos, lo que ocasiona decoloraciones, necrosis y caída del follaje (figura 6) (13), (31), (32).

Figura 5 Phyllachora balansae (Speg.) en Cedrela tonduzii (C. DC.). A. Daño generalizado en el follaje; B. Áreas necróticas con presencia de estromas color negro.
Figure 5. Phyllachora balansae (Speg.) in Cedrela tonduzii (C. DC.). A. General damage to foliage; B. Necrotic areas with presence of black stromae.

Figura 6 Cenicilla blanca ocasionada por Oidium sp. en: A. Acacia mangium (Willd.); B. Eucalyptus deglupta (Blume).
Figure 6. White ashtray by Oidium sp. in: A. Acacia mangium (Willd.); B. Eucalyptus deglupta (Blume).
La “antracnosis” es producida por especies de Colletotrichum, las cuales son generalistas, forman manchas dispersas en la lámina foliar, pero especialmente ocasionan extensas áreas necróticas en los bordes; si la infección es severa, en plantas presentan defoliación total (figura 7) (16), (33), (34), (35), (36), (37), (38). También se reportan las “royas” Melampsoridium alni (Pucciniastraceae, Pucciniomycetes) en A acuminata (figura 8), Olivea tectonae (Chaconiaceae, Pucciniomycetes) en T. grandis y Austropuccinia psidii (Sphaerophragmiaceae, Pucciniomycetes) en Syzygium jambos ((L.) Alston) (39), (40).

Figura 7 “Antracnosis” producida por Colletotrichum sp. en: A. Calophyllum brasiliense (Cambess.); B. Dalbergia retusa (Hemsl.); C. Dipteryx panamensis ((Pittier) Record & Mell); D. Erythrina fusca (Lour.); E. Inga sp.; F. Persea caerulea ((Ruiz & Pav.) Mez).
Figure 7. "Anthracnose" produced by Colletotrichum sp. in: A. Calophyllum brasiliense (Cambess.); B. Dalbergia retusa (Hemsl.); C. Dipteryx panamensis ((Pittier) Record & Mell); D. Erythrina fusca (Lour.); E. Inga sp.; F. Persea caerulea ((Ruiz & Pav.) Mez).

Figura 8 Melampsoridium alni en Alnus acuminata. A. Necrosis producida en el follaje; B. Pústulas amarillas en el envés de la lámina foliar.
Figure 8. Melampsoridium alni in Alnus acuminata. A. Necrosis produced in the foliage; B. Yellow pustules on the underside of the leaf blade.
Raíces
En las raíces, además de patógenos causantes de pudriciones, cuando no se prepara adecuadamente el suelo, hay ataques de larvas de Phyllophaga spp., insecto coleóptero de la familia Melolonthidae, muy conocido por los viveristas debido a los daños que causan en la mayoría de las especies de plantas; las larvas en sus primeros instares se alimentan de raíces finas y en su último instar se pueden alimentar de las más gruesas e incluso de la principal, causando debilidad o muerte en las plantas (16), (41), (42).
Conclusiones
La mayor parte de los problemas detectados afectan el follaje y son producidos por hongos. Con respecto a síntomas, los tizones en coníferas y las manchas en latifoliadas son abundantes, al igual que las quemas o antracnosis ocasionadas por especies de Colletotrichum o algunas “royas”.
El estado sanitario de las plantas en los viveros es fundamental en los procesos de reforestación, ya que plantas enfermas trasladadas al campo tienen menores probabilidades de sobrevivir y, pueden convertirse en focos de diseminación de plagas y enfermedades en los proyectos de reforestación. Muchos de los problemas fitosanitarios diagnosticados en este estudio, pueden deberse a prácticas de manejo inadecuadas, como acumulación de material remanente y alta presencia de mala hierba, utilización de semillas y sustratos contaminados y especialmente regímenes de riego excesivos o fuera de los momentos del día recomendados, que conlleven a condiciones de estrés de las plantas y altos niveles de humedad relativa y en los sustratos de producción.
En los viveros forestales es fundamental implementar el Manejo Integrado de Plagas (MIP), el cual se refiere a “la utilización de varias tácticas, que conforman una estrategia óptima para lograr reducir las poblaciones de organismos plaga a niveles tolerables, de acuerdo con niveles de daño económico, ecológico y social”, este conjunto de tácticas o estrategias debe formar parte del manejo de las plantas en el vivero y las acciones deben ser planeadas en el programa anual de actividades. Para realizar MIP se requiere tener disponible la información sobre varios aspectos, como: a. Conocimiento de la identidad y ciclo biológico de las especies plaga; b. Conocimiento de los factores que regulan las poblaciones de plagas; c. Conocimiento de los hospedantes, especialmente sobre cultivo, susceptibilidad, tolerancia y resistencia; d. Conocimiento sobre métodos de monitoreo y evaluación; e. Conocimiento sobre la importancia de las especies plaga; f. Análisis costo beneficio de aplicación de tratamientos; g. Conocimiento de tácticas y estrategias de prevención y control (16).