Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
InterSedes
versión On-line ISSN 2215-2458versión impresa ISSN 2215-2458
InterSedes vol.14 no.29 San José sep./dic. 2013
Valoración de algunos productos para el control del mal de panamá en el cultivo de coco (musa sp. (aaa) subgrupo gros michel)
Evaluation of some products to control "Panamá disease" on coco (Musa sp. (AAA) subgroup Gros Michel)
Evaluation of some products to control "Panamá disease" on coco (Musa sp. (AAA) subgroup Gros Michel)
*Dirección para correspondencia:
Resumen
El objetivo de este estudio fue evaluar, a nivel de campo, la eficacia de productos biológicos y químicos para el control del mal de Panamá en banano de altura (Musa AAA, cv. Cocos). El área experimental correspondía a 60 plantas de banano propagadas de manera in vitro sembradas mediante el sistema de siembra “tres bolillo”, colocadas dentro de un anillo plástico, rellenado con suelo dejando un borde para evitar la deriva de los productos, posteriormente se procedió a realizar la inoculación con Fusarium oxysporum f.sp. cubense a cada una de las repeticiones. Se establecieron 6 tratamientos: T1.Tricho Plus, T2.Serenade, T3. Polyversum, T4. Plant Pro, T5. Butrol, T6. Testigo. De los cuales los tratamientos T4 y T5 fueron los que mostraron diferencias significativas en cuanto a la reducción de la cantidad de unidades formadoras de colonias de Foc en el suelo, ninguno de los tratamientos presentó diferencias en cuanto a las poblaciones microbianas en el suelo.
Palabras Claves: mal de Panamá, Gros Michel, severidad, Fusarium Oxysporum f.sp. cubense, Combate del mal de Panamá
Summary
The objective of this study was to evaluate, at field level, the effectiveness of biological and chemical control of Mal de Panama disease in banana crop. The experimental area corresponded to 60 banana plants in vitro, placed inside a plastic ring. The incidence and severity of the disease was evaluated, most plants showed the first symptoms of the disease from 140 days after application of treatments; the different treatments showed different levels of severity for each of the evaluations, this made that not exist clear relationship of the incidence, because some plants without external symptoms showed internal damage of the disease, except the treatment T1 which presented a 100% incidence with external and internal symptoms, while the treatment T6 was the only one that presented a less severity index respect the incidence level . With respect to growth variables evaluated not found significant differences between the treatments
Keywords: Gros Michel, Fusarium oxysporum f.sp. cubense, Control of Panamá Disease.
Introducción
En Costa Rica, el banano se cultiva en forma comercial en zonas con una alta precipitación y temperatura promedio de 24°C, con altitudes que van hasta los 300 msnm. En la actualidad existe interés en la producción de banano en áreas localizadas a mayores altitudes, entre 440 y 1300 msnm, conocido como banano de altura (3), ya que la fruta presenta un sabor más dulce, debido a que su ciclo de producción es más prolongado y se da una mayor acumulación de almidones que posteriormente son desdoblados en azúcares durante la maduración. En el cantón de Turrialba, la producción tradicional de banano, se realiza a pequeña escala, (en fincas con menos de 5 hectáreas). En años anteriores, la producción se dedicaba a satisfacer el consumo propio de las familias, la alimentación de animales domésticos y para el mercado local. Sin embargo, con la entrada al mercado de empresas procesadoras de banano, la producción se revaloró como una posible fuente de mayores ingresos. En algunos casos los productores han sustituido parcialmente cultivos tan tradicionales como el café y la caña de azúcar por el banano.
Este cultivo afronta una serie de plagas, de las cuales la marchitez por Fusarium o mal de Panamá causado por el hongo Fusarium oxysporum f.sp. cubense (Foc), la cual es a nivel mundial una de las enfermedades más ampliamente distribuida y de mayor impacto en el cultivo la cual ha generado grandes pérdidas económicas en la mayoría de los países donde se cultivan musáceas.
La infección inicia cuando Foc penetra a la planta de banano a través de las raíces secundarias, y las raíces muertas o dañadas, la cual pasa al cormo e invade los vasos del xilema ocasionando la muerte de la planta. Tras la muerte de la planta, los conidios retornan al suelo, la habilidad que manifiesta el patógeno para sobrevivir en el suelo hasta por 30 años (15), lo cual puede asociarse a la producción de estructuras de resistencia. Los síntomas externos que se pueden observar en la planta, para cualquiera de las razas, son un amarillamiento gradual del follaje el cual se extiende desde las hojas más viejas hacia las más jóvenes, extendiéndose a lo largo del margen foliar y continuando hacia la nervadura central de la hoja hasta quedar completamente seca y de un color café. En el cormo los síntomas son parecidos a los del pseudotallo, estrías necróticas, oscuras o azuladas pueden observarse sobre un fondo blanco.
Actualmente Foc es una seria amenaza para la industria bananera y en especial para los pequeños productores quienes cultivan el banano en asocio con otros cultivos, como el café y cacao bajo sistemas agroforestales con variedades susceptibles a la enfermedad. También para pequeñas fincas que producen banano para mercados locales e industrias, donde son muy apetecidos por su sabor y aroma (20). De igual manera, a pesar de que la raza 4 (tropical), de Foc no ha sido reportada en el continente americano, constituye una amenaza para la industria bananera dado que el 100% de las plantaciones comerciales corresponden a cultivares del subgrupo Cavendish, todos susceptibles a esta raza (15).
En Costa Rica, el banano orgánico y el banano de altura, ambos basados en los cultivares del subgrupo Gros Michel, altamente susceptibles a la raza 1 del patógeno, se han visto severamente afectados por epidemias de la enfermedad, y esto pone en riesgo la economía de muchas familias y la disponibilidad de fruta para el mercado local y la industria de alimentos.
Métodos de control
Lamentablemente los métodos de control químico no han sido efectivos para combatir el marchitamiento por Fusarium, tampoco las buenas prácticas culturales han reducido su incidencia y severidad. Varias investigaciones han centrado sus esfuerzos en la búsqueda de fuentes naturales de resistencia al patógeno en especies y cultivares silvestres, así como en diploides sintéticos desarrollados por programas de mejoramiento (24). Por otra parte el control biológico ha demostrado ser una alternativa de manejo de la enfermedad, existen un grupo importante de hongos y bacterias que presentan efectos antagónicos con otros microorganismos y esta acción puede ser aprovechada como una forma de control biológico de patógenos.
Selección de fungicidas y desinfectantes
Los fungicidas y desinfectantes seleccionados así como algunas de sus características de los mismos se desarrollaran a continuación:
Tricho-plus. Es un producto que entre sus ingredientes activos contiene esporas de los hongos Trichoderma harzianum y Trichoderma viride en base de talco. El biocontrol de fitopatógenos de suelo con especies de Trichoderma ha sido objeto de estudio, y se ha aplicado a pequeñas escalas directamente al suelo o en el tratamiento de las semillas. Obteniendo resultados con los hongos Trichoderma harzianum y Streptomyces violaceusniger registrando buenos niveles de control de la enfermedad.
Sin embargo los informes de la eficacia de T. harzianumen el control de Foc son contradictorios, y la mayoría se refieren a la eficacia de ensayos in vitro o invernaderos bajo condiciones controladas. A pesar de esto, el uso del genero principalmente T. harzianum/viride, está siendo utilizado para el control de un grupo importante de patógenos del suelo entre ellos Foc, ya que actúa como biocontrolador de patógenos, ya que compite por el espacio y los nutrientes con los principales hongos o los depreda directamente (11).
Serenade Soil. Es un fungicida biológico y se ha demostrado también que otra de las alternativas biológicas para el control de enfermedades, cuyo ingrediente activo es una bacterial género Bacillus, la cual presenta un gran potencial como antagonista principalmente por la gran cantidad de enzimas líticas,antibióticos y otras sustancias con actividad biocida capaces de producir efectos de control sobre varias especiesde agentes fitopatógenos, esto mediante una bacteria denominada Bacillus subtilis raza QST 713, la cual se activa a través de varios mecanismos de acción, funcionando en un primer nivel formando una barrera física en la superficie vegetal para prevenir la adherencia del patógeno a la planta. En un segundo nivel los lipopéptidos forman micelas mixtas, en la superficie vegetal, que perforan las membranas de las células fungosas y de las esporas para prevenir su crecimiento. Esta bacteria ha demostrado tener un amplio espectro de acción siendo usado comercialmente para el control de diversas enfermedades (16).
Poliversum. Este producto tiene como agente activo esporas provenientes del hongo Phythium oligandrum, el cual coloniza la rizosfera de la planta tratada. Su fuerte habilidad micoparasital y competitiva inhibe el crecimiento y efecto antagónico de muchos hongos patógenos del suelo ya que este induce una reacción de defensa dentro de la planta a través de la estimulación de las fitohormonas, las cuales están relacionadas con los mecanismos de defensa de las plantas contra las enfermedades. Este hongo no produce ningún antibiótico y por lo tanto es considerado un verdadero promotor del crecimiento por medio de la inducción de la resistencia de las plantas (14).
Plant-Pro 47,4 EC. Es un producto químico a base de yodo, que tiene propiedades en la desinfección de suelo. Se ha demostrado a nivel de campo que productos a base de yodo, proporcionaron un control significativo de Fusarium podredumbre de la corona de tomate (Fusarium f. sp. oxysporum radicis-lycopersici) y marchitez bacteriana (Ralstonia solanacearum) en campos naturalmente infestados. Estos productos también tiene el potencial para ser utilizados como un tratamiento de semilla para reducir las enfermedades transmitidas por hongos patógenos (6).
Butrol 31,5 EC. Otra de las alternativas químicas, se encuentra el producto comercial Butrol cuyo ingrediente activo es la molécula TCMTB el cual es un fungicida-bactericida de amplio espectro, que actúa por contacto, el cual ha mostrado resultados en pruebas in vitro para inhibir el crecimiento micelial de F. oxysporum y otros hongos de suelo (7).
El objetivo del presente trabajo fue determinar, a nivel de campo, la eficacia de algunos productos biológicos y químicos para el control del mal de Panamá en banano de altura (Musa AAA, cv. Coco).
Materiales y métodos
Descripción del área experimental
El ensayo se realizó en una sección de la finca, ubicada en la localidad de Guayabo del cantón de Turrialba, provincia de Cartago, cuyas coordenadas son latitud 9°56'35.99" Norte y longitud 83°39'29.51" Oeste, a una altitud de 734 m.s.n.m.
El área experimental correspondió a una siembra de 60 plantas obtenidas por cultivo in vitro de ápices vegetativos en un sistema de “tres bolillo” a una distancia de 2 metros entre cada una. En cada punto de siembra se colocó un anillo plástico (Figura 1) de 56 cm de diámetro y 30 centímetros de altura, proveniente de un estañon, este se enterró a una profundidad de 10 centímetros y fueron rellenados con suelo dejando un borde de 10 centímetros, para evitar interferencia por deriva de los productos, en el momento de ser aplicados.
El experimento fue establecido por representantes de la sección de la Corporación Bananera Nacional (CORBANA) y la Universidad de Costa Rica, Sede del Atlántico. Durante el período experimental (Mayo 2012-Enero 2013) los meses con mayor precipitación y humedad relativa fueron Julio (600 mm/mes) y Noviembre (500 mm/mes), así mismo estos meses fueron los que presentaron una mayor humedad relativa (96%) y (97%) respectivamente.
En cuanto al programa nutricional se realizó una aplicación de 60 g por planta de la fórmula 10-30-10 esto a la siembra de las plántulas. Posteriormente, se aplicó 60 g por planta de la fórmula 18-5-15 cada cuatro semanas hasta el final del ensayo. El combate de la Sigatoka se realizó en forma integral mediante las prácticas culturales como cirugía, despunte y deshoja moderada cuando las mismas presentaron más del 50% del área foliar necrosada y no se aplicaron fungicidas.
Preparación del inóculo de Foc
El inóculo de Foc utilizado provino de cultivos monospóricos, de la colección que posee el laboratorio de Fitopatología de la Universidad de Costa Rica – Sede del Atlántico. Las cepas seleccionadas para este ensayo ya habían sido probadas como patogénicas en plantas del cultivar Gros Michel, las cuales presentaron los síntomas típicos de la enfermedad (8).
De cada una de las cepas seleccionadas, se tomaron 15 granos de arroz infectado y se colocaron en cada uno de los 6 erlenmeyer de 1 litro, los cuales fueron previamente autoclavados con 130 gramos de arroz y 70 ml de agua destilada. Cada erlenmeyer fue colocado en una incubadora a una temperatura de 28°C por espacio de 18 días hasta que el micelio del patógeno cubriera por completo el arroz, Una vez pasado este tiempo, cada uno de los erlenmeyer con el arroz inoculado, se le agregó 750 ml de agua destilada previamente autoclavada, y se agitó por 15 minutos, para facilitar la suspensión del inóculo en un recipiente.
La cantidad de suspensión del inóculo recolectada fue de 8500 ml, de la cual se le tomó una alícuota para realizar una dilución de 1:20, con el fin de realizar el conteo de conidios con el hematocitometro, y se determinó una concentración de inóculo de 7.8x105 segmentos de micelio y conidios. De la suspensión del inóculo obtenida, se realizó una dilución en estañones de 200 litros de agua con el fin de inocular cada uno de los tratamientos. Finalmente se aplicó una dosis de 7 litros de la suspensión (33.150 partes de micelio/ml) con una regadera de manera uniforme en el suelo que se encontraba dentro de cada anillo plástico previamente enterrado en el suelo.
Material experimental
Las plantas utilizadas se obtuvieron por cultivo in vitro de ápices de un cultivar del subgrupo Gros Michel, conocida localmente como Coco; reproducidas en el Laboratorio de Biotecnología del CATIE, las cuales tenían 3 meses de edad cuando fueron sembradas en el campo.
Aplicación de los tratamientos
La aplicación al suelo se realizó con una regadera para cada uno de los tratamientos, utilizando un volumen del producto diluido en 8 litros de agua para cada una de las repeticiones. Previo a la aplicación de los tratamientos, se sembraron las plantas de banano. Se realizaron dos aplicaciones por tratamiento una al momento de la siembra y la segunda 22 días después.
Tratamientos
Los productos que se utilizaron en los tratamientos como prácticas de control se describen en el cuadro 1.
Evaluación de la presencia de Microorganismos y patógeno en el suelo
Se determinó la cantidad de microorganismos y de inóculo de Foc en el suelo antes de la aplicación de cada uno de los tratamientos y repeticiones (0 días) y luego a los 22, 60, 120 y 180 días después de la primera aplicación de los productos. La muestra (compuesta) fue tomada en 4 puntos equidistantes alrededor de la planta y hasta una profundidad de 30 cm, con la ayuda de un barreno tubular.
La determinación de la población de microorganismos y de Foc en el suelo se hizo a partir de muestras tomadas a cada uno de las repeticiones de cada tratamiento, las cuales se colocaron en bolsas plásticas debidamente identificadas y trasladas al Laboratorio de Fitopatología de la Universidad de Costa Rica, Sede del Atlántico, donde se conservaron a 4oC.
Para cada una de las muestras se tomaron 5 g de suelo, los cuales fueron colocados por separado en erlenmeyer con 45 ml de agua estéril y agitada 120 rpm por 15 minutos para obtener una dilución de 10-1 (solución madre). La solución obtenida fue llevada a la cámara de flujo laminar, donde se tomó con la ayuda de una pipeta graduada, 1 ml de la solución madre y colocada en un tubo de ensayo con 9 ml de agua estéril para obtener la dilución 10-2. Para el crecimiento del hongo se pipeteó 0,1 ml y se esparció en placas de Petri con el medio de cultivo específico Komada, para el crecimiento del hongo. Las placas fueron incubadas a 25oC durante un periodo de 5 días, para posteriormente contar cada una de las UFC presentes en cada repetición.
En cuanto al crecimiento de microorganismos se utilizara la misma metodología; en donde la muestra de suelo se homogeneizará y se tomarán 5 gramos, el cual se colocó en un erlenmeyer con 45 ml de agua estéril, para obtener una dilución de 10-1. A cada solución madre se le tomará con una pipeta graduada. Para observar el crecimiento de las poblaciones microbianas se colocaron 1 ml de las disoluciones 10-3 y 10-4 en el medio de cultivo PDA (papa – dextrosa - agar) mezclado con el antibiótico cloranfenicol para el crecimiento de los hongos. Las diluciones 10-5 y 10-6 serán colocaron en Agar Nutritivo para el crecimiento de las bacterias y actinomicetes. Cada una de las diluciones fue incubada por 5 días a 25° C para contar las UFC. Las UFC se expresaran en número de UFC g-1 de suelo seco, utilizando la siguiente fórmula: UFC = (UFC x C)/PS Donde: UFC = UFC contadas en la placa petri; C = concentración de la dilución; y PS = peso seco de la muestra de suelo.
Evaluación de la incidencia y severidad de Foc a nivel de campo
Para el cálculo de la incidencia se contabilizaron las plantas que presentaban los síntomas de la enfermedad por cada uno de los tratamientos. Los resultados se expresan en términos de porcentaje de plantas enfermas. Esta evaluación fue realizada al finalizar las evaluaciones de síntomas externos (250 días después de la siembra) utilizando la siguiente fórmula:
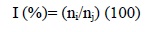
La severidad de la enfermedad expresada por el nivel de daño de los síntomas externos se estimó con la escala de Poveda (2013, datos en prensa). Las evaluaciones se iniciaron a los 140 días después de la siembra de las plantas, con intervalos de 8 días, hasta los 250 días después de la siembra. Los síntomas internos se estimaron con la escala de Orjeda (6), modificada para la presente investigación. Para esto se realizó una única evaluación al finalizar el ensayo (250 días después de sembradas las plantas), realizando cortes transversales a nivel del cormo a cada una de las plantas, esto para observar el nivel de decoloración del tejido vascular.
Variables de crecimiento del cultivo
Se midieron variables de crecimiento de las plantas como emisión foliar, altura de la plantade la base del pseudotallo hasta el ángulo formado por la hoja y circunferencia del pseudotallo. Las evaluaciones iniciaron a los 60 días de sembradas las plantas en campo y hasta los 224 días. Los intervalos de evaluación fueron de un mes entre cada evaluación hasta cumplir con la totalidad del ensayo.
Medición del pH
Para cada uno de los tratamientos y repeticiones se realizó una medición del pH del suelo por medio de un “pH-metros” (pH100: ExStik® pH Meter), para determinar el grado de acidez presente en cada repetición.
Diseño experimental
El diseño experimental utilizado durante este ensayo fue un irrestricto al azar con 6 tratamientos y 10 repeticiones por tratamiento donde cada unidad experimental fue una planta (60 plantas evaluadas). Los datos fueron analizados para verificar el cumplimiento de los supuestos estadísticos a través de la prueba de Duncan utilizando el programa estadístico InfoStat. Cuando una variable no cumplía con los supuestos de normalidad de datos y homogeneidad de varianzas se transformaron según la naturaleza de las variables. Para el análisis de las variables realizadas en una única ocasión como lo son severidad síntomas internos y medición del pH del suelo, se utilizó el siguiente modelo estadístico:
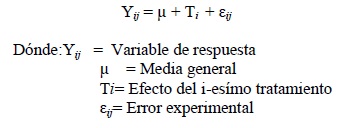

Resultados y discusión
Indicadores Biológicos
Población de Fusarium oxysporum en el suelo
Se corroboró la presencia de F. Oxysporum en el suelo, se observó que este presentaba una distribución generalizada en el campo experimental. Esta condición de inoculó, la presencia de un hospedero susceptible, junto con las características químicas en el suelo como la acidez y factores ambientales, proporcionaron las condiciones idóneas para el desarrollo de la enfermedad y la expresión de los síntomas.
Con respecto a la presencia del patógeno Foc en el suelo donde se realizó el ensayo, se presentaron diferencias (p=0,0022) entre los tratamientos (cuadro 3), donde T4 y T5 (Triyoduro de Potasio y TCMTB) difirieron del resto de tratamientos evaluados, ya que éstos presentaron una disminución de la población de Foc en el suelo. El resto de los tratamientos no difieren entre ellos, lo que sugiere que las poblaciones de Foc se mantuvieron similares en cantidad. El efecto fungicida de los tratamientos no se pudo constatar con esta variable.
Aun cuando en los tratamientos 4 y 5 se presentó una menor población de Foc esto no es indicativo de que la planta no presente los síntomas como se discutirá posteriormente, lo que sugiere que el manejo con estos productos debe incluirse en un programa integrado de la enfermedad, combinando el efecto de reducción de inóculo con el efecto fungicida de otros productos. En estudios realizados se combinaron productos bilógicos con fungicidas, encontrando que este efecto proporciona un mayor grado de supresión al marchitamiento en plantas de Cyclamen persicum, encontrando un mayor grado de control del marchitamiento por Fusarium sp en plantas de Cyclamen persicum después de la combinación del fungicida Bencimidazol y Carbendazim con desinfectantes (8).
En otras investigaciones se determinó que compuestos del amonio cuaternario tales como Sporekill y Prazin son generalmente considerados como de acción desinfectante rápida activa a bajas concentraciones, reduciendo el número de colonias de Foc que se desarrollan en PDA (18). En donde la aplicación de productos químicos o biológicos al suelo puede tener dos efectos: uno ser absorbido por las raíces y entrar en la corriente xilematica y otro tener un efecto sobre los propágalos de patógenos, presentes en el suelo (17).
Las evaluaciones (0, 22, 60, 120 y 180 dda) de Foc en el suelo no difieren estadísticamente entre los tratamientos, aun así se puede observar en la figura 9 que hay una reducción a los 60 días que concuerda con las condiciones de humedad en el suelo producida por las precipitaciones de los meses de evaluación, en donde estas condiciones de anaerobiosis en el suelo pueden provocar que las poblaciones de hongos sean menores.
Adicionalmente este comportamiento se puede deber a que solo se realizaron dos aplicaciones de los productos (0-22 días), ya que el objetivo era evaluar la capacidad de desinfección de los productos aplicados al inicio del ensayo, por lo que esta condición pudo afectar de alguna manera la cantidad de estructuras del patógeno cuantificadas en el suelo, ya que si se hubieran realizado más aplicaciones tal vez se pudiera haber generado diferencias significativas de los tratamientos en el tiempo.
Sin embargo esta disminución en los tratamientos 4 y 5, no es un indicativo de que los productos generaron algún efecto sobre las poblaciones del patógeno ya el medio selectivo Komada no determina la cantidad de UFC de Foc presente en el suelo debido a que en ensayos realizados con tratamientos de desinfección de suelo contra Fusarium oxysporum f. sp. vasinfectum raza 4 sobre el algodón (2), donde se determinó que las diferencias en las poblaciones de F. oxysporum entre los tratamientos de desinfección utilizados en ese ensayo pueden no ser detectables utilizando un medio de Komada.
En la figura 2, se puede observar que los tratamientos no presentaron una respuesta en el tiempo, al no producir un efecto sobre la inhibición de Foc en el suelo, ya que a partir de la última aplicación de los productos que fue realizada a los 22 días después de la primera aplicación se dio una tendencia a la disminución del patógeno en el suelo de todos los tratamientos; siendo los tratamientos 4 (Triyoduro de Potasio) y 5 (TCMTB) los que presentaron una mayor disminución de las UFC de Foc en el suelo hasta, aproximadamente los 60 días después de aplicado los productos que fue cuando se empezó a dar un aumento de las colonias de Foc. Este aumento en la población pudo haberse favorecido por las condiciones de humedad en el suelo, ya que a partir de los 60 días se dio un aumento considerable en la precipitación, además de la condición de pH ácido (4,5), junto con la disminución del efecto residual de los productos, sugieren que las colonias de Foc en el suelo comenzaran a aumentar. Esto debido a que, el hongo Fusarium se desarrolla mejor en climas con una alta precipitación y humedad, además de pH ácidos (5).
Poblaciones microbianas
En cuanto a las poblaciones microbianas en el suelo, no se detectaron diferencias significativas entre los valores de UFC de hongos entre los diferentes tratamientos (p=0,588). Estos siempre presentaron valores intermedios antes y después de la aplicación de los tratamientos; esto debido a que valores de UFC de hongos entre un rango de 3-5 son valores normales de poblaciones de hongos en el suelo, con lo cual los diferentes tratamientos no afectan la poblaciones deseadas (21).Mientras que los valores de UFC de bacterias y actinomicetos en el suelo no presentaron diferencias significativas entre los tratamientos (p>0,05). En donde el pH pudo haber influido en la cantidad de colonias presentes en el suelo, ya que al presentarse un pH bajo (4.5), se presenta un desbalance con las poblaciones de bacterias y actinomicetos; ya que pH de suelo menores de 5,5 presentan una actividad baja de bacterias. Estas poblaciones también se pudieron ver afectadas negativamente por la presencia de otros organismos antagónicos y de sustancias contaminantes en el suelo, así como por la aplicación de los productos (1). Se señala que valores de UFC de actinos y bacterias, menores a 6 son considerados como un nivel bajo de dichas poblaciones (21).
Incidencia y Severidad de la enfermedad
El 50% de las plantas presentaron los primeros síntomas externos de la enfermedad a partir de los 140 días después de aplicado los tratamientos, que fue cuando se empezaron a realizar las evaluaciones de severidad de síntomas externos (Figura 4). Al finalizar el ensayo la incidencia de los síntomas externos de los diferentes tratamientos fue diferencial, donde las plantas con el tratamiento 1 (T. harzianum), presentaron un 100% de incidencia de síntomas externos e internos de la enfermedad (Figura 3). El grado de incidencia y severidad que presenta el tratamiento con T. harzianum, se puede deber a que las plantas fueron inoculadas con Foc 22 días antes de aplicar los tratamientos, lo que pudo haber ocasionado al igual que en los otros tratamientos biológicos, que las poblaciones de Foc en el suelo aumentaran de manera considerable y no se diera un control eficiente de los productos. El uso de T. harzianum aplicado antes de inocular con Foc puede provocar un efecto en retardar la aparición de síntomas de la enfermedad (4). Este mismo autor en una investigación sobre aislamientos de Trichoderma para el control de Foc; sugiere que una aplicación temprana del controlador biológico, muestra una mayor competencia para ocupar espacios que son colonizados por la mayoría de patógenos oportunistas o fitopatógenos, en este caso Foc.
También se señala que inoculaciones de T. harzianum siete días antes de la inoculación de Foc presentaron un 0% de plantas enfermas a nivel de invernadero y en plantaciones comerciales de los cultivares Burro Cemsa, FHIA 03 y FHIA 23; T. harzianum produjo menos del 1% de plantas afectadas en comparación con plantas sin inocular con T. harzianum (100%) y plantas inoculadas con T. harzianum en el mismo día de la inoculación del patógeno (40%) (12). Estos niveles de severidad observados en el campo (Figura 4), en donde el tratamiento 1 (T. harzianum) es el que presenta un mayor nivel de severidad externo en las plantas, en el tiempo que duraron las evaluaciones en el campo experimental, mientras que los demás tratamientos se encuentran en un rango similar, este alto nivel de severidad del tratamiento 1 se puede deber a lo explicado anteriormente, sobre las inoculaciones tempranas de hongos endofíticos.
Lo cual quiere decir que aplicaciones tempranas de hongos y bacterias endofíticos pueden presentar una reducción en los síntomas de la enfermedad o retardar su aparición debido a la activación de paredes y principalmente de la membrana celular que detienen el paso del patógeno y su tasa de crecimiento, así como evitan la colonización y el establecimiento de los espacios intercelulares, que son ocupados tempranamente por los hongos endofíticos de Trichoderma spp., además, de activar la producción de enzimas líticas y metabolitos tóxicos favoreciendo el biocontrol (23).
Por otro lado, los demás tratamientos muestran porcentajes de incidencia interna muy similares más del 60%, además de presentar índices de severidad interna muy altos (figura 3), lo cual quiere decir que las plantas bajo los diferentes tratamientos presentaron en su totalidad los síntomas internos de la enfermedad. Además de que los demás tratamientos no presentaron ningún efecto sobre la enfermedad, lo cual puede deberse al bajo contenido de microorganismos presentes en el suelo. Debido a que suelos supresivos con altos contenidos de actinomicetos y bacterias reducen la germinación de clamidiosporas de Foc en un 41 ± 4% y más de la mitad de la severidad del mal de Panamá en plantas de banano del cultivar Cavendish comparado con suelos conducibles o conductivos con alto contenido de hongos filamentosos y levaduras (10).
Estos niveles de severidad observados en el campo (Figura 4), en donde el tratamiento 1 (T. harzianum) es el que presenta un mayor nivel de severidad externo en las plantas, en el tiempo que duraron las evaluaciones en el campo experimental, mientras que los demás tratamientos se encuentran en un rango similar, este alto nivel de severidad del tratamiento 1 se puede deber a lo explicado. Esto debido a lo dicho anteriormente sobre las inoculaciones tempranas de hongos endofíticos (4).
Como se ha discutido anteriormente la frecuencia en la aplicación de los productos puede sugerir que no se presentara una reducción de la sintomatología de la enfermedad. Aún así es importante resaltar que cuando se observa una planta con un porcentaje de incidencia de sintomatología externa bajo no implica que esté libre de la enfermedad. Como se puede observar en la figura 3, hubo tratamientos que presentaron incidencias externas bajas pero al realizar la evaluación interna se presentaron síntomas avanzados de la enfermedad según la escala de Ojeda (1998). Este comportamiento es importante en una plantación porque se pueden seleccionar semilla de plantas sanas que en realidad no lo están .En trabajos realizados se, demostró que aislamientos de Foc provenientes de plantas de banano del cultivar Gros Michel, presentaban una variabilidad en la patogenicidad, expresando una sintomatología externa muy variada, lo cual puede esperarse en un suelo como el que se utilizó en la presente investigación (19).
Variables de crecimiento de las plantas
Para las variables de crecimiento; altura de las plantas, circunferencia del pseudotallo y numero de hojas nuevas emitidas mensualmente no se presentaron diferencias significativas entre los tratamientos evaluados (p≤0.05), igualmente no se presentan interacción tratamiento medición para ninguna de las dos variables.
En la figura 5, se puede observar que en cuanto al crecimiento de las plantas y desarrollo del pseudotallo, estos presentaron un crecimiento uniforme para todos los tratamientos desde el inicio (69 dda) hasta el final de las evaluaciones (224 dda), con lo cual ninguno de los tratamientos mostro un efecto en el desarrollo de las plantas, esto se puede deber a que los tratamientos después de los 60 dda (Figura 2), no presentaron ningún efecto sobre la población de Foc en el suelo y a partir de los 140 días fue cuando se presentaron los primeros síntomas de la enfermedad, lo que pudo haber afectado el crecimiento de las plantas ya que se da un menor desarrollo de las plantas inoculadas con Foc en comparación con plantas que no fueron inoculadas con el patógeno.
En cuanto al número de hojas nuevas emitidas mensualmente, se puede observar en la figura 5 que a partir de los 131 después de aplicados los productos se dio una disminución del número de hojas, posiblemente debido a que ya se empezaban a manifestar los primeros síntomas de la enfermedad, ya que a aproximadamente a los 140 dda, fue cuando se observó que en la mayoría de las plantas ya presentaban los síntomas de la enfermedad, reduciendo la cantidad de hojas hasta los 224 dda.
A pesar de que no se encontraron diferencias estadísticas con las variables de crecimiento se pudo observar que plantas con una mayor severidad presentaron un menor índice de crecimiento global en comparación con las plantas que no presentaron los síntomas de la enfermedad, además que las plantas que mostraron mayor severidad de síntomas presentaron un menor número de hojas nuevas emitidas, coincidiendo con otros autores, ya que estas plantas emitían menos hojas en comparación con plantas que no presentaban los síntomas de la enfermedad.
Conclusiones
• Se determinó una disminución de las cantidades de unidades formadoras de colonias de Focen el suelo, para los tratamientos Triyoduro de Potasio y TCMB, sin embargo estos tratamientos no afectaron las cantidades de UFC de hongos, bacterias y actinomicetos en el suelo
• Las plantas que se desarrollaron en los diferentes tratamientos evaluados en este ensayo, presentaron los primeros síntomas externos típicos de la enfermedad a partir de los 140 días después de sembradas las plantas.
• Se determinó una escala para la evaluación de los síntomas externos ocasionados por la enfermedad del mal de Panamá en el campo
• La aplicación de los tratamientos tanto químicos como biológicos no redujeron la incidencia ni la severidad del mal de Panamá.
• Se observaron plantas que se muestran sanas externamente sin embargo internamente poseen los síntomas iniciales de decoloración del tejido vascular del pseudotallo.
• Los tratamientos evaluados no provocaron un mayor crecimiento y desarrollo de las plantas en comparación con el testigo absoluto.
Referencias bibliográficas
Acuña, O; Peña, W; Serrano, E; Pocasangre, L; Rosales, F; Delgado, E; Trejos, J; Segura, A. (2006). XVII Reunión Internacional de ACORBAT. Bananicultura: um negócio sustenável. Joinville-Santa Catrina- Brasil. 001: 222-233. [ Links ]
Bennett, RS; Spurgeon, DW; DeTar, WR; Gerik, JS; Hutmacher, RB; Hanson, BD. (2011). Plant Dis. 95:967-976. [ Links ]
Brenes, S. 2010. Memorias ACORBAT. (2010). Medellín, Colombia. [ Links ]
Davis,R. 2005. Pest Advisory Leaflet. N°42. 4 p. [ Links ]
Kokalis-Burelle, N; Fuentes, B. (2000). J. Nematol. 32:440 (abstract). [ Links ]
Martínez, F; García, C; Martínez, P. (2009). Investigación agropecuaria. 6(1):13-19. [ Links ]
Minuto, A; Migheli, Q; Garibaldi, A. (1995). Crop Prot. 14:221–226. [ Links ]
Orjeda, G. (1998). Memory. INIBAP (International Network for Improvement of Banana and Plantain). Montpellier, Francia. p. 19-29. [ Links ]
Peng, H; Sivasithamparam, K; Turner, DW. (1999). Soil Biology & Biochemistry. N°31. (10):1363-1374. [ Links ]
Pérez, L, Batlle, V, Chacón, J. y Montenegro, V. (2009). Fitosanidad. 13(4): 259-263 [ Links ]
Picard, K; Trilly, Y; Benhamou, N. (2000). American society for Microbiology. 66(10): 4305-4314. [ Links ]
Ploetz C, (2006). Phytopathology. 96(6): 653-656. [ Links ]
Riveros, F; Pinilla, B. (2003). Congreso de Fitopatología Chile. Memoria. [ Links ]
Rodríguez, D; Montilla, J. (2002). Manejo Integrado de Plagas. Costa Rica. 63:46-50. [ Links ]
Tanner, RS. (1989). J. Ind. Microbiol. 4:145–154. [ Links ]
Stover RH. (1959). Nature 184:1591-1592. [ Links ]
Umaña, G; Saenz, M; Umaña, D. (2000). “Asociación de Pequeños Productores de Talamanca APPTA. Labor. Postcosecha”.Centro de investigaciones Agronómicas (CIA), Universidad de Costa Rica. [ Links ]
Uribe, L. (2008). In Memorias XI Congreso Agronómico Nacional/ III Congreso Nacional de suelos: El reto es producir y competir. San José, CR. p 39-47 [ Links ]
Vander, Molen, GE; Labavitch, JM. ans De Vay, JE. (1986). Physiol plant. 66:298-302 [ Links ]
Vinale, F; Sivasithamparam, K; Ghisalberti, EL; Marra, R; Woo, SL; Lorito, M. (2008). Soil Bioloy & Biochemistry 40:1-10. [ Links ]
Zambrano, AY; Martínez, G; Gutiérrez, Z; Manzanilla, E; Vicente-Villardón, JL.; Demey, JR. (2007). INCI 32(11):775-779. [ Links ]
*Correspondencia a:
Lenin Poveda-Vega Costarricense. Estudiante de Licenciatura en Agronomía. Universidad de Costa Rica. Sede del Atlántico. Email: povedav12@gmail.com
Saúl Brenes-Gamboa. Costarricense. Agrónomo. Profesor Instructor. Cultivos. Universidad de Costa Rica. Sede del Atlántico. Email: saul.brenes@ucr.ac.cr
Mauricio Guzmán-Quesada. Costarricense. Investigador. Coordinador Fitopatología. CORBANA-Costa Rica. Email: mguzman@corbana.co.cr
Ana Tapia- Fernandez. Costarricense. Agrónoma. Profesora Fitopatología Universidad de Costa Rica Sede del Atlántico. Email: ana.tapia@ucr.ac.cr
1. Costarricense. Estudiante de Licenciatura en Agronomía. Universidad de Costa Rica. Sede del Atlántico. Email: povedav12@gmail.com
2. Costarricense. Agrónomo. Profesor Instructor. Cultivos. Universidad de Costa Rica. Sede del Atlántico. Email: saul.brenes@ucr.ac.cr
3. Costarricense. Investigador. Coordinador Fitopatología. CORBANA-Costa Rica. Email: mguzman@corbana.co.cr
4. Costarricense. Agrónoma. Profesora Fitopatología Universidad de Costa Rica Sede del Atlántico. Email: ana.tapia@ucr.ac.cr
Recibido: 25.07.13 Aprobado: 02.11.1














