Introducción
El género Cryptosporidium spp. está compuesto por diferentes especies reportadas en vertebrados (Xiao & Fayer, 2008), donde se destaca el Cryptosporidium parvum con sus subtipos H y C (humanos y animales domésticos) (Shahbazi et al., 2020; Uga et al., 2000), que suele estar acompañado por Giardia duodenalis, Ciclospora cayetanensis y los microsporidios (Klein et al., 2008).
Los protozoarios como Cryptosporidium spp. son causa común de enfermedades diarréicas parasitarias, iniciadas con la infección de células epiteliales del tracto gastrointestinal de vertebrados domésticos y silvestres (Meireles, 2010; Muadica et al., 2021; Xiao, Sulaiman et al., 2002; Xiao & Fayer, 2008). La enfermedad denominada criptosporidiosis, impacta de moderada a grave en países en desarrollo y es responsable de infecciones clínicas (enteritis y diarreas severas) y subclínicas (sistema respiratorio) (Hernández-Gallo et al., 2018; Zhang et al., 2020). Su principal cuadro clínico es la gastroenteritis aguda: diarrea (<2 semanas de evolución) acompañada de vómitos, dolor abdominal y/o fiebre (Yalda Lucero, 2014).
La infección predomina en animales jóvenes y su patogenicidad varía por factores como edad, inmunidad, genética, huésped y dosis infecciosa (Feng et al., 2018) (Ryan et al., 2014). Se ha reportado en todos los continentes (Xiao & Fayer, 2008) y se considera una zoonosis re-emergente (Díaz-Lee et al., 2011), que presenta alta mortalidad en neonatos o animales jóvenes (50 %) (Connor et al., 2017) y alta prevalencia en terneros (7 y 21 días) (Garber et al., 1994) y niños pequeños (preescolar). En los Estados Unidos, se ha observado un aumento de la incidencia del protozoario en época de verano, mayor incidencia en hombres, así como la división en dos grupos etarios (niños de 1 a 9 años y adultos 30 y 39 años) (Yoder & Beach, 2010)
La inmunosupresión es determinante para su desarrollo, al igual que su asocio a comorbilidades como síndromes de inmunodeficiencia por infecciones virales y de hiperinmunoglobulina M, asociadas a deficiencias de receptores de la familia del factor de necrosis tumoral, expresadas por una variedad de células, incluidas las células B, macrófagos, células dendríticas, principalmente CD40 (Hunter & Nichols, 2002; Lougaris et al., 2005).
La criptosporidiosis presenta diversas vías de contagio, como a) la fecal-oral, b) el contacto directo con el huésped y c) a través de agua, comida y fómites (indirecto); su modo de transmisión es por lo general, horizontal por contacto directo con animales infectados, es frecuente en veterinarios y trabajadores de higiene y salud pública (Drinkard et al., 2015). Entre los factores que favorecen la infección con Cryptosporidium spp. están a) la alta cantidad de ooquistes procedentes de individuos infectados (fuentes de agua), b) la resistencia ambiental de los ooquistes y c) el grado de virulencia (infección con números pequeños de ooquistes (Ryan et al., 2014). Esta revisión tiene como objetivo documentar las características más importantes de virulencia y patogenia de Cryptosporidium spp., así como la descripción de sus variantes genéticas y su potencial zoonótico.
Cryptosporidium spp.
Cryptosporidium spp. es un protozoo con afinidad entérica del Phylum Apicomplexa y la clase Coccidia, orden Eucoccidiorida, familia Cryptosporidae (Xiao & Fayer, 2008), es un parásito intracelular obligado, monoxeno, con fases de reproducción sexual, que afecta múltiples especies de vertebrados, incluida la humana (Borowski et al, 2010; Thompson et al., 2016).
Se conocen diecinueve especies de Cryptosporidium, entre las que se destacan C. parvum (humanos), C. bovis, C. ryanae (bovinos) (Santin, 2020), C. canis (caninos) y C. suis (porcinos) (Chalmers & Giles, 2010). En humanos se han reportado ocho especies (C. hominis, C. parvum, C. meleagridis, C. felis, C. canis, C. muris, C. suis y C. cervine) (Fayer, 2004). Su intensidad clínica y duración varía en función de factores del huésped (edad, estado inmunológico) y del parásito (dosis infectiva, fuente de infección, vida media de los ooquistes) (Del Coco et al., 2008).
El periodo de incubación de Cryptosporidium spp. es variable; los primeros síntomas inician alrededor de los 7 (1-14) días después de la ingesta del parásito (por agua y/o alimentos contaminados) (Hunter et al., 2007), la sintomatología se presenta hasta los 122 días (Chen et al., 2004). En humanos, se puede presentar una fase asintomática con episodios de recaída (presencia de diarrea acuosa y/o mucosa o sanguinolenta) a los 45 días (Hunter et al., 2007).
Cryptosporidium spp. tiene un ciclo de vida de tipo monoxeno intracelular obligado (Chen et al., 2004), cursa dos estados el asexual y el sexual, madura en el tejido del hospedero y es autoinfeccioso (Tandel et al., 2019). Su ciclo inicia luego de la ingestión del ooquiste por el animal (≤10 ooquistes); después que los esporozoitos emergen de los ooquistes, estos se activan a nivel intestinal (enterocitos), adhiriéndose a la membrana del epitelio y se ubica intra y extracitoplasmática en las denominadas vacuolas/sacos parasitóforos (Certad et al., 2017). Luego, se convierten en merontes tipo I, donde pueden continuar en el ciclo asexual o seguir la fase sexual que permite la formación de dos generaciones de merogonias (merontes tipo II). Los merontes tipo I generan entre seis y ocho núcleos y cada uno da lugar a un merozoito que es a nivel estructural igual a un esporozoito. Los merozoitos abandonan el meronte e invaden otras células del huésped donde pueden dar lugar a merontes tipo I o tipo II. Los merontes tipo II, tienen cuatro núcleos y generan cuatro merozoitos (Bouzid et al., 2013) (Figura 1).
Tras la infección de varias células, los merontes tipo II se diferencian en microgametos y macrogametos (equivalentes a espermatozoides y óvulos) y dan inicio a su fase sexual que origina un zigoto que desarrolla el ooquiste con cuatro esporozoitos desnudos (Gerace et al., 2019). Existen dos tipos de ooquistes, los de pared delgada y los de pared gruesa, los primeros son responsables de la infección y los segundos persisten en el medio ambiente por períodos más largos e infecta a nuevos individuos al permanecer en la membrana parasitófoga o dentro de un huésped (merogonias y ooquistes de pared delgada), lo que genera este segundo procesos de autoinfección (Tzipori & Ward, 2002). Los ooquistes poseen una pared trilaminar, resistente a la rotura química y mecánica, que mantiene la viabilidad de los esporozoitos internos en condiciones ambientales adversas (Leitch & He, 2011).
Modos de transmisión y factores de riesgo
Existen diferentes vías de transmisión para Cryptosporidium spp. La transmisión directa a través de la ruta fecal-oral, que ocasiona infecciones accidentales con los ooquistes esporulados excretados en las heces de un huésped infectado (Ryan et al., 2014). También se transmite de forma horizontal gracias a su capacidad de sobrevivencia durante días y en condiciones de humedad y temperatura favorables (Gharpure et al., 2019).
La criptosporidiosis se asocia al consumo de aguas contaminadas y al uso de piscinas, por las propiedades del agua que favorecen la sobrevivencia y desarrollo del parásito (Hachich et al., 2004). En Estados Unidos, es considerado un patógeno de categoría B como agente contaminante de las fuentes agua (Rotz et al., 2002). Se ha encontrado en aguas superficiales, subterráneas, aguas tratadas y sin tratar (Rose, 1997), son las heces humanas y/o animales la principal fuente de contaminación, por la utilización de materia orgánica como abono o por el uso de aguas residuales (Meinhardt et al., 1996). Los ooquistes son resistentes a diversos métodos químicos de desinfección, aunque son sensibles a coagulación, filtración y sedimentación (Fayer, 2004), su alta resistencia a el cloro, es una de las principales razones de su alta transmisión en piscinas (Yoder & Beach, 2010).
Los alimentos y subproductos también se consideran fuentes de infección de Cryptosporidium spp, la leche cruda (Ursini et al., 2020) y el uso de pasturas contaminadas (Chalmers & Giles, 2010) son las más relevantes, que sumado a las bajas dosis infectantes y la sobrevivencia ambiental, ubican al Cryptosporidium spp. como agente causal de enfermedades transmitidas por alimentos (ETA) (Quiroz et al., 2000).
También se han reportado otras fuentes de transmisión como: a) la nosocomial (hospitales y guarderías) (Alpert et al., 1986), b) a través de fómites, c) a través del suelo, d) por insectos vectores (cucarachas y moscas) (Dillingham et al., 2002), e) por inhalación de ooquistes durante el vómito (Clavel et al., 1996), f) por posible propagación por vía hematógena (reporte en macrófagos) (Certad et al., 2017) y g) por contacto directo con animales de zoológico (Gu et al., 2016).
Entre los principales factores de riesgo para los humanos se encuentran: a) el contacto con animales, b) brotes de diarrea en el hogar y c) heces en lugares públicos (Bouzid et al., 2018). En animales domésticos los principales factores de riesgo son a) el tipo de rebaño, b) la ubicación geográfica, c) la presencia de crías, d) el clima y e) la habilidad materna. En menor proporción, se reportó la enfermedad en humanos tras el contacto con a) fómites y equipos contaminados, b) profesionales y personal del sector pecuario. Además, en lecherías se reportó que a) la presencia de gatos, b) la inclusión de individuos externos, c) el uso de aguas subterráneas, d) no tratar las excretas, e) la manipulación de equipos de ordeño y f) la presencia permanente de los humanos en la misma explotación, incrementan la probabilidad de presencia de la enfermedad. Por otro lado, el efecto de personal tecnificado, buenas prácticas ganaderas, el tratamiento del agua y el tratamiento de las excretas, reducen los riesgos de transmisión del Cryptosporidium spp. (Garro et al., 2016).
Factores de virulencia de Cryptosporidium spp.
Existen diversos factores responsables del establecimiento y perpetuación de la infección por Cryptosporidium spp. (Okhuysen & Chappell, 2002), en donde se destaca su capacidad de inducir la patogenicidad (virulencia) (Thompson et al., 2016), lo que genera las consecuencias en el hospedero. Entre los más relevantes están los que influyen en: a) la excitación (proteasas y aminipeptidadas), b) la unión al epitelio (circumsporozoitos -gp900, gp60 y P30), c) el deslizamiento, d) la invasión (fosfolipasas secretoras), e) la supervivencia intracelular y f) el daño de la célula huésped (hemolisinas) (Bouzid et al., 2013). La detección de estos factores de virulencia se ha realizado por métodos moleculares e inmunológicos. Los factores de virulencia asociados a la infección por Cryptosporidium, spp. se enumeran en el Cuadro 1 y en la Figura 2 se evidencia el mecanismo mediante el cual muchos de ellos influyen sobre la patogenia.
Cuadro 1 Factores de virulencia del Cryptosporidum spp.
| Factores de virulencia | Funciones | Descripción | Referencias |
| CSL | Adhesión | Localizado en micronemas y gránulos densos del complejo apical y presente en superficie esporozoitos y merozoitos | Tzipori & Ward (2002) |
| TRAP-C1 | Adhesión Locomoción | Se encuentra enEimeria, Toxoplasma y Plasmodium | Bouzid et al. (2013) |
| Cp47 | Adhesión | Localizado entre la película apical del esporozoito y microtúbulos de membrana asociados a la proteína | Boulter-Bitzer et al. (2007); Bouzid et al. (2013) |
| CPS-500 | Adhesión - locomoción | Antígeno polar glicolípido y tubulovesicular citoplasmático de esporozoito y merozoitos | Bouzid et al. (2013) |
| GP900 | Adhesión | Almacenado en la superficie del esporozoito durante la infección | Cevallos et al. (2000) |
| Gp15/45/60 o Cpgp40/15 o S60 o Gp 15/45 | Penetración y motilidad | Glicoproteína que se localiza en la superficie de esporozoito y merozoito | O'Connor et al. (2007) |
| Gp60/40/15 | Adhesión | Glicoproteína de superficie | Bouter-Bitzer et al. (2007) |
| GP25-200 | Ocupa la superficie de la célula del hospedador | Antigeno gp apical de superficie de esporozoitos y merozoitos | Carey et al. (2004) |
| Ga1/GalNAc lectin | Excitación | Inhibe la adhesión de esporozoítos a células Caco-2. Asociado con estructuras membranosas | Joe et al. (1994) |
| p23 | Adhesión - locomoción | Involucrado en la motilidad y deslizamiento | Borowski et al. (2010); Okhuysen & Chappell (2002) |
| p30 | Adhesión | Involucrado en adhesión a las células | Bouzid et al. (2013) |
| ATP | Transporte | Ayuda a los cambios electrolíticos | Okhuysen & Chappell (2002) |
| Cistein proteasa o calpaina | Remodelación del citoesqueleto | Activa la cisteína proteasas. Se activa en respuesta al Ca+ | Perez-Cordon et al. (2011) |
| Serin proteasa | Invasión | Digestión de proteínas Evade respuestas inmunes Esencial para supervivencia del parasito y crecimiento | Nava et al. (2019) |
| Aminopeptidasa | Excitación | De los esporozoítos | Okhuysen & Chappell (2002) |
| HSP70 | Proteína de choque térmico | Chaperona dependiente de ATP | Jian et al. (2014) |
| HSP90 | Proteína de choque térmico | Chaperona dependiente de ATP | Feng et al. (2009) |
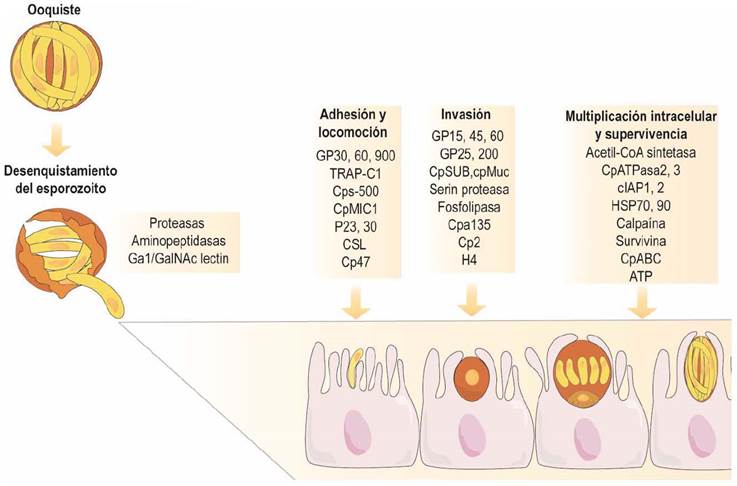
Figura 2 Influencia de diversos factores de virulencia sobre la patogenia del Cryptosporidium spp. Modificado de Bouzid et al. (2013).
Patogenia del Cryptosporidium
El parásito se ubica en la superficie del epitelio gastrointestinal y del tracto respiratorio de los mamíferos, aves, reptiles y peces. Se presenta una forma respiratoria en aves y otra entérica en mamíferos, su ciclo de vida se desarrolla en un solo huésped en la superficie luminal del epitelio intestinal (Gerace et al., 2019).
Para la forma entérica, tras la ingestión vía oral del ooquiste, este es transportado por la faringe, esófago, estómago e intestino (peristaltismo), donde al interaccionar con ácidos gástricos, pancreáticos y sales biliares (Laurent et al., 1999), facilitan su excreción por: a) el debilitamiento de la pared, b) el aumento de la permeabilidad (Chatterjee et al., 2010) y c) el incremento de la temperatura. La etapa infecciosa de Cryptosporidium spp. está mediada por ooquistes esporulados (esporozoitos) de pared gruesa (4-6 μm de diámetro) (Dowle et al., 2013), que en bajo número (<10) causan la infección (Lendner & Daugschies, 2014).
Los esporozoitos secretan proteasas, tripsinas y adhesinas en la primera hora de infección a los orgánulos apicales de la célula, lo que facilita su invasión, recubre las puntas y los lados de las vellosidades intestinales (tropismo por yeyuno e íleon), lo que favorece el desarrollo intracelular (Chatterjee et al., 2010), que genera alteraciones como el acortamiento de las vellosidades y el alargamiento de las criptas. La presencia del parásito estimula la liberación de mediadores inflamatorios como interferón-gamma (INF-β), interleucina 8 (IL- 8) y factor de necrosis tumoral (TNF, por sus siglas en ingles), así como, la liberación de factores solubles que incrementan la secreción de cloro (Cl-) y agua (H2O), disminuyen la absorción de sodio (Na), lo que favorece la diarrea por osmosis (Certad et al., 2017).
La pared del ooquiste de Cryptosporidium spp. contiene glicoproteínas similares a la mucina y a adhesinas relacionadas con la trompospondina (Certad et al., 2017), que favorecen su adhesión al enterocito a través de vías y receptores (glicoproteínas gp900, gp60 y CSL). Luego se liberan esporozoitos móviles en el intestino y que, mediante roptria y micronemas, penetran en otras células y forman vacuolas parasitólogas, para la reproducción asexual (merogonía) y/o la reproducción sexual (gametogonía), mediante la liberación de ooquistes de paredes gruesas y de ooquistes de paredes delgadas (Garcia, 2016).
El complejo apical y de superficie expresa receptores de membrana fundamentales en la invasión y/o adhesión a la célula y mesénquima, denominadas glicoproteínas similares a los circumsporozoitos o CSL (por sus siglas en inglés -circumsporozoite like glycoprotein-), interactúa con proteínas de membrana como GalNac (N-acetilgalactosamina) y glicoproteínas GP900. Los esporozoitos y merozoitos también expresan glicoproteínas de superficie como 15/40/60, p23, TRAP-C1, entre otras (Bouzid et al., 2013).
Otro factor que regula la invasión de Cryptosporidium spp. es el calcio (Ca2+), al modular transportadores en el retículo endoplasmático, mitocondrias y membrana celular. Cryptosporidium spp. posee Ca2+ que convierte adenosín monofosfato (AMP) en adenosín monofosfato cíclico (AMPc), para estimular las paredes basolaterales del enterocito a nivel de la bomba sodio potasio ATPasa, lo que genera la pérdida de electrolitos en el individuo. La teoría de la vía Ca2+ está asociada a la activación de la calpaína en enterocito, influyen sobre el Ca2+ y activan las fosfolipasas (Luo et al., 2016; Sarkhosh et al., 2019). Un incremento en el nivel de Calcio (Ca2+) intracelular, produce diversos procesos bioquímicos, uno de ellos la activación de la Calpaina, la cual una vez estimulada degrada sustratos de membrana, citoplasmáticos y nucleares, lo que altera la arquitectura celular y lleva a la apoptosis (Reza Momeni, 2011).
Para completar el ciclo biológico, el Cryptosporidium spp. sale de la célula infectada e invade los mecanismos de defensa celular y de apoptosis, a través de sus factores de virulencia de multiplicación celular y supervivencia (Figura 2). Entre los mecanismos inhibitorios para el C. parvum están las proteínas inhibidoras de las caspasas (IAP), (cIAP1, cIAP2 y survivina) (Liu et al., 2008). La inducción de apoptosis por parte del parásito para escapar de la célula huésped que se ha demostrado in vitro (Chen et al., 1999) e in vivo, aún está por esclarecer el proceso al considerarse la apoptosis un mecanismo de defensa (Sasahara et al., 2003).
Respuesta inmunológica
La inmunidad contra Cryptosporidium spp. se basa en respuestas inmunitarias innatas y adaptativas. Las respuestas innatas provienen de las células natural killer (tNK), las dendríticas, los macrófagos, las quimiocinas, los receptores tipo toll y la óxido nítrico sintetasa (ONS). Además, el factor de necrosis insulínico β activa los macrófagos para producir óxido nítrico (vía óxido nítrico sintetasa); las células auxiliares Th1 y CD4 actúan contra los parásitos intracelulares, producen interferón beta (INF-β), interleucinas (IL-2, IL-12) y factor de necrosis tumoral (TNF), y las células auxiliares Th2 ayudan a eliminar parásitos. Las respuestas adaptativas provienen de células T y B (Leitch & He, 2011).
Lesiones macroscópicas
No se reportan lesiones macroscópicas específicas generadas por Cryptosporidium spp. en mamíferos y aves, ya que la enteritis es común para varios patógenos. No obstante, se asocia a a) aumento en la fluidez del contenido intestinal, b) hiperemia de la mucosa y c) distensión general del intestino. Los ganglios mesentéricos se agrandan, el yeyuno, íleon y colon pueden presentar congestión e hiperemia junto con úlceras multifocales de distribución difusa. A nivel sistémico, se encuentran anomalías de la absorción y de las funciones secretoras del intestino y deshidratación severa. Las lesiones respiratorias pueden incluir rinitis, conjuntivitis, sinusitis, traqueítis y aerosaculitis (aves). También se pueden encontrar riñones pálidos y agrandados (Mohteshamuddin et al., 2020).
Técnicas de diagnóstico para Cryptosporidium spp.
Las muestras más comunes para el diagnóstico de Cryptosporidium spp. son las heces de individuos sospechosos. El análisis macroscópico se basa en la consistencia de las heces en donde confluye la consistencia acuosa y presencia de moco. No obstante, pueden existir individuos asintomáticos con heces sólidas (cargas de ooquistes de bajas a moderadas). El análisis coprológico debe hacerse seriado, se muestrea por pareado o triplicado, para poder realizar entre cinco a seis frotis que brinden confiabilidad (Garcia, 2016).
La cuantificación de los ooquistes se realiza con las técnicas de flotación o sedimentación. Las técnicas de flotación más relevantes son la de sacarosa de Sheather, el sulfato de Zinc y el cloruro de Sodio saturado (Pakdad et al., 2018), que bajo microscopía de campo claro permite observar ooquistes teñidos de rosa y bajo microscopía de contraste de fases permite observar ooquistes brillantes y birrefringentes (McNabb et al., 1985).
Existen técnicas de microscopía en otros fluidos, tejidos y en heces que también identifican ooquistes como: a) la tinción en muestras de líquido duodenal, bilis, esputo, lavado broncoalveolar y biopsias, b) el montaje húmedo de yodo-solución salina (en heces concentradas), c) la tinción ácido-resistente (naturaleza de esporozoitos) (económica) (Morgan et al., 1998), d) la tinción con azul de safranina y azul de metileno en metanol (ooquistes de color naranja-rosa) (Baxby et al., 1984), e) la tinción negativa (carbol fuschina y nigrosina / safranina / verde malaquita) y f) la tinción ácido-alcohol resistente + DMSO (ooquistes de color rosa brillante) (Pohjola et al., 1985). Se pueden utilizar tinciones fluorescentes (más específicas) en donde se destacan: a) auramina-rodamina, b) auramina-fenol, auramina-carbol fucsina y c) naranja de acridina (Mirhashemi et al., 2015), al igual que usar ácido-alcohol resistentes + anticuerpos fluorescentes anti-Cryptosporidium y tinciones con hematoxilina y eosina Giemsa / Jenner, que permiten identificar las etapas de desarrollo (cuerpos pequeños, esféricos y basófilos) en las microvellosidades intestinales (Current & Reese, 1986).
Entre las pruebas serológicas está la detección de anticuerpos (ELISA) anti-Cryptosporidium, a través de la presencia de IgG e IgM (Vanathy et al., 2017). La sensibilidad (66 - 100 %) y especificidad (93 - 100 %) en humanos son variables (De, 2013). La observación de antígenos específicos para Cryptosporidium/Giardia o para Cryptosporidium/Giardia/Entamoeba se realiza mediante inmunocromatográfia rápida (Agnamey et al., 2011).
Los marcadores moleculares más utilizados para la tipificación de Cryptosporidium spp. son los genes ARN 18s ribosomal (18S rRNA) y de la glicoproteína de 60 kDA (gp60). Este último codifica una proteína precursora de las glicoproteínas gp45, gp40 y gp15 implicadas en la unión y posterior invasión al enterocito, basado en la heterogeneidad de algunos trinucleótidos (TCA, TCG o TCT) ubicados en el extremo 5' (Zahedi et al., 2016), que ha facilitado la definición de diferentes subtipos dentro de una misma especie (Ryan et al., 2014).
Entre los métodos moleculares para la detección de Cryptosporidium spp., se encuentra la reacción en cadena de la polimerasa (PCR), la cual se considera una de las técnicas diagnósticas más sensibles y específicas para muestras clínicas y ambientales, al permitir la genotipificación y subtipificación del ADN (ácido desoxirribonucleico) de Cryptosporidium spp. La PCR anidada (nested PCR) permite amplificar un mayor número de copias del gen, los más utilizados son gp60, hsp70, ARNr 18S, COWP y TRAP (C1 y C2). La PCR en tiempo real (qPCR) detecta el ADN en tiempo real mediante sondas de hibridación (Higgins et al., 2001; Limor et al., 2002) y la PCR múltiple combina la amplificación de diferentes genes diana (Verweij et al., 2004). No obstante, las pruebas de PCR requieren de protocolos estrictos de extracción y procesamiento de ADN en la materia fecal.
El análisis de microsatélites permite identificar las repeticiones de secuencia simple o los microsatélites e identificar polimorfismos dentro de diferentes tipos de Cryptosporidium spp. (Snelling et al., 2007). No obstante, las especies y/o genotipos de Cryptosporidium spp., solo pueden ser identificados mediante secuenciación de genes o análisis de polimorfismos en la longitud de los fragmentos de restricción (RFLP, por sus siglas en inglés). Estos RFLP analizan los productos de la PCR cortados con enzimas de restricción e identifican diferentes genotipos de Cryptosporidium spp mediante genotipado y subtipificación (Snelling et al., 2007). Otra técnica para la detección de Cryptosporidium spp. es hibridación fluorescente in situ (FISH), que permite la hibridación mediante una sonda de oligonucleótidos sintéticos dirigidas a regiones particulares de ARN ribosomal (ARNr) del patógeno (Alagappan et al., 2009).
Especies de Cryptosporidium spp. en humanos y animales domésticos
Cryptosporidium spp. tiene diferentes especies que afectan humanos y animales domésticos, silvestres y peces, en donde C. parvum presenta mayor prevalencia en humanos y en algunas especies animales, e influye con mayor frecuencia e intensidad en individuos jóvenes (Zhang et al., 2020). En bovinos, también presenta afinidad por animales jóvenes (3 a 21 días) identificándose C. parvum, C. bovis y C. ryanae en animales post destete y C. andersoni en adultos. El C. parvum presenta una alta prevalencia (90 %) y es considerada una zoonosis muy influyente, que hace parte del complejo de diarrea neonatal no específica en terneros (Thompson et al., 2016). La tasa de infección del C. bovis en terneros pre-destete puede llegar al 100 % y post-destete al 33 % (Murakoshi et al., 2012). La prevalencia fluctúa entre 0 a 100 %, con diversos Cryptosporidium spp. en diferentes edades (Del Coco et al., 2008; Mohteshamuddin et al., 2020). Se ha reportado C. parvum en búfalos de agua como parte de la diarrea neonatal no específica (Maurya et al., 2013).
En porcinos, se reportan especies como C. parvum, C. suis, C. scrofarum, C. muris y C. tyzzeri, que a su vez causan enteritis (necrótica) y diarrea, aunque poco frecuente, en cerdos entre los ocho a veintiún días, con signos como deshidratación, inapetencia y pérdida de peso (Guselle et al., 2003). También se identificó el C. suis en humanos en forma asintomática (Xiao, Bern et al., 2002).
En ovinos y caprinos, si bien existe literatura antigua (Barker & Carbonell, 1974), son pocos los reportes (Mason et al., 1981) que presentan coincidencia con otros rumiantes. La mayor susceptibilidad se da en animales jóvenes menores de un mes de vida, donde se presenta alta morbilidad y mortalidad (Vieira et al, 1997). Se han identificado diversas especies como C. parvum, C. ubiquitum, C. xaioi, C. homininis, C. suis, C. andersoni, C. fayeri, C. scrofarum, entre otros (Foreyt, 1990; Majeed et al., 2018; Robertson et al., 2014).
En camélidos suramericanos se ha detectado C. parvum, sin embargo, en estos no se presentan signos clínicos (Zhang et al., 2020). En conejos se ha reportado C. parvum y C. cuniculus, en gazapos antes del destete con curso asintomático y con signos de diarrea, acompañada de alta mortalidad (Robinson & Chalmers, 2010).
En caninos, C. canis, presenta la diarrea como su principal síntoma, en individuos menores de veinticuatro meses (Fayer et al., 2001). En felinos domésticos, C. felis y C. parvum, causa diarrea recurrente asociada a inmunosupresión secundaria proveniente de leucemia felina (Mtambo et al., 1991), aunque se reportan casos de enfermedad grave y persistente (Barr et al., 1994).
La criptosporidiosis aviar se presenta en diversas especies de aves de forma subclínica y suele alojarse en el ciego. Se han identificado ooquistes similares a C. parvum, al igual que C. meleagridis (Sréter et al., 2000), C. bayley y C. galli, en la bolsa de Fabricio, la cloaca y el proventrículo (Baroudi et al., 2013; Chvala et al., 2006). En peces se ha identificado C. scophthalmi en el epitelio intestinal y C. molnari en el estómago, y con el tiempo ha ganado protagonismo como fuente de contaminación de aguas con un impacto zoonótico y en salud pública (Certad et al., 2015; Reid et al., 2010).
En serpientes el C. serpentis causa hiperemia y engrosamiento de la mucosa gástrica, con aspecto empedrado y ausencia de pliegues rugosos, así como el C. varanii causa enteritis (Yimming et al., 2016).
Tratamiento y prevención
A pesar de los avances en investigación no existe un tratamiento eficaz y específico contra la criptosporidiosis por su localización intracelular y por los factores de resistencia del Cryptosporidium spp. Si bien, se reportan tratamientos basados en combinación de medicamentos antiparasitarios (paromomicina, zitromicina y nitazoxanida) considerados moderadamente efectivos (Sparks et al., 2015), son los factores de prevención como a) el lavado de manos y fómites, b) la interrupción de las vías de transmisión, c) la protección de individuos vulnerables, d) evitar el contacto con heces (humanas y de animales) y e) evitar la ingesta de aguas sin tratamiento, los que reducen la incidencia de la enfermedad (Chalmers & Davies, 2010).
Conclusiones
La variabilidad en la prevalencia, la amplia distribución, la diversidad de mecanismos de interacción con el huésped, la complejidad de su ciclo de vida, la resistencia a diferentes ambientes y la capacidad infectiva (virulencia), ubican al Cryptosporidium spp como un agente zoonótico relevante. Factores como la juventud del huésped, la especie de Cryptosporidium spp, la vía infección (contacto directo - ingesta agua y leche contaminadas), el tipo de explotación, la ubicación geográfica y los condiciones ambientales, influyen en la variabilidad en las tasas de infección (0 a 100 %). De igual forma, la inespecificidad de los síntomas y la co-infección con otros patógenos en diferentes especies, generan confusión en el diagnóstico clínico y son los métodos diagnósticos de laboratorio y moleculares los que determinan su diagnóstico certero e identificación de variante. El diagnóstico y tratamiento oportuno evita los efectos letales de la enfermedad, aunque la diarrea y sus efectos secundarios tienen un impacto económico importante. El control sanitario ha mostrado ser efectivo en la disminución del patógeno y el uso de la información epidemiológica ha permitido construir mapas claros con factores de riesgo y ubicación, lo que genero mayor conocimiento sobre sus zonas de influencia. Sin embargo, la variabilidad genética dentro de la especie, las características del huesped, y los factores de virulencia (adhesión, invasión y permanencia celular), presentan un reto para la salud pública. La morbilidad y mortalidad de los animales infectados en producciones pecuarias y en animales de compañía, depende de la intensidad de los síntomas clínicos (diarrea) y de la prevalencia e incidencia dependiente de los factores de riesgo, por lo que se recomienda continuar con investigaciones que contribuyan a documentar las características de patogenia, transmisión, prevención y control del Crytosporidium spp.
















