Introducción
El frijol común (Phaseolus vulgaris L.) es una de las leguminosas comestibles más importantes a nivel mundial. Constituye un complemento nutricional indispensable en la alimentación diaria de más de 300 millones de personas en el mundo (Magaña Lemus et al., 2015). Esta especie proporciona una fuente significativa de proteínas, vitaminas y minerales a la dieta humana. Su grano se considera estratégico, por su importancia social y económica en varios continentes, como Asia y América (Organización de las Naciones Unidas para la Alimentación y la Agricultura, 2020; Polania et al., 2016).
Entre los nutrientes necesarios para el desarrollo del frijol, el nitrógeno constituye uno de los elementos esenciales limitantes (Izaguirre-Mayoral et al., 2018; Xin et al., 2014). Para incrementar la disponibilidad de este nutriente y mejorar la productividad del cultivo, se incorporan al suelo fertilizantes inorgánicos. Esta práctica es costosa y provoca, en ocasiones, serias consecuencias ambientales (Xin et al., 2014; Yong et al., 2018).
Una alternativa económica y ecológica a la fertilización inorgánica es la obtención de nitrógeno a partir de la fijación biológica, proceso que permite que las leguminosas puedan crecer en suelos con escasa disponibilidad de este nutriente. Esto se debe a su capacidad para establecer asociaciones simbióticas con bacterias del suelo llamadas rizobios. Mediante este proceso, estos microorganismos transforman el dinitrógeno (N2) atmosférico en amonio (NH4 +), una forma de nitrógeno asimilable para las plantas (Koskey et al., 2017; Ramírez-Bahena et al., 2016).
Las leguminosas son muy variables en cuanto a su eficiencia para fijar nitrógeno atmosférico en simbiosis. La soya (Glicine max L.), en simbiosis con Bradyrhizobium, puede fijar de 100 a 150 kg/ha/año de N. En caupí (Vigna unguiculata L.), este valor es de 90 kg/ha/año de N. En asociación con Rhizobium, lupinus (Lupinus spp.) fija de 60 a 100 kg/ha/año de N y el frijol (Phaseolus vulgaris L.) de 20 a 80 kg/ha/año de N (Kakraliya et al, 2018). El frijol común está considerado, dentro de las leguminosas estudiadas, la menos eficiente en este proceso (Polania et al., 2016).
La búsqueda de alternativas que mejoren la nutrición nitrogenada en el frijol común, que además, permitan disminuir el uso de fertilizantes inorgánicos e incrementar su rendimiento han sido motivo de estudio. Dentro de ellas, se incluye el empleo de inoculantes a base de rizobios enriquecidos en inductores de la nodulación. En el Instituto Nacional de Ciencias Agrícolas, se desarrolló un producto denominado a nivel comercial como Azofert®-F. Este contiene una cepa de rizobio seleccionada por su competitividad y eficiencia, y posee altas concentraciones de factores de nodulación. Estas moléculas generan una mayor producción de señales por la bacteria, lo que influye en el éxito de la simbiosis (Nápoles García et al., 2016).
Un estudio anterior evidenció que la aplicación del biofertilizante Azofert®-F con una mezcla de oligogalacturónidos (Pectimorf®), potenció la nodulación y el crecimiento en plantas de frijol común, con respecto a las plantas que solo se trataron con el biofertilizante (Lara-Acosta et al., 2019). Se consideró que tal efecto podría estar relacionado con un mayor aporte de nitrógeno como resultado de incrementos en la fijación biológica de este nutriente, a partir de los resultados en la nodulación.
En estudios posteriores, la aplicación de Pectimorf® a plantas biofertilizadas con Azofert®-F, incrementó la actividad nitrogenasa y la expresión de enzimas involucradas en la asimilación del nitrógeno. Este efecto conllevó a incrementar en más de un 10 % la efectividad de la fijación simbiótica del nitrógeno. Es por ello, que la aplicación del bioestimulante Pectimorf® en plantas biofertilizadas con Azofert®-F, se considera una alternativa para mejorar la nutrición nitrogenada en etapas tempranas del crecimiento (V3, cuando las plantas tienen el segundo par de hojas trifoliadas desplegadas) (Lara et al., 2021). Sin embargo, se desconoce el efecto de la combinación de ambos productos en etapas posteriores del crecimiento de las plantas. Por tanto, el objetivo del presente trabajo fue determinar el efecto de Pectimorf® en indicadores relacionados con la fijación biológica del nitrógeno y en el crecimiento de plantas de frijol común biofertilizadas con Azofert®-F, en la etapa de crecimiento R5.
Materiales y métodos
El estudio se realizó en el Centro Nacional de Ciencias Genómicas (CCG) de la Universidad Nacional Autónoma de México (UNAM), Cuernavaca, México, entre los meses de octubre de 2018 y marzo de 2019 y en el Departamento de Fisiología y Bioquímica Vegetal del Instituto Nacional de Ciencias Agrícolas (INCA), provincia Mayabeque, Cuba, durante los meses de noviembre y diciembre de 2019.
Como material vegetal se utilizaron semillas de frijol común, variedad Cuba Cueto-25-9-N (Phaseolus vulgaris L.), procedentes del banco de germoplasma de semillas del Instituto de Investigaciones Fundamentales en Agricultura Tropical ''Alejandro de Humboldt'' (INIFAT), Cuba (Fernández et al., 2014). Por su comportamiento ante las enfermedades y manejo agronómico, esta variedad se incluye dentro de las veinticinco variedades de frijol común seleccionadas para facilitar el plan estatal de producción de semillas en Cuba (Faure et al., 2016).
Como biofertilizante se empleó el producto comercial Azofert®-F, con registro No. 002/17 y patente concedida por resolución OCPI No. 556/2002 (Nápoles, 2002), a base de la cepa Rhizobium tropici: CIAT 899 (Martínez-Romero et al., 1991) a una concentración de 1 x 1010 UFC/mL. El bioestimulante Pectimorf®, compuesto por una mezcla de oligosacáridos pécticos (oligogalacturónidos, OGs), con registro No. RCF 017/18 y patente No. 22859/2003 (Cabrera, 2003), se empleó en concentraciones de 5, 10 y 100 mg L-1, seleccionadas a partir de estudios previos, en los que se evaluaron varias concentraciones (1, 5, 10, 20, 40 y 100 mg L-1), en dos formas de aplicación, a las semillas y por aspersión foliar, para determinar las concentraciones más efectivas en la estimulación de la nodulación y el crecimiento (Lara-Acosta et al., 2019).
En el estudio se establecieron cuatro tratamientos. Uno en el que las semillas se inocularon con Azofert®-F, otro en la que las semillas de frijol común se trataron con una mezcla que contenía Pectimorf®, mezcla de oligogalacturónidos a 10 mg L-1, y el inoculante Azofert®-F, una cepa de rizobio seleccionada por su competitividad, eficiencia y nodulación (Nápoles García et al., 2016), a la concentración referida. En los restantes tratamientos las semillas se inocularon con Azofert®-F y luego, en la etapa de crecimiento V3, se aplicó el bioestimulante Pectimorf® por aspersión foliar a las concentraciones de 5 y 100 mg L-1 (1,5 mL por planta). Los tratamientos se establecieron de la forma siguiente:
T1: Azofert®-F.
T2: Azofert®-F+Pectimorf® (10 mg L-1) aplicados a las semillas.
T3: Azofert®-F+Pectimorf® (5 mg L-1) aplicado por aspersión foliar.
T4: Azofert®-F+Pectimorf® (100 mg L-1) aplicado por aspersión foliar.
Los experimentos se realizaron bajo un diseño completamente aleatorizado en condiciones controladas y semicontroladas, se repitieron en dos ocasiones. Solo se muestran los datos de una repetición dada la similitud en el comportamiento de los resultados.
Condiciones controladas
El experimento se realizó en el CCG. Las semillas de frijol se desinfectaron de acuerdo con el método propuesto por Ramírez et al. (2013) y se pusieron a germinar durante dos días a 30 ºC en la oscuridad. Cuando las semillas habían emitido las radículas, se plantaron en macetas con vermiculita estéril, a una profundidad de 2 cm y en este momento se inocularon con un 1 mL de Azofert®-F. En el tratamiento de Pectimorf® a las semillas (10 mg L-1), la inoculación con Azofert®-F se realizó junto con la aplicación de este producto, en el momento de la siembra, a razón de 1:1 v/v (2 mL/semilla).
Las plantas crecieron a 26-29 ºC y 60 % de humedad relativa, con un fotoperíodo de 16 h luz/8 h oscuridad, 4800 LUX y se regaron con solución nutritiva deficiente de nitrógeno (0,385 mM) (Summerfield et al., 1977). En la etapa de crecimiento correspondiente a R5 (prefloración), primera etapa de la fase reproductiva que se caracteriza por una elevada actividad metabólica para la síntesis de compuestos necesarios en las siguientes etapas, se evaluó en diez plantas por tratamiento el número de nódulos totales formados por planta (u/planta) y la masa seca de los nódulos (MSNT, g/planta). Esta última variable se determinó mediante el uso de una balanza analítica, luego de colocar las muestras en una estufa durante 72 h a 60 ºC, tiempo requerido para que mantuvieran un peso constante.
La actividad nitrogenasa se determinó por el método de reducción del acetileno, descrito por Hardy et al. (1968). Para esto, cada una de las raíces noduladas de las plantas se colocó en un frasco de vidrio de 120 mL y se selló con un tapón de goma para impedir el intercambio gaseoso. Luego, se extrajeron 2 mL de aire de los frascos y se sustituyeron por acetileno. Transcurridos 90 min, se tomaron 1,4 mL de gas y se inyectaron en un cromatógrafo de gases, equipado con un detector de ionización de llama y una columna empacadora. La actividad nitrogenasa se expresó en µmol C2H4/h/planta. La actividad nitrogenasa específica se determinó mediante el cociente de la actividad nitrogenasa por planta y la masa seca de los nódulos totales formados por planta, este resultado se expresó en µmol C2H4/h/g MSNT/planta.
Se evaluaron variables relacionados con el crecimiento de las plantas de frijol: masa seca aérea y radical (g/planta). Para ello, se utilizó una balanza analítica, luego de colocar las muestras en una estufa según lo antes descrito.
Condiciones semicontroladas
El experimento se realizó en el INCA. Las semillas se inocularon con Azofert®-F, previo a la siembra, a la concentración referida en un volumen de 200 mL por cada 46,04 kg de semilla, dosis recomendada por la casa comercial para la siembra en campo. La aplicación de Pectimorf® a las semillas se realizó junto con Azofert®-F, previo a la siembra, para lo cual se mezclaron ambos productos, en un volumen de 400 mL por cada 46,04 kg de semilla.
Las plantas crecieron en recipientes plásticos de 0,55 kg de capacidad de suelo Ferralítico Rojo Lixiviado típico, éutrico (Hernández et al., 2015) y se regaron cada día con 50 mL de agua de grifo (526 ± 20 µS cm-1). Las variables climatológicas promedios, 21,3 ± 2 ºC de temperatura y 80,4 ± 4 % de humedad relativa, se calcularon a partir del registro mensual por la Estación Meteorológica de Tapaste No. 78 374, ubicada en el km 3 ½ Carretera Tapaste-San José, San José de las Lajas, provincia Mayabeque, Cuba.
Para el análisis químico del suelo se tomaron muestras de 0-20 cm de profundidad y se emplearon los métodos descritos por Paneque Pérez et al. (2010). El suelo se caracterizó por presentar pH cercano a la neutralidad, contenido medio de materia orgánica, contenido alto de fósforo asimilable y niveles adecuados de calcio y magnesio (Cuadro 1). Las características químicas del suelo se consideraron adecuadas para el crecimiento de plantas de frijol Cuba Cueto-25-9-N, a partir de lo informado en los manuales para la producción sostenible de este cultivo (Espinoza et al., 2019; Faure et al., 2017).
Cuadro 1 Características químicas del suelo Ferralítico Rojo Lixiviado típico, éutrico, que se utilizó para el crecimiento de las plantas de frijol variedad Cuba Cueto-25-9-N, Mayabeque, Cuba, 2019.
| Características químicas del suelo | |||||
| pH (H2O) | M.O | P | Ca2+ | Mg2+ | |
| g kg-1 | mg kg-1 | cmol kg-1 | |||
| 7,30 | 30,70 | 73,00 | 14,00 | 2,00 | |
El contenido de materia orgánica (M.O) se determinó según el método de Walkley & Black (1934), el pH por el método potenciométrico, con una relación suelo-agua (1:2,5), el fósforo asimilable por el método de Oniani a partir de una extracción con H2SO4 (0,1 N), los cationes intercambiables calcio (Ca2+) y magnesio (Mg2+) por complejometría, a partir de una extracción con NH4OAc (1 mol L-1) a pH= 7. / The organic matter content (M.O) was determined using the Walkley & Black (1934) method, the pH by potentiometric method, with a soil-to-water ratio of 1:2.5. Available phosphorus was determined using the Oniani method from extraction with 0.1 N H2SO4. The exchangeable cations calcium (Ca2+) and magnesium (Mg2+) were determined by complexometry, following an extraction with 1 mol L-1 NH4OAc at pH= 7.
En la etapa R5 de crecimiento del cultivo, se determinó en diez plantas por tratamiento, el número (u/planta) y la masa seca de los nódulos (g/planta). Para determinar esta última variable, se empleó una balanza analítica, luego de colocar las muestras en una estufa durante 72 h a 75 ºC, tiempo requerido para que mantuvieran un peso constante.
La concentración de ureidos en los exudados xilemáticos, se determinó a partir de diez plantas por tratamiento. Los exudados se colectaron de tallos cortados en el horario de 12:00 a 13:00 h y las plantas se regaron una hora antes de iniciar la colecta. A las plantas se les realizó un corte por debajo del nudo cotiledonario y se les colocaron secciones de mangueras ajustadas al diámetro del tallo. La savia se colectó con una jeringa con una aguja metálica de unos 5 cm, se colocó en tubos eppendorff y luego se almacenó a -20 ºC. Para el análisis se emplearon 10 µL de cada exudado (Ramírez et al., 2013). Los ureidos se determinaron según el método de detección espectrofotométrico de Gordon Young y Conway (1942). La cuantificación se realizó a partir de una curva de calibración de alantoína (SIGMA), con un rango de concentración de 0,005-0,2 µmol mL-1. La concentración de ureidos se expresó en µmol mL-1 de savia xilemática.
La concentración de los nutrientes nitrógeno y fósforo, se determinó en hojas de diez plantas por tratamiento, luego de ser secadas en estufa por 72 h a 75 ºC. Las determinaciones se realizaron por análisis químico, mediante las metodologías descritas en el Manual de Técnicas de Laboratorio. Para determinar la concentración de nitrógeno se empleó el método Nessler y para la de fósforo el reactivo azul de molibdeno (Paneque Pérez et al., 2010).
Se evaluaron variables relacionadas con el crecimiento de las plantas de frijol común: masa seca aérea y radical (g/planta). Para ello, se utilizó una balanza analítica, luego de colocar las muestras en una estufa, como se describe en la evaluación anterior.
La efectividad del bioestimulante Pectimorf® sobre el crecimiento con respecto a la inoculación, se determinó a partir de la ecuación (1) de Santillana et al. (2005).

Donde:
E: efectividad del bioestimulante Pectimorf® en el crecimiento con respecto a la inoculación.
MSTPm: masa seca total de las plantas inoculadas y tratadas con Pectimorf®.
MSTb: masa seca total de las plantas solo inoculadas.
Análisis de los datos
Los datos se procesaron mediante un análisis de varianza de clasificación simple y comparación de medias por la prueba de Tukey p<0,05; en el programa estadístico IBM SPSS, Statistics v22. Antes del análisis de varianza, se comprobó la normalidad de los datos por la prueba de Kolmogorov-Smirnov y la homogeneidad de varianzas con el estadístico de Levene. Los gráficos se realizaron con el programa Microsoft Excel 2010.
Resultados
Condiciones controladas
La aplicación foliar de Pectimorf® a la concentración de 5 mg L-1 incrementó el número de nódulos en las plantas de frijol en un 22,49 %, sin mostrar diferencias significativas con el resto de los tratamientos en los que se incluyó el bioestimulante (Figura 1A). Sin embargo, en la masa seca de estas estructuras, los incrementos se obtuvieron con la aplicación a las semillas y la aspersión foliar a la concentración de 100 mg L-1, con incrementos de 55,47 % y 59,38 %, respectivamente (Figura 1B).
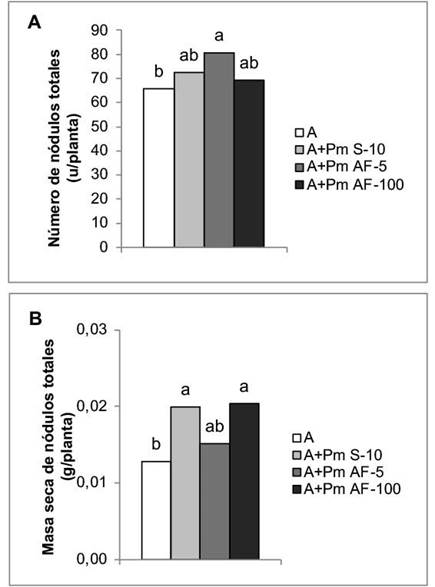
Figura 1 Efecto de la aplicación de Pectimorf® (mezcla de oligogalacturónidos) en la nodulación de plantas de frijol (Phaseolus vulgaris L.) variedad Cuba Cueto-25-9-N biofertilizadas con Azofert®-F, evaluadas en R5 (prefloración) y cultivadas en condiciones controladas. Cuernavaca, México, 2018-2019.
En la actividad de la enzima nitrogenasa, los mejores resultados se obtuvieron con la aplicación a las semillas y la aspersión foliar a la concentración de 100 mg L-1, con incrementos de 136,87 % y 182,50 %, respectivamente (Figura 2A). En cuanto a la actividad nitrogenasa específica, los mayores valores correspondieron a la aplicación a las semillas y a la aspersión foliar a la mayor concentración que se empleó (100 mg L-1), con incrementos de 108,18 % y 111,68 %, respectivamente, en comparación con la actividad de esta enzima en las plantas que solo se trataron con Azofert®-F (Figura 2B).
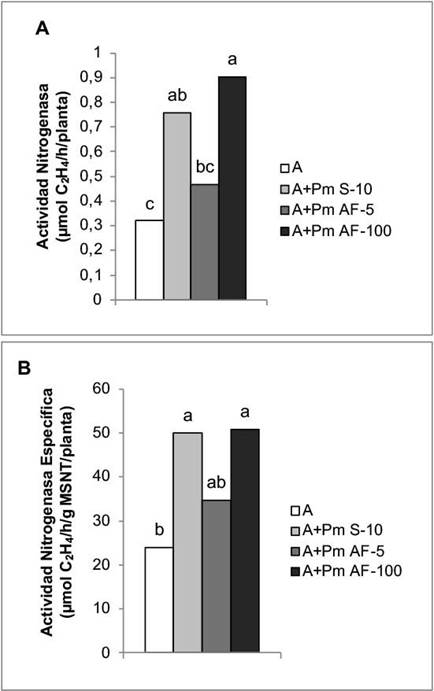
Figura 2 Efecto de la aplicación de Pectimorf® (mezcla de oligogalacturónidos) en la actividad de la enzima nitrogenasa de nódulos de plantas de frijol (Phaseolus vulgaris L.) variedad Cuba Cueto-25-9-N biofertilizadas con Azofert®-F, evaluadas en R5 (prefloración) y cultivadas en condiciones controladas. Cuernavaca, México, 2018-2019.
En cuanto a las variables de crecimiento, la aplicación de Pectimorf® a las semillas junto con el inoculante Azofert®-F, fue el tratamiento que mostró mayor efecto en el desarrollo del sistema radical. Esta forma de aplicación incrementó la masa seca de la raíz en un 15,51 %, con respecto a las plantas que solo se biofertilizaron. No se encontraron diferencias significativas entre los tratamientos con Pectimorf® (Figura 3A). Sin embargo, en esta etapa del crecimiento, la aplicación de la mezcla de OGs no tuvo un efecto significativo en el desarrollo aéreo de las plantas (Figura 3B).
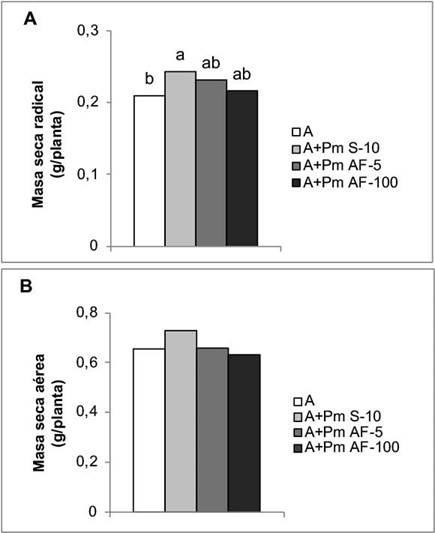
Figura 3 Efecto de la aplicación de Pectimorf® (mezcla de oligogalacturónidos) en algunos indicadores del crecimiento de plantas de frijol (Phaseolus vulgaris L.) Cuba Cueto-25-9-N biofertilizadas con Azofert®-F, evaluadas en R5 (prefloración) y cultivadas en condiciones controladas. Cuernavaca, México, 2018-2019. Medias con letras iguales no difieren significativamente según Tukey (p<0,05), n=10. ES x: error estándar de la media, (A) ES x=0,003 y (B) ES x=0,04.
Condiciones semicontroladas
La aplicación de Pectimorf® a las semillas y la aspersión foliar a la concentración de 100 mg L-1, favorecieron la nodulación. Con ambos tratamientos se obtuvieron incrementos de 30,12 % y 50,60 %, respectivamente, en el número de nódulos (Figura 4A) y de 62,50 % y 50,00 % en la masa seca de estas estructuras (Figura 4B).
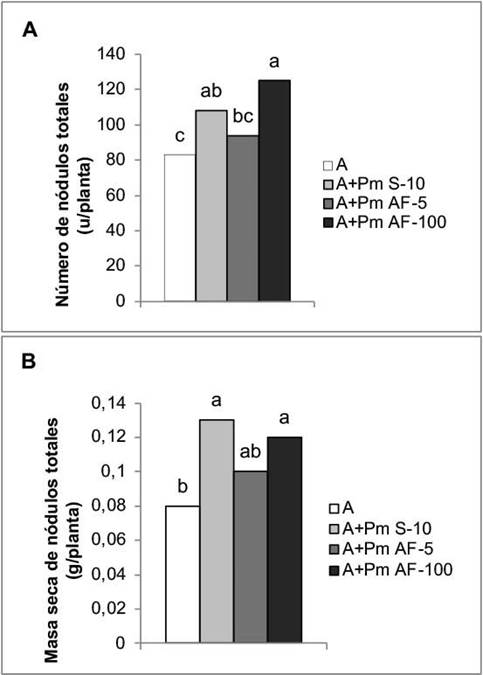
Figura 4 Efecto de la aplicación de Pectimorf® (mezcla de oligogalacturónidos) en la nodulación de plantas de frijol (Phaseolus vulgaris L.) variedad Cuba Cueto-25-9-N biofertilizadas con Azofert®-F, evaluadas en R5 (prefloración) y cultivadas en condiciones semicontroladas. Mayabeque, Cuba, 2019.
En la concentración de ureidos que se determinó en los exudados xilemáticos, no mostró diferencias entre los tratamientos con Pectimorf®, pero la aplicación a las semillas fue el tratamiento que mostró diferencias significativas con las plantas que solo se biofertilizaron. Esta forma de aplicación logró incrementar en 20,85 % el contenido de este metabolito en los exudados de las plantas (Figura 5). Este tratamiento también tuvo efecto positivo en el número y en la masa seca de los nódulos, como se observa en la Figura 3.
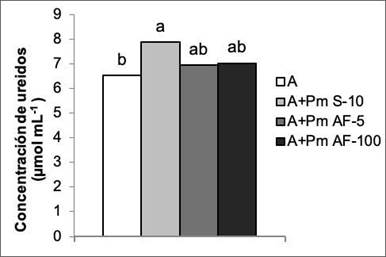
Figura 5 Efecto de la aplicación de Pectimorf® (mezcla de oligogalacturónidos) en el contenido de ureidos en exudados xilemáticos de plantas de frijol (Phaseolus vulgaris L.) variedad Cuba Cueto-25-9-N biofertilizadas con Azofert®-F, evaluada en R5 (prefloración) y cultivadas en condiciones semicontroladas. Mayabeque, Cuba, 2019.
En cuanto a los nutrientes, el contenido de nitrógeno fue mayor en un 18,35 % en las hojas de las plantas que las semillas se trataron con Azofert®-F y se asperjaron con Pectimorf® a la concentración de 100 mg L-1 en la etapa V3, con respecto a la concentración en las plantas que solo se biofertilizaron. En la concentración de fósforo, los incrementos se obtuvieron con la aplicación de 10 mg L-1 a las semillas junto con Azofert®-F y con la aspersión foliar posterior de 5 mg L-1 de Pectimorf®, con valores de 11,11 % y 13,89 %, respectivamente (Cuadro 2).
Cuadro 2 Efecto de la aplicación de Pectimorf® (Pm) en la concentración de nitrógeno y fósforo en hojas trifoliadas de plantas de frijol (Phaseolus vulgaris L.) Cuba Cueto-25-9-N biofertilizadas con Azofert®-F (A), evaluados en R5 (prefloración) y condiciones semicontroladas de cultivo. Mayabeque, Cuba, 2019.
| Tratamientos | Nutrientes (%) | ||
| N | P | ||
| A | 3,87 b | 0,36 b | |
| A+Pm 10 mg L-1 a semillas | 3,92 b | 0,40 a | |
| A+Pm por aspersión foliar a 5 mg L-1 | 4,22 ab | 0,41 a | |
| A+Pm por aspersión foliar a 100 mg L-1 | 4,58 a | 0,37 b | |
| ES x | 0,1 | 0,007 | |
A: Azofert®-F, A+Pm S-10: Azofert®-F+Pectimorf® (10 mg L-1) aplicados a las semillas, A+Pm AF-5: Azofert®-F+Pectimorf® (5 mg L-1) aplicado por aspersión foliar en V3, A+Pm AF-100: Azofert®-F+Pectimorf® (100 mg L-1) aplicado por aspersión foliar en V3. Medias con letras iguales no difieren significativamente según Tukey (p<0,05), n=2. ES x: error estándar de la media. / A: Azofert®-F, A+Pm S-10: Azofert®-F+Pectimorf® (10 mg L-1) applied to the seeds, A+Pm AF-5: Azofert®-F+Pectimorf® (5 mg L-1) applied via foliar spray in V3, A+Pm AF-100: Azofert®-F+Pectimorf® (100 mg L-1) applied via foliar spray in V3. Means with the same letters do not differ significantly according to Tukey (p<0.05), n=2. ES x: standard error of the mean.
En los indicadores relacionados con el crecimiento vegetal, los mayores efectos se observaron con la aplicación de Azofert®-F y Pectimorf® a las semillas y la aspersión foliar a la mayor concentración que se aplicó (100 mg L-1), con incrementos de 28,26 % y 34,78 %, respectivamente, en la masa seca radical (Figura 6A). Este último tratamiento también favoreció el desarrollo aéreo de las plantas, el cual contribuyó a incrementar en un 23,14 % la masa seca aérea, con respecto al tratamiento que solo se biofertilizó (Figura 6B).
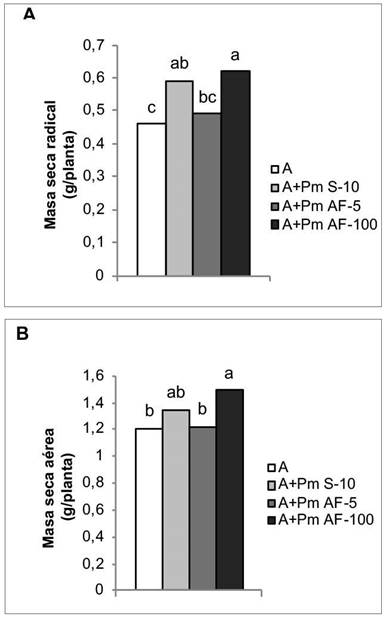
Figura 6 Efecto de la aplicación de Pectimorf® (mezcla de oligogalacturónidos) en algunos indicadores del crecimiento de plantas de frijol (Phaseolus vulgaris L.) Cuba Cueto-25-9-N biofertilizadas con Azofert®-F, evaluadas en R5 (prefloración) y cultivadas en condiciones semicontroladas. Mayabeque, Cuba, 2019.
El bioestimulante Pectimorf® en sus dos formas de aplicación y a las concentraciones evaluadas, aumentó el crecimiento de las plantas con respecto a las que solo se biofertilizaron. Los mejores resultados se obtuvieron con el tratamiento a las semillas y la aspersión foliar a la concentración de 100 mg L-1, con incrementos superiores al 15 % (Figura 7).
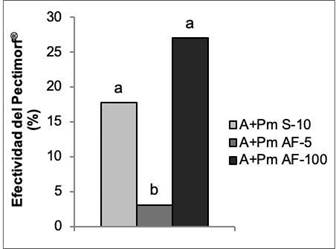
Figura 7 Efectividad del bioestimulante Pectimorf® (mezcla de oligogalacturónidos) en el crecimiento con respecto a la inoculación de plantas de frijol (Phaseolus vulgaris L.) Cuba Cueto-25-9-N con Azofert®-F, evaluadas en R5 (prefloración) y cultivadas en condiciones semicontroladas. Mayabeque, Cuba, 2019. Medias con letras iguales no difieren significativamente según Tukey (p<0,05), n=10. ES x: error estándar de la media, ES x=0,02.
Discusión
En el presente trabajo, las variables de nodulación, en general, mostraron un efecto positivo del producto, tanto en condiciones controladas como semicontroladas (Figuras 1 y 4), lo que garantizó mayor cantidad de sitios de infección y de bacteroides establecidos en los nódulos. En evaluaciones realizadas a los 18 días después de la siembra (etapa de crecimiento V3), la aplicación de Pectimorf® mostró efectos similares en el número de nódulos formados por planta, sin embargo, no incrementó la masa seca de estas estructuras (Lara et al., 2021).
El efecto de la mezcla de oligogalacturónidos sobre las variables de nodulación evaluadas, podría estar relacionado con su capacidad para actuar como sustituto de hormonas tradicionales, como la auxina (Izquierdo et al., 2016; Santos et al., 2017). Se plantea que las auxinas tienen una función importante en la formación de los nódulos (Bensmihen, 2015; Kohlen et al., 2018; Li et al., 2014), sobre todo el ácido indolacético (AIA) (Barraza et al., 2018). Tanto la acumulación local de auxina, como su transporte desde la parte aérea hasta la raíz, resulta esencial para inducir la nodulación, el crecimiento y el desarrollo temprano de los nódulos (Kohlen et al., 2018). En plantas de frijol común inoculadas con rizobios se observó un incremento en la concentración de AIA en la raíz durante la asociación simbiótica. Sin embargo, cuando las plantas se trataron con inhibidores de transportadores de auxina, como el ácido 1-naftilftalámico y el ácido tri-indobenzoico, se redujo de manera considerable el número de nódulos (Barraza et al., 2018), por lo que se considera que esta hormona es necesaria para el desarrollo normal de nódulos determinados.
El bioestimulante Pectimorf® también incrementó la actividad de la enzima nitrogenasa (Figura 2), con valores superiores al 100 % con respecto a la actividad en los nódulos de las plantas que no se trataron con este bioestimulante. En etapas tempranas del crecimiento de las plantas de frijol Cuba Cueto-25-9-N (V3), también se obtuvo un aumento en la actividad de esta enzima con el tratamiento a las semillas y la aspersión foliar a la concentración de 100 mg L-1 (Lara et al., 2021). A este resultado no solo pudo haber contribuido el incremento en la masa de los nódulos, sino también el efecto que tiene esta mezcla de OGs en la actividad fotosintética. La principal fuente de carbohidratos que sostiene el crecimiento, desarrollo y funcionamiento de los nódulos es la fotosíntesis (Motaroki Menge et al., 2018) y los oligogalacturónidos (OGs) estimulan su actividad (Izquierdo et al., 2016), lo que permite un mayor aporte de compuestos carbonados a los nódulos e incrementos en el suministro de nutrientes y energía a los bacteroides, lo que favorece la actividad de la enzima nitrogenasa.
El nitrógeno fijado en los nódulos mediante la actividad nitrogenasa se convierte en ureidos y luego se transporta hacia las hojas a través del xilema (Cerqueira Rodrigues et al., 2013; Hungria & Kaschuk, 2014). Las plantas que nodulan acumulan más ureidos que cualquier otro compuesto nitrogenado en los exudados del xilema (Hungria & Kaschuk, 2014). Es por ello, que la abundancia de ureidos en la savia del xilema se utiliza como medida indirecta de la proporción de nitrógeno en la planta, derivado de la fijación biológica del nitrógeno (Polania et al., 2016).
Los tratamientos con Pectimorf® que incrementaron la actividad de la enzima nitrogenasa (10 y 100 mg L-1) (Figura 2), también favorecieron la síntesis de ureidos en los nódulos (Figura 5). El incremento en la concentración de ureidos transportado en la savia xilemática garantiza una mayor disponibilidad de nitrógeno en las hojas (Pádua Oliveira et al., 2017). Sin embargo, las plantas con mayor contenido de nitrógeno en este órgano no presentaron incrementos significativos (p<0,05) en la concentración de ureidos en los exudados xilemáticos (Cuadro 2, Figura 5), aunque mostraron aumentos significativos en la nodulación y en la masa radical (Figuras 4 y 6). Estos resultados sugieren que el incremento de este macronutriente, como consecuencia de la aplicación de Pectimorf®, podría favorecer no solo la fijación biológica del nitrógeno, sino también el metabolismo de este elemento por reducción de nitratos provenientes del suelo, como ocurrió cuando se aplicó por aspersión foliar a la concentración de 100 mg L-1.
No hubo relación entre el contenido de ureidos en los exudados xilemáticos y el contenido de nitrógeno en las hojas trifoliadas cuando se aplicaron ambos bioestimulantes a las semillas (Figura 5, Cuadro 2). Estos compuestos nitrogenados, productos de la fijación biológica, podrían haberse almacenado en el tallo, para luego en etapas posteriores de crecimiento del cultivo movilizarse hacia la parte aérea (Yong et al., 2018).
El tratamiento asperjado con 100 mg L-1 de Pectimorf®, mostró mayor contenido de nitrógeno en las hojas, pero un menor contenido de fósforo, con respecto al resto de los tratamientos en que se aplicó el bioestimulante (Cuadro 2). Este resultado quizás sea consecuencia de un gasto energético superior, debido al incremento en la fijación y/o al metabolismo del nitrógeno. Se conoce que el fósforo se requiere en grandes concentraciones para la síntesis de trifosfato de adenosina (ATP), molécula que tiene una función importante en la fijación biológica y en el metabolismo del nitrógeno, ya que interviene en el funcionamiento de las enzimas nitrogenasa y glutamina sintetasa, en la biosíntesis de membrana y en la transmisión de señales (Divito & Sadras, 2014; Samavat et al., 2012). El fósforo es fundamental también en procesos como la fotosíntesis, la respiración y el transporte de carbohidratos (Ghanbari et al., 2013).
En las variables de crecimiento evaluadas, tanto en condiciones controladas como semicontroladas, la aplicación de Pectimorf® estimuló el desarrollo del sistema radical. Este efecto coincide con resultados previos (Lara-Acosta et al., 2019; Lara et al., 2021; Pérez et al., 2013; Santos et al., 2017), que confirman el poder enraizador de esta mezcla de OGs.
El incremento en el crecimiento radical le posibilita a la planta una mayor capacidad exploratoria en el suelo, lo que le garantiza una mayor absorción de agua y minerales; esto favorece la nutrición de las plantas y puede beneficiar su crecimiento y desarrollo (Dell'Amico et al., 2017). Sin embargo, este bioestimulante solo favoreció el desarrollo aéreo de las plantas en condiciones semicontroladas, es probable que este resultado se deba a un mayor aporte de nitrógeno por la fijación biológica, comparado con el experimento en condiciones controladas. Además de la fijación biológica, las plantas también contaban con nitrógeno procedente del suelo, que a pesar de que se encontraba en bajos niveles, pudo favorecer el crecimiento de las plantas. En el experimento realizado en condiciones controladas en etapas tempranas del crecimiento (V3), el bioestimulante tampoco favoreció el desarrollo foliar de las plantas (Lara et al., 2021).
El efecto positivo del Pectimorf® en los indicadores evaluados en condiciones semicontroladas, conllevó a incrementar el crecimiento de las plantas por encima del 15 % con respecto a las inoculadas con Azofert®-F. También se han obtenido resultados similares en plantas de frijol cultivadas en condiciones controladas, que han tenido como única fuente de nitrógeno la fijación biológica (Lara et al., 2021). Con base en estos resultados, el bioestimulante Pectimorf® podría contribuir a incrementar la disponibilidad de nitrógeno en plantas biofertilizadas, cultivadas en suelos con bajos niveles de este mineral, tanto en la etapa vegetativa como a inicios de la etapa reproductiva.
Las diferencias en las concentraciones en las distintas formas de aplicación evaluadas, sugieren diferentes mecanismos de acción del Pectimorf® en el crecimiento de este cultivo. Es por ello, que se hace necesario evaluar parámetros bioquímicos y moleculares que permitan definir que vías o rutas metabólicas se estimulan con cada uno de estas concentraciones y formas de aplicación.
Conclusiones
De las concentraciones y formas de aplicación de Pectimorf® que se estudiaron, los mejores efectos en la fijación biológica del nitrógeno y en el crecimiento, se obtuvieron con la aplicación a las semillas de 10 mg L-1, junto con Azofert®-F y con la aspersión foliar de 100 mg L-1 en la etapa de crecimiento V3 en plantas biofertilizadas. El mayor efecto en el crecimiento de las plantas se obtuvo en el desarrollo del sistema radical.
La aplicación del bioestimulante Pectimorf®, en plantas biofertilizadas con Azofert®-F, incrementó la fijación biológica del nitrógeno en la fase vegetativa y en la etapa de prefloración de plantas de frijol común, lo cual podría garantizar un adecuado desarrollo e incrementos en el rendimiento de esta leguminosa. Por lo que sería necesario, además, realizar experimentos en campo para evaluar el efecto de este bioestimulante en la productividad del cultivo.