INTRODUCCIÓN
Pocos ambientes permanecen siempre dentro de los ámbitos de temperatura óptimos para las funciones vitales (aproximadamente 5-25 ºC), y en respuesta a estas limitaciones ambientales las plantas despliegan una amplia plasticidad estructural y fisiológica que les permite adaptarse a diferentes temperaturas provocadas por la geografía, y por los ritmos diurnos y estacionales ( Larcher, 1980 ; Kappen, 1981 ). La mayoría de las especies vegetales son sensibles al estrés por temperatura y sufren cuando estas son bajas o muy altas con respecto a los umbrales definidos para cada una. Por ejemplo, las plantas tropicales sufren daños al ser expuestas a temperaturas menores a 10 ºC (“chilling injury”) y la mayoría de las especies empiezan a tener problemas entre los 30 y 40 °C. Pequeños incrementos de la temperatura (de 30 a 35 ºC) pueden dañar los órganos reproductivos de muchos cultivos, entre ellos trigo ( Triticum aestivum (L). Thell), maíz ( Zea mays L.), arroz ( Oryza sativa L.), maní ( Arachis hypogaea L.) y tomate ( Solanum lycopersicum L.). A pesar de esto, los mecanismos moleculares de la percepción de la temperatura por parte de las plantas, la naturaleza y acción de los posibles termo-sensores permanecen casi en el misterio ( Samach y Wigge, 2005 ).
Aunque se pueden alcanzar temperaturas de más de 55 ºC en los trópicos de África, México y California, entre 60 y 70 ºC parece ser el límite para la supervivencia de las plantas ( Larcher, 1980 ; Levitt 1980 ; Berry y Raison, 1981 ). En un gran número de cultivos, el ámbito de temperatura bajo el cual el desarrollo es al menos 50% del obtenido a temperaturas óptimas es muy estrecho, y varía de 10-15 a 40-45 ºC ( Parent y Tardieu, 2012 ). Esto indica que la tolerancia al calor no ha sido modificada por la domesticación y el mejoramiento genético, ocurridos a lo largo de unos 12 000 años de evolución de los cultivos en varios continentes.
El promedio mundial de la temperatura ambiental se ha incrementado gradualmente en los últimos 150 años, como consecuencia de la actividad humana y la emisión de gases con efecto invernadero como CO2, metano, clorofluorocarbonos y óxido nitroso ( Jones y Moberg, 2003 ; Wahid et al., 2007 ). La tasa de calentamiento global de 1901 al año 2000 se ha estimado en 0,07 °C cada década ( Jones y Moberg, 2003 ), y en los últimos cien años, a nivel mundial, se produjo un incremento de las temperaturas mínimas y máximas de 1,86 y 0,88 °C, respectivamente ( Easterling et al., 1997 ). Se estima que para el año 2025 la temperatura promedio global se incrementará 1 °C, y en 3 °C para el 2100 ( Wahid et al., 2007 ). Se proyecta que los efectos del cambio climático incluirán modificaciones de los ámbitos ecológicos y geográficos donde se distribuyen las plantas, la zonificación agrícola y las épocas de siembra; irregularidades que representan amenazas potenciales para la producción agrícola y que cambiarán las prioridades actuales del mejoramiento genético ( Porter, 2005 ; Long y Ort, 2010 ), en especial en las regiones tropicales cálidas, donde la temperatura es un factor determinante en el rendimiento de los cultivos ( Corley, 1983 ; Challinor et al., 2007 ). Por estas razones, la respuesta de las plantas al incremento en la temperatura ambiental y al calentamiento global ha alcanzado las agendas sociales y políticas del mundo, porque el suministro sostenible de alimentos es crucial para la seguridad alimentaria de las sociedades.
El sobrecalentamiento es solo uno de los múltiples estreses que interaccionan cotidianamente en los agroecosistemas tropicales, y es a menudo acompañado por alta radiación, poca disponibilidad de agua e incrementos en la concentración de CO2 atmosférico. En la parte I de esta revisión se examina el papel central que juega la temperatura, como componente del ambiente físico y del clima, sobre el crecimiento y el rendimiento de los cultivos; razón por la cual el interés de la comunidad científica y de los sectores agro-productivos en las respuestas de las plantas a la temperatura se ha renovado en las últimas décadas ( Wheeler et al., 2000 ). El objetivo de esta revisión fue integrar los mecanismos por los cuales las plantas responden al estrés por calor a lo largo del continuo suelo-planta-atmósfera, desde una perspectiva agronómica.
Estudio, detección y diagnóstico del estrés por altas temperaturas
El estrés por calor puede ser definido como la elevación de la temperatura por un período lo suficientemente prolongado como para causar daños irreversibles en el metabolismo y el desarrollo de las plantas; es un fenómeno complejo que involucra la duración del estrés, la tasa de su incremento y las temperaturas máximas alcanzadas ( Porch y Hall, 2013 ). Las respuestas varían si se trata de un estrés transitorio o permanente, por altas temperaturas nocturnas, diurnas, el promedio diario, o si existe una interacción entre las temperaturas diurnas y nocturnas. En general, se reconocen cuatro tipos de estrés térmico en las plantas: el provocado por temperaturas altas sostenidas; los episodios frecuentes de temperaturas altas (“heat shock”); el daño por enfriamiento (de 0 a 10 °C) o “chilling injury” en numerosos frutos, follajes y flores tropicales; y los daños por congelamiento a temperaturas inferiores a los 0 ºC, que causan la formación de hielo en los tejidos de las plantas ( Larcher, 1980 ).
La exposición de las plantas a temperaturas muy altas (>50 °C) resulta en un severo daño a nivel celular en cuestión de minutos y en el colapso rápido de la organización celular. Sin embargo, cuando se presentan temperaturas moderadamente altas, los daños se dan después de exposiciones más prolongadas ( Wahid et al., 2007 ). Las altas temperaturas desencadenan una cascada de señales que activan la expresión de genes y la síntesis de “proteínas del estrés”, algunas específicas del estrés por calor (“heat-shock proteins”, HSPs), que estabilizan la estructura de proteínas y enzimas ( Iba, 2002 ), y están involucradas en la protección del aparato fotosintético y la estabilidad de las membranas ( Georgieva, 1999 ; Wang et al., 2004 ; Wahid et al., 2007 ). Además, las plantas producen una serie de enzimas antioxidantes y desintoxicantes para atenuar el daño causado por las especies de oxígeno reactivas (ROS), cuya producción es inducida por el estrés por calor ( Almeselmani et al., 2006 ). Otras toxinas producidas durante el estrés térmico son los productos de la fotorespiración (glicolato) y los subproductos de las alteraciones metabólicas necesarias para el reciclaje de las proteínas y la acumulación de osmolitos, iones y sustancias de defensa.
La tolerancia al calor es la capacidad de las plantas para crecer y rendir económicamente, bajo condiciones de alta temperatura ( Wahid et al., 2007 ). El régimen de temperatura influye en el desarrollo vegetal, más a menudo acelerándolo; sin embargo, la sensibilidad de los procesos fisiológicos al estrés térmico cambia durante el desarrollo y con los ciclos fenológicos, y difiere entre las especies y los cultivares. Esta dependencia del crecimiento vegetal de la temperatura es el fundamento de las predicciones realizadas con modelos como el de grados día o de prácticas agronómicas como el forzamiento de la floración en algunos ornamentales. Entre más corto es el ciclo de vida de una planta, más pronunciada parece ser la aceleración fenológica impulsada por las altas temperaturas.
A escala agronómica, los experimentos de genotipo x ambiente y el análisis cuantitativo del crecimiento de los cultivos constituyen herramientas para el estudio de los efectos y de la tolerancia de las plantas a altas temperaturas. La gran variedad de especies, escenarios y la diversidad de las respuestas observadas a este tipo de estrés, indican la necesidad de uniformar y tecnificar los protocolos de investigación.
La determinación de la susceptibilidad o resistencia de las hojas al calor ha sido hecha con modificaciones del método clásico de “inducción de la necrosis”. En este método, diferentes muestras de hojas son expuestas a una serie de temperaturas por 30 min., luego de los cuales se observan por periodos que pueden extenderse desde minutos y horas, hasta unas 2-4 semanas, en busca de daños necróticos ( Bilger et al., 1984 ). El estudio del fenómeno de la “quema por sol” de los frutos (“sun-burn”, “fruit scorching”), causado en realidad por las altas temperaturas alcanzadas en la superficie del fruto, demuestra la importancia de estudiar los daños por calor en órganos que permanecen unidos a las plantas después de los eventos climáticos o de la aplicación de tratamientos para su inducción y prevención.
Las diferentes modalidades de la imagenología son recursos modernos para estudiar, prevenir y remediar el estrés térmico en el campo. Incluyen la espectrometría infrarroja, los índices espectrales de la vegetación como el diferencial normalizado (“normalized difference vegetation index”, NDVI), los sensores multi-angulares en 3D y Lidar, y la fluorescencia para el diagnóstico del estrés de varios tipos. Estas aplicaciones son posibles porque las propiedades de absorción, transmisión y reflexión de la luz (propiedades radiativas) de las superficies vegetales determinan su capacidad para absorber, reflejar y transmitir la radiación ( Jones y Vaughan, 2010 ). Las hojas verdes con concentraciones apropiadas de nitrógeno (~1-2%) y clorofila, absorben la luz fotosintéticamente activa (RFA, roja y azul) y reflejan la luz verde e infrarroja en un patrón característico, que es alterado por las deficiencias nutricionales, la sequía, y las temperaturas extremas, y puede ser monitoreado y registrado a través de varios instrumentos, y aplicado a través de diferentes modelos de estrés y productividad.
La temperatura de las plantas y los cultivos (doseles) puede ser medida con derivaciones de la ley de Stefan-Boltzmann, porque la radiación infrarroja reflejada por las plantas calientes es mayor que la emitida por las más frescas. La temperatura de las plantas está determinada en gran medida por la transpiración y la disipación del calor por evaporación (calor latente). Por lo tanto, las plantas bien irrigadas tienen menores temperaturas que las plantas que sufren estrés hídrico. Una posible aplicación de estos procesos es el manejo de los terrenos con sistemas de posicionamiento geográfico (GPS), para la distribución de los insumos agrícolas, según los requerimientos de los cultivos, en diferentes zonas y etapas fenológicas. La termometría infrarroja y los índices de estrés ( Rosenberg et al., 1983 ), permiten administrar eficientemente el agua de riego y la sombra. Esta instrumentación se puede integrar a la maquinaria agrícola moderna y puede dirigir la dosificación eficiente del agua, los fertilizantes y otros agroquímicos, con efectos positivos en el ambiente y en las finanzas de los sistemas productivos.
Las técnicas moleculares son herramientas de aplicación transversal y en esta revisión se ofrecen abundantes ejemplos de sus resultados y aplicaciones al estudio del estrés térmico en los cultivos.
Temperaturas óptimas y umbrales de estrés por calor en los cultivos tropicales
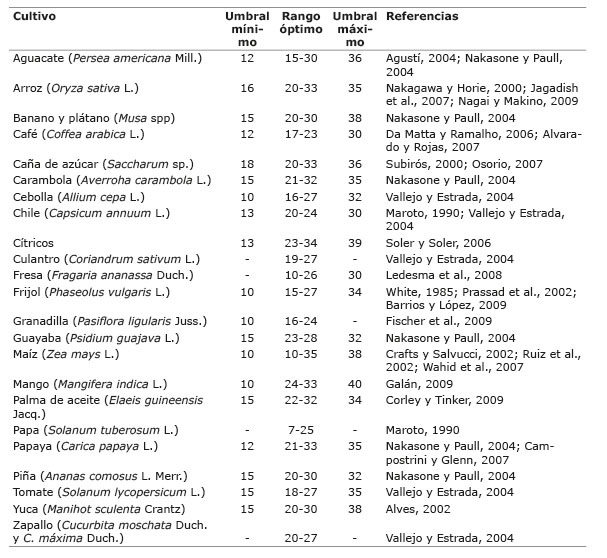
Cada especie cultivada tiene una temperatura mínima, máxima y óptima para su desarrollo normal y sobrevivencia. Cuando la temperatura excede o baja de esos límites, el crecimiento y el rendimiento de los cultivos se ven afectados ( Ulukan, 2008 ). Existe un umbral inferior o temperatura base y uno superior, pero varían entre y dentro de las especies de plantas y con el hábitat donde se desarrollan ( Cuadro 1 ). El umbral de estrés por alta temperatura es aquella a la cual se inicia la afección severa de algún proceso vital o una reducción detectable en el crecimiento y desarrollo de las plantas. A pesar de que los cultivos tropicales tienen una temperatura base más elevada que los cultivos de zonas templadas, el estrés por calor ya es considerado una de las mayores limitantes para la producción agrícola ( Corley, 1983 ; Wahid, et al., 2007 ).
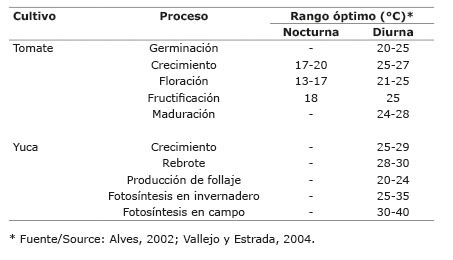
Cuadro 1 Ámbito de temperatura óptima (°C), umbrales mínimo y máximo de estrés por temperatura para algunos cultivos tropicales de importancia. 2015. Table 1. Optimum temperature for growth, and minimum and maximum temperatures (°C) for thermal stress of some major tropical crops. 2015.
Los umbrales y las temperaturas óptimas pueden variar con los cultivares y el lugar donde estos fueron desarrollados. Por ejemplo, existen cultivares de maíz adaptados a zonas bajas, con un rango de temperatura de 20 a 38 °C, mientras que los de zonas altas poseen un rango de 7 a 27 °C ( Laffite, 2001 ; Ruiz et al., 2002 ). Los efectos de la temperatura varían también con el desarrollo del cultivo y la fenología ( Wahid et al., 2007 ). Por ejemplo, en tomate y yuca se pueden observar grandes diferencias en los rangos de temperatura adecuados para sus diferentes fases del desarrollo ( Cuadro 2 ).
Respuestas de las plantas al estrés por altas temperaturas
Cambios ultraestructurales y fuga de electrolitos
El estrés térmico interfiere con el balance de energía de las células y de las plantas, e inhibe la adquisición y acelera el consumo de energía. El estrés abiótico, en general, estimula la glicólisis. La pared celular y los sistemas de membranas plasmáticas (cloroplastos, mitocondrias, aparato de Golgi, tonoplasto y retículo endoplasmático) son las primeras traductoras del estrés en las plantas. El estrés puede causar la síntesis y acumulación de metabolitos como el etileno, el ácido abscísico (ABA), los ácidos salicílico y jasmónico, solutos compatibles como la prolina, metabolitos secundarios (alcaloides, terpenoides, fenoles, fitoalexinas, compuestos cianogénicos) y proteínas del estrés (“stress-related proteins”) de varios tipos, como las deshidrinas y las HSPs.
Las altas temperaturas generan cambios anatómicos, morfológicos y funcionales en las plantas, algunos similares a los producidos por el estrés hídrico: reducción del tamaño de las células, reducida conductancia estomática y cierre de estomas, cambios en la permeabilidad de las membranas, incrementos de la densidad de estomas y tricomas, y vasos del xilema de mayor tamaño. Los efectos acumulativos de estos cambios usualmente resultan en un pobre crecimiento y reducida productividad de las plantas ( Wahid et al., 2007 ).
Las membranas celulares son las primeras afectadas por el estrés debido al calor ( Wang et al., 2011 ), porque el incremento de la temperatura conduce a la desnaturalización de proteínas y enzimas, y a aumentos en la cantidad de ácidos grasos insaturados ( Savchenko et al., 2002 ). Lo anterior ocasiona que los lípidos de las membranas se vuelvan más fluidos y permeables, y permite la pérdida de electrolitos ( Los y Murata, 2004 ; Porch y Hall, 2013 ). La localización del fotosistema II en las membranas de los tilacoides lo hace muy sensible a las altas temperaturas ( Zinn et al., 2010 ; Porch y Hall, 2013 ), por lo que la emisión de fluorescencia ha sido utilizada como indicador del estrés térmico (y de otros tipos) en las plantas. Mantener las funciones de las membranas celulares es clave para el metabolismo básico (la fotosíntesis) e intermedio (la respiración) bajo condiciones de estrés ( Blum, 1988 ), y para la tolerancia al calor.
Las perturbaciones debidas al estrés por calor son notables en la membrana plasmática, las mitocondrias, el retículo endoplasmático (RE), los ribosomas y los cloroplastos ( Pareek et al., 1997 ; Xu et al., 2006 ), ya que rápidamente (4 h) se observa lisis y acumulación de gránulos densos en el citoplasma (cerca de las discontinuidades de las membranas), distensión de las membranas del RE, aumento en la asociación de los ribosomas con el RE, reducción en el número de crestas mitocondriales y desorganización de la red fibrilar de las paredes celulares. En estudios detallados de los simbiontes dinoflagelados de los corales, la descomposición de la estructura de los tilacoides en las primeras 48 h a 32 °C, precedió la aparición de las ROS y la ocurrencia de daño oxidativo severo. Después de 72 h de exposición al calor, se observaron los procesos homeostáticos de síntesis de HSPs y de enzimas anti-oxidantes ( Downs et al., 2013 ).
La pérdida de electrolitos varía con la edad de los tejidos, el órgano, el estado de desarrollo y la especie. El incremento en la pérdida de solutos puede ser utilizado como un indicador de la estabilidad de las membranas y como una medida indirecta de la tolerancia al calor. Sin embargo, la relación entre la estabilidad de las membranas y el rendimiento bajo altas temperaturas varía entre las especies, por lo que se recomienda realizar estudios específicos para cada cultivo antes de utilizar esta sola variable fisiológica como un criterio de selección ( Wahid et al., 2007 ). La pérdida de los electrolitos como indicador de la termoestabilidad de las membranas, ha sido utilizada en Arabidopsis ( Wang et al., 2011 ) y en diversos cultivos como papa y tomate ( Chen et al., 1982 ), crisantemo ( Yeh y Lin, 2003 ), algodón ( Rahman et al., 2004 ; Karademir et al., 2012 ) y maíz ( Castro et al., 2012 ).
Metabolismo celular
Las plantas poseen un número limitado de sistemas bioquímicos capaces de responder a una multitud de estreses, que en el campo a menudo ocurren en combinaciones ( Figura 1 ). Los síntomas del daño por calor son expresiones del metabolismo celular aberrante, producto de lesiones bioquímicas, y se inician como anormalidades anatómicas en las células y tejidos, que se extienden a los órganos y a las plantas completas. Los síntomas pueden manifestarse inicialmente como reducciones del potencial redox de la savia, la activación de enzimas como la fenilalanina-amonio-liasa (PAL), desviaciones en el contenido de carbohidratos, alteraciones en los niveles de los reguladores del crecimiento, acumulación de sustancias tóxicas, cambios de color y el desarrollo de malformaciones. Se inhibe el progreso del ciclo celular y la duración de la fase S se prolonga, retrasando la entrada en la mitosis. Lo anterior ocasiona que el crecimiento se reduzca.
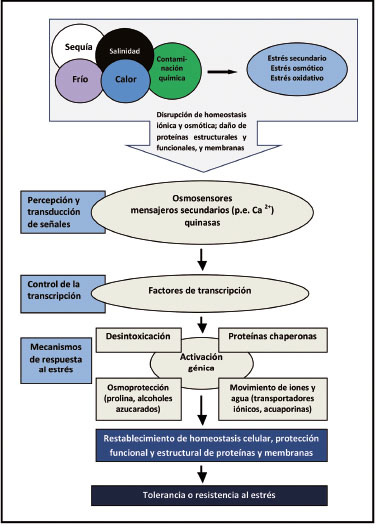
Figura 1 El estrés térmico, hídrico, salino-osmótico y la contaminación química, inducen la remodelación del transcriptoma y del sistema bioquímico general, y causan respuestas en las plantas que restablecen la homeostasis celular y les confieren tolerancia y resistencia al estrés (traducida de Sadras y Richards, 2014 ). Figure 1. Temperature, water, saline-osmotic, and environmental pollutant stress induce transcriptome and general biochemical system remodeling, causing plant responses to reestablish cellular homeostasis and conferring tolerance and resistance to stress (translated from Sadras and Richards, 2014 ).
La tolerancia y la recuperación ante el estrés por el calor son resultado de una re-programación del transcriptoma, mediada por los niveles de [ATP]/[AMP] celular en las plantas y regulada por sensores de energía. Estos sensores están representados bioquímicamente por las quinasas, enzimas dependientes o sensibles al calcio y al ATP, cuya actividad es estimulada por estreses como la oscuridad y el calor, e inactivadas por la abundancia de azúcares. Bajo condiciones de estrés por calor se estimula el catabolismo y se inhibe el anabolismo; estos cambios promueven la supervivencia y restauran la homeostasis celular ( Atkin y Tjoelker, 2003 ; Sung et al., 2003 ; Baena-González et al., 2007 ).
Uno de los principales traductores de la temperatura ambiental (T) en respuestas fisiológicas es la respiración celular (R). La respiración de las plantas libera ~60 giga toneladas de C por año (Gt C/año) a la atmósfera, mientras que juntas la combustión de hidrocarburos, la fabricación de cemento y los cambios en el uso de la tierra a nivel mundial, liberan solo 7,1 Gt C/año. R presenta una dependencia cuantitativa de T. La máxima actividad enzimática limita R a baja T; mientras que la disponibilidad de sustratos limita R a alta T ( Figura 2 ). La Q10 de la respiración es ~2, pero a mayor T durante el crecimiento de las plantas se reduce progresivamente el valor de Q10. Estos ajustes son el fundamento de la aclimatación, de las posibilidades del “priming” o endurecimiento, y de la termotolerancia inducida heredable ( Berry y Raison, 1981 ).
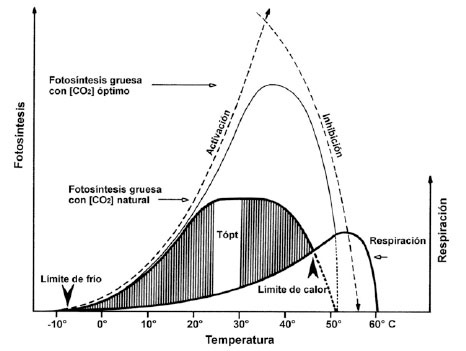
Figura 2 Cambios en las tasas de fotosíntesis y de respiración, y el balance de carbono de las plantas cuando estas son cultivadas bajo [CO2] natural y óptimas más elevadas (traducida de Larcher, 1980). Figure 2. Changes in photosynthetic and respiration rates, and carbon balance of plants grown under low, natural and optimal, elevated [CO2] (translated from Larcher, 1980).
La aclimatación de R a T consiste en la reducción de la sensibilidad de R a cambios en T, y en una reducción de la Q10 proporcional a la temperatura de las plantas durante su desarrollo. La aclimatación de R a un cambio en T puede ocurrir dentro de los primeros dos días de estrés, y se ajusta dinámicamente a la naturaleza temporal de ese estrés. Esto determina la aclimatación máxima de R ante eventos futuros. Los ajustes en R compensan los cambios en T y resultan finalmente en una reducción a largo plazo de la sensibilidad de R a T ( Atkin y Tjoelker, 2003 ; Sung et al., 2003 ). La aclimatación al calor puede ser de tipo I, que ocurre muy rápido, es de efectos más limitados y está basada en ajustes de la Q10; o de tipo II, que depende de cambios en la capacidad enzimática de la respiración y se expresa más en las hojas y raíces producidas bajo el nuevo régimen de temperatura ( Atkin y Tjoelker, 2003 ).
La principal consecuencia de la exposición de las plantas a las altas temperaturas es el descenso del balance de carbono, como resultado de la inactivación de la Rubisco 2 , la reducción de la fotosíntesis y del desbalance entre la fotosíntesis y la respiración. Este último ocurre a temperaturas cercanas a 50 °C, punto en el que la respiración oscura y la foto-respiración aumentan conforme la fotosíntesis cae considerablemente ( Figura 2 ). Esta situación se ve atenuada en ambientes ricos en CO2 ( Wahid et al., 2007 ).
Producción de antioxidantes
Además de acelerar el metabolismo celular y causar la deshidratación de los tejidos, el estrés por calor genera un estrés oxidativo porque induce la producción de especies reactivas de oxígeno (ROS). Estas incluyen el oxígeno simple (1O2 “singlet”), radicales de superóxido (O2-), peróxido de hidrógeno (H2O2) y radicales hidroxilos (OH-), que provocan la peroxidación autocatalítica de los lípidos y los pigmentos de las membranas celulares, la pérdida de la semi-permeabilidad de estas y la modificación o pérdida de sus funciones fundamentales de transporte y osmoregulación (Almeselmani et al., 2006; Wahid et al., 2007), que culmina con la fuga de electrolitos y agrava los problemas osmóticos y los desbalances hídricos.
La protección contra el estrés oxidativo es un componente importante en el repertorio de las plantas para tolerar el estrés por altas temperaturas ( Wahid et al., 2007 ). Las plantas responden con la producción de enzimas antioxidantes como la superóxido dismutasa (SOD), la ascorbato peroxidasa (APX), la glutationa reductasa (GR), la guayacol peroxidasa específica (POX) y las catalasas (CAT) ( Mittler, 2002 ; Almeselmani et al., 2006 ; Nagesh y Devaraj, 2008 ). Por ejemplo, en vainica ( Phaseolus vulgaris ) el estrés causado por las ROS (en especial H2O2), daña las membranas y se da una reducción de más del 50% de las CAT, daño moderado en el ADN genómico, y, finalmente la muerte celular, atribuida más a la peroxidación de los lípidos de las membranas que a la oxidación proteica o la inhibición enzimática. Sin embargo, en cultivares tolerantes se activan los mecanismos antioxidantes y se duplica el nivel de POX en la planta ( Nagesh y Devaraj, 2008 ).
El estrés por alta temperatura y las condiciones de estrés abiótico, también inducen la producción de metabolitos secundarios en las plantas, entre los que se destacan los fenoles (flavonoides, antocianinas, ligninas, etc.) y los carotenoides. La modulación de los niveles de carotenoides, antocianinas y fenoles solubles es de importancia en la prevención del estrés oxidativo ( Wahid, 2007 ).
Los carotenoides son reconocidos por proteger las estructuras celulares ante varios tipos de estrés. En caña de azúcar, por ejemplo, los niveles de carotenoides y antocianinas se incrementaron significativamente en brotes que fueron sometidos a estrés por calor en un periodo de 24-48 h y permaneció estable durante el evento de estrés ( Wahid, 2007 ). En tomate, la temperatura ideal para la formación del licopeno es de 24 °C, pero cuando las temperaturas suben por encima de 30 °C se inhibe su síntesis y se favorece la de los carotenos (pigmentos amarillos), lo que da lugar a frutos amarillo-anaranjados de menor valor comercial ( Vallejo y Estrada, 2004 ).
En fresa, cuando las plantas se sometieron a temperaturas relativamente altas (22-30 °C), aumentaron la concentración de antioxidantes en los frutos con respecto a las plantas que crecieron en temperaturas menores (12-18 °C). La elevación de las temperaturas durante el ciclo de desarrollo del cultivo también causó incrementos del contenido de ácidos fenólicos, flavonoides y antocianinas ( Wang y Zheng, 2001 ).
Respuestas moleculares, HSPs y otras proteínas del estrés
Otra de las respuestas de las plantas al estrés por calor es la síntesis y acumulación de proteínas de choque térmico (HSPs). Las HSPs juegan un papel preventivo al proteger a las proteínas y enzimas de la desnaturalización ( Iba, 2002 ; Zinn et al., 2010 ). Su producción se da cuando las plantas son expuestas a incrementos abruptos o graduales de la temperatura. Las HSPs actúan como “chaperonas moleculares” que protegen y reparan la estructura espacial de las proteínas ( Wahid et al., 2007 ), y así permiten el funcionamiento de las células durante los episodios de estrés por temperaturas elevadas ( Taiz y Zeiger, 2006 ).
La inducción y biosíntesis de las HSPs es rápida e intensa, y su producción puede ser inducida en distintos tipos de células. Estas se asocian con estructuras como la pared celular, los cloroplastos, los ribosomas y las mitocondrias ( Wahid et al., 2007 ); se encargan de estabilizar y prevenir la agregación de las proteínas y mantenerlas en su estado funcional, de manera que pueden replegarse y reconformarse nuevamente. Cuando las proteínas son desnaturalizadas por el estrés por calor, algunas HSPs solubilizan los agregados y los reciclan de forma tal que las proteínas puedan ser llevadas nuevamente a una forma funcional. Otras HSPs se encargan de remover los polipéptidos no funcionales y potencialmente tóxicos, una función importante para mantener la homeostasis celular ( Wang et al., 2004 ).
Las HSPs son clasificadas en cinco grupos según su peso molecular: smHSP (15-30 kDa), HSP60 (57-60 kDa), HSP70 (69-71 kDa), HSP90 (80-94 kDa) y HSP100 (100-114 kDa) ( Iba, 2002 ; Wang et al., 2004 ). Resaltan las smHSP, las más abundantes y diversas entre las plantas. Bajo condiciones de estrés por altas temperaturas, las smHSP pueden incrementarse hasta 200 veces, mientras que las demás lo hacen solo unas diez veces ( Wahid et al., 2007 ). Las HSPs también pueden ser inducidas por el estrés osmótico o salino, la hipoxia y por compuestos con arsénico y otros agentes químicos; las hormonas como el ácido abscísico y el etileno también estimulan su producción ( Iba, 2002 ).
La producción de las HSPs es iniciada con la mediación del factor de transcripción HSF, un trímero fosforilado enlazado a un elemento de choque térmico (HSE), que promueve la transcripción del ARNm de las HSPs y su síntesis. En ausencia de estrés térmico, el HSF se encuentra en forma de monómeros incapaces de unirse al ADN para direccionar su transcripción y producir HSPs ( Iba, 2002 ; Wang et al., 2004 ; Taiz y Zeiger, 2006 ). Existen variaciones en los patrones de producción de las HSPs entre las especies y entre genotipos de plantas; por ejemplo, cuando plántulas de maíz, trigo y centeno fueron expuestas a estrés por calor (42 °C), en maíz se produjeron cinco tipos de smHSPs mitocondriales (19, 20, 22, 23 y 28 kDa), mientras que en trigo y centeno solo un tipo (20 kDa), lo que fue asociado a la mayor tolerancia mostrada por el maíz ( Wahid et al., 2007 ). A nivel intraespecífico, el genotipo de arroz N22 mostró mayor tolerancia a altas temperaturas y acumuló mayor cantidad de smHSPs que los cultivares más sensibles ( Jagadish et al., 2010 ).
Además de las HSPs, el estrés induce la expresión de otras proteínas que contribuyen a la tolerancia al calor, como el complejo Cu/Zn-SOD, la manganeso peroxidasa (Mn-POD) y la ubiquitina ( Wahid et al., 2007 ). Iba (2002) indica que la Mn-POD cumple un papel vital en la minimización del daño oxidativo. En caña de azúcar se han identificado tres deshidrinas de bajo peso molecular, cuya expresión se incrementa con el estrés por altas temperaturas ( Wahid y Close, 2007 ). Bajo shock térmico, la ubiquitina, una proteína de vida corta ( Dreher y Callis, 2007 ), se une a miles de proteínas y así las selecciona para su degradación, con lo que controla numerosos eventos del metabolismo y el desarrollo de las plantas. Los complejos resultantes del enlace de la ubiquitina son reconocidos y metabolizados por el proteosoma 26S ( Smalle y Vierstra, 2004 ). El reciclaje selectivo de estas proteínas es parte esencial del ajuste metabólico necesario para producir un nuevo andamio celular de proteínas termoestables, pero implica un incremento en los costos asociados con la creciente respiración de mantenimiento.
Acumulación de osmolitos compatibles
La acumulación de compuestos solubles de bajo peso molecular, conocidos como osmolitos compatibles, es una de las respuestas fisiológicas y de adaptación al estrés por altas temperaturas, y a otros tipos de estrés abiótico como la sequía y la salinidad ( Schwacke et al., 1999 ; Iba, 2002 ; Nagesh y Devaraj, 2008 ). Se destacan los azúcares solubles, alcoholes azucarados (manitol, sorbitol y glicerol), la prolina, la glicina betaína y componentes azufrados ternarios ( Wahid et al., 2007 ; Nagesh y Devaraj, 2008 ). La acumulación de estos solutos confiere tolerancia al estrés por calor porque mantiene el balance hídrico en las células y la estabilidad de las membranas, y por su acción buffer del potencial redox, amortiguando la alteración de las funciones celulares causadas por el estrés ( Park et al., 2006 ; Wahid, 2007 ; Wahid y Close, 2007 ).
La glicina betaína (GB) es una amina cuaternaria anfotérica sintetizada a partir de la colina, a través de una oxidación de dos pasos, por medio de la colina mono-oxigenasa y la betaína aldehído deshidrogenasa, o a partir de la glicina, a través de tres N-metilaciones sucesivas ( Sakamoto y Murata, 2002 ; Ashraf y Foolad, 2007 ). Varios estudios in vitro han indicado que la GB protege algunas enzimas y proteínas complejas, como las del fotosistema II, contra la inactivación inducida por el calor ( Yang et al., 2005 ). Se han encontrado altos niveles de GB en maíz y caña de azúcar sujetos a déficit hídrico o a altas temperaturas ( Quan et al., 2004 ; Wahid, 2007 ; Wahid y Close, 2007 ). La capacidad de sintetizar GB difiere entre especies; algunas como arroz, mostaza, arabidopsis y tabaco, no la producen naturalmente ( Ashraf y Foolad, 2007 ; Wahid et al., 2007 ).
La prolina es un aminoácido proteico con una excepcional rigidez conformacional, esencial para el metabolismo primario ( Szabados y Savouré, 2010 ). Los contenidos de este osmolito se elevan en las plantas como respuesta al estrés ambiental como sequía, alta temperatura, alta luminosidad, alta radiación ultravioleta, alta salinidad y altos contenidos de metales pesados en el suelo ( Kavi-Kishor et al., 2005 ; Verbruggen y Hermans, 2008 ; Szabados y Savouré, 2010 ). En caña de azúcar, por ejemplo, cuando se sometieron brotes al estrés por calor se dio una acumulación lineal de azúcares solubles, prolina y GB, metabolitos que no estaban presentes en las plantas testigo. De estas, la prolina fue la que tuvo una acumulación más marcada y prolongada (durante 60 h), seguida por la GB y los azúcares solubles (durante 48 h cada uno) ( Wahid, 2007 ). En vainica, los contenidos de prolina se elevaron cinco veces en las plantas sometidas a estrés por alta temperatura con respecto al control ( Nagesh y Devaraj, 2008 ). En tomate la prolina se acumula no solo en las células expuestas a estrés hídrico, sino también en los tejidos que sufren desecación, como los granos de polen, que pierden cerca del 90% de su agua durante la maduración. Este osmolito junto con las betaínas previene la disrupción de las funciones celulares durante la desecación del polen ( Schwacke et al., 1999 ). En frijol caupí ( Vigna unguiculata L. Walp.) se hipotetiza que la reducida translocación de prolina desde las paredes de las anteras y el tejido tapetal a los granos de polen en desarrollo, es la causa de la pérdida de la viabilidad cuando hay estrés por calor, ya que se requieren grandes cantidades de prolina para el desarrollo del polen, su germinación y el crecimiento del tubo polínico ( Porch y Hall, 2013 ).
La utilización de las reservas de carbohidratos no estructurales (NSC) de las plantas ha sido asociada con frecuencia al ajuste osmótico, el alivio temporal de los efectos de las reducciones de la fotosíntesis y la deficiencia de carbono, y la recuperación post-estrés. Los NSC son almidones, azúcares variados (sacarosa) y alcoholes azucarados, como el manitol y el sorbitol, que participan en el mantenimiento de la turgencia del floema. Algunas reservas alimenticias muestran un gran dinamismo y son utilizadas en plazos diurnos y en ciclos estacionales, mientras que otras pueden ser almacenadas por décadas y su disponibilidad en tiempos de crisis puede ser limitada ( Dietze et al., 2013 ).
La percepción del estrés y la producción de señales son mecanismos cruciales para el desarrollo de tolerancia en las plantas. En el caso específico del estrés por altas temperaturas, se sugiere que los cambios en la permeabilidad de las membranas juegan un papel fundamental en la percepción de las señales y en la expresión de los genes que codifican las respuestas y confieren la tolerancia al estrés por calor. Una de las señales fundamentales es el aumento del Ca2+ citoplasmático, asociado a la adquisición de tolerancia mediante la reorganización citoesquelética y la transducción de señales como las proteínas quinasas activadas por mitógenos (MAPK) y las dependientes de calcio (CDPK) ( Larkindale y Knight, 2002 ; Wahid et al., 2007 ; Conde et al., 2011 ). Además, el influjo de Ca2+ y la acción de las CDPK están altamente correlacionados con la expresión de las HSPs ( Wahid et al., 2007 ; Conde et al., 2011 ). Estas cascadas de señales a nivel nuclear conducen a la producción de antioxidantes y osmolitos compatibles que confieren termotolerancia ( Iba, 2002 ; Conde et al., 2011 ). Otros osmolitos compatibles son el ácido g-4-aminobutírico (GABA), un aminoácido no proteico sintetizado a partir del ácido glutámico, mediante una reacción catalizada por la glutamato descarboxilasa (GAD) ( Wahid et al., 2007 ).
Cuando se presenta una condición de estrés se da un aumento en el nivel citosólico de iones calcio, que se unen a la calmodulina y la activan, y esta a su vez conduce a la activación de la GAD. Durante episodios de alta temperatura, la acumulación de GABA se incrementa entre seis y diez veces en plantas estresadas con respecto a aquellas que no lo están ( Taiz y Zeiger, 2006 ).
Fotosíntesis y procesos relacionados
La fotosíntesis figura entre los procesos fisiológicos más sensibles a las altas temperaturas, y puede ser inhibida antes de que aparezcan otros síntomas de estrés. Las altas temperaturas producen daños en los fotosistemas I y II y en el ciclo de Calvin, pero el fotosistema II es el componente fotosintético más susceptible al daño irreversible ( Qiu y Lu, 2003 ). El fotosistema I es más termoestable bajo altas temperaturas que el fotosistema II, que es más termolábil. Sin embargo, el fotosistema II puede adaptarse a cambios ligeros en la temperatura, optimizándose la fotosíntesis bajo ambientes variables, excepto cuando se supera el límite máximo de temperatura para un cultivo dado ( Wahid et al., 2007 ). Se indica que el fotosistema II solo se ve afectado por temperaturas muy altas (>45 °C), por lo que el incremento en la tasa de respiración (oscura y foto-respiración) y la desactivación de Rubisco pueden ser más importantes inicialmente ( Salvucci y Crafts, 2004 ; Sharkey, 2005 ; Kurek et al., 2007 ). En general, las altas temperaturas afectan la capacidad fotosintética de manera más drástica en plantas C3 que en las C4 o en las CAM ( Taiz y Zeiger, 2006 ).
En muchos cultivos, la conductancia estomática (gS) y la fotosíntesis declinan ante temperaturas relativamente altas ( Wahid et al., 2007 ). Por ejemplo, en pepino y garbanzo la fotosíntesis decayó en un 90% cuando las hojas fueron sometidas a 40 °C durante una hora con respecto a las hojas de las plantas control (28 °C); sin embargo, en ambientes enriquecidos con CO2 este efecto se atenuó ( Taub et al., 2000 ; Haldimann y Feller, 2005 ).
En papaya, cuando la temperatura se eleva por encima de los 30 °C, la asimilación máxima de carbono decrece linealmente, lo que ocasiona que cuando se alcanzan 41 °C el valor de este parámetro es apenas la mitad que cuando se estaba a 30 °C. La temperatura actúa indirectamente en papaya por el incremento del déficit de presión de vapor (VPD), que provoca una caída de la conductancia estomática ( Campostrini y Glenn, 2007 ). Por ejemplo, cuando la variedad “Sunrise Solo” fue sembrada al sureste de Brasil y la temperatura se incrementó de 20 a 40 °C, el déficit de vapor de aire entre las hojas y el aire pasó de 2 a 6 kPa y la conductancia estomática bajó de 20 a 5 µmol/m2/s. Al igual que en papaya, en limón ( Citrus limon ) la máxima asimilación de CO2 se alcanzó cuando se tuvieron temperaturas que se consideran óptimas para la fotosíntesis (25-30 °C), pero decayó notablemente una vez que se superó este ámbito de temperatura, mientras que la respiración oscura continuó su incremento hasta los 40 °C. Esta respuesta muestra como los cambios en las temperaturas foliares afectan la actividad de la Rubisco y la regeneración de la ribulosa-1,5-bifosfato (RuBP) ( Pimentel et al., 2007 ).
En el maíz, un cultivo C4, la fotosíntesis neta se inhibió a partir de los 38 °C, y el efecto fue más severo cuando la temperatura se incrementó bruscamente que cuando lo hizo gradualmente. La transpiración se incrementó gradualmente conforme se incrementó la temperatura, lo que indica que la inhibición de la fotosíntesis no estuvo asociada con el cierre estomático. La eficiencia del fotosistema II no se vio afectada incluso a temperaturas superiores a los 45 °C, por lo que la principal razón de la caída de la tasa de fotosíntesis fue la inactivación de la Rubisco, cuya actividad decreció a partir de los 32,5 °C y se inactivó casi por completo a los 45 °C ( Crafts y Salvucci, 2002 ).
El floema bajo estrés. Partición de los asimilados
Los meristemos, los frutos, las semillas y las hojas jóvenes están estrechamente asociados con las hojas maduras y con toda la planta en general, a través de complejas redes de relaciones fuente:sumidero. Cuando se presenta un estrés moderado debido a altas temperaturas, se da una reducción de la fotosíntesis y de la actividad de las fuentes y los sumideros simultáneamente.
Las altas temperaturas dan como resultado menor crecimiento, productividad e índice de cosecha ( Taiz y Zeiger, 2006 ), debido a que el crecimiento y la respiración de las raíces y de los otros sumideros de las plantas decrece. Esto ocurre parcialmente porque los asimilados destinados al crecimiento y el rendimiento tienen que ser utilizados en otras actividades críticas para sobrevivir al estrés, como la respiración de mantenimiento, el ajuste osmótico y el crecimiento de las raíces. Debido a que los diferentes procesos fisiológicos responden al estrés a ritmos diferentes ( Hsiao, 1973 ), las plantas pueden aclimatarse y adoptar fenotipos más apropiados para las nuevas condiciones ( Larkindale et al., 2005 ; Gruber et al., 2013 ). Sin embargo, bajo condiciones de estrés (hídrico) el floema puede colapsar, debido al aumento de los solutos y de la viscosidad de la savia en las hojas, y a la incapacidad de las plantas para mantener la turgencia del floema en estados avanzados del estrés ( Sevanto, 2014 ).
La tolerancia relativamente alta de la translocación de asimilados al estrés hídrico, comparada con la susceptibilidad del crecimiento de las hojas y la fotosíntesis, permite a las plantas ajustar el transporte de asimilados hacia los sumideros que se mantienen funcionando por más tiempo luego de la imposición del estrés, como es el caso de las raíces. Dada la plasticidad del sistema radical de las plantas ante diferentes estreses ( Larkindale et al., 2005 ; Gruber et al., 2013 ), los cambios en el patrón de distribución de los asimilados en respuesta al estrés por altas temperaturas pueden resultar en una serie de fenotipos y relaciones raíz:tallo, según el tipo de estrés impuesto y el grado de calentamiento de la raíz y del suelo.
En arroz, los rendimientos y el índice de cosecha decaen significativamente cuando las plantas son expuestas a altas temperaturas. En los ensayos realizados por Prasad et al. (2006) , el índice de cosecha se redujo en más de un 55 % en cada uno de los dos años en los que llevaron a cabo sus experimentos. Resultados similares son indicados para maní y soya, donde la productividad y el índice de cosecha se redujeron notablemente cuando fueron sometidos a altas temperaturas ( Boote et al., 2005 ). En cultivares de frijol sensibles a altas temperaturas se tienen menores índices de cosecha ( Omae et al., 2012 ) y en maíz, el estrés por calor durante la etapa de llenado de los granos, restringe moderadamente el proceso de almacenamiento en las semillas y afecta su contenido de almidón, proteínas y aceites ( Wilhelm et al., 1999 ).
Cambios hormonales, señalización y aclimatación al estrés por alta temperatura
Las plantas tienen la habilidad de monitorear y adaptarse a condiciones ambientales adversas, y el grado de adaptabilidad o tolerancia a diferentes tipos de estrés varía entre especies y genotipos. Las hormonas juegan un papel central en la habilidad de los organismos para integrar las señales y responder adecuadamente a los cambios ( Wahid et al., 2007 ), pero la homeostasis, estabilidad, biosíntesis y compartimentación de las hormonas son también afectadas por el estrés por calor ( Maestri et al., 2002 ).
El ácido salicílico (SA) está involucrado en la termotolerancia basal y adquirida, y sus niveles se incrementan como respuesta al estrés por alta temperatura ( Kotak et al., 2007 ; Snyman y Cronjé, 2008 ). Esta hormona causa cierre estomático en respuesta a elicitores en la epidermis, y potencia el incremento en los niveles de proteínas del choque térmico HSP70 ( Cronjé y Bornman, 1999 ; Cronjé et al., 2004 ), lo que mejora la termotolerancia de las plantas. Mediante tratamientos con ácido salicílico se logró inducir o mejorar la termotolerancia en microplantas de papa, plántulas de pepino y plantas de tabaco producidas in vitro ( López et al., 1998 ; Dat et al., 2000 ; Shi et al., 2006 ).
La producción de ácido abscísico (ABA) en las plantas aumenta cuando coinciden la sequía y la alta temperatura, y constituye un componente importante en la adquisición de termotolerancia. Se sugiere que esta hormona está involucrada en las vías bioquímicas esenciales para la sobrevivencia a la desecación inducida por las altas temperaturas ( Gong et al., 1998 ; Barnabás et al., 2008 ). Contrario a los efectos del ABA, las giberelinas inhiben la termotolerancia de las plantas. Estudios en cebada indicaron que la aplicación de ácido giberélico exógeno a un mutante enano tolerante al estrés por temperatura, lo volvió sensible a este tipo de estrés. Por otro lado, la aplicación de triazol paclobutrazol, un compuesto antagonista de las giberelinas, le confirió tolerancia al calor ( Vettakkorumakankav et al., 1999 ). El etileno causa cierre estomático y controla la síntesis de flavonoles con propiedades antioxidantes. La acumulación de esteroles como los brasinosteroides parece fortalecer el crecimientno vegetal y conferir mayor tolerancia al calor. Otras hormonas vegetales como la auxina, las estrigolactonas y las citoquininas pueden estar involucradas en la tolerancia al calor solo de forma indirecta ( Murata et al., 2015 ).
El estrés por alta temperatura afecta de diferentes formas la producción de etileno en las distintas especies de plantas. Usualmente, la producción de esta hormona se incrementa hasta los 35 °C, punto a partir del cual decrece, y se inhibe después de los 40 °C ( Huberman et al., 1997 ); en soya se ve inhibida hasta después de los 45 °C ( Wahid et al., 2007 ). A pesar de que el etileno está relacionado con la abscisión de los órganos reproductivos, investigaciones recientes indican que esta hormona cumple un papel muy importante en la termotolerancia del polen en tomate. Cuando se interfirió en la síntesis de etileno o se redujeron sus niveles, se incrementó la sensibilidad del polen al estrés por calor, mientras que cuando se incrementaron los niveles de etileno antes de exponer la planta al estrés, se incrementó la calidad del polen, cuya germinación aumentó entre 2,6 y 10 veces ( Firon et al., 2012 ). Altas temperaturas causan la abscisión de órganos reproductivos en cultivos como frijol, maní, chile y tomate ( Prasad et al., 2000 ; Porch y Jahn, 2001 ; Susuki et al., 2001 ; Prasad et al., 2002 ; Vallejo y Estrada, 2004 ). En chile, este fenómeno es explicado por un incremento del ácido 1-amino-ciclopropano-1-carboxílico (ACC), precursor del etileno y de la reducción de los niveles de ácido indol-3-acético y la capacidad de transportar auxinas hacia los órganos reproductivos ( Huberman et al., 1997 ).
Las citoquininas atenúan los daños causados por el estrés por calor. Estudios llevados a cabo en Agrostis stolonifera indican que la aplicación exógena de citoquininas aminora los daños debidos al estrés por calor, ya que inhiben la acción de las proteasas sobre la ribulosa-1,5-bifosfato caboxilasa, e inducen o sobre-regulan la producción de HSPs ( Veerasamy et al., 2007 ). La disminución de los contenidos de citoquininas en plantas de trigo, debido al estrés por alta temperatura, fue responsable de la reducción del llenado y del peso seco del grano ( Banowetz et al., 1999 ). En maíz, los contenidos de citoquininas en los granos se redujeron con el estrés por calor, por lo que mantener niveles elevados de esta hormona durante el periodo de estrés puede conferir termotolerancia en las plantas y ayudar a lograr rendimientos estables ( Cheikh y Jones, 1994 ).
Aunque los párrafos anteriores describieron el papel individual de diferentes hormonas en la coordinacion de las respuestas de las plantas al estrés, los efectos hormonales son, a menudo, el resultado de la retroalimentación (“cross-talk”) metabólica y fisiológica de señalización, en la que los niveles de grupos de hormonas con efectos complementarios y a veces antagonistas, responden al estado energético celular, percibido inicialmente por quinasas sensibles al calcio ( Murata et al., 2015 ), y sus efectos son elevados a las escalas de planta completa y dosel, de acuerdo con las prioridades en la asignación de los recursos, impuestas por el desarrollo bajo condiciones de estrés por altas temperaturas.