Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Agronomía Mesoamericana
versão On-line ISSN 2215-3608versão impressa ISSN 1659-1321
Agron. Mesoam vol.23 no.1 San Pedro Jun. 2012
Comunicación Corta
Contenido de carbono y nitrógeno de la biomasa microbiana en suelos de La HabanaLuís A. Gómez-Jorrin2*, Amalia Morales-Valdes2, Graciela Dueñas-Vega2, Juana María Dantin-Martínez2, Nereida Chávez-Gonzalez2, Maite Torres-Leblanch3*
*Dirección para correspondencia
Resumen
Contenido de carbono y nitrógeno de la biomasa microbiana en suelos de La Habana. La presente investigación fue diseñada con el objetivo de calcular el carbono (C) y el nitrógeno (N) inmovilizado en la biomasa microbiana de cuatro suelos Ferralíticos Rojos de la Provincia de La Habana, Cuba, empleando la metodología de “fumigación extracción” en el año 2006. Se colectaron muestras de cuatro sitios (Bainoa, La Salud, Quivicán y Guanajay), los cuales mostraron diferencias en las características físico – químicas, incluyendo diferencias en contenido de materia orgánica entre 2,8 y 5%. La sensibilidad de las metodologías empleadas fue valorada utilizando el error estándar de las medias como parámetro estadístico. Los niveles de C inmovilizados en la biomasa microbiana en los suelos estudiados, variaron entre 289 y 425 μg/g de suelo y tuvieron una correlación altamente significativa con el contenido de materia orgánica del suelo. Los contenidos de N inmovilizados variaron entre 62 y 90 μg/g de suelo y se observó también una correlación significativa entre este parámetro y el contenido de nitrógeno total. El error estándar de la media para las determinaciones del C microbiano varió entre 2 y 16 y fueron ligeramente superiores a lo hallado en reportes anteriores; mientras que los errores observados en las determinaciones del N microbiano se mantuvieron entre los rangos considerados adecuados. Finalmente la metodología fue adaptada a las condiciones del laboratorio.
Palabras clave: Biomasa microbiana, fumigación extracción; carbono y nitrógeno; suelos ferralíticos rojos.
Abstract
Microbial biomass carbon and nitrogen content in Havana Soil. This research was carried out to calculate the microbial biomass carbon and nitrogen content in Red Ferralitic Soils from the Havana province, using the “fumigation and extraction” method. For this work soil samples were taken from four different sites (Bainoa, La Salud, Quivicán and Guanajay) with different physicalchemical characteristics, including organic matter content which ranged from 2.8 and 5%. The sensibility of the methods employed was asssessed using the mean standard error as statistical parameter. The C content in soil microbial biomass ranged from 289 and 425 μg/g of soil (289 – 425 mg/kg of soil) and had it a significant correlation by soil organic matter content. On the other hand, N content in soil microbial biomass ranged from 62 and 90 μg/g of soil (62-90 mg/kg of soil), and had it a significant correlation by soil nitrogen content. The mean standard error of microbial C determinations ranged from 2 and 16, being slightly superior to previous reports, while the mean standard error of the microbial N determinations were among adequate limits. Finally, this methodology was adapted to laboratory conditions.
Key words: Microbial biomass, fumigation-extraction method, carbon and nitrogen, red ferralitic soil.
Contenido de carbono y nitrógeno de la biomasa microbiana en suelos de La Habana. La presente investigación fue diseñada con el objetivo de calcular el carbono (C) y el nitrógeno (N) inmovilizado en la biomasa microbiana de cuatro suelos Ferralíticos Rojos de la Provincia de La Habana, Cuba, empleando la metodología de “fumigación extracción” en el año 2006. Se colectaron muestras de cuatro sitios (Bainoa, La Salud, Quivicán y Guanajay), los cuales mostraron diferencias en las características físico – químicas, incluyendo diferencias en contenido de materia orgánica entre 2,8 y 5%. La sensibilidad de las metodologías empleadas fue valorada utilizando el error estándar de las medias como parámetro estadístico. Los niveles de C inmovilizados en la biomasa microbiana en los suelos estudiados, variaron entre 289 y 425 μg/g de suelo y tuvieron una correlación altamente significativa con el contenido de materia orgánica del suelo. Los contenidos de N inmovilizados variaron entre 62 y 90 μg/g de suelo y se observó también una correlación significativa entre este parámetro y el contenido de nitrógeno total. El error estándar de la media para las determinaciones del C microbiano varió entre 2 y 16 y fueron ligeramente superiores a lo hallado en reportes anteriores; mientras que los errores observados en las determinaciones del N microbiano se mantuvieron entre los rangos considerados adecuados. Finalmente la metodología fue adaptada a las condiciones del laboratorio.
Palabras clave: Biomasa microbiana, fumigación extracción; carbono y nitrógeno; suelos ferralíticos rojos.
Abstract
Microbial biomass carbon and nitrogen content in Havana Soil. This research was carried out to calculate the microbial biomass carbon and nitrogen content in Red Ferralitic Soils from the Havana province, using the “fumigation and extraction” method. For this work soil samples were taken from four different sites (Bainoa, La Salud, Quivicán and Guanajay) with different physicalchemical characteristics, including organic matter content which ranged from 2.8 and 5%. The sensibility of the methods employed was asssessed using the mean standard error as statistical parameter. The C content in soil microbial biomass ranged from 289 and 425 μg/g of soil (289 – 425 mg/kg of soil) and had it a significant correlation by soil organic matter content. On the other hand, N content in soil microbial biomass ranged from 62 and 90 μg/g of soil (62-90 mg/kg of soil), and had it a significant correlation by soil nitrogen content. The mean standard error of microbial C determinations ranged from 2 and 16, being slightly superior to previous reports, while the mean standard error of the microbial N determinations were among adequate limits. Finally, this methodology was adapted to laboratory conditions.
Key words: Microbial biomass, fumigation-extraction method, carbon and nitrogen, red ferralitic soil.
Introducción
El rol de la microflora del suelo en el reciclaje de nutriente y su relación con los parámetros que definen la fertilidad del suelo ha sido reconocido desde hace tiempo (Franzluebbers et al. 1995). Mientras su influencia sobre la calidad del suelo, así como la aceptación de que las fluctuaciones de biomasa microbiana del suelo constituye un índice “temprano” de los cambios en el contenido de materia orgánica (MO) es un hecho en el que se ha enfatizado más recientemente (Sallih y Pansu 1983, Polwson et al. 1987, Sparling 1992, Bouzaiane et al. 2002, Beding et al. 2004, Mahmood et al. 2007, Dick 2009).
Para la determinación de la biomasa microbiana del suelo se han desarrollado numerosas metodologías: 1)métodos basados en siembra en placa con medios de cultivo, 2) métodos empleando microscopía (Zvyangintsev et al. 1984, Nathalie et al. 2007, Bertaux et al. 2007), 3) respiración inducida por carbohidratos (Anderson y Domsch 1980), 4) método de fumigación con cloroformo con incubación o extracción con sulfato de potasio (Brookes et al. 1985, Azam et al. 2003) y 5) métodos empleando técnicas de biología molecular (Leckie et al. 2004, Burygin et al. 2007, Dick 2009) entre los más importantes. El desarrollo de esta diversidad de metodología está relacionada con la complejidad que se presenta en el estudio de las comunidades microbianas del suelo y su actividad (Azam et al. 2003, Dick 2009).
Entre esta diversidad de métodos se ha reconocido que la determinación del carbono (C) y nitrógeno (N) de la biomasa microbiana del suelo por el método de “fumigación y extracción” propuesto por Brookes et al. (1985) es de los más adecuados para la evaluación de la evolución de la fertilidad de suelos sometidos a diferentes manejos y dosis de fertilizantes químicos (Franzluebbers et al. 1995, Bouzaiaine et al. 2002, Dick 2009), debido a que este permite hacer el cálculo de las cantidades de C y el N inmovilizado por la microflora del suelo.
En Cuba varios trabajos (Gómez et al. 1988, Alfonso et al. 1999, Guerrero et al. 1999, Calero et al. 1999 y 2001, Font et al. 2001, Chaveli et al. 2001) informan el uso de indicadores biológicos tales como la respiración basal, la inducida con carbohidratos y nitrógeno, la capacidad nitrificadora real, el grado de descomposición de la celulosa, el cálculo de la biomasa bacteriana empleando microscopia fluorescente como parámetros adecuados para la evaluación del impacto de la fertilización mineral, el efecto de los diferentes sistemas de labranza, el uso de abonos verdes y la influencia de diferentes prácticas de manejo sobre la fertilidad del suelo. Sin embargo, a pesar de ello no existen antecedentes del uso de métodos químicos para calcular la biomasa microbiana en suelos agrícolas en el país, por ello el objetivo del presente trabajo fue calcular el C y el N inmovilizados por la microflora en suelos Ferralíticos Rojos del sur de la provincia La Habana, y su relación con el contenido de materia orgánica del suelo.
Materiales y Métodos
Origen y características de los suelos empleados para el estudio
Se colectaron muestras de suelo de la capa arable entre 0 a 20 cm de profundidad de cuatro sitios diferentes dentro de la provincia de La Habana en el mes de Junio del 2006: 1) Bainoa, en el municipio Jaruco bajo pasto natural sin cultivo anterior, 2) áreas agrícolas de la Dirección de Suelos La Renée– Habana en el municipio Quivican sometido a una sucesiva rotación frijol común maíz, 3) Finca de productor privado en la CCS “Francisco Velásquez” en el municipio de Guanajay (pasto natural sin cultivar) y 4) áreas de pastoreo de ganado vacuno cercanas al poblado de la salud en el municipio Quivican, de acuerdo a las indicaciones de la Norma Ramal del Ministerio de la Agricultura (NRAG) – 266 (Ministerio de la Agricultura 1979), considerando como área de estudio una hectárea en cada sitio y el contenido de materia orgánica de los suelos como criterio de selección. Los suelos fueron sometidos a una caracterización físico – química según las normas NRAG 372 (Ministerio de la Agricultura 1980); NRG 878 (Ministerio de la Agricultura 1987); NRAG 879 y NRAG 892 (Ministerio de la Agricultura 1988) (Cuadro 1).
El resultado de la caracterización de los suelos, los cuales se clasificaron como Ferralíticos Rojos de acuerdo a Hernández et al. (1999), mostró que los mismos tenían diferencias en contenido de materia orgánica y disponibilidad de nutrientes (Cuadro 2).
Determinación del carbono y el nitrógeno en la biomasa microbiana del suelo
Principio de la metodología de “fumigación y extracción” de Brookes et al. (1985): A través de la exposición de la microflora del suelo a una atmósfera de cloroformo por espacio de 24 horas, los microorganismos del suelo son lizados, pero los componentes inanimados de la materia orgánica no se afectan. El C y N orgánico extraído en una solución de sulfato de potasio (0,5 M) es determinado en muestras de suelo fumigadas y no fumigadas, el incremento en las cantidades de C y N determinado en las muestras fumigadas con respecto a los controles es considerado como carbono y nitrógeno de la biomasa microbiana del suelo. El método es usualmente nombrado como “fumigación extracción”.
Fumigación con cloroformo y extracción de los nutrientes en una solución de sulfato de potasio
Fumigación y extracción: Para someter los suelos a una atmósfera de cloroformo se ubicaron cuatro beakers de 50 ml de capacidad conteniendo 15 g de suelo, tamizados por malla de 2 mm en una de secadora para vacío de plástico, que además contenía dos beakers con 25 ml de cloroformo libre de etanol dos beakers con 25 ml de cloroformo libre de etanol con perlitas de vidrio y un beaker con 25 ml de H2O destilada. Para provocar la atmósfera de cloroformo la desecadora se conectó por medio de una manguera plástica a una bomba eléctrica de vacío y se provocó vacío hasta observar la ebullición del cloroformo en el interior de los beakers por espacio de dos minutos, la llave de la desecadora se cerró y se desconectó la manguera de la bomba de vacío, y se incubó a temperatura ambiente (28 ± 4°C) durante 24 h. Una desecadora con un contenido similar al descrito anteriormente, excepto que no contenía los beakers con cloroformo fue incubada al unísono y las muestras de suelo ubicadas en esta segunda desecadora fueron consideradas como muestras controles.
Después de pasado 24 a 28 horas el cloroformo fue evacuado de la desecadora por repetida evacuación del mismo empleando para ello la bomba de vacío.
Para realizar la extracción de los nutrientes provenientes de la biomasa microbiana del suelo, los 15 g de suelo se pasaron a un erlenmeyer de 200 ml de capacidad e inmediatamente después fue añadida a los frascos 60 ml de una solución de sulfato de potasio 0,5 M (87,14 g/l), los cuales fueron sometidos a agitación vertical entre 35 y 40 minutos, el extracto de suelo fue filtrado empleando papel de filtro Watman No. 42, las muestras controles fueron sometidas al mismo procedimiento.
Determinación del carbono y el nitrógeno en el extracto de suelo
El carbono y el nitrógeno en el extracto de suelo fueron determinados por oxidación con dicromato de potasio (variante de Vance et al. 1987) y por reducción de nitrato a amonio por digestión de Kjeldhal respectivamente.
El C en la biomasa microbiana del suelo se calculó de la siguiente manera:
Donde Ec es la diferencia entre el C determinado en las muestras fumigadas con respecto al C determinado en las muestras no fumigadas.
Kec fue considerada 0,38 (Vance et al. 1987, Wu et al. 1990)
El N en la biomasa microbiana se calculó según la fórmula siguiente:
Esquemas experimentales y evaluación estadística de los datos
Cada muestra de suelo incubada en cada beaker individual se consideró como una réplica, los suelos colectados en los diferentes sitios fueron incubados siempre en la misma desecadora, tanto para tratamiento fumigado con cloroformo, como el no fumigado, el esquema experimental se organizó entonces como un factorial de 4 suelos x 2 modos de fumigación, y la experiencia se repitió ocho veces (ocho réplicas), los resultados fueron evaluados estadísticamente para análisis de varianza empleando el software XLSTAT, 2010.
Resultados y Discusión
Los contenidos de C determinados en la solución de sulfato de potasio en las muestras controles oscilaron entre 77 y 102 μg/g de suelo y para las muestras fumigadas entre 207 y 286 μg/g de suelo (Cuadro 3), valores comprendidos en los rangos reportados por la literatura internacional (Brookes et al. 1985, Vance et al. 1987, Bending et al. 2004), y por tanto los niveles de C inmovilizado en la biomasa microbiana del suelo observados (289–426 μg g/suelo) en los cuatro suelos estuvieron también dentro de los rangos reportados.
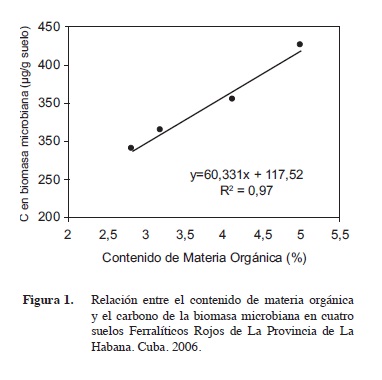
Tanto el carbono extraído en la solución de sulfato de potasio en muestras fumigadas y no fumigadas y por tanto las cantidades totales de C en la biomasa microbiana del suelo se incrementaron en la medida que los suelos elevaron su contenido de materia orgánica (Figura 1), así se pudo observar que el comportamiento de los cuatros suelos estudiados con respecto a estos parámetros fue el siguiente Bainoa < La Renée < Guanajay < La Salud (Cuadro 3).
La evaluación de la relación entre el carbono inmovilizado por la biomasa microbiana y el contenido de materia orgánica en los cuatro suelos estudiados, reflejó que por cada unidad porcentual de M.O que se incrementa la biomasa microbiana, aumenta la inmovilización de C en 60,3 μg/g de suelo (Figura 1), aspecto que refleja la relación directa que existió entre estos dos parámetros, fenómeno que ha sido reportado con anterioridad por diferentes autores (Brookes et al., 1985, Sparling et al. 1992, Beding et al. 2004, Leckie et al. 2004, Oulbachir et al. 2009, Dick 2009).
Por otro lado, el N extraído en las muestras no fumigadas varió entre 16 y 24 μg/g de suelo (16 y 24 mg/ kg de suelo), mientras que para las fumigadas varió entre 44 y 60 μg/g de suelo (44 y 60 mg/kg de suelo) (Cuadro 4), valores que están comprendidos entre los rangos reportados por la literatura internacional (Brookes et al. 1985, Vance et al. 1987, Beding et al. 2004).
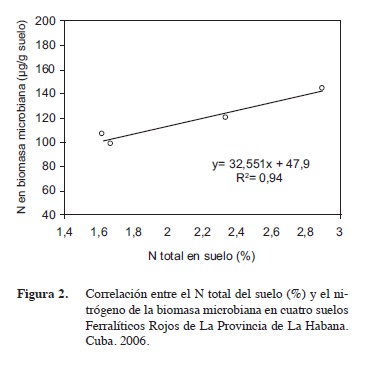
El N inmovilizado por los microorganismos en los cuatro suelos estudiados, no mostró relación con el contenido de M.O en los mismos (dato no mostrado), pero sí con el contenido porcentual de N hallados en estos (Figura 2), esta correlación hallada entre N en la biomasa microbiana y el contenido porcentual de nitrógeno en estos suelos reflejó que por cada unidad que se incremente de N se incrementa en 32,5 μg de N por g de suelo inmovilizado por la microflora (32 mg/kg de suelo), resultado que concuerda con lo observado por Myrold et al. (1987) y por Beding et al. (2004) durante el estudio de varios suelos agrícolas en los Estados Unidos y en Inglaterra respectivamente.
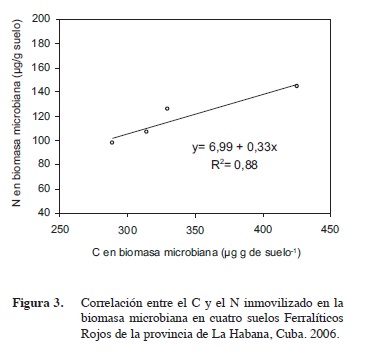
La relación ínter nutriente media hallada en esta experiencia para el C y el N inmovilizado en la biomasa microbiana mostró que la microflora en estos suelos acumula siete unidades de C por cada unidad de N (Figura 3), y a partir de este valor cada unidad de C suplementaria que se incremente elevará en 0,33 unidades el N inmovilizado por la biomasa microbiana. Fließbach et al. (2006) hallaron relaciones C/N en la biomasa microbiana de suelos en Suiza comprendidos entre 5,95 y 7,24, lo que está en correspondencia con los resultados observados en esta investigación (Figura 3). Estos autores también expresaron que este parámetro es un reflejo de la composición de la microflora del suelo, aspecto que será necesario estudiar en suelos agrícolas en Cuba en un futuro.
La evaluación de la repetitividad y la reproducibilidad de la metodología empleada para la determinación del C en la biomasa microbiana, se dio empleando el parámetro estadístico error estándar de la media desde muestras fumigadas y no fumigadas y la diferencia entre estas mostró que los errores en las determinaciones variaron entre 2 y 16 (Cuadro 3) y fueron ligeramente superiores a los reportados por los autores de la metodología (Brookes et al. 1985, Vance et al. 1987), lo que señala que es un aspecto en el que hay que trabajar más en el futuro para su disminución.
La evaluación de los errores estándar durante las determinaciones del N inmovilizado por los microorganismos de los cuatro suelos incluidos en este estudio con el uso de la metodología de Brookes et al. (1985), mostraron que las medias para los parámetros N extraído en los extractos de suelo de muestras no fumigadas variaron entre 0,49 y 2,28 y para las muestras fumigadas entre 1,55 y 3,99 (Cuadro 4), errores comprendidos entre los rangos reportados por autores que han empleado esta metodología (Brookes et al. 1985 y Vance et al. 1987).
Al respecto la literatura internacional (Beding et al. 2004, Dell et al. 2005, Murata et al. 2006) reconoce que los nutrientes (C y N) inmovilizados por los microorganismos del suelo y calculados por el método de “fumigación y extracción” deben ser considerados “indicadores directos o cuantitativos”, por su relación directa con la disponibilidad de estos nutrientes en los mismos.
Los resultados hallados en este trabajo reflejaron que los niveles de C y N inmovilizado en la biomasa microbiana tuvieron una correlación significativa (Figuras 1 y 2) con los contenidos porcentuales de M.O y N en suelo respectivamente, aspecto de gran importancia para los estudios de evaluación de la fertilidad de suelo y la disponibilidad de nutrientes en los mismos.
Por otro lado si se tiene en cuenta que las fluctuaciones de biomasa microbiana son un índice “temprano” de las variaciones en el contenido de materia orgánica del suelo (Powlson et al. 1987), entonces puede comprenderse que al monitorear el primer índice estaremos conociendo en menos tiempo si el manejo de los diferentes sistemas agrícolas está permitiendo al suelo ganar o perder en M.O (fertilidad), aspecto que constituye la principal limitante de los laboratorios de análisis de suelo del país y del actual servicio agroquímico para dar recomendaciones precisas sobre este aspecto.
Por tanto la posibilidad del empleo de la metodología de “fumigación con cloroformo” (Brookes et al. 1985) en los laboratorios de análisis de suelo del país para calcular los contenidos de C y N de la biomasa microbiana, permitirá disponer de nuevos indicadores biológicos para el monitoreo de la fertilidad de los suelos.
El rol de la microflora del suelo en el reciclaje de nutriente y su relación con los parámetros que definen la fertilidad del suelo ha sido reconocido desde hace tiempo (Franzluebbers et al. 1995). Mientras su influencia sobre la calidad del suelo, así como la aceptación de que las fluctuaciones de biomasa microbiana del suelo constituye un índice “temprano” de los cambios en el contenido de materia orgánica (MO) es un hecho en el que se ha enfatizado más recientemente (Sallih y Pansu 1983, Polwson et al. 1987, Sparling 1992, Bouzaiane et al. 2002, Beding et al. 2004, Mahmood et al. 2007, Dick 2009).
Para la determinación de la biomasa microbiana del suelo se han desarrollado numerosas metodologías: 1)métodos basados en siembra en placa con medios de cultivo, 2) métodos empleando microscopía (Zvyangintsev et al. 1984, Nathalie et al. 2007, Bertaux et al. 2007), 3) respiración inducida por carbohidratos (Anderson y Domsch 1980), 4) método de fumigación con cloroformo con incubación o extracción con sulfato de potasio (Brookes et al. 1985, Azam et al. 2003) y 5) métodos empleando técnicas de biología molecular (Leckie et al. 2004, Burygin et al. 2007, Dick 2009) entre los más importantes. El desarrollo de esta diversidad de metodología está relacionada con la complejidad que se presenta en el estudio de las comunidades microbianas del suelo y su actividad (Azam et al. 2003, Dick 2009).
Entre esta diversidad de métodos se ha reconocido que la determinación del carbono (C) y nitrógeno (N) de la biomasa microbiana del suelo por el método de “fumigación y extracción” propuesto por Brookes et al. (1985) es de los más adecuados para la evaluación de la evolución de la fertilidad de suelos sometidos a diferentes manejos y dosis de fertilizantes químicos (Franzluebbers et al. 1995, Bouzaiaine et al. 2002, Dick 2009), debido a que este permite hacer el cálculo de las cantidades de C y el N inmovilizado por la microflora del suelo.
En Cuba varios trabajos (Gómez et al. 1988, Alfonso et al. 1999, Guerrero et al. 1999, Calero et al. 1999 y 2001, Font et al. 2001, Chaveli et al. 2001) informan el uso de indicadores biológicos tales como la respiración basal, la inducida con carbohidratos y nitrógeno, la capacidad nitrificadora real, el grado de descomposición de la celulosa, el cálculo de la biomasa bacteriana empleando microscopia fluorescente como parámetros adecuados para la evaluación del impacto de la fertilización mineral, el efecto de los diferentes sistemas de labranza, el uso de abonos verdes y la influencia de diferentes prácticas de manejo sobre la fertilidad del suelo. Sin embargo, a pesar de ello no existen antecedentes del uso de métodos químicos para calcular la biomasa microbiana en suelos agrícolas en el país, por ello el objetivo del presente trabajo fue calcular el C y el N inmovilizados por la microflora en suelos Ferralíticos Rojos del sur de la provincia La Habana, y su relación con el contenido de materia orgánica del suelo.
Materiales y Métodos
Origen y características de los suelos empleados para el estudio
Se colectaron muestras de suelo de la capa arable entre 0 a 20 cm de profundidad de cuatro sitios diferentes dentro de la provincia de La Habana en el mes de Junio del 2006: 1) Bainoa, en el municipio Jaruco bajo pasto natural sin cultivo anterior, 2) áreas agrícolas de la Dirección de Suelos La Renée– Habana en el municipio Quivican sometido a una sucesiva rotación frijol común maíz, 3) Finca de productor privado en la CCS “Francisco Velásquez” en el municipio de Guanajay (pasto natural sin cultivar) y 4) áreas de pastoreo de ganado vacuno cercanas al poblado de la salud en el municipio Quivican, de acuerdo a las indicaciones de la Norma Ramal del Ministerio de la Agricultura (NRAG) – 266 (Ministerio de la Agricultura 1979), considerando como área de estudio una hectárea en cada sitio y el contenido de materia orgánica de los suelos como criterio de selección. Los suelos fueron sometidos a una caracterización físico – química según las normas NRAG 372 (Ministerio de la Agricultura 1980); NRG 878 (Ministerio de la Agricultura 1987); NRAG 879 y NRAG 892 (Ministerio de la Agricultura 1988) (Cuadro 1).
Determinación del carbono y el nitrógeno en la biomasa microbiana del suelo
Principio de la metodología de “fumigación y extracción” de Brookes et al. (1985): A través de la exposición de la microflora del suelo a una atmósfera de cloroformo por espacio de 24 horas, los microorganismos del suelo son lizados, pero los componentes inanimados de la materia orgánica no se afectan. El C y N orgánico extraído en una solución de sulfato de potasio (0,5 M) es determinado en muestras de suelo fumigadas y no fumigadas, el incremento en las cantidades de C y N determinado en las muestras fumigadas con respecto a los controles es considerado como carbono y nitrógeno de la biomasa microbiana del suelo. El método es usualmente nombrado como “fumigación extracción”.
Fumigación con cloroformo y extracción de los nutrientes en una solución de sulfato de potasio
Fumigación y extracción: Para someter los suelos a una atmósfera de cloroformo se ubicaron cuatro beakers de 50 ml de capacidad conteniendo 15 g de suelo, tamizados por malla de 2 mm en una de secadora para vacío de plástico, que además contenía dos beakers con 25 ml de cloroformo libre de etanol dos beakers con 25 ml de cloroformo libre de etanol con perlitas de vidrio y un beaker con 25 ml de H2O destilada. Para provocar la atmósfera de cloroformo la desecadora se conectó por medio de una manguera plástica a una bomba eléctrica de vacío y se provocó vacío hasta observar la ebullición del cloroformo en el interior de los beakers por espacio de dos minutos, la llave de la desecadora se cerró y se desconectó la manguera de la bomba de vacío, y se incubó a temperatura ambiente (28 ± 4°C) durante 24 h. Una desecadora con un contenido similar al descrito anteriormente, excepto que no contenía los beakers con cloroformo fue incubada al unísono y las muestras de suelo ubicadas en esta segunda desecadora fueron consideradas como muestras controles.
Después de pasado 24 a 28 horas el cloroformo fue evacuado de la desecadora por repetida evacuación del mismo empleando para ello la bomba de vacío.
Para realizar la extracción de los nutrientes provenientes de la biomasa microbiana del suelo, los 15 g de suelo se pasaron a un erlenmeyer de 200 ml de capacidad e inmediatamente después fue añadida a los frascos 60 ml de una solución de sulfato de potasio 0,5 M (87,14 g/l), los cuales fueron sometidos a agitación vertical entre 35 y 40 minutos, el extracto de suelo fue filtrado empleando papel de filtro Watman No. 42, las muestras controles fueron sometidas al mismo procedimiento.
Determinación del carbono y el nitrógeno en el extracto de suelo
El carbono y el nitrógeno en el extracto de suelo fueron determinados por oxidación con dicromato de potasio (variante de Vance et al. 1987) y por reducción de nitrato a amonio por digestión de Kjeldhal respectivamente.
El C en la biomasa microbiana del suelo se calculó de la siguiente manera:
C en la biomasa = Ec / Kec
Donde Ec es la diferencia entre el C determinado en las muestras fumigadas con respecto al C determinado en las muestras no fumigadas.
Kec fue considerada 0,38 (Vance et al. 1987, Wu et al. 1990)
El N en la biomasa microbiana se calculó según la fórmula siguiente:
N en Biomasa microbiana = En / Ken
Donde En es el incremento de N hallado en las muestras fumigadas con respecto a las controles y Ken = 0,45 factor empírico (Brookes et al. 1985).Esquemas experimentales y evaluación estadística de los datos
Cada muestra de suelo incubada en cada beaker individual se consideró como una réplica, los suelos colectados en los diferentes sitios fueron incubados siempre en la misma desecadora, tanto para tratamiento fumigado con cloroformo, como el no fumigado, el esquema experimental se organizó entonces como un factorial de 4 suelos x 2 modos de fumigación, y la experiencia se repitió ocho veces (ocho réplicas), los resultados fueron evaluados estadísticamente para análisis de varianza empleando el software XLSTAT, 2010.
Resultados y Discusión
Los contenidos de C determinados en la solución de sulfato de potasio en las muestras controles oscilaron entre 77 y 102 μg/g de suelo y para las muestras fumigadas entre 207 y 286 μg/g de suelo (Cuadro 3), valores comprendidos en los rangos reportados por la literatura internacional (Brookes et al. 1985, Vance et al. 1987, Bending et al. 2004), y por tanto los niveles de C inmovilizado en la biomasa microbiana del suelo observados (289–426 μg g/suelo) en los cuatro suelos estuvieron también dentro de los rangos reportados.
Tanto el carbono extraído en la solución de sulfato de potasio en muestras fumigadas y no fumigadas y por tanto las cantidades totales de C en la biomasa microbiana del suelo se incrementaron en la medida que los suelos elevaron su contenido de materia orgánica (Figura 1), así se pudo observar que el comportamiento de los cuatros suelos estudiados con respecto a estos parámetros fue el siguiente Bainoa < La Renée < Guanajay < La Salud (Cuadro 3).
La evaluación de la relación entre el carbono inmovilizado por la biomasa microbiana y el contenido de materia orgánica en los cuatro suelos estudiados, reflejó que por cada unidad porcentual de M.O que se incrementa la biomasa microbiana, aumenta la inmovilización de C en 60,3 μg/g de suelo (Figura 1), aspecto que refleja la relación directa que existió entre estos dos parámetros, fenómeno que ha sido reportado con anterioridad por diferentes autores (Brookes et al., 1985, Sparling et al. 1992, Beding et al. 2004, Leckie et al. 2004, Oulbachir et al. 2009, Dick 2009).
Por otro lado, el N extraído en las muestras no fumigadas varió entre 16 y 24 μg/g de suelo (16 y 24 mg/ kg de suelo), mientras que para las fumigadas varió entre 44 y 60 μg/g de suelo (44 y 60 mg/kg de suelo) (Cuadro 4), valores que están comprendidos entre los rangos reportados por la literatura internacional (Brookes et al. 1985, Vance et al. 1987, Beding et al. 2004).
El N inmovilizado por los microorganismos en los cuatro suelos estudiados, no mostró relación con el contenido de M.O en los mismos (dato no mostrado), pero sí con el contenido porcentual de N hallados en estos (Figura 2), esta correlación hallada entre N en la biomasa microbiana y el contenido porcentual de nitrógeno en estos suelos reflejó que por cada unidad que se incremente de N se incrementa en 32,5 μg de N por g de suelo inmovilizado por la microflora (32 mg/kg de suelo), resultado que concuerda con lo observado por Myrold et al. (1987) y por Beding et al. (2004) durante el estudio de varios suelos agrícolas en los Estados Unidos y en Inglaterra respectivamente.
La relación ínter nutriente media hallada en esta experiencia para el C y el N inmovilizado en la biomasa microbiana mostró que la microflora en estos suelos acumula siete unidades de C por cada unidad de N (Figura 3), y a partir de este valor cada unidad de C suplementaria que se incremente elevará en 0,33 unidades el N inmovilizado por la biomasa microbiana. Fließbach et al. (2006) hallaron relaciones C/N en la biomasa microbiana de suelos en Suiza comprendidos entre 5,95 y 7,24, lo que está en correspondencia con los resultados observados en esta investigación (Figura 3). Estos autores también expresaron que este parámetro es un reflejo de la composición de la microflora del suelo, aspecto que será necesario estudiar en suelos agrícolas en Cuba en un futuro.
La evaluación de la repetitividad y la reproducibilidad de la metodología empleada para la determinación del C en la biomasa microbiana, se dio empleando el parámetro estadístico error estándar de la media desde muestras fumigadas y no fumigadas y la diferencia entre estas mostró que los errores en las determinaciones variaron entre 2 y 16 (Cuadro 3) y fueron ligeramente superiores a los reportados por los autores de la metodología (Brookes et al. 1985, Vance et al. 1987), lo que señala que es un aspecto en el que hay que trabajar más en el futuro para su disminución.
La evaluación de los errores estándar durante las determinaciones del N inmovilizado por los microorganismos de los cuatro suelos incluidos en este estudio con el uso de la metodología de Brookes et al. (1985), mostraron que las medias para los parámetros N extraído en los extractos de suelo de muestras no fumigadas variaron entre 0,49 y 2,28 y para las muestras fumigadas entre 1,55 y 3,99 (Cuadro 4), errores comprendidos entre los rangos reportados por autores que han empleado esta metodología (Brookes et al. 1985 y Vance et al. 1987).
Al respecto la literatura internacional (Beding et al. 2004, Dell et al. 2005, Murata et al. 2006) reconoce que los nutrientes (C y N) inmovilizados por los microorganismos del suelo y calculados por el método de “fumigación y extracción” deben ser considerados “indicadores directos o cuantitativos”, por su relación directa con la disponibilidad de estos nutrientes en los mismos.
Los resultados hallados en este trabajo reflejaron que los niveles de C y N inmovilizado en la biomasa microbiana tuvieron una correlación significativa (Figuras 1 y 2) con los contenidos porcentuales de M.O y N en suelo respectivamente, aspecto de gran importancia para los estudios de evaluación de la fertilidad de suelo y la disponibilidad de nutrientes en los mismos.
Por otro lado si se tiene en cuenta que las fluctuaciones de biomasa microbiana son un índice “temprano” de las variaciones en el contenido de materia orgánica del suelo (Powlson et al. 1987), entonces puede comprenderse que al monitorear el primer índice estaremos conociendo en menos tiempo si el manejo de los diferentes sistemas agrícolas está permitiendo al suelo ganar o perder en M.O (fertilidad), aspecto que constituye la principal limitante de los laboratorios de análisis de suelo del país y del actual servicio agroquímico para dar recomendaciones precisas sobre este aspecto.
Por tanto la posibilidad del empleo de la metodología de “fumigación con cloroformo” (Brookes et al. 1985) en los laboratorios de análisis de suelo del país para calcular los contenidos de C y N de la biomasa microbiana, permitirá disponer de nuevos indicadores biológicos para el monitoreo de la fertilidad de los suelos.
Literatura Citada
Alfonso, CA; Monederos, M; Calero, B; Guerrero, A y Somoza, V (1999). Recuperación de los suelos degradados dedicados a cultivos varios del agro-ecosistemas del sur de la Habana. Informe proyecto 002-00 021. CITMA. 42 p. [ Links ]
Azam, F; Farooq, S; Ladhi, A. 2003. Microbial biomass in Agricultural soils–determination, synthesis dynamics and role in plant nutrition. Pakistan Journal of Biological Sciences 6:629-639. [ Links ]
Beding, GD; Turner, MK; Rayus, F; Marx, MC; Wood, M. 2004. Microbial and biochemical soil quality indicators and their potential for differentiating areas under contrasting agricultural management regimes. Soil Biology and Biochemistry 36:1785-1792. [ Links ]
Bertaux, J; Gloger, U; Schmid, M; Hatmann, A; Scheu, S. 2007. Routine florescence in situ hybridation in soil. International Conference Rhizosphere 2, Montpellier France. 150 p. [ Links ]
Bouzaiane, O; Hassen, A; Jedidi, N. 2002. Détermination de la biomasse C et N par la méthode de fumigation extraction dans un sol amende de résidus organiques. In International Symposium on Environmental Pollution Control and Waste Management (Proceedings). EUPCOWM. Tunis. 416 p. [ Links ]
Brookes, PC; Landman, A; Pruden, G; Jenkinson DS. 1985. Chloroform fumigation and the release of soil nitrogen; a rapid direct extraction method to measure microbial biomasa nitrogen in soil. Soil Biology and. Biochemistry 17:837-842. [ Links ]
Calero, B; Guerrero, A; Alfonso, C; Somoza, V; Camacho, E. 1999. Efecto residual de la fertilización mineral sobre el estado microbiológico del suelo. La Ciencia y el hombre XI 33:89-94. [ Links ]
Carney, KH; Matson, PA. 2005. Plant communities, soil microorganisms and soil carbon cycling: Does altering the world belowground matter to ecosystem functioning. Ecosystems 8:928-940. [ Links ]
Chaveli, P; Font, L; Calero, B; Mendoza, L; Valenciano, M. 2001. Indicadores microbiológicos para la evaluación del impacto provocado por la erosión en un suelo pardo sin carbonato de la provincia de Camagüey, Cuba. In XV Congreso Latinoamericano y V Cubano de la Ciencia del Suelo. Centro de Convenciones Plaza América, Varadero, Cuba. 230 p. [ Links ]
Dell, CJ; Rice, CW. 2005. Short – term competition for ammonium and nitrate in tallgrass prairie. Soil Science Society and American Journal 69:371-377. [ Links ]
De-Polli, H; A, Costantimf; R, Romanink y M. M, Pimentel. 2007. Chloroform fumigation – extraction labile C pool (Microbial biomass C plus) shows high correlations to microbial biomass C in Argentineans and Brazilian soils. C.I. Suelos (Argentina) 25:15-22. [ Links ]
Dick, R. 2009. Manipulating microorganisms to optimize ecosystems services. (Conference). “Hotel Nacional, La Habana, Cuba, 5 de Octubre 2009. 142 p. [ Links ]
Fließbach, A; Oberholzer, H-R; Gunst, L; Ma”der, P. 2006. Soil organic matter and biological soil quality indicators alter 21 years of organic and conventional farming. Agriculture, Ecosystems and Environment. 118:273-284. [ Links ]
Font, L; Calero, B; A del Castillo; P, Chaveli; M, Valenciano y A, Guevara. 2001. Estado microbiológico del suelo ferritico como base para la planificación, uso y manejo integral de agroecosistemas citricolas. In XV Congreso Latinoamericano y V Cubano de la Ciencia del Suelo. Centro de Convenciones Plaza América, Varadero, Cuba. 230 p. [ Links ]
Franzluebbers, AJ; Zuberer, DA; Hans, F. 1995. Comparison of microbiological methods for evaluating quality and fertility of soil. Biology and Fertility Soils 19:135-140. [ Links ]
Gómez, LA; Martínez, A; Guzmán, A. 1988. Biomasa bacteriana en suelos Ferralítico Rojo Típico. 1er Congreso Cubano del la Ciencia del Suelo. ESIB, Ciudad de La Habana, Cuba. 120 p. [ Links ]
Hernández, A; Pérez, JM; Marsán, R; Morales, M; López, R. 1999. Correlación de la nueva versión de clasificación genética de los suelos de Cuba, con clasificaciones internacionales (SOIL TAXONOMY y FAO-UNESCO) y clasificaciones nacionales (2da. clasificación genética y clasificación de series de suelos). 64 p. [ Links ]
Leckie, SE; Prescott, CE; Grayston, SJ; Newfeld, JD; Mohn, WW. 2004. Comparison of chloroforms fumigation – extraction, phospholipids fatty acid and DNA methods to determine microbial biomass in forest humus. Soil Biology and Biochemistry 36:529-532. [ Links ]
Mahmood, T; Ali, R; Hussain, F; Malik, KA; Tahir, GR. 2007. Seasonal changes in soil microbial biomass nitrogen under as irrigated wheat – maize cropping systems. Pakistan Journal of Botany 39:1751-1761. [ Links ]
Ministerio de la Agricultura (1979): NRAG266: 1979. Suelo, muestreo agroquímico.10 p. [ Links ]
Ministerio de la Agricultura (1980): NRAG372: 1980. Suelo, humedad natural. Determinación. 8 p. [ Links ]
Ministerio de la Agricultura (1987): NRAG878: 1987. Suelo, Análisis Químico. Determinación de los índices de acidez. 12 p. [ Links ]
Ministerio de la Agricultura (1988): NRAG879: 1988. Suelo, Análisis Químico. Determinación de los cationes intercambiables y de la capacidad de intercambio catiónico. 14 p. [ Links ]
Ministerio de la Agricultura (1988): NRAG892: 1988. Suelo, análisis químico. Determinación de los contenidos de fósforo y nitrógeno Total, % de materia orgánica y % de humus. 21 p. [ Links ]
Murata, T; Tanaka, H; Kurokawa, Y. 2006. Seasonal variations of labile organic carbon and fertility in grassland soil in Tokio Japan. ID. No. 948. Session 10. Soil Fertility:57-58. [ Links ]
Myrold, DD.1987. Relationship between microbial biomass nitrogen and a nitrogen availability index. Soil, Science Society of American, Journal 51:1047-1049. [ Links ]
Nathalie, W; Timothy, R; Bengough, J. 2007. New tools for motion analysis of time – lapse confocal laser scanning microscopy images: exploring the dynamics of Arabidopsis root growth. International Conference Rhizosphere 2, Montpellier France. 150 p. [ Links ]
Oulbachir, K ; A, Dellal ; A, Bekki. 2009. Les variations de la biomasse microbienne etudiée sous des environnementales différentes dans quatre sols superposés séparé a deux a deux par une croûte calcaire. European Journal of Scientific Research 36:407-417. [ Links ]
Powlson, DS; Brookes, PC; Christensen, BT. 1987. Measurement of soil microbial biomass provides an early indication of changes in total soil organic matter due to straw incorporation. Soil, Biology and Biochemistry 19:159-164. [ Links ]
Sallih, Z; Pansu, M. 1983. Modelling of Soil Carbon Forms after Organic Amendement under Controlled Conditions. Soil, Biology and Biochemistry 25:1755-1762. [ Links ]
Sparling, G. P. 1992. Ratio of microbial biomass carbon to soil organic carbon as a sensitive indicator of changes in soil organic matter. Australian Journal of Soil Research 30:195-207. [ Links ]
Vance, ED; Brookes, PC; Jenkinson, DS. 1987. An extraction method for measuring soil microbial C. Soil Biology and Biochemistry 19:703-708. [ Links ]
Wu, J; Brookes, PC; Jenkinson, DS. 1990. Measurement of soil microbial biomass C by fumigation extraction an automated procedure. Soil, Biology and Biochemistry 22:1167-1169. [ Links ]
Zvyagintsev, DG; Lukin, SA; Lishinkina, GA; Kozhevin, PA. 1984. A method for more accurate quantitative determination of soil microorganisms. Microbiology3:541-544. [ Links ]
*Correspondencia a:
Luís A. Gómez-Jorrin. Departamento de Nutrición y Agrobiología, Instituto de Suelos. Autopista Costa – Costa y Antigua Carretera de Vento, Capdevila, Boyeros, Ciudad de La Habana, Cuba. gomezjo@minag.cu
Amalia Morales-Valdes. Departamento de Nutrición y Agrobiología, Instituto de Suelos. Autopista Costa – Costa y Antigua Carretera de Vento, Capdevila, Boyeros, Ciudad de La Habana, Cuba. gomezjo@minag.cu
Graciela Dueñas-Vega. Departamento de Nutrición y Agrobiología, Instituto de Suelos. Autopista Costa – Costa y Antigua Carretera de Vento, Capdevila, Boyeros, Ciudad de La Habana, Cuba. gomezjo@minag.cu
Juana María Dantin-Martínez. Departamento de Nutrición y Agrobiología, Instituto de Suelos. Autopista Costa – Costa y Antigua Carretera de Vento, Capdevila, Boyeros, Ciudad de La Habana, Cuba. gomezjo@minag.cu
Nereida Chávez-Gonzalez. Departamento de Nutrición y Agrobiología, Instituto de Suelos. Autopista Costa – Costa y Antigua Carretera de Vento, Capdevila, Boyeros, Ciudad de La Habana, Cuba. gomezjo@minag.cu
Maite Torres-Leblanch. Instituto de Investigaciones Fundamentales de La Agricultura Tropical (INIFAT) Alejandro de Humbolt, Calle 1 y 2, Santiago de las Vegas, Boyeros, Ciudad de La Habana, Cuba. C.P 17 200.
1. El presente trabajo se desarrolló dentro del marco del proyecto de investigación PR 11-60 “Evaluación del Impacto de la FBN sobre la Fertilidad de los Suelos Ferralíticos Rojos en el sur de La Habana empleando Indicadores Biológicos”, el cual fue financiado por el Ministerio de la Agricultura de Cuba entre los años 2006 y 2009.
2. Departamento de Nutrición y Agrobiología, Instituto de Suelos. Autopista Costa – Costa y Antigua Carretera de Vento, Capdevila, Boyeros, Ciudad de La Habana, Cuba. gomezjo@minag.cu
3. Instituto de Investigaciones Fundamentales de La Agricultura Tropical (INIFAT) Alejandro de Humbolt, Calle 1 y 2, Santiago de las Vegas, Boyeros, Ciudad de La Habana, Cuba. C.P 17 200.
Alfonso, CA; Monederos, M; Calero, B; Guerrero, A y Somoza, V (1999). Recuperación de los suelos degradados dedicados a cultivos varios del agro-ecosistemas del sur de la Habana. Informe proyecto 002-00 021. CITMA. 42 p. [ Links ]
Azam, F; Farooq, S; Ladhi, A. 2003. Microbial biomass in Agricultural soils–determination, synthesis dynamics and role in plant nutrition. Pakistan Journal of Biological Sciences 6:629-639. [ Links ]
Beding, GD; Turner, MK; Rayus, F; Marx, MC; Wood, M. 2004. Microbial and biochemical soil quality indicators and their potential for differentiating areas under contrasting agricultural management regimes. Soil Biology and Biochemistry 36:1785-1792. [ Links ]
Bertaux, J; Gloger, U; Schmid, M; Hatmann, A; Scheu, S. 2007. Routine florescence in situ hybridation in soil. International Conference Rhizosphere 2, Montpellier France. 150 p. [ Links ]
Bouzaiane, O; Hassen, A; Jedidi, N. 2002. Détermination de la biomasse C et N par la méthode de fumigation extraction dans un sol amende de résidus organiques. In International Symposium on Environmental Pollution Control and Waste Management (Proceedings). EUPCOWM. Tunis. 416 p. [ Links ]
Brookes, PC; Landman, A; Pruden, G; Jenkinson DS. 1985. Chloroform fumigation and the release of soil nitrogen; a rapid direct extraction method to measure microbial biomasa nitrogen in soil. Soil Biology and. Biochemistry 17:837-842. [ Links ]
Calero, B; Guerrero, A; Alfonso, C; Somoza, V; Camacho, E. 1999. Efecto residual de la fertilización mineral sobre el estado microbiológico del suelo. La Ciencia y el hombre XI 33:89-94. [ Links ]
Carney, KH; Matson, PA. 2005. Plant communities, soil microorganisms and soil carbon cycling: Does altering the world belowground matter to ecosystem functioning. Ecosystems 8:928-940. [ Links ]
Chaveli, P; Font, L; Calero, B; Mendoza, L; Valenciano, M. 2001. Indicadores microbiológicos para la evaluación del impacto provocado por la erosión en un suelo pardo sin carbonato de la provincia de Camagüey, Cuba. In XV Congreso Latinoamericano y V Cubano de la Ciencia del Suelo. Centro de Convenciones Plaza América, Varadero, Cuba. 230 p. [ Links ]
Dell, CJ; Rice, CW. 2005. Short – term competition for ammonium and nitrate in tallgrass prairie. Soil Science Society and American Journal 69:371-377. [ Links ]
De-Polli, H; A, Costantimf; R, Romanink y M. M, Pimentel. 2007. Chloroform fumigation – extraction labile C pool (Microbial biomass C plus) shows high correlations to microbial biomass C in Argentineans and Brazilian soils. C.I. Suelos (Argentina) 25:15-22. [ Links ]
Dick, R. 2009. Manipulating microorganisms to optimize ecosystems services. (Conference). “Hotel Nacional, La Habana, Cuba, 5 de Octubre 2009. 142 p. [ Links ]
Fließbach, A; Oberholzer, H-R; Gunst, L; Ma”der, P. 2006. Soil organic matter and biological soil quality indicators alter 21 years of organic and conventional farming. Agriculture, Ecosystems and Environment. 118:273-284. [ Links ]
Font, L; Calero, B; A del Castillo; P, Chaveli; M, Valenciano y A, Guevara. 2001. Estado microbiológico del suelo ferritico como base para la planificación, uso y manejo integral de agroecosistemas citricolas. In XV Congreso Latinoamericano y V Cubano de la Ciencia del Suelo. Centro de Convenciones Plaza América, Varadero, Cuba. 230 p. [ Links ]
Franzluebbers, AJ; Zuberer, DA; Hans, F. 1995. Comparison of microbiological methods for evaluating quality and fertility of soil. Biology and Fertility Soils 19:135-140. [ Links ]
Gómez, LA; Martínez, A; Guzmán, A. 1988. Biomasa bacteriana en suelos Ferralítico Rojo Típico. 1er Congreso Cubano del la Ciencia del Suelo. ESIB, Ciudad de La Habana, Cuba. 120 p. [ Links ]
Hernández, A; Pérez, JM; Marsán, R; Morales, M; López, R. 1999. Correlación de la nueva versión de clasificación genética de los suelos de Cuba, con clasificaciones internacionales (SOIL TAXONOMY y FAO-UNESCO) y clasificaciones nacionales (2da. clasificación genética y clasificación de series de suelos). 64 p. [ Links ]
Leckie, SE; Prescott, CE; Grayston, SJ; Newfeld, JD; Mohn, WW. 2004. Comparison of chloroforms fumigation – extraction, phospholipids fatty acid and DNA methods to determine microbial biomass in forest humus. Soil Biology and Biochemistry 36:529-532. [ Links ]
Mahmood, T; Ali, R; Hussain, F; Malik, KA; Tahir, GR. 2007. Seasonal changes in soil microbial biomass nitrogen under as irrigated wheat – maize cropping systems. Pakistan Journal of Botany 39:1751-1761. [ Links ]
Ministerio de la Agricultura (1979): NRAG266: 1979. Suelo, muestreo agroquímico.10 p. [ Links ]
Ministerio de la Agricultura (1980): NRAG372: 1980. Suelo, humedad natural. Determinación. 8 p. [ Links ]
Ministerio de la Agricultura (1987): NRAG878: 1987. Suelo, Análisis Químico. Determinación de los índices de acidez. 12 p. [ Links ]
Ministerio de la Agricultura (1988): NRAG879: 1988. Suelo, Análisis Químico. Determinación de los cationes intercambiables y de la capacidad de intercambio catiónico. 14 p. [ Links ]
Ministerio de la Agricultura (1988): NRAG892: 1988. Suelo, análisis químico. Determinación de los contenidos de fósforo y nitrógeno Total, % de materia orgánica y % de humus. 21 p. [ Links ]
Murata, T; Tanaka, H; Kurokawa, Y. 2006. Seasonal variations of labile organic carbon and fertility in grassland soil in Tokio Japan. ID. No. 948. Session 10. Soil Fertility:57-58. [ Links ]
Myrold, DD.1987. Relationship between microbial biomass nitrogen and a nitrogen availability index. Soil, Science Society of American, Journal 51:1047-1049. [ Links ]
Nathalie, W; Timothy, R; Bengough, J. 2007. New tools for motion analysis of time – lapse confocal laser scanning microscopy images: exploring the dynamics of Arabidopsis root growth. International Conference Rhizosphere 2, Montpellier France. 150 p. [ Links ]
Oulbachir, K ; A, Dellal ; A, Bekki. 2009. Les variations de la biomasse microbienne etudiée sous des environnementales différentes dans quatre sols superposés séparé a deux a deux par une croûte calcaire. European Journal of Scientific Research 36:407-417. [ Links ]
Powlson, DS; Brookes, PC; Christensen, BT. 1987. Measurement of soil microbial biomass provides an early indication of changes in total soil organic matter due to straw incorporation. Soil, Biology and Biochemistry 19:159-164. [ Links ]
Sallih, Z; Pansu, M. 1983. Modelling of Soil Carbon Forms after Organic Amendement under Controlled Conditions. Soil, Biology and Biochemistry 25:1755-1762. [ Links ]
Sparling, G. P. 1992. Ratio of microbial biomass carbon to soil organic carbon as a sensitive indicator of changes in soil organic matter. Australian Journal of Soil Research 30:195-207. [ Links ]
Vance, ED; Brookes, PC; Jenkinson, DS. 1987. An extraction method for measuring soil microbial C. Soil Biology and Biochemistry 19:703-708. [ Links ]
Wu, J; Brookes, PC; Jenkinson, DS. 1990. Measurement of soil microbial biomass C by fumigation extraction an automated procedure. Soil, Biology and Biochemistry 22:1167-1169. [ Links ]
Zvyagintsev, DG; Lukin, SA; Lishinkina, GA; Kozhevin, PA. 1984. A method for more accurate quantitative determination of soil microorganisms. Microbiology3:541-544. [ Links ]
*Correspondencia a:
Luís A. Gómez-Jorrin. Departamento de Nutrición y Agrobiología, Instituto de Suelos. Autopista Costa – Costa y Antigua Carretera de Vento, Capdevila, Boyeros, Ciudad de La Habana, Cuba. gomezjo@minag.cu
Amalia Morales-Valdes. Departamento de Nutrición y Agrobiología, Instituto de Suelos. Autopista Costa – Costa y Antigua Carretera de Vento, Capdevila, Boyeros, Ciudad de La Habana, Cuba. gomezjo@minag.cu
Graciela Dueñas-Vega. Departamento de Nutrición y Agrobiología, Instituto de Suelos. Autopista Costa – Costa y Antigua Carretera de Vento, Capdevila, Boyeros, Ciudad de La Habana, Cuba. gomezjo@minag.cu
Juana María Dantin-Martínez. Departamento de Nutrición y Agrobiología, Instituto de Suelos. Autopista Costa – Costa y Antigua Carretera de Vento, Capdevila, Boyeros, Ciudad de La Habana, Cuba. gomezjo@minag.cu
Nereida Chávez-Gonzalez. Departamento de Nutrición y Agrobiología, Instituto de Suelos. Autopista Costa – Costa y Antigua Carretera de Vento, Capdevila, Boyeros, Ciudad de La Habana, Cuba. gomezjo@minag.cu
Maite Torres-Leblanch. Instituto de Investigaciones Fundamentales de La Agricultura Tropical (INIFAT) Alejandro de Humbolt, Calle 1 y 2, Santiago de las Vegas, Boyeros, Ciudad de La Habana, Cuba. C.P 17 200.
1. El presente trabajo se desarrolló dentro del marco del proyecto de investigación PR 11-60 “Evaluación del Impacto de la FBN sobre la Fertilidad de los Suelos Ferralíticos Rojos en el sur de La Habana empleando Indicadores Biológicos”, el cual fue financiado por el Ministerio de la Agricultura de Cuba entre los años 2006 y 2009.
2. Departamento de Nutrición y Agrobiología, Instituto de Suelos. Autopista Costa – Costa y Antigua Carretera de Vento, Capdevila, Boyeros, Ciudad de La Habana, Cuba. gomezjo@minag.cu
3. Instituto de Investigaciones Fundamentales de La Agricultura Tropical (INIFAT) Alejandro de Humbolt, Calle 1 y 2, Santiago de las Vegas, Boyeros, Ciudad de La Habana, Cuba. C.P 17 200.
Recibido: 11 de enero, 2011. Aceptado: 12 de marzo, 2012.