Introducción
Se conoce a la periodontitis como una enfermedad crónica no transmisible, asociada a una biopelícula disbiótica. Está caracterizada por la destrucción progresiva del aparato de soporte dental y con un impacto severo en la calidad de vida. En la actualidad, en su clasificación se establecen cuatro estadios y tres grados que dependen de la severidad, la complejidad y del tipo de progresión. Las formas severas de la enfermedad implican una pérdida de inserción interdental mayor o igual a 5 mm, pérdida de hueso que se extiende hasta el tercio medio o apical de la raíz y pérdida dental, mayor o igual a 4. Más específicamente, las características de la periodontitis de Grado C son: progresión rápida, con pérdidas de PS y NIC mayores a los 2 mm en los últimos cinco años, niveles de placa bajos con relación a la cantidad de pérdida ósea y patrones que sugieren una progresión rápida o un inicio temprano de la enfermedad (Papapanou PN.,2018).
Se ha demostrado que el tratamiento periodontal no quirúrgico (fase higiénica y activa) detiene la actividad de la enfermedad en la mayoría de los pacientes con periodontitis, en especial en combinación con cuidados adecuados de mantenimiento (Rosalem W.,2011). Pero en algunos casos, puede producirse una escasa respuesta al tratamiento, relacionada con la permanencia de especies bacterianas en las bolsas periodontales después del desbridamiento. Es posible encontrar: Agregatibacter actinomycetemcomitans (A. actinomycetemcomitans), Porphyromona gingivalis (P. gingivalis), Tannerella forsythia (T. forsythia), Treponema denticola (T. denticola), entre otros (Colombo AP.,2011, Usin MM.,2016).
Si bien las enfermedades periodontales son multifactoriales, uno de los componentes de la etiopatogenia, es la presencia de biomasas bacterianas agresivas. Estas prevalecen en algunas lesiones, sobre-todo a ciertas edades y en diversos tipos de periodontitis. En pacientes jóvenes, hay poca evidencia de la recuperación de la salud periodontal para los casos severos generalizados, con riesgo de pérdida dental, manejados con tratamiento periodontal y seguimiento prolongado. Nos propusimos evaluar la evolución de la respuesta clínica y la composición microbiológica de bolsas periodontales a lo largo de cinco años. El seguimiento fue de una paciente joven con periodontitis estadio III grado C generalizada. El tratamiento fue terapia periodontal no quirúrgica y quirúrgica utilizando material regenerativo (amelogeninas (EDM®) y un sustituto óseo (Bio-Oss®)
Presentación del caso clínico
Paciente de sexo femenino de 19 años de edad al momento de la consulta, sistémicamente sana, de profesión diseñadora gráfica, con movilidad grado 2 en los dientes anteriores superiores e inferiores. Al examen clínico exhibía recesiones gingivales generalizadas, escasas manifestaciones clínicas con bajo grado de inflamación. El biofilm se presentaba delgado, poco calcificado no correspondiéndose con la magnitud de la destrucción. Según los criterios establecidos en el Workshop Mundial sobre la clasificación de enfermedades y alteraciones periodontales y periim-plantares del año 2017, este caso se diagnosticó como Periodontitis Grado C, estadio III generalizada (Papapanou PN, 2018).
Se elaboró una historia clínica odontológica completa con radio- grafías seriadas y ficha Periodontal (Florida, Go-Probe®). En la Figura 1 (1a) se muestra la condición clínica al momento de la primera consulta con un registro de 45,4% de placa bacteriana (PB) y 48,3% de hemorragia (H). Con sonda manual, CP15 Hu-Friedy, se midió la pérdida de inserción clínica (NIC) y la profundidad de sondaje (PS) expresada en milímetros (mm). En figura 1b se muestra la ficha periodontal donde se presentan los sitios con PS mayor a 6 mm, NIC ≥5mm y movilidad grado 2 en incisivos superiores e inferiores.
En la figura 2 se pueden observarse las radiografías seriadas de boca completa pretratamiento. Antes de iniciar la terapia, la paciente firmó un consentimiento aceptando las prácticas que se le realizarían y la aceptación de cirugías. El estudio fue realizado acorde a la Declaración Helsinki de los Derechos de los Pacientes.
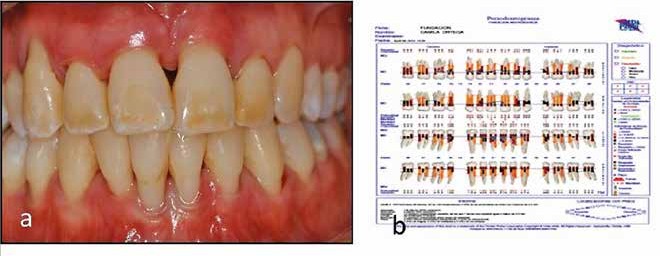
Figura 1: Estado Inicial. a-examen clínico con escasas manifestaciones clínicas y biofilm poco calcificado; b- ficha periodontal (Florida, Go-Probe®) bolsas periodontales con Profundidad de sondaje > a 6 mm y pérdida de Inserción clínica ≥5 mm. Con diagnóstico de Periodontitis grado C, estadío III generalizada.
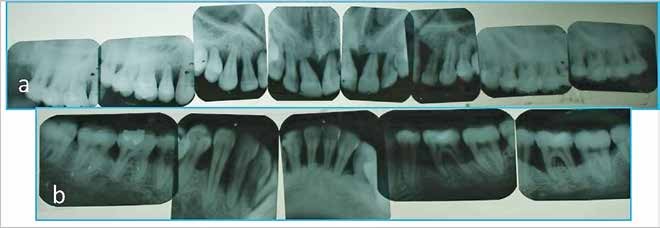
Figura 2a y 2b: Examen radiográfico seriado pre tratamiento. Arriba a la izquierda se ubican los sitios 25 al 27 y abajo a la izquierda los sitios 45 al 47.
Se examinaron seis sitios por diente y se calculó la frecuencia de bolsas periodontales mayores y menores de 5 mm. Se extrajo material de la profundidad de cada bolsa con conos endodónticos. Para ello, en primer lugar se eliminó la placa supragingival y luego se insertaron seis puntas de papel estéril N° 30i por sitio. La maniobra se realizó de a uno por vez, hasta la parte inferior de la bolsa periodontal y permaneció 30 segundos con movimiento de cateterismo. Las puntas de papel, de un mismo sitio se transfirieron a un microtubo estéril que contenía 200 ml de solución salina tamponada con fosfato. Las muestras recolectadas se almacenaron a 20°C hasta ser analizadas por la reacción de amplificación de la polimerasa de punto final, mediante oligonucleótidos específicos para cada una de las bacterias antes mencionadas. El ADN de las muestras subgingivales se aisló según métodos convencionales (Ashimoto A,1986).
Las variables de pronóstico clínico establecidas en este estudio fueron los cambios de PS, NIC, H y PB y cantidad de bolsas periodontales mayores y menores de 5mm, y a la presencia/ausencia de cada una de las bacterias periodontales. Cada medición tomada en la primera visita se consideró la línea de base, se repitieron en cada momento de la consulta: a los 1, 3 y 6 meses después del tratamiento periodontal y a los 6, 36 y 60 meses post cirugía.
1- Fase etiológica
Se realizó motivación, instrucción de técnica de higiene oral, raspaje y alisado radicular progresivo. Se indicó el uso de enjuagatorios con digluconato de clorhexidina al 0,12%, 15ml durante 30 segundos, 2 veces por día, después de media hora de la rutina de la higiene bucal durante 60 días, comenzando a posterior de la primera sesión de debridamiento mecánico. También se indicó la administración por vía sistémica de Amoxicilina 875 mg y Metronidazol 500 mg cada 12 horas, durante 7 días, a partir de la primera sesión de raspaje y alisado radicular (Romito GA., 2020). Se controló la evolución al mes a los 3 meses y a los 6, registrando los parámetros clínicos (PB, H, PS, NIC), remotivación y raspaje. Para la identificación microbiológica, se tomaron muestras de PB subgingival de los mismos sitios estudiados a los 30 días, 3 y 6 meses post terapia inicial.
2- Fase correctiva:
En los sitios con bolsas residuales mayores a 5mm y con defectos infraóseos se realizó terapia quirúrgica. En el sector antero-inferior y antero-superior se realizó la técnica de colgajo de acceso. Debido a las características anatómicas del defecto se colocaron amelogeninas (EDM®, Biora AB, Malmo, Sweden) en los sectores 15 al 17 y del 45 al 47, (Figura 3).
En los dientes 25 al 27 y 35 al 36 se aplicó hueso esponjoso regenerativo (Bio-Oss®, Geistlich Bio- Oss®G Eistlich-Pharma AG, Wolhusen, Switzerland) (Silva-Senem MX.,2013) (Figura 4).
3- Fase de mantenimiento periodontal
Para mantener la salud oral y favorecer la reparación de los tejidos periodontales tratados, la paciente ingresó a un programa de mantenimiento que consistió en evaluaciones trimestrales durante el primer año y semestrales en los años posteriores, a fin de evitar la recidiva de la enfermedad.
En cada visita se re-evaluaron los parámetros clínicos periodontales (PB, H, PS, NIC) y se tomaron muestras de PB subgingival de los mismos sitios estudiados a los 6 meses, 36 meses (3 años) y 60 meses (5 años) post terapia quirúrgica para la identificación de bacterias periodontales.
Mediante el software Infostat/ P2018 se aplicó el test chi cuadrado para analizar la diferencia de PB, H, cantidad de bolsas periodontales según su profundidad y el porcentaje de bacterias presentes desde el inicio y en cada uno de las intervenciones. La diferencia después de la cirugía se comparó usando el test Kruskal-Wallis y para PS y NIC se utilizó el test t de Student. Se consideró como nivel de significación un valor p<0.05 y un poder del 80%.
Se observó una mejoría significativa de todos los parámetros clínicos al mes de iniciado el tratamiento. Éstos mantuvieron modificaciones leves hasta los 6 meses. En la Tabla 1 se observa que la diferencia de PB entre el inicio y 6 meses representó un 35,06% (p=0,001), y de H un 42,8% de disminución (p=0,001). Luego de la cirugía la mejoría evidenció un 1,78 % para PB y 0,63% para H (p<0,05). Desde el inicio hasta el quinto año de control, la PB disminuyó un 36,84% y la H 43,43%. Las bolsas periodontales con profundidades mayores a 5 mm disminuyeron al ir observándose un incremento proporcional en el número de bolsas menores a 5 mm.
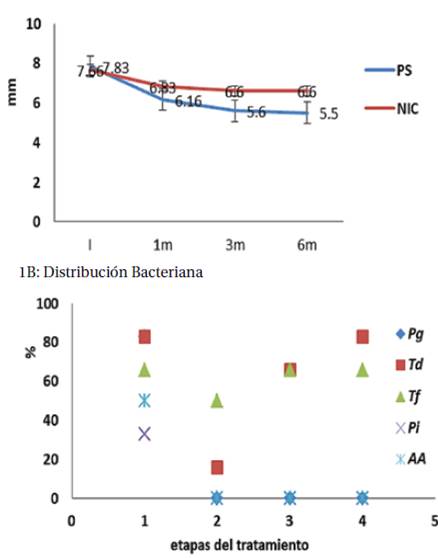
En el gráfico 1A se observan los valores de PS y NIC registrados hasta los 6 meses y en el gráfico 2A los valores según el tipo de cirugía aplicada hasta los 60 meses. A los 6 meses de iniciado el tratamiento periodontal la PS disminuyó en promedio 2,5mm para los dientes 16 y 36. Los dientes 21 y 32 mejoraron en 1,5mm y los dientes 26 y 46 lo hicieron en 3 mm. En el gráfico 2A se observa que luego de realizada la cirugía la PS mejoró en 2,5 mm cuando se trató con sustituto óseo, 1,5 mm con colgajo de acceso y 1,5 con amelogeninas. En total la PS disminuyó en todo el tratamiento, 5 mm para el sustituto óseo, 3mm para colgajo de acceso y 4,5 mm con amelogeninas.
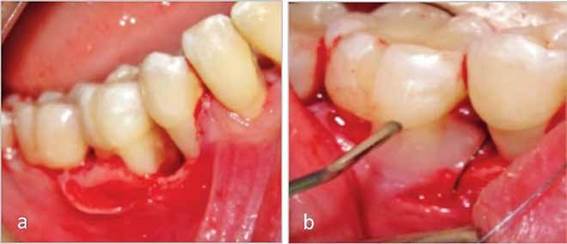
Figura 3 A Colgajo Periodontal y 3B Colocación de amelogeninas (EDM®, Biora AB, Sweden) en los sectores 15 al 17 y del 45 al 47.
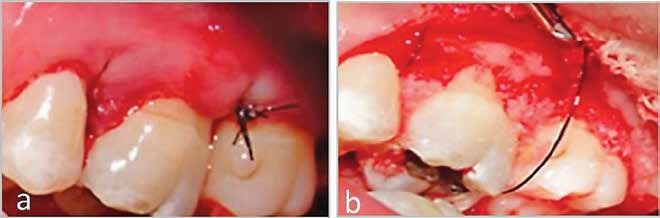
Figura 4 a Colgajo Periodontal y 4b- Colocación hueso esponjoso regenerativo (Bio-Oss®, Geistlich Bio-Oss®, Switzerland) en el tratamiento del defecto óseo angular en el sector 3 (en 25 al 27 y 35 al 36).
Tabla 1 Registro de placa bacteriana, hemorragia y bolsas periodontales en los distintos momentos del tratamiento
| Momentos | PB | H | Bolsas >5mm | Bolsas <5mm |
| Inicio | 45,4 | 48,3 | 80 (47,6) | 88 (51,9) |
| 1m | 11,6 | 8,46 | 45 (26,5) | 123 (72,6) |
| 3m | 8,9 | 7,49 | 33 (19,5) | 135 (79,6) |
| 6 m | 10,34 | 5,5 | 28(16,5) | 140 (82,6) |
| 6 m PC | 5,68 | 3,12 | 9 (5,3 | 159 (93,8) |
| 36 m PC | 8,6 | 5,95 | 7 (4,1) | 161 (94,9) |
| 60 m PC | 8,56 | 4,87 | 7 (4,1) | 161 (94,9) |
m: meses; PC pos cirugía, PB placa bacteriana, H hemorragia, Los números expresan la cantidad de bolsas y entre paréntesis el porcentaje.
1A: muestra los valores medios de Profundidad de Sondaje (PS) y Nivel de inserciónn clínica (NIC) en los diferentes momentos del tratamiento I inicial, 1m: un mes, 3m a los tres meses, 6m evaluación a los seis meses-Las barras verticales representan el error estándar. 1B frecuencia expresada como porcentaje de bacterias identificadas en cada momento del tratamiento. Se consideró el 100% a la totalidad de las bolsas analizadas I: Inicial, 2, 1 mes de iniciado el tratamiento; 3 a los 3 meses, 4 a los 6 meses. Pg Porphyromona gingivales, Td: Treponema denticola, Tf Tannerella forsythia; Pi Prevotella intermedia, AA Agregatibacter actinomycetemcomitans
A los 6 meses de iniciado el tratamiento periodontal, los valores registrados de NIC muestran una ganancia de 1,5mm para el sector 1 y 4. Para los sectores 2 y 5 fue de 0.5 mm y en los sectores 3 y 6 el cambio fue de 2 mm (Gráfico 1A). Luego de realizado la cirugía el NIC ganó 3,5 mm cuando se trató con sustituto óseo, 1,5mm con colgajo de acceso y 2,5mm con amelogeninas. En los cinco años la mejora en NIC fue: 5 mm con sustituto óseo, 2 mm con colgajo de acceso y 4,5 mm con amelogeninas (Gráfico 2A).
En el gráfico 1B se presentan las bacterias identificadas por biología molecular en los sitios seleccionados. Se observó que la frecuencia de T.denticola y T.forsythia persistió en la mayoría de las bolsas periodontales hasta los 6 meses. Se apreció una disminución en la variedad de especies bacterianas, con una consecuente mejoría en los valores medios de PS y NIC a lo largo del tratamiento. En el gráfico 2B se observa que luego de las diferentes cirugías realizadas, no se detectaron bacterias periodontales en la primera evaluación clínica (6 meses PC). En todas las bolsas tratadas con colgajo de acceso y en el 50% de las bolsas tratadas con sustituto óseo, se observó que T.denticola repuebla los sitios tratados luego de 36 meses. Las bolsas donde el manejo fue con amelogeninas no mostraron flora bacteriana hasta los 60 meses, momento en que se identificó nuevamente T.denticola.
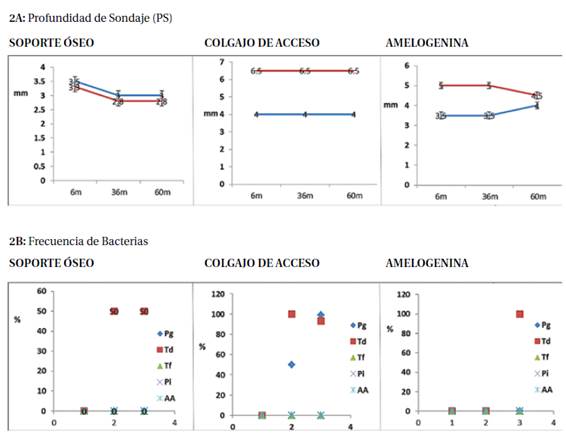
Grafico N2 Frecuencia bacteriana, NIC y PS según la cirugía realizada- 2A: Profundidad de Sondaje (PS)
2A, representa los valores medios de Profundidad de Sondaje (PS) y Nivel de inserciónn clínica (NIC) en los diferentes momentos post cirugía 6m 6 meses despúes de la cirugía, 36m a los 36 posteriores; 60 meses. Las barras verticales representan el error estándar. 2B muestra la frecuencia de bacterias identificadas en cada momento del tratamiento expresada como porcentaje (%).Se consideró el 100% a la totalidad de las bolsas analizadas. 2 indica la revisión a los 36 meses post cirugía. Pg Porphyromona gingivales, Td: Treponema denticola, Tf Tannerella forsythia; Pi Prevotella intermedia, AA Agregatibacter actinomycetemcomitans.
A. actinomycetemcomitans se encontró en el 50% de las bolsas estudiadas mientras que P intermedia se identificó en el 33% al inicio del tratamiento. Ambas bacterias no se volvieron a identificar a posteriori bajo ningún tipo de tratamiento aplicado. La disminución de la cantidad y variedad de especies bacterianas se acompaña con la mejoría en los valores de PS y NIC (gráfico 1 y 2).
Discusión
En este trabajo longitudinal, se observa que fue posible conservar toda la dentadura definitiva de la paciente, brindando estabilidad a los dientes en forma satisfactoria. Se evitó el avance de la patología periodontal y se procuró el mantenimiento de los resultados obtenidos. Además, se logró una mejora significativa en los niveles de PS y NIC, con lo que podemos especular que se debió a un cambio en la composición de la flora bacteriana a una más compatible con salud periodontal.
Muchos estudios refieren mejores resultados en relación a la ganancia de NIC posterior al tratamiento no quirúrgico, aunque son reportes de seguimientos cortos (Roshna T.,2013). Estudios de seguimiento por largo tiempo muestran que la falta de mantenimiento conduce a pérdidas de NIC ganado (9). Es necesario recordar que varios autores consideran al NIC como medida de información pasada, mientras que otros consideran a la PS como una variable más exacta sobre la progresión de la actividad (Page RC., 2007, Rodrigues AS.,2012). En nuestro caso, la disminución de PS fue de alrededor de 5 mm y ganancia de NIC de 3,16 mm al final del quinto año de terapias.
Aunque en la actualidad es un tema controversial y de discusión científica, en este trabajo se ha determinado que el uso conjunto de antibióticos como amoxicilina y metronidazol asociado al tratamiento no quirúrgico, implicó una reducción significativa de patógenos asociados a periodontitis severas (Romito GA.,2013, Artzi Z.,2015). El control de la proliferación de especies agresivas se acompañó de una mejora en los parámetros clínicos (Artzi Z.,2015). Observamos una disminución significativa de bacterias virulentas.
Sin embargo, los antibióticos indicados no afectaron a T.denticola y T.forsythia. En la visita del mes de tratamiento, se observó una disminución de la presencia de estos patógenos para luego volver a ser identificados en todas las evaluaciones posteriores a la cirugía. En un estudio con 15 pacientes con periodontitis agresiva y seis meses de duración, se describió que las frecuencias de P.gingivalis y T.forsythia disminuyeron significativamente al primer mes después del uso de antibióticos en comparación con el valor inicial. La disminución de la frecuencia de P.gingivalis también fue estadísticamente significativa entre el momento de la reevaluación y el primer mes después de la administración de antibióticos (Rodrigues AS.,2012).
En el presente caso, los defectos infraóseos no pudieron ser tratados únicamente con raspaje y alisado radicular, sino que además, requirieron abordaje quirúrgico. Después de la terapia periodontal, las bolsas periodontales remanentes tienen la capacidad de formar nichos ecológicos que alojan bacterias. En estos casos, la terapia periodontal quirúrgica (de resección, de regeneración o ambos) reduce o elimina las bolsas asociadas a los defectos infraóseos o angulares, logrando regeneración del sitio involucrado (Proussaefs P.,2003). El uso de materiales regenerativos, injertos óseos, membranas de barrera y agentes para la cicatrización de heridas se utilizan frecuentemente y producen una mejoría significativa (Froum S.,2002), y logran evitar una recolonización inmediata de especies patógenas, como fue observado en este caso clínico,.
Se confirmó que el tratamiento regenerativo que incluye hueso bovino, matriz inorgánica en el tratamiento de los defectos infraóseos, produce una reducción significativa de la bolsa periodontal, ganancia de inserción y relleno óseo mayor, en comparación con la cirugía de colgajo de acceso (Zuchelli G.,2003). Froum et al. observaron ganancia del NIC de 4,3 mm y de hueso de 3,8 mm después de la aplicación de hueso bovino mineralizado en defectos intraóseos (Froum S.,2002). En el presente estudio, obtuvimos una ganancia de 3,5 mm de NIC a los cinco años de tratamiento. Varios autores, describen que combinando técnicas quirúrgicas mínimamente invasivas como amelogeninas se obtiene una reducción significativa de la PS (3,17±0,6 mm), también afirman que se produce una mejora del NIC con una ganancia promedio de 4,05mm y con una mínima recesión gingival (Froum S.,2002, Zuchelli G.,2003). Todos los estudios muestran resultados significativamente positivos en términos de reducción de PS y de ganancia de NIC respecto a las mediciones prequirúrgicos como fue observado en este caso.
Está establecido que el tratamiento periodontal sin una apropiada terapia de soporte es poco valioso (Cortellini P.,2017). La disciplina que debe manifestar el paciente hacia la terapia periodontal es esencial para evitar la recurrencia, que es alta entre los individuos que incumplen. El deterioro, en estos pacientes, se muestra similar a sujetos con EP no tratados y continúa el retroceso, aunque a una velocidad menor (Cortellini P.,2015). En este estudio, la terapia periodontal de apoyo fue adaptada al paciente basado en la susceptibilidad, la historia médica, la severidad inicial y respuesta a la cirugía periodontal con seguimiento cada dos meses hasta los 6 meses y controles subsecuentes cada seis meses hasta los cinco años logrando de este modo conservar la dentición.
Conclusión
El tratamiento periodontal no quirúrgico combinado con antibióticos, cirugía en los sitios requeridos y mantenimiento, resulta exitoso. La mejoría de los parámetros clínicos se observa paralela a los cambios en la calidad de la microbiota. El principal objetivo del tratamiento, es modificar la microbiota subgingival patogénica a no patogénica, y prevenir la repoblación de la placa subgingival por bacterias virulentas. Sin embargo, los sitios tratados tienden a ser recolonizados por bacterias patógenas. El tratamiento periodontal ideal no sólo ha de prevenir la pérdida de inserción, sino también promover la reparación de los tejidos de soporte del diente, evitando la recolonización de especies patógenas (Cortellini P.,2019).
La aplicación de diferentes técnicas de recuperación de la salud del periodonto en una misma paciente y el seguimiento de la composición microbiológica de los sitios tratados, evidenció que la calidad de la flora bacteriana que repuebla las bolsas es responsable de la mejoría de los parámetros periodontales. De modo que, una terapia de soporte que incluya motivación y refuerzo de higiene oral cada seis meses, es clave para garantizar el éxito del tratamiento.
Agradecimientos:
Los autores quieren agradecer a la paciente por su disposición.
Financiamiento
El trabajo fue financiado en parte por fondos de SECyT- UNC y per- sonales.
María M. Usin 1 ; Sandra Tabares 2 ; Estela Ribotta de Albera 3 ; Adela Sembaj 2* .
1- Cátedra B Periodoncia, Facultad de Odontología, Universidad Nacional de Córdoba. bachiusin@hotmail.com
2- Cátedra de Bioquímica y Biología Molecular, Facultad de Ciencias Médicas, Universidad Nacional de Córdoba.marcelasandry@yahoo.com.ar
3- Fundación Independencia, Facultad de Odontología, Universidad Nacional de Cuyo. estela.albera@gmail.com
*Corresponding author: Adela Sembaj. Cátedra de Bioquímica y Biología Molecular, Facultad de Ciencias Médicas, Universidad Nacional de Córdoba.
Segundo Piso Pabellón-Argentina Ciudad Universitaria. Córdoba Argentina. asembaj@biomed.uncor.edu 54-9-351 4333024.
Argentina