Introducción
El cáncer oral ocasiona problemas de salud a escala mundial y junto con el cáncer faríngeo alcanzan el 6to lugar entre todos los tipos de neoplasias malignas, de las cuales la más frecuente en la cavidad bucal es el carcinoma oral de células escamosas (COCE). La etiología de COCE es multifactorial y se asocia a tabaquismo, alcoholismo, genética, historia familiar de cáncer, infección por virus papiloma humano e inflamación crónica. El COCE presenta una prevalencia alrededor de un 90% de todos los tipos de cáncer oral y durante la década pasada su incidencia aumentó en un 50%. Además, se incrementa con los años y la mayoría afecta a mayores de 40 años (Fernández et ál., 2015). De manera global es responsable de 145.000 muertes cada año y su tasa de supervivencia no ha variado con respecto a la década pasada y es de 53-56% a los 5 años (Gupta et ál., 2016). La ubicación más común del COCE es en el borde lateral de la lengua y este se asocia con mayor frecuencia a metástasis ganglionares (Azimi et ál., 2014). La tasa de sobrevida de personas afectadas por COCE varía según el tratamiento recibido, suele ser de un 58% en individuos tratados con cirugía y quimioterapia, de un 40% bajo cirugía y radioterapia, y de un 10% cuando son solamente tratados con quimioterapia más radioterapia o sólo radioterapia a los 5 años (Gupta et ál.). Los datos de sobrevida y de muerte asociada a COCE expuestos, se deben principalmente a que su diagnóstico se realiza en etapas avanzadas de su desarrollo (Rhodus et ál., 2014). La invasión de las células epiteliales neoplásicas a otros tejidos y el pronóstico de COCE se han asociado, entre otras cosas, con la presencia de inflamación en el frente de invasión del tumor. Incluso, la presencia de hinchazón intensa en muestras histopatológicas de COCE lingual complica el pronóstico en mayores de 60 años (Seppälä et ál., 2015). Sin embargo, actualmente no está claramente establecido si la respuesta inmune del infiltrado inflamatorio en el ambiente de COCE afecta el comportamiento del tumor (Quan et ál., 2016).
La periodontitis crónica es la patología infecciosa e inflamatoria que destruye el tejido periodontal, y es altamente prevalente en ambos sexos y en mayores de 40 años (Rhodus et ál.). Está asociada con el aumento de la presencia de las bacterias del grupo rojo en la placa subgingival Porphyromonas gingivalis, Tannerella forsythia y Treponema denticola, que desencadenan una respuesta inflamatoria activando la respuesta inmune innata y adaptativa del hospedero, y esta es la razón por la cual se cree que se asocia con el cáncer oral, (Eke et ál., 2016), (Silva et ál., 2015), (Moraes et ál., 2016). Actualmente, la evidencia sugiere que los individuos con diagnóstico de periodontitis presentan un riesgo elevado de desarrollar cáncer oral (HR 1,79, 95%CI:1.42-2.25), (Wen et ál., 2014). Incluso, los pacientes con pérdida de inserción clínica mayor a 1,5 mm. presentan un aumento de la incidencia y de riesgo de desarrollar lesiones potencialmente malignas (OR 1,55) y malignas en la cavidad oral (OR 4,57). Además, el riesgo de desarrollar cáncer oral aumenta cuando los individuos presentan el hábito de tabáquico, alcoholismo y pérdida dentaria sin su sustitución (OR 12,89), comparado cuando no fuman, no beben alcohol y no han perdido dientes (Missih, 2013). Además, la periodontitis crónica aumenta el riesgo de mortalidad por cáncer orodigestivo (RR 2.28, 95% CI: 1.17-4.45) y esta aumenta a mayor severidad de la enfermedad periodontal (valor-p: 0.01), (Ahn et ál., 2012).
El objetivo de la presente revisión es describir los efectos de la periodontitis en el comportamiento del carcinoma oral de células escamosas.
Método
Los datos utilizados en esta revisión narrativa, fueron extraídos de la base de datos PubMed, EBSCO Discovery y SCIELO utilizando los siguientes términos: “oral cáncer”, oral cavity, y “periodontitis” abarcando la literatura en español y en inglés más citada por la mayoría de los autores que han tratado el tema.
Resultados
Infiltrado inflamatorio en el carcinoma oral de células escamosas
La presencia de infiltrado inflamatorio del sistema inmune innato y adaptativo en el microambiente de COCE modifica la progresión, carácter fuerte y pronóstico del tumor. Al respecto, se ha determinado que los neutrófilos aumentan la invasión de COCE mediante el aumento en el número de invadopodia de las células epiteliales neoplásicas y por estimular la degradación de la matriz extracelular.
Además, tanto los neutrófilos como las células tumorales del COCE secretan IL-8 y TNF alfa; sin embargo, cuando son cultivados juntos se produce un mecanismo co-estimulatorio, incrementado los valores de IL-8 y TNF alfa (Glogauer et ál., 2015). La presencia de abundantes eosinófilos en el estroma del COCE puede favorecer su invasión, considerándose un factor que determina un mal pronóstico (Jain et ál., 2014). Particularmente, la proteína catiónica eosinofílica del eosinófilo provoca cambios morfológicos en líneas celulares de COCE, tales como vacuolización y pérdida de la adhesión. Además, el aumento de la concentración de proteína catiónica eosinofílica disminuye la viabilidad celular de COCE (De Lima et ál. 2015). En el microambiente de COCE los macrófagos se pueden encontrar en fenotipo M1 y M2 (Costa et ál., 2013). El primero corresponde al estado del macrófago en el cual su función es principalmente inmune. El segundo, a un estado opuesto al anterior, es decir, los macrófagos sintetizan citocinas pro-angiogénicas. Muestras histológicas de COCE presentan un alto porcentaje de macrófagos comparados con muestras histológicas de individuos sanos; no obstante, es importante destacar que entre quienes poseen COCE la densidad de macrófagos es mayor en los que presentan metástasis comparados con los que no la tienen, (Mori et ál., 2011). El tiempo de sobrevida es menor en gente con altos niveles de macrófagos en el espesor de COCE (44 meses), comparado con quienes tienen bajos niveles de macrófagos (93 meses). Por lo tanto, el fenotipo M2 en el microambiente de COCE puede favorecer una respuesta inmunosupresiva, induciendo la invasión a distancia de COCE y reduciendo la sobrevida de los afectados (Costa et ál., 2011). Por otro lado, los macrófagos en fenotipo M2 favorecen la progresión de COCE debido a que inducen la adquisición fenotípica de la transición epitelio mesénquima aumentando la expresión de vimentina y disminuyendo la de e-cadherina en las células tumorales, y esto genera una menor sobrevida en los afectados (Blonde et ál., 2012), (Hu et ál., 2016).
El infiltrado de células del sistema inmune adaptativo en COCE puede estar constituido por linfocitos T y B. Al respecto, Quan et ál. Informaron que el infiltrado de linfocitos T es mayor que el de linfocitos B en el microambiente de COCE, y que su distribución suele ser en acúmulos rodeando y en el espesor del tumor (Quan et. ál). Además, considerando a los linfocitos T, es mayor el infiltrado de CD4 que de CD8. Zhou et ál., identificaron en muestras histopatológicas de carcinoma espinocelular lingual infiltrado de linfocitos T reguladores y B reguladores, y que el aumento de la densidad de los linfocitos B reguladores en el microambiente del tumor se relacionó con linfocitos T reguladores y tal evento puede asociarse con ser un predictor de mal pronóstico (Zhou et ál., 2016). Sin embargo, Lao et ál. Advirtieron que altos niveles de infiltrado de linfocitos B CD19+ en muestras de carcinoma espinocelular lingual se asocian a un buen pronóstico, (Lao et ál., 2016).
Asociación de periodontitis con el carcinoma oral de células escamosas
La periodontitis se ha asociado a la génesis y progresión de COCE. La primera se puede explicar debido a que la presencia de un ambiente bacteriano e inflamatorio pueden inducir la transformación maligna de lesiones potencialmente malignas a COCE o que las bacterias gram negativas causen inestabilidad genómica gatillando el desarrollo de COCE. La participación de la periodontitis en la progresión de COCE se puede entender, debido a que en la periodontitis se destruyen tejidos blandos y duros de la boca, activándose la actividad osteoclástica oral, que favorece la invasión de las células tumorales a tejidos adyacentes (Krüger et ál., 2013). Además, la periodontitis induce una respuesta inflamatoria sistémica de bajo grado que puede ser una vía de la promoción de la carcinogénesis para COCE, (Galvão- Moreira et ál., 2016), (Gondivkar et ál., 2016), (Gholizadeha et ál., 2016).
Se considera que la periodontitis presenta un riesgo para el desarrollo de COCE, demostrado por un OR de 2,4 (95% CI: 1.5-3,8), (Galvão-Moreira et ál.). Por el contrario contrario, también se demostró que el tratamiento contra la enfermedad periodontal disminuye el riesgo de presentar COCE (OR 0,2 95% CI: 0,1-0,5). Estudios como los de Wen BW et ál., Galvão-Moreira et ál. Y Zeng et ál. sugieren que COCE se asocia más con los pacientes que presentan periodontitis en comparación con quienes tienen gingivitis, (Wen et ál.) (Galvão-Moreira et ál.) (Zeng et ál., 2015).
Según Divaris et ál. y Chang et ál. patrones clínicos presentes en la periodontitis como; la movilidad dentaria, pérdida de dientes y sangrado de encías se asocian a mayor riesgo de presentar carcinomas de cabeza y cuello (CCC), (Divaris et ál., 2010), (Chang et ál., 2013).
La movilidad dentaria producto de la enfermedad periodontal con los antecedentes de tabaquismo que presenta el paciente se asocian a un sinergismo de factores para desarrollar COCE.
Moergel et ál. realizó un estudio retrospectivo de caso-control, donde analizó la pérdida de hueso en 178 con COCE y 123 pacientes sin la enfermedad (Moergel et ál., 2013).
La pérdida de hueso marginal se consideró como un parámetro clínico objetivo para la periodontitis crónica. Se concluyó con una diferencia estadísticamente significativa que los pacientes con COCE presentan mayor pérdida ósea en comparación con el grupo control.
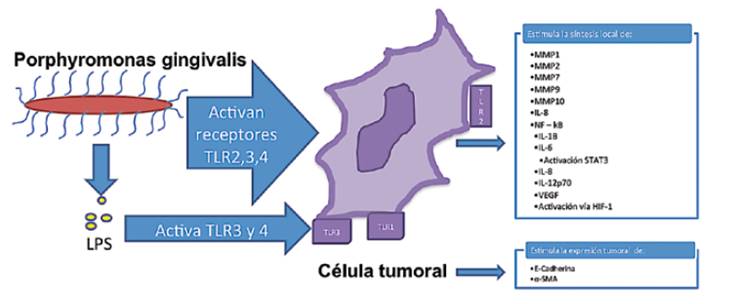
Ilustración 1: Reacción de la célula cancerosa ante Porphyromonas gingivalis en el medio local. Su presencia y la liberación de LPS estimulan a receptores tipo Toll de la superficie de la célula cancerosa (TLR), lo que genera una cadena de reacciones internas que desembocan en la síntesis de citocinas proinflamatorias, y en la activación de otras vías responsables de la síntesis de otros mediadores proinflamatorios. Se estima que la acción local de estas citocinas tendrían un efecto en determinar la progresión y carácter fuerte de la célula tumoral; sin embargo aún no están esclarecidos los mecanismos de cómo estos interactúan con la célula.
Efectos de la periodontitis en el carcinoma oral de células escamosas
Los efectos de la periodontitis en COCE son favorecer su invasión a otros tejidos, tumorogenicidad y carácter fuerte (Binder et ál., 2015), (Ha et ál., 2015), Ilustración1. En general, la periodontitis provoca cambios negativos en el COCE debido a que P. Gingivalis, F. Nuclea-tum y LPS actúan sobre las células neoplásicas induciendo la síntesis de MMPs y citocinas en el ambiente tumoral (Ha Ob et ál., 2016) servar Ilustración 1. Al respecto, Ha et ál. puntualizaron que la presencia de P. Gingivalis en el ambiente de COCE favorece el aumento de los niveles de MMPs y de IL-8 (Ha et ál., 2016). Los autores midieron los niveles de las MMP-1, MMP-2, MMP-7, MMP-9 y MMP-10 en 3 líneas celulares diferentes infectadas con P. Gingivalis. Los resultados mostraron que aumentaron los niveles de expresión de MMP- 1 a las 24 h en las líneas celulares OSC-20 y SAS y a las 72 h en la línea celular SCC-25. Los niveles de expresión de MMP-2 aumentaron en los tres tipos de líneas celulares nombrados; sin embargo, los valores fueron considerablemente mayores en la línea celular OSC- 20. Con respecto a los niveles de MMP-7, presentaron un aumento en los niveles de expresión con una tendencia similar en las 3 líneas celulares.
Por el contrario, los niveles de MMP-9 y MMP-10 aumentaron levemente en las 3 líneas celulares, debido a que los niveles de MMP- 9 y MMP-10 basales en tales líneas celulares son muy elevados. Por lo tanto, los resultados sugieren que la participación de las MMPs en la progresión de cáncer oral varía según el tipo de MMP y las características de COCE. Además, los mismos autores, evaluaron los niveles de IL-8 y los niveles de mRNA IL-8 en las líneas celulares OSC-20, SAS y SCC-25 posterior a su infección con P. Gingivalis. Encontraron que la expresión de mRNA IL-8 en las líneas celulares OSC-20 y SAS aumentaron 1,5 y 2,4 veces respectivamente comparado con sus valores basales, y que estos fueron similares y congruentes con los niveles de IL-8 en el sobrenadante de tales cultivos. Por el contrario, tanto los niveles de IL-8 del sobrenadante y de mRNA IL-8 de las líneas celulares OSC-20, SAS y SCC-25 aumentaron levemente. Los resultados expresan que puede existir una relación entre los niveles de IL-8 y la invasión de COCE (Ha et ál., 2016).
Además, se ha descrito que la presencia de bacterias podría activar la vía factor inducible por hipoxia-1 (HIF-1). La presencia de LPS activa a los TLR-3 y TLR-4, y tales receptores se han visto fuertemente expresado en las células malignas de COCE. La activación de los TLR-3 y TLR-4 en COCE por LPS, regula la expresión de HIF-1 y de VEGF mediante el factor NF-κB. Este regula la expresión de citocinas y puede aumentar en la presencia de hipoxia. Se ha demostrado que el factor NF-κB e hipoxia regulan un aumento de la síntesis de IL- 1β, IL- 6, IL-8, y de IL-12P70 en las líneas celulares HSC3 y SCC4. Tanto el aumento de la expresión de citocinas inflamatorias como de VEGF en el espesor de COCE podrían favorecer su proliferación y migración (Ha et ál.). Siguiendo la misma línea, otro receptor TLR asociado a la infección de células epiteliales neoplásicas con patógenos periodontales es el TLR-2. La presencia de P. Gingivalis y F. Nucleatum desencadenó la señalización de TLR-2, aumentando la síntesis de IL-6 que activa a STAT3. El procedimiento sugiere que la vía IL- 6-STAT3 favorece el crecimiento e invasión de COCE (Binder et ál.) Por otro lado, P. Gingivalis activa las vías ERK1/2-Ets1, p38/HSP27, y PAR2/ NFκB en COCE, induciendo la expresión de proMMP9 (Inaba et ál., 2014).
La infección crónica por P. Gingivalis, además de aumentar los niveles de MMP-1, MMP-10 y de IL-8, también puede incrementar el carácter fuerte de COCE por la inducción de cambios fenotípicos en COCE. Ha et ál. precisaron que la forma poligonal de las células de COCE tras la exposición por 5 semanas con P. Gingivalis, se transformaron en células neoplásicas delgadas y alargadas, expresaron E-cadherina y α-SMA que son marcadores mesenquimales, y advirtieron que CD44 y CD133 son marcadores de células madres cancerosas, aumentaron la capacidad de migración e invasión, eincrementaron la resistencia al tratamiento con quimioterapia (Ha et ál., 2016). Los resultados sugieren que la periodontitis crónica puede favorecer el carácter fuerte del tumor por contribuir a la transición epitelio mesénquima y que las células adquieran apariencia de células madres cancerosas en COCE (Ha et ál., 2015)
Conclusión
Tanto los estudios clínicos, que relacionan parámetros clínicos periodontales con COCE, como los estudios in vitro, que evalúan principalmente el efecto de P. Gingivalis en el comportamiento biológico de líneas celulares de COCE, coinciden en que la periodontitis se relaciona con el desarrollo de COCE. La explicación a tal relación, además de la respuesta inflamatoria que induce la presencia de bacterias patogénicas periodontales en el ambiente del tumor, participando como un agente promotor de la carcinogénesis oral, se puede deber a que ambas patologías son más frecuentes en mayores de 40 años y a que comparten factores de riesgo para su génesis, tales como tabaquismo, consumo de alcohol, mala nutrición, infección e higiene deficiente.
Autores:
Jorge Briceño1, Daniela Cavagnola1, Jorge Candia1, Carolina Somarriva1, Alejandra
Fernández1. 1 Facultad de Odontología, Universidad Andrés Bello, Chile. Autor de correspondencia: Alejandra Fernández Universidad Andres Bello Departamento de Cirugía y Patología Facultad de Odontología Código postal 8370133 Echaurren 237, Santiago, Chile Phone number: +56-226615834 Email: alejandra.fernandez@unab.cl, fernandez.alejandra@gmail.com CHILE