Introducción
La osteonecrosis mandibular relacionada con medicamentos (ONMRM), antes conocida como osteonecrosis mandibular por Bifosfonatos, es un síndrome descrito el año 2003 (Ruggiero, S. 2014; Kim, YH. 2014; Khan, A. 2015) caracterizado por la aparición de hueso expuesto y necrótico en maxilar o mandíbula, posterior a la realización de una exodoncia, o en relación con úlceras por decúbito de prótesis dentales. En un principio, este cuadro se asociaba sólo al uso de terapias antirresortivas con Bifosfonatos nitrogenados (BF) (Heufelder, M. 2014. Otto, S.2015).
Esta complicación suele presentarse con dolor espontáneo -aunque algunos casos puedan cursar sin dolor-, odinofagia, abscesos de tejidos blandos y fístulas extraorales.
La disminución de la calidad de vida del paciente determina su perentorio tratamiento, (Filleul, O. 2010; Beth-Tasdogan, NH. 2016).
El presente artículo pretende abordar esta patología desde diferentes ámbitos, centrándonos en su etiopatogenia, prevención y protocolos de tratamiento. No en vano, se calcula que existen 200 millones de pacientes en el mundo bajo terapias antirresortivas (Wagner, G. 2013), lo que hace necesario que los odontólogos nos mantengamos actualizados sobre sus posibles efectos en la salud bucal. En cuanto al tratamiento, se quiso darle un enfoque hacia la práctica diaria del odontólogo general, más que un abordaje terapéutico de especialidad.
Materiales y métodos
Se efectuó una revisión de la literatura con una estrategia de búsqueda empleando los términos MeSH específicos, en las bases de datos Cochrane y MEDLINE desde enero 2010 hasta agosto 2017, que abarcaran publicaciones en inglés y castellano. Fueron considerados estudios en animales, reportes de casos clínicos de más de un paciente, estudios retrospectivos y prospectivos, revisiones sistemáticas y meta-análisis. Posteriormente, se procedió a efectuar una integración narrativa de los resultados extraídos en torno a la evidencia relevante (scoping review), (Dijikers, M. 2015). Se tuvo especial consideración en que los estudios tributaran a los objetivos propuestos, es decir, se privilegiaron aquellos artículos que tuvieran una clara orientación práctica a la clínica del odontólogo general y aquellos que discutieran el rol preminente de la infección en la etiopatogenia de la ONMRM.
1. Definición
En la perspectiva de unificar criterios diagnósticos, recogemos la definición estipulada por la Asociación Americana de Cirujanos Orales y Maxilofaciales (AAOMS por sus siglas en inglés), (Ruggiero, S. 2014), quien advierte que para diagnosticar una ONMRM, deben estar presentes al mismo tiempo: tratamiento actual o previo con agentes antirresortivos o antiangiogénicos; presencia de hueso expuesto que puede ser sondeado a través de una fístula intraoral o extra oral en la región maxilofacial que ha persistido durante más de 8 semanas; y ausencia de antecedentes de radioterapia en la región orofacial o enfermedad metastásica evidente, (Ruggiero, S. 2014). Como acotación, las 8 semanas estipuladas son consistentes con un promedio de tiempo, en el cual la mayoría de traumas y procedimientos quirúrgicos orales hubieran cicatrizado en pacientes sanos, (Crincoli, V. 2015), y la presencia de radioterapia transformaría el diagnóstico en osteoradionecrosis, (Hellstein, JW. 2011). La definición de la AAOMS es aceptada por la mayoría de los artículos consultados, (Rupel, K. 2014; Ruggiero, S. 2014; Kim, HY. 2017; Khan, A. 2016; Saia, G. 2010; Fernández, E. 2015), pero cuenta con detractores (Kim, HY. 2017; Rosella, D. 2016), quienes expresan que basarse sólo en criterios clínicos puede dar pie a imprecisiones diagnósticas, que descartarían su utilidad como variable operacional confiable en estudios epidemiológicos, (Kim, HY. 2017). Por otro lado, no siempre hay presencia de hueso necrótico expuesto, (Rosella, D. 2016). Una de las características más interesantes de la ONMRM, es que rara vez se ha observado en otras regiones del cuerpo. Sólo uno de los investigadores consultados menciona incidencias de un 0,1% por caso verificado en el conducto auditivo externo, (Khan, A. 2015). Pese a que en un principio se asoció este cuadro únicamente con el uso de BF (alendronato, risedronato, ibandronato, ácido zoledrónico o zoledronato), actualmente se sabe que los fármacos inhibidores de ligando RANK-L (denosumab) (Dmab) y antiangiogénicos (sunitinub, bevacizumab) también pueden causarlo, (Kim, YH. 2014, Beth-Tasdogan, NH. 2016, Kim, HY. 2017, Silva LF. 2016, Migliorati, CA. 2013, Mupparapu, M. 2016). Es por esta razón, que a partir del año 2014, se comienza a utilizar la nomenclatura osteonecrosis mandibular relacionada con el uso de medicamentos, (Ruggiero, S. 2014). A modo de recordatorio, los BF son medicamentos antirresortivos, bloqueadores de la resorción ósea osteoclástica que inhiben la disolución mineral, (Filleul, O. 2010; Gaudin, E. 2015; Beth-Tasdogan, NH. 2016; Poxleitner, P. 2017). Se adhieren a la superficie del hueso y son ingeridos por los osteoclastos, alterando su capacidad de reabsorber hueso, (Rupel, K. 2014; Arbildo- Vega, A. 2014; Kim, YH. 2014; Fliefel, R. 2015; Fernández, E. 2015; Silva LF. 2016). Los BF se usan comúnmente vía oral o intravenosa (IV) para tratar enfermedades con elevada actividad osteoclástica como osteoporosis postmenopaúsica, cáncer de mama, próstata y pulmón, hipercalcemia maligna, metástasis óseas, lesiones líticas en el contexto de mieloma múltiple y enfermedad de Paget, (Rupel, K. 2014; Arbildo-Vega, A. 2014; Kim, YH. 2014; Fliefel, R. 2015; Fernández, E. 2015; Silva LF. 2016). Por su parte, los fármacos inhibidores de ligando RANK-L, que tienen como principal ejemplo al Dmab, son anticuerpos monoclonales humanos que impiden la unión entre el receptor RANK y el ligando RANKL, disminuyendo la función de los osteoclastos, incluidas su formación, diferenciación y supervivencia, (Rupel, K. 2014; Ruggiero, S. 2014; Albu-Stan, IA. 2017; Hellstein, JW. 2011; Matsumoto, A. 2017; Niibe, K. 2015). El Dmab incrementa la masa y la densidad ósea, tanto en el hueso cortical como en el trabecular (Beth-Tasdogan, NH. 2016; Hellstein, JW. 2011; Rosella, D. 2016; Matsumoto, A. 2017) y se utiliza en el tratamiento de osteoporosis postmenopáusica, artritis reumatoide, terapia de sustitución androgénica y mieloma múltiple, entre otros cuadros, (Hellstein JW. 2011). El primer caso de ONMRM relacionada con Dmab, fue informado el año 2010, (Hellstein JW. 2011). Por último, los inhibidores de la angiogénesis o antiangiogénicos, interfieren en la neoformación de vasos sanguíneos uniéndose a varias proteínas y moléculas de señalización, que interrumpen la cascada generadora de angiogénesis, (Ruggiero, S. 2014; Beth- Tasdogan, NH. 2016; Albu-Stan, IA. 2017). Estos nuevos medicamentos han mostrado eficacia en el tratamiento de tumores gastrointestinales y neuroendocrinos, carcinomas de células renales y otras neoplasias malignas, (Ruggiero, S. 2014; Beth-Tasdogan, NH. 2016) y también han sido relacionados con la ONMRM.
2. Factores de riesgo e incidencia
Son factores de riesgo: el uso de fármacos antirresortivos, inhibidores de RANK-L o antiangiogénicos, una duración del tratamiento mayor a 3-4 años, la vía IV de la medicación, uso de corticoides, diabetes, enfermedad periodontal, extracción dental, tabaquismo, hipertiroidismo, diálisis, edad avanzada, anemia, deficiencia de vitamina D e historia previa de ONMRM, (Ruggiero, S. 2014; Khan, A. 2015; Khan, A. 2016, Heufelder 2012, Otto, S. 2015; Saia, G. 2010).
También se menciona el uso de prótesis fijas, (Niibe, K. 2015), o removibles desajustadas (Fliefel, R. 2015; Katsarelis, H. 2015; Heufelder, M. 2014; Niibe, K. 2015). La extracción dental y el uso de BF IV por más de 3-4 años, se repiten invariablemente como los factores de mayor preponderancia. Lamentablemente aún no es posible determinar de manera objetiva el riesgo de desarrollar ONMRM, (Hellstein, JW. 2011; Kim, HY. 2017). Los datos epidemiológicos sobre la prevalencia e incidencia de ONMRM son limitados y normalmente se basan en estudios retrospectivos, (Khan, A. 2015; Heufelder, M. 2014; Otto, S. 2015) con rangos variables, dependiendo del tipo de medicación y enfermedad estudiada, (Beth-Tasdogan, NH. 2016). Las tasas de incidencia de ONMRM para los pacientes que utilizan BF IV presentan márgenes amplios, con cifras que van desde un 0,8% hasta un 12%, (Gaudin, E. 2015). En terapia con zoledronato entre 0,7% y 6,7%, (Ruggiero, S. 2014) y con Dmab, entre 0,7% y 1,9% (Ruggiero, S. 2014). La incidencia de ONMRM es mayor en pacientes con cáncer, que han estado en tratamiento con BF IV, (Filleul, O. 2010; Khan, A. 2016; Beth-Tasdogan, NH. 2016; Hellstein, JW. 2011; Rosella, D. 2016), versus pacientes en terapia por osteoporosis vía oral (0,19% vs 0,15% a 0,001%, respectivamente), (Ruggiero, S. 2014; Khan, A. 2015; Gaudin, E. 2015; Khan, A. 2016; Mupparapu, M. 2016). Asimismo, la recuperación de una ONMRM es mejor y más rápida en pacientes con BF orales, que con tratamiento IV, (Filleul, O. 2010; Ruggiero, S. 2014; Heufelder, M. 2014; Otto, S. 2015; Hellstein, JW. 2011; Saia, G. 2010). Destaca el hecho de que esta enfermedad tiene el doble o triple de prevalencia en mandíbula que en maxila, (Ruggiero, S. 2014; Heufelder, M. 2014; Crincoli, V. 2015; Girbone, J. 2013), sobre todo en zonas de hueso prominente cubierto por mucosa delgada, (Filleul, O. 2010; Khan, A. 2015). En cuanto a la variable “género” no hay consenso, pero existen autores que no informan diferencias estadísticas, (Otto, S. 2015; Saia, G. 2010; Kim, HY. 2017) y otros que sí (Filleul, O. 2010; Ruggiero, S. 2014). No obstante, la baja incidencia de ONMRM en comparación con la gran cantidad de personas que usan antirresortivos, (Ruggiero, S. 2014; Saia, G. 2010; Hasegawa T. 2017; Mupparapu, M. 2016), se ha verificado un aumento en el uso de estos fármacos, ampliando nuestra población de riesgo, (Filleul, O. 2010; Heufelder, M. 2014; Matsumoto, A. 2017).
3. Etiopatogenia
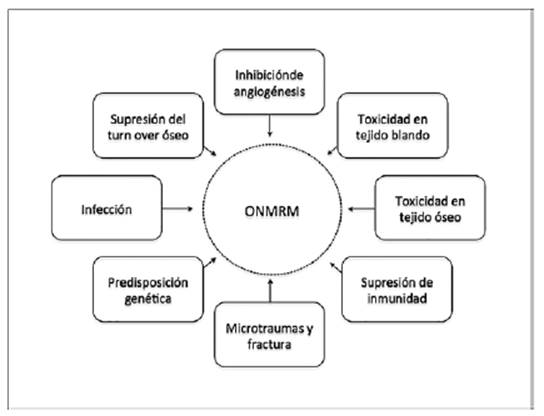
Pese a la extensión y pertinencia de la literatura consultada, no hay consenso sobre la etiopatogenia de la ONMRM, (Ruggiero, S. 2014; Khan, A. 2015; Khan, A. 2016; Hasegawa T. 2017; Poxleitner, P. 2017; Kim, KM. 2015). Una década atrás, la mayoría de los estudios identificaban el potencial rol de los BF en su desarrollo, pero el conocimiento actual de que la terapia con Dmab e inhibidores de RANK-L también incrementa el riesgo de ONMRM, entonces enfatiza la necesidad de explorar nuevas vías y procedimientos comunes para estos fármacos, (Khan, A. 2015; Katsarelis, H. 2015). Resulta plausible que la génesis sea fruto de la interacción de los siguientes factores, (Ruggiero, S. 2014; Khan, A. 2016; Migliorati, CA. 2013; Kim, KM. 2015), (figura 1):
i. Supresión del remodelado o turn-over óseo: Teóricamente, el remodelado óseo estaría disminuido en presencia de antirresortivos de alta potencia y Dmab, (Ruggiero, S. 2014; Khan, A. 2015; Gaudin, E. 2015; Katsarelis, H. 2015). El turn-over puede ser hasta 10 veces mayor en el hueso alveolar versus otros huesos del cuerpo, y como los BF se encuentran atraídos al tejido óseo con altas tasas de remodelación, se podría explicar la gran concentración de BF y, por tanto, de ONMRM en huesos de maxila y mandíbula, (Katsarelis, H. 2015; Beth-Tasdogan NH. 2016; Albu- Stan, IA. 2017). En la práctica, existe evidencia de que el remodelado óseo no se encuentra reducido en lesiones con ONMRM, (Khan, A. 2015; Katsarelis, H. 2015; Fernández, E. 2015; Kim, KM. 2015), y si así fuese, debiésemos esperar un cuadro de osteopetrosis, y no de osteonecrosis, (Katsarelis, H. 2015). Por otro lado, la ONMRM no aparece asociada a otras patologías que causan supresión del turnover como el hipoparatiroidismo, (Khan, A. 2015; Katsarelis, H. 2015).
ii. Inhibición de angiogénesis: Se ha descrito ONMRM en pacientes oncológicos tratados con agentes antiangiogénicos. Los BF también tienen propiedades antiangiogénicas que pudiesen contribuir al desarrollo de ONMRM, (Ruggiero, S. 2014; Khan, A. 2015; Beth- Tasdogan, NH. 2016; Fernández, E. 2015; Kim, KM. 2015; Aguirre, J. 2010). Hipotéticamente, una vascularidad disminuida comprometería los estadios iniciales de la reparación ósea tras una exodoncia, (Ruggiero, S. 2014; Hellstein, JW. 2011; Fernández, E. 2015; Aguirre, J. 2010), pero en la mayoría de los estudios histológicos de tejidos afectados por ONMRM, se informa una irrigación y volumen vascular normales, (Khan, A. 2015; Kim, KM. 2015) en relación con el sitio óseo, ya sea en maxila o mandíbula.
iii. Toxicidad de los BF en tejido blando: Si bien la exposición directa a soluciones con BF, incluso en bajas concentraciones, produce efectos tóxicos y apoptosis en fibroblastos del ligamento periodontal, células endoteliales, osteoblastos y células epiteliales, (Ruggiero, S. 2014; Albu-Stan, IA. 2017; Fernández, E. 2015; Kim, KM. 2015; Agarwal, P. 2012), el rol de este factor no es del todo claro. Además, en teoría, esta toxicidad se vería reducida en presencia de hueso, debido a que los BF son captados por la superficie del tejido óseo. Los estudios in vivo al respecto no son concluyentes, (Arbildo-Vega, A. 2014; Ruggiero, S. 2014; Kim, KM. 2015).
iv. Toxicidad de los BF en tejido óseo: Altas concentraciones de BF son capaces de causar apoptosis en células óseas, (Fernández, E. 2015), y las moléculas de BF que se retienen en tejido óseo, pueden tener una vida media de varios meses, (Beth-Tasdogan, NH. 2016; Hellstein, JW. 2011), o años, (Hasegawa T. 2017; Poxleitner, P. 2017), lo que podría tener un rol en la generación de ONMRM. Que este factor por sí solo sea el productor de lesiones osteonecróticas es objetable, porque, en presencia de BF, debiesen presentarse cuadros similares en otros huesos del cuerpo, (Kim, KM. 2015), hecho que no ha sido observado.
v. Supresión de la inmunidad: Los BF controlan la actividad de varias células relacionadas con la respuesta inmune, como monocitos y macrófagos, (Kim, KM. 2015). El riesgo de ONMRM después de una extracción dental es mayor si durante la terapia con BF, se administran concomitantemente agentes esteroides o quimioterapéuticos oncológicos, que pudiesen influir en el funcionamiento del sistema inmune, (Ruggiero, S. 2014; Beth-Tasdogan, NH. 2016; Albu-Stan, IA. 2017; Kim, KM. 2015).
vi. Microtraumas- microfracturas: Los huesos, maxilar y mandíbula, resisten cargas masticatorias de hasta 400kg/cm2, (Fernández, E. 2015), lo que podría generar microfracturas que con el paso del tiempo, suscitan un efecto acumulativo, (Fliefel, R. 2015; Katsarelis, H. 2015: Beth-Tasdogan, NH. 2016; Fernández, E. 2015; Hasegawa T. 2017), y dan lugar a lesiones latentes de ONMRM. Los resultados de estudios en animales siguen arrojando resultados discordantes, (Kim, KM. 2015).
vii. Predisposición genética: No todos los pacientes con similares comorbilidades y similar manejo médico desarrollan ONMRM. Más aun, la interacción entre genes y fármacos (fármaco genética) puede influenciar el riesgo de desarrollar ONMRM, (Khan, A. 2015; Khan, A. 2016). Se ha sugerido que ciertos polimorfismos en la farnesyl pirofosfato sintetasa o en el citocromo P450 de determinados genes asociados al recambio óseo y formación de colágeno, podrían predisponer al desarrollo de ONMRM, (Ruggiero, S. 2014; Khan, A. 2015; Kim, KM. 2015).
viii. Infección: Existe evidencia experimental la cual expresa que la infección y el uso de BF serían condiciones suficientes para producir ONMRM, (Katsarelis, H. 2015; Kim, KM. 2015). La presencia frecuente de infección asociada a las lesiones de ONMRM surge del análisis de pruebas histológicas, (Fliefel, R. 2015; Beth-Tasdogan, NH. 2016; Albu-Stan, IA. 2017; Heufelder, M. 2014; Otto, S. 2015; Wagner, G. 2013). Al parecer la infección, ha devenido en el factor de mayor relevancia como causa primigenia de esta patología. Se suscribe su actual preeminencia, dedicando un apartado al análisis de esta variable al finalizar este artículo.
Probablemente la ONMRM es causada por una combinación de elementos que aún no pueden ser explicados con un único mecanismo fisiopatológico, (Arbildo-Vega, A. 2014; Wagner, G. 2013; Silva, LF. 2016; Kim, KM. 2015). Hoy existen dos teorías principales, (Fliefel, R. 2015): una de ellas plantea que la sumatoria de la inhibición de la actividad osteoclástica, la supresión del turn-over óseo, la propagación del micro-trauma y la infección local, conducen a la necrosis, con la exposición ósea como un evento tardío. La segunda hipótesis, (Fliefel, R. 2015; Fernández, E. 2015), sugiere que una ruptura en la mucosa oral lleva a la entrada de bacterias e infección local, lo que junto a una pobre remodelación ósea, produciría la necrosis. Estaríamos ante un escenario dentro del cual tenemos, por un lado hueso con una superficie con altas concentraciones de BF y, por otro lado, una alta actividad osteoclástica causada por infección bacteriana. La alta actividad osteoclástica, a su vez, produciría la liberación de altas concentraciones de BF en el entorno circundante a la lesión, con los consiguientes efectos tóxicos sobre células regenerativas, (Fernández, E. 2015). Así se establece un círculo vicioso, en el cual una lesión ósea y de tejido blando, provocadas por un trauma (exodoncia, úlcera protésica), no logran reparar debido a la infección persistente, que se traduce en una prolongada resorción ósea con liberación de BF, (Khan, A. 2015).
4. Opciones terapéuticas
Antes de hablar de las terapias propiamente tales, se recomienda calificar al paciente según riesgo.
Los de “bajo riesgo”, son aquellos que siguen tratamiento con BF orales o BF IV en concentraciones bajas, para osteoporosis, osteopenia o enfermedad de Paget, (Beth- Tasdogan, NH. 2016; Poxleitner, P. 2017). Los pacientes de “alto riesgo”, en cambio, son aquellos con medicación por cáncer, mieloma múltiple y metástasis óseas, con fármacoterapia IV en altas concentraciones, (Beth-Tasdogan, NH. 2016; Poxleitner, P. 2017). Además, cabe sumar y ponderar los factores de riesgo mencionados en un comienzo:
duración del tratamiento, co-morbilidades asociadas, uso de prótesis removibles, etc. En el manejo clínico de la ONMRM, debiese primar un enfoque preventivo en todo momento, (Ruggiero, S. 2014; Gaudin, E. 2015; Albu-Stan, IA. 2017; Poxleitner, P. 2017; Matsumoto, A. 2017). Los pacientes que comiencen terapias, sea por cáncer, osteoporosis u otra enfermedad, deben ser sometidos previamente a tratamiento odontológico, (Ruggiero, S. 2014; Khan, A. 2015; Khan, A. 2016; Fernández, E. 2015; Fernández, E. 2015; Matsumoto, A. 2017) que incluya evaluación radiográfica, (Ruggiero, S. 2014; Khan, A. 2016; Girbone J. 2013), fase etiológica, (Khan, A. 2015; Albu-Stan, IA. 2017; Girbone J. 2013; Poxleitner, P. 2017; Kim, KM. 2015) y una adecuada terapia rehabilitadora, (Ruggiero, S. 2014; Beth-Tasdogan, NH. 2016). Siempre y cuando el estado sistémico del paciente lo permita, se considerará retrasar el uso de la farmacoterapia, hasta que la salud bucal del paciente se encuentre estabilizada, (Arbildo-Vega, A. 2014; Poxleitner, P. 2017). De hecho, los pacientes que reciben atención dental adecuada y que mantienen en el tiempo una óptima salud oral, tienen bajo riesgo de desarrollar ONMRM, (Ruggiero, S. 2014; Khan, A. 2015; Katsarelis, H. 2015; Poxleitner, P. 2017; Matsumoto, A. 2017).
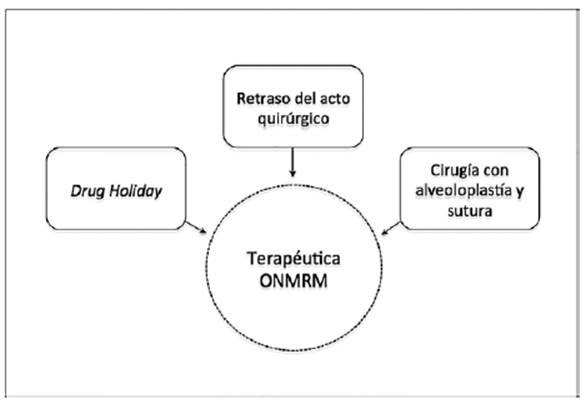
Dejando establecido este marco conceptual preventivo, cuando nos enfrentamos a un paciente que ya se encuentra bajo terapia farmacológica, sea con BF, Dmab o fármacos antiangiogénicos, y que requiere perentoriamente una exodoncia, la literatura consultada plantea tres opciones (figura 2). La primera , drug holiday, se refiere a la suspensión temporal de un medicamento en pacientes crónicos, con el fin de reducir la probabilidad de efectos secundarios adversos ante un acto quirúrgico. El odontólogo puede solicitar la evaluación y posible interrupción del tratamiento con BF o fármacos relacionados.
Para los BF se informa sobre protocolos de suspensión por períodos variables de: 1 día antes, (Matsumoto, A. 2017), 2 meses antes, (Ruggiero, S. 2014), 3 meses antes, (Kim, YH. 2014), 3 a 6 mesesantes y 1 a 2 meses después de la cirugía, (Saia, G. 2010). Los autores de dichos estudios concuerdan en que el tiempo de suspensión dependerá del estado sistémico del paciente. Kim (Kim, KM. 2015), recomienda un drug holiday de 2 a 4 meses en pacientes osteoporóticos en tratamiento con BF orales, pero no es concluyente en el caso de gente con cáncer que está bajo tratamiento con BF endovenosos.
La AAOMS, (Ruggiero, S. 2014), por su parte, reconoce que hay datos limitados para apoyar o refutar la aplicación del drug holiday en los individuos con osteoporosis, pero mencionan un “beneficio teórico” en pacientes de alto riesgo, bajo terapia de BF orales, si se suspenden los medicamentos 2 meses antes de cualquier procedimiento dental invasivo, (Ruggiero, S. 2014; Damm, DD. 2013). La International Osteonecrosis of the Jaw Task Force, (Khan, A. 2016), en cambio, recomienda la suspensión de los antirresortivos después del procedimiento dental. Puesto que la absorción de BF se incrementa en los sitios con lesión ósea local, la suspensión de la terapia antirresortiva después de la cirugía, pudiese reducir la precipitación de BF yasea en maxila o en mandíbula. Al igual que la AAOMS, destacan que no existe evidencia concreta que la interrupción de la terapia antirresortiva reduzca el riesgo de ONMRM. Si bien el concepto de drug holiday sigue siendo válido, (Kim, KM. 2015), trae consigo otras interrogantes como: ¿qué es más riesgoso: la exodoncia con posibilidad de ocurrencia de ONMRM o una infección orofacial en un paciente sistémicamente comprometido? ¿Es beneficioso dejar a los pacientes sin su terapia antirresortiva a causa de una extracción dental? Aún no contamos con la evidencia para afirmar que la interrupción de la terapia farmacológica presente un poder preventivo infalible contra la ONMRM, (Ruggiero, S. 2014; Gaudin, E. 2015; Khan, A. 2016; Hellstein, JW. 2011; Kim, KM. 2015; Matsumoto, A. 2017), pero sí conocemos con certeza el efecto de estos fármacos sobre la mejora de la calidad de vida de los pacientes, (Ruggiero, S. 2014; Khan, A. 2015; Fliefel, R. 2015; Mupparapu, M. 2016; Matsumoto, A. 2017): previenen y reducen “eventos óseos” e incidencias de fracturas patológicas, (Khan, A. 2016; Hellstein, JW. 2011; Poxleitner, P. 2017; Matsumoto, A. 2017), toda vez que disminuyen complicaciones asociadas a estas enfermedades, (Gaudin, E. 2015; Fliefel, R. 2015; Poxleitner, P. 2017; Mupparapu, M. 2016). En otras palabras, el suspender la medicación antirresortiva por un tratamiento dental, puede incurrir en un detrimento de la salud ósea general del paciente, (Khan, A. 2015. Khan, A. 2016). Considerando los datos de incidencia de ONMRM, los beneficios del uso de estos agentes farmacológicos son mucho mayores que los riesgos conocidos hasta el momento, (Hellstein, JW. 2011; Mupparapu, M. 2016). En concordancia con esta tendencia, el Consejo de Asuntos Científicos de la Asociación Dental Americana, no recomienda la suspensión de BF, antes de procedimientos dentales invasivos, (Hellstein, JW. 2011). En el caso del Dmab y fármacos antiangiogénicos, no se encontraron protocolos precisos de tiempos de suspensión.
Como segunda opción terapéutica, tenemos el retrasar el acto quirúrgico. La AAOMS, (Ruggiero, S. 2014) recomienda esto, especialmente en pacientes de alto riesgo. Esta posibilidad terapéutica presenta detractores, (Otto, S. 2015; Hellstein, JW. 2011; Saia, G. 2010; Hasegawa T. 2017; Migliorati, CA. 2013; Niibe, K. 2015), quienes consideran que un diente con caries o enfermedad periodontal que no es extraído a tiempo, es un factor de riesgo en sí mismo para la formación de una lesión osteonecrótica futura, y un foco infeccioso en un paciente sistémicamente comprometido. Como posibilidades para evitar la exodoncia, se sugiere cortar la corona dentaria tras realizar tratamiento de endodoncia al remanente radicular en dientes que no pueden ser rehabilitados, (Arbildo- Vega, A. 2014; Hellstein, JW. 2011; Rosella, D. 2016). Se sugiere, eso sí, evitar técnicas endodónticas que sobrepasen el ápice, (Crincoli, V. 2015). También se refieren a la ferulización periodontal de dientes con movilidad grado I o II, (Rosella, D. 2016).
Una tercera opción, es seguir la propuesta de una línea de investigadores que han buscado técnicas quirúrgicas específicas las cuales disminuyan la ocurrencia de ONMRM. Se describen técnicas con, (Saia, G. 2010; Hasegawa T. 2017), o sin, (Heufelder, M. 2014; Otto, S. 2015; Hasegawa T. 2017; Mozzati, M. 2013; Matsumoto, A. 2017) drug holiday, en pacientes con cáncer, (Heufelder, M. 2014; Saia, G. 2010), osteoporosis, (Hasegawa, T. 2017; Mozzati, M. 2013) o ambos, (Migliorati, CA. 2013; Matsumoto, A. 2017), bajo terapias con Dmab, (Matsumoto, A. 2017), BF oral, (Otto, S. 2015; Saia, G. 2010; Hasegawa T. 2017; Migliorati, CA. 2013; Mozzati, M. 2013), e IV, (Otto, S. 2015; Saia, G. 2010; Hasegawa T. 2017; Migliorati, CA. 2013), que incluyen: profilaxis antibiótica, elevación de un colgajo mucoperióstico, alisado de bordes y espículas óseas con gubia o fresas y cierre de la herida con sutura, (Heufelder, M. 2014; Otto, S. 2015; Saia, G. 2010; Hasegawa T. 2017; Mozzati, M. 2013; Matsumoto, A. 2017). Se sugieren como cuidados post-operatorios, antibioterapia, (Heufelder, M. 2014; Saia, G. 2010; Mozzati, M. 2013; Matsumoto, A. 2017), dieta blanda, (Matsumoto, A. 2017), evitar el uso de prótesis removibles, (Heufelder, M. 2014; Matsumoto, A. 2017), uso de colutorios de clorhexidina, (Saia, G. 2010; Mozzati, M. 2013; Matsumoto, A. 2017), y retiro de suturas 2 a 3 semanas después de la cirugía, (Heufelder, M. 2014; Mozzati, M. 2013; Matsumoto, A. 2017). En los casos estudiados, se logró un cierre apropiado en la mayoría de los sitios de extracción, aunque se informa cierta demora en la cicatrización del tejido blando, que puede llevar 4 a 5 semanas, (Otto, S. 2015; Migliorati, CA. 2013). La alveoloplastía y sutura descritos, se menciona en otros artículos, (Gaudin, E. 2015; Khan, A. 2016; Hellstein, JW. 2011; Fernández, E. 2015), y los consideran como factores esenciales para evitar la aparición de ONMRM. En el caso de la alveoloplastía, se cree que podría ser favorable por el beneficio teórico de retirar hueso destinado a sufrir remodelación, (Gaudin, E. 2015; Heufelder, M. 2014), o bien, por la posibilidad de que la eliminación de espículas óseas evita la perforación e infección de la mucosa, (Heufelder, M. 2014; Otto, S. 2015; Fernández, E. 2015; Matsumoto, A. 2017). En el caso de la sutura, su utilidad se debe a la aislación de la herida del medio bucal, disminuyendo la posibilidad de infección, (Heufelder, M. 2014; Hellstein, JW. 2011; Saia, G. 2010). Saia et ál. (Saia, G. 2010), explicitan que la exodoncia “simple” (cicatrización por segunda intención) presenta un mayor riesgo de ONMRM que la hecha a colgajo, la que implica sutura y, por ende, cicatrización por primera intención.
En cuanto al uso de terapia antibiótica previa, se ha informado sobre estudios, (Poxleitner, P. 2017) comparando pacientes con terapia profiláctica versus algunos sin terapia, en los cuales se observó en ambos grupos aparición de lesiones de ONMRM, aunque persistiendo una mayor incidencia de ONMRM en el grupo sin profilaxis. Lo anteriormente expuesto se engarza con el hecho de que la indicación de “profilaxis antibióticas” es hoy por hoy un tema controversial debido a la alerta sanitaria establecida por la OMS producto del incremento de la “resistencia antibiótica”, (World Health Organization. 2015): por tanto, cabrá ser cada día más cauteloso con esta prescripción y su potencial eficacia terapéutica.
En resumen, se podría realizar exodoncias en pacientes con terapia antirresortiva o antiangiogénica, sin necesidad de suspender el tratamiento farmacológico, siempre y cuando seamos cautelosos en determinar los factores de riesgo, (Girbone J. 2013), y sigamos los protocolos quirúrgicos descritos que eviten la infección de la herida, (Beth-Tasdogan, NH. 2016; Heufelder, M. 2014).
Si a pesar de nuestros esfuerzos por evitarlo, nos encontramos frente a una lesión de ONMRM, debemos asegurarnos primero, de realizar un diagnóstico correcto, con base en las definiciones actuales, (Ruggiero, S. 2014). Es fácil confundir ONMRM en sus estados iniciales, con alveolitis, osteítis alveolar y sinusitis. Por otro lado, la sintomatología puede ocurrir hasta 2 o 3 meses posteriores a la exodoncia, (Arbildo-Vega, A. 2014; Vera-Sirera, B. 2012). El diagnóstico, tal como se discutió en un principio, es eminentemente clínico, pero las radiografías e imágenes 3D nos pueden entregar ciertas pistas como presencia de osteoesclerosis localizada o difusa, o espesamiento de la lámina dura, (Khan, A. 2015; Saia, G. 2010). Luego de la confirmación diagnóstica, tenemos que determinar en cuál etapa nos encontramos de la enfermedad.
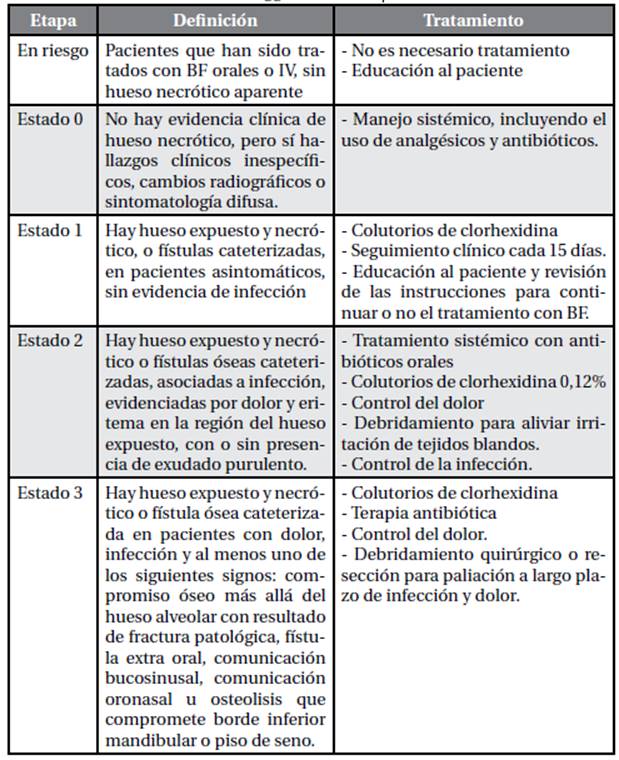
La definición de estas, entregada por la AAOMS, (Ruggiero, S. 2014), se presenta en la Tabla 1. La categoría “en riesgo”, fue añadida el 2009, (Rupel, K. 2014; Ruggiero, S. 2014; Hellstein, JW. 2011; Saia, G. 2010; Mupparapu, M. 2016), ya que se ha informado que hasta un 50% de pacientes con síntomas inespecíficos en un inicio, pueden progresar a etapas más avanzadas de ONMRM, (Ruggiero, S. 2014; Khan, A. 2015; Hellstein, JW. 2011).
Si bien existen otras tablas de tipificación de ONMRM, (Rosella, D. 2016), la de AAOMS es la que más se repite entre los artículos consultados, a pesar de que algunos críticos, (Khan, A. 2016), apelan a que las etapas “en riesgo” y etapa 0, podrían inducir a un sobre-diagnóstico de la enfermedad. Una vez definido el diagnóstico y la fase en la que nos encontramos, no existe un protocolo de tratamiento universalmente aceptado para la ONMRM, (Arbildo-Vega, A. 2014; Kim, YH. 2014; Khan, A. 2015; Fliefel, R. 2015; Albu-Stan, IA. 2017; Wagner, G. 2013). Eso sí, contamos con dos aproximaciones terapéuticas: tratamiento no quirúrgico o paliativo, y el quirúrgico, (Rupel, K. 2014; Ruggiero, S. 2014; Beth-Tasdogan, NH. 2016; Albu-Stan, IA. 2017). Ambas opciones tienen por objetivo el alivio del dolor, el control de la infección del tejido necrótico y la prevención de la progresión de la ONMRM a otros sitios vecinos, (Ruggiero, S. 2014; Fliefel, R. 2015; Beth-Tasdogan, NH. 2016; Kim, KM. 2015). Las terapias paliativas o no quirúrgicas tienden a ser más utilizadas en las etapas iniciales de ONMRM, (Ruggiero, S. 2014; Rosella, D. 2016; Poxleitner, P. 2017), e incluyen la mejora en la higiene oral, colutorios con clorhexidina al 0,12% o al 0,2%, uso de antibióticos sistémicos (penicilina, betalactámicos, eritromicina, quinolonas, clindamicina, metronidazol y doxiciclina) y empleo de analgésicos y antiinflamatorios, (Fliefel, R. 2015; Khan, A. 2016; Beth-Tasdogan, NH. 2016; Albu-Stan, IA. 2017; Hellstein, JW. 2011; Girbone J. 2013). La cicatrización de la herida puede ser acelerada con el uso de agentes del tipo pentoxifilina (agente vasodilatador que mejora el flujo sanguíneo) y vitamina E (con propiedades antioxidantes), (Beth-Tasdogan, NH. 2016), medicamentos que han sido exitosamente utilizados para las osteoradionecrosis. Por otra parte, las aproximaciones quirúrgicas incluyen el desbridamiento y eliminación del hueso necrótico, (Rupel, K. 2014; Fliefel, R. 2015; Beth-Tasdogan, NH. 2016). Si bien en estudios correspondientes a los años 2010-2014, los tratamientos sugeridos eran más bien paliativos, últimamente los estudios de protocolos quirúrgicos han demostrado la remisión exitosa de las lesiones, (Rupel, K. 2014; Kim, YH. 2014; Khan, A. 2015; Heufelder, M. 2014; Silva LF. 2016). El consenso aún no está del todo definido, pero los resultados obtenidos por Rupel et ál, (Rupel, K. 2014) advierten que el tratamiento paliativo por sí solo, es menos eficaz en comparación con el quirúrgico: 33% de estabilización o mejoría leve, versus un 75% a 85% de reparación completa. Datos similares sobre la mejor evolución con terapias quirúrgicas, son informados por otros autores, (Fliefel, R. 2015; Khan, A. 2016; Heufelder, M. 2014; Silva LF. 2016; Hasegawa T. 2017). La AAOMS expresa que, sin importar la etapa en la que se encuentra la ONMRM, los secuestros óseos y el hueso necrótico, deben ser extirpados quirúrgicamente, (Ruggiero, S. 2014). Los controles postoperatorios tienen que ser periódicos y se recomiendan hasta 1 año después del procedimiento, antes de considerar el éxito quirúrgico, (Fliefel, R. 2015; Beth-Tasdogan, NH. 2016; Albu-Stan, IA. 2017; Otto, S. 2015; Silva LF. 2016). En los artículos estudiados se describen tratamientos complementarios como terapia láser, ozono, uso de plasma rico en plaquetas, terapia antibiótica a largo plazo y oxígeno hiperbárico, (Khan, A. 2015; Fliefel, R. 2015; Beth-Tasdogan, NH. 2016; Khan, A. 2016; Vera-Sirera, B. 2012). Este último junto con el uso de plasma rico en plaquetas y factores de crecimiento tipo fibroblastos, son los que han mostrado mejores resultados hasta el momento, (Khan, A. 2015; Silva LF. 2016; Vera-Sirera, B. 2012). El tratamiento con Teriparatide, un fármaco que funciona como acelerador de la formación ósea, (Fliefel, R. 2015; Khan, A. 2016; Beth-Tasdogan, NH. 2016; Crincoli, V. 2015), ha demostrado muy buenos resultados. (Kim, YH. 2014; Khan, A. 2015). Sin embargo, debido a su alto precio, resulta difícil su recomendación sin considerar la influencia del entorno socioeconómico del paciente.
5. ONMRM: ¿entidad patológica en sí o sobreinfección de una herida?
Algunos autores, incluidos los de este artículo, creen que la infección sería un factor clave en el desarrollo de lesiones osteonecróticas, (Filleul, O. 2010; Khan, A. 2015; Khan, A. 2016; Fernández, E. 2015; Kim, KM. 2015; Matsumoto, A. 2017). Incluso se ha propuesto que la infección de la herida post-exodoncia podría ser el factor causal primordial de ONMRM, y no la medicación antirresortiva o antiangiogénica en sí, (Katsarelis, H. 2015; Otto, S. 2015; Saia, G. 2010; Fernández, E. 2015). Sorprendentemente, existe gran cantidad de evidencia a favor de esta afirmación. Por ejemplo: se describen en la literatura, áreas expuestas de hueso necrótico que pueden permanecer asintomáticas por semanas, meses y años, pero que se transforman en lesiones sintomáticas cuando la infección y la inflamación toman parte, (Khan, A. 2015; Fliefel, R. 2015). Tal como se explicó en un apartado anterior, contamos con evidencia experimental la cual advierte que la infección y el uso de BF son condiciones suficientes para producir ONMRM, (Katsarelis, H. 2015; Kim, KM. 2015).
Conjuntamente, la resorción ósea presente en las lesiones osteonecróticas no se puede fundamentar debido a una alta actividad osteoclástica si los pacientes están bajo terapia antirresortiva, (Wagner, G. 2013), cuya función es justamente inhibir la actividad de los osteoclastos. El inesperado incremento de la reabsorción ósea en presencia de BF, se podría explicar considerando las comunidades microbianas tipo biofilm que infiltran la estructura del hueso afectado y los tejidos blandos que circundan la herida, (Ruggiero, S. 2014; Katsarelis, H. 2015; Mozzati, M. 2013), y que participan activamente en la disolución mineral, (Khan, A. 2015; Wagner, G. 2013; Hellstein, JW. 2011; Migliorati, CA. 2013), y resorción osteoclástica en la superficie del hueso, (Khan, A. 2015; Khan, A. 2016). La estructuración en forma de biofilm, hace a las bacterias más resistentes a las defensas del hospedero y a la fármacoterapia antibiótica, (Katsarelis, H. 2015; Wagner, G. 2013; Fernández, E. 2015). Varios autores, (Filleul, O. 2010; Hellstein, JW. 2011; Hellstein, JW. 2011; Valour, F. 2014) informan infección por actinomyces en estudios histológicos con áreas de exposición ósea. Otros investigadores, (Filleul, O. 2010; Katsarelis, H. 2015; Albu-Stan, IA. 2017; Silva LF. 2016; Vera-Sirera, B. 2012; Valour, F. 2014), destacan específicamente la presencia de actinomyces israelii (AI) en un 70 a 100% de las muestras provenientes de lesiones de ONMRM. Se cree que los AI facilitan la adherencia de más microflora bucal, y reducen la tensión de oxígeno, contribuyendo a la iniciación y desarrollo de la infección, y a la generación de un biofilm for talecido y heterogéneo, (Crincoli, V. 2015; Valour, F. 2014). Si bien el AI es un microorganismo comensal de nuestra flora normal, es responsable del 70% de infecciones orocervicofaciales, por lo que se considera que la infección por actinomices es una de tipo endógena incitada por una lesión mucosa, (Valour, F. 2014). Según Katsarelis los BF se podrían encontrar relacionados de una manera diferente a la aparición de ONMRM: causa una pérdida en la capacidad reactiva de los macrófagos y disminuye el crecimiento y proliferación de células epiteliales, favoreciendo la persistencia del cuadro infeccioso causado por el biofilm, (Katsarelis, H. 2015). Con toda seguridad, la infección desempeña un papel crucial en la patogénesis de esta condición patológica, lo que subraya la importancia clave de tratar esta infección (Khan, A. 2015).
Si la infección de la herida fuese la clave en la etiopatogenia de la ONMRM, las implicancias serían varias, y muy significativas: primero que todo, se explicaría la baja incidencia de ONMRM entre pacientes que utilizan terapias antirresortivas, antiangiogénicas o de inhibidores de RANKL. Si el mero uso de estos fármacos provocara ONMRM, la incidencia debiese ser mayor. Teniendo en cuenta el bajo valor predictivo positivo entre ambos factores, es difícil llegar a la conclusión de que el uso de BF está causalmente asociado con la ONMRM, (Kim, HY. 2017). Segundo, ayudaría a dilucidar porqué la mayor incidencia de este síndrome ocurre en maxilas y mandíbulas: las condiciones higiénicas del entorno bucal post-exodoncia, son las que podrían devenir como factores de riesgo para la generación de una ONMRM. Tercero, se entendería que las terapias complementarias que dificultan el crecimiento de microorganismos, como por ejemplo, el oxígeno hiperbárico, resulten ser tan eficaces, (Vera-Sirera, B. 2012) y el porqué del éxito inicial, aunque limitado, de las terapias paliativas que contemplan colutorios antisépticos y uso de antibióticos pre y postoperatorios. Cuarto, se justificaría el éxito de los protocolos quirúrgicos que incluyen colgajo y sutura: esta última cubre los sitios de extracción, aislándolos del contacto con biofilm bucal (Saia, G. 2010; Girbone J. 2013; Matsumoto, A. 2017). Lo mismo en el caso de la remoción de espículas óseas: su eliminación tendría más que ver con evitar la perforación e infección de las mucosas, que con eliminar hueso de poca capacidad reparativa, (Fernández, E. 2015; Mozzati, M. 2013; Matsumoto, A. 2017). Quinto, pero relacionado intrínsecamente con el ítem anterior, se explicaría también cómo una prótesis fija o removible en mal estado pueden causar una lesión osteonecrótica. Se ha descrito que las prótesis removibles desajustadas, ya sea por confección o por vencimiento de su vida útil, en conjunción con torus mandibular, torus palatino y líneas milohioídeas recubiertas con mucosa bucal muy delgada, generan condiciones propicias para una potencial ONMRM, (Arbildo-Vega, A. 2014; Ruggiero, S. 2014; Heufelder, M. 2014; Fernández, E. 2015; Niibe, K. 2015). El trauma causado produce úlceras bucales, que al ser infectadas con biofilm, pueden transformarse en sitio de lesión de ONMRM, (Ruggiero, S. 2014; Khan, A. 2016; Fernández, E. 2015; Niibe, K. 2015), sin exodoncias de por medio. Los pacientes y los dentistas, debiesen ser cautelosos en prevenir la perforación mucosa traumática por prótesis dentales (Poxleitner, P. 2017; Matsumoto, A. 2017), por lo que los controles en estos casos, deben ser más seguidos. Es crítico que estos pacientes sean educados en cuanto al uso y mantención de sus prótesis, tomando precaución de consultar ante cualquier molestia, dolor, inflamación o exposición ósea, (Ruggiero, S. 2014; Poxleitner, P. 2017). El rebasado blando también sería una opción válida de tratamiento, con el fin de evitar úlceras por presión o roce, (Girbone J. 2013). Sexto: la nula preponderancia estadística del drug holiday descrita en importantes meta-análisis, (Rupel, K. 2014) y estudios retrospectivos, (Hasegawa T. 2017), resultaría razonable. Por último, si efectivamente la infección por biofilm dental juega un rol superlativo en la etiopatogenia de la ONMRM, el tratamiento odontológico previo en pacientes candidatos a terapias con antirresortivos, inhibidores de RANKL o antiangiogénicos, debiese ser un factor adicional transcendental a incluir dentro de los protocolos médicos de tratamiento de estas personas. Después de todo, el destartraje, tratamientos periodontales, eliminación de lesiones de caries activas y dientes con mal pronóstico, disminuirían el número de bacterias presentes en boca, (Beth-Tasdogan, NH. 2016; Albu- Stan, IA. 2017), aumentando las probabilidades de evitar lesiones de ONMRM, y mejorando la calidad de vida de los pacientes.
Conclusiones
Un tratamiento dental rutinario no debe ser aplazado sólo porque el paciente utiliza agentes antirresortivos o antiangiogénicos. Según la literatura actual, se podrían realizar exodoncias en individuos bajo estas terapias, evitando el drug holiday, siempre y cuando se sopese los factores de riesgo individuales, y el enfoque esté en llevar a cabo una correcta técnica quirúrgica evitando la infección de la herida. Si la ONMRM se instala, se recomienda eliminar el hueso necrótico y cubrir la herida más eventual indicación de antibioterapia. Así, la aislación del hueso del biofilm dental, favorecerá la reparación y cicatrización del sitio. Se agrega a lo anterior, las implicancias y cuidados adicionales que se debe tener en odontología prostodóntica respecto del correcto ajuste y alivio protésico. El hecho de que actualmente la literatura tienda a clasificar las exodoncias en estos pacientes como un procedimiento seguro, es un gran cambio respecto a las primeras instrucciones terapéuticas.
Es una tarea pendiente llevar a cabo estudios prospectivos en relación con la evolución cicatrizal de alvéolos dentales en pacientes bajo terapia antirresortiva con BF v/s aquellos bajo terapia con agentes anabólicos - que además cuenten con grupos control - los que de seguro proveerán nueva y valiosa información respecto de la especificidad histológica y fisiológica de las células del tejido óseo en cuestión. La generación casi excluyente de ONMRM en estos huesos, podría explicarse a partir del hecho de que la mayoría de estudios son realizados en osteocitos aislados de huesos craneales y largos, y muy escasamente en los huesos maxila o mandíbula. Esto es relevante, ya que la biología de los osteoblastos y osteoclastos de los huesos antes mencionados, no necesariamente es similar en todos los aspectos a la observada en las células óseas de otras áreas (calvaria-fíbula), (Vasta A, 2008).
Autores:
Enrique Fernández M.
Cirujano dentista. D.D.S. Especialista en Rehabilitación Oral. Profesor asistente.
Docente de Pregrado Clínica Integrada del Adulto I y II. Docente de Postgrado de Rehabilitación Oral. Universidad San Sebastián. Santiago de Chile. Paula Padilla A. Cirujano dentista. D.D.S. Especialista en Rehabilitación Oral. Docente Clínica Integrada
del Adulto I y II. Universidad San Sebastián. Santiago de Chile. Christopher Reyes Cirujano dentista. Universidad San Sebastián. Santiago de Chile. David Lisboa Cirujano dentista. D.D.S. Especialista en Cirugía y Traumatología Buco Maxilo Facial. Hospital de Angol, IX Región, Chile. CHILE