Introducción
Hans Peter Bimler propuso que los aparatos ortopédicos funcionales trabajan con control de acción intrínseco, lo que significa que el paciente alimenta inconscientemente, con ayuda del sistema de reflejos neuromusculares, la fuerza de acción de dichos aparatos sobre los dientes, periodonto y maxilares (Bimler y Bimler, 1985). A pesar del tiempo transcurrido dicha propuesta se mantiene estable; sin embargo, son los procesos celulares y moleculares subyacentes a la estimulación ortopédica funcional (EOF) los que se han ido profundizando (Haugh et ál., 2015; Hu et ál., 2015; Rosa et ál., 2015).
Muchos procesos fisiológicos están basados en procesos moleculares.
En el caso de la EOF se ha sugerido una serie de segundos mensajeros (o señales intracelulares) que explicarían su mecanismo de acción.
Entre estas señales se describirán aquellas que juegan un rol más prominente con respecto a otras: óxido nítrico (NO), la prostaglandina E2 (PGE2), el Ca2+ y las conexinas (Loiselle et ál., 2013; Nguyen y Jacobs, 2013; Thompson et ál., 2012).
La revisión procura actualizar puntualmente algunos de los más importantes mecanismos celulares y moleculares originados por la EOF, incidiendo en el rol central que cumplen los osteocitos en respuesta a dicha estimulación (Prideaux et al., 2016; Rosa et al., 2015).
Se buscaron artículos del 2000 al 2016 en las bases de datos PubMed, ScienceDirect y Google Scholar empleando los términos: estimulación mecánica, tejido óseo, osteocitos, mecantransducción, uniones comunicantes, conexinas, ortopedia funcional y ortopedia funcional de los maxilares, tanto en español como en inglés. Se seleccionaron 28 artículos, además se incluyen en la bibliografía 5 libros de la especialidad y 1 artículo histórico.
El estímulo ortopédico funcional
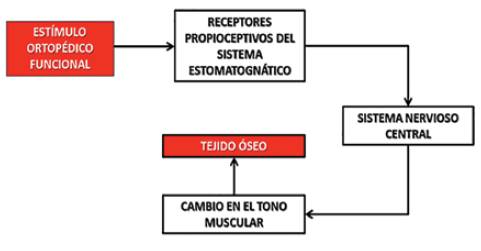
Uno de los efectos más importantes de la EOF sobre el sistema estomatognático es la activación neural (Simões et ál., 2013). La EOF activa terminaciones nerviosas sensitivas llamadas propioceptores: en el periodonto, en la articulación temporomandibular, en la lengua, en mucosa bucal y en los músculos del sistema estomatognático (Simões et ál., 2013). De todos estos componentes, que principalmente reciben la inervación del nervio trigémino, parten las vías aferentes que llevan la información al sistema nervioso central (Simões, 2004). Esta información aferente es interpretada en áreas sensibles del neocórtex y del tronco encefálico, de donde parten las vías eferentes, que generan cambios en los tonos musculares produciendo así la activación mecánica necesaria para modular el crecimiento y desarrollo del tejido óseo como se gráfica en la figura 1 (Simões, 2004; Planas, 2008; Queiroz et ál., 2012; Sakai et ál., 2012).
El concepto de enthesis y la mecanotransducción del estímulo ortopédico funcional
La interfase entre los tendones y el hueso recibe el nombre de enthesis (Liu et ál.,2012). Las enthesis varían en grosor desde unos pocos micrómetros hasta unos cuantos milímetros y pueden ser de naturaleza fibrosa o fibrocartilaginosa, lo que contribuye a una eficiente transferencia de la carga muscular hacia el tejido óseo (Liu et ál., 2012; Schwartz et ál., 2012). En otras palabras, la enthesis es la zona donde la información mecánica, en el presente trabajo la estimulación ortopédica funcional, es transmitida hacia el tejido óseo.
El tejido óseo y los osteocitos
El tejido óseo es particularmente dependiente de la estimulación mecánica, la cual guía a su población de células residentes hacia la adaptación, mantenimiento y reparación (Buo y Stains, 2014; Thompson et ál., 2012). El hueso presenta tres poblaciones celulares que regulan su metabolismo: osteoblastos, osteoclastos y osteocitos, y son estos últimos los que forman redes interconectadas con otros similares, gracias a sus prolongaciones celulares que se extienden mediante canalículos; además, dichas células se conectan con los osteoblastos y osteoclastos de la superficie ósea (Prideaux et ál., 2016; Jing et ál., 2013; Mullen et ál., 2013).
Los osteocitos son la población celular predominante en el tejido óseo, aproximadamente entre el 90 a 95% del total de células de dicho tejido; y están distribuidas a través de toda la matriz calcificada, lo cual les confiere una ubicación estratégica y un rol central en el metabolismo óseo (Prideaux et ál., 2016; Mullen et ál., 2013; Tatsumi et ál., 2007). Actualmente, es ampliamente aceptado que las cargas mecánicas impuestas a los huesos activan al flujo de líquido intersticial que se encuentra a través de la matriz circundante no mineralizada que rodea a los osteocitos y a sus prolongaciones celulares. Se piensa que de alguna manera este flujo activa los osteocitos, produciendo moléculas de señalización que regularían la actividad del resto de células óseas (Rosa et ál., 2015; Spyropoulou et ál., 2015; Klein-Nulend et ál., 2013). Justamente, el proceso por el cual estás cargas mecánicas son transformadas en señales bioquímicas es denominado mecanotransducción, lo cual permite la adaptación del tejido óseo y su homeostasis. La mecanotransducción ha sido descrita como un proceso compuesto por una serie de pasos: (1) La carga mecánica induce una señal física a nivel celular que es detectada por el osteocito; (2) la señal física es transformada por el osteocito en una señal bioquímica y (3) la señal bioquímica es movilizada dentro del osteocito y transmitida a las células efectores, los osteoblastos y osteoclastos (Haugh et ál., 2015; Rosa et ál., 2015; Temiyasathit y Jacobs, 2010).
Los mecanosensores y el rol de las uniones comunicantes
El paradigma actual es que la tensión de cizallamiento inducida por el flujo del líquido intersticial que fluye a lo largo del cuerpo y de los procesos celulares del osteocito es el modo por el cual la carga mecánica afecta el metabolismo de dichas células, y en cuestión de segundos a minutos, activa múltiples vías de señalización intracelular y extracelular (Rosa et ál, 2015; Temiyasathit & Jacobs, 2010). Se han propuesto varias estructuras por medio de las cuales los osteocitos detectarían las cargas mecánicas e iniciarían la cascada de señalización, todas ellas están dentro del concepto de mecanosensor que se puede definir como una molécula, complejo molecular o estructura biológica capaz de detectar cambios en el medio circundante relacionado con alteraciones físicas en el entorno (Takano- Yamamoto, 2014; Vaughan et ál. 2013; Fujita et ál., 2012; Thompson et ál., 2012). Dentro de los mecanosensores que se han sugerido para el osteocito figuran: las integrinas, las conexinas hemicanales y los canales iónicos; sin embargo, es el cilio primario, una estructura microtubular que protruye desde la membrana celular como una antena, el óptimo candidato para ser el principal mecanosensor (Takano- Yamamoto, 2014; Klein-Nulend et ál., 2013; Kaiser et ál., 2012; Malone et ál., 2007).
Se ha encontrado que el flujo de cizallamiento del líquido intersticial que rodea al osteocito produce movilización (activación) de los cilios primarios de dicha célula como se observa en la figura 2.
Consecuencia de dicha activación se incrementa intracelularmente la expresión génica de la enzima ciclooxigenasa tipo 2 (Cox-2), PGE2, NO, adenosin trifosfato (ATP) y Ca2+, y este ion es un importante regulador de diversos procesos celulares, como la transcripción génica, la respuesta inmune y la proliferación celular (Nguyen y Jacobs, 2013; Klein-Nulend et ál., 2013; Ishihara et ál., 2013; Lu et ál., 2012). Además, la movilización del Ca2+, tanto intracelular como extracelularmente, es uno de los eventos iniciales en el proceso de mecanotransducción (Nguyen y Jacobs, 2013; Rosa et ál., 2015; Ishihara et ál., 2013; Kaiser et ál., 2012; Lu et ál., 2012).
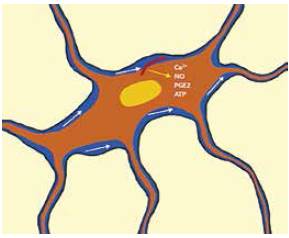
La movilización del cilio primario (línea roja curvada) por el flujo del líquido intersticial (banda azul que rodea al cuerpo y prolongaciones del osteocito) es transformado intracelularmente en señales bioquímicas como son el Ca2+, el óxido nítrico (NO,) la prostaglandina E2 (PGE) y el ATP, adaptado de Nguyen y Jacobs, 2013
Figura 2 Movilización del cilio primario y la mecanotransducción en el osteocito
Las moléculas mencionadas en el párrafo anterior, circulan entre los osteocitos y llegan hasta los osteoblastos y osteoclastos mediante uniones comunicantes (Loiselle et ál., 2013). Las uniones comunicantes son estructuras conformadas por la unión de dos hemicanales o conexonas que se acoplan en las membranas de dos células adyacentes; cada conexona está formada por 6 moléculas llamada cada una conexina (Loiselle et ál., 2013.; Batra et ál., 2012). Se han descrito 21 isoformas de conexinas en humanos, los cuales muestran una alta homología, y son conservados evolutivamente entre las diferentes especies. Cada conexina recibe su nombre de acuerdo con su peso molecular y son altamente reguladas debido a su corta vida media de sólo unas pocas horas (Buo y Stains, 2014; Temiyasathit y Jacobs, 2014; Loiselle et ál., 2013; Batra et ál., 2012). Se ha encontrado que las conexinas se incrementan en respuesta a necesidades biológicas, como por ejemplo el originado por un estímulo mecánico; lo cual sugiere que los osteocitos generan una mejor conexión entre sí en respuesta a la función (Merrifield et ál., 2016; Thomson et ál., 2012; Turner et ál., 2002;). La interconexión entre los osteocitos y de ellas con los osteoblastos y osteoclastos hace que el hueso se comporte como un sincitio, similar en funcionamiento al músculo liso o al músculo cardiaco como se observa en la figura 3 (Prideaux et ál., 2016; Merrifield et ál., 2016; Klein- Nulend et ál., 2013; Mason, 2004).
Se ha demostrado que las conexinas que se encuentra en los osteocitos regulan la liberación y el transporte de ATP, Ca2+, adenosin monofostato cíclico (AMPc), PGE2 y NO, y esta última molécula promueve la formación ósea e inhibiendo la reabsorción, en respuesta al estímulo mecánico (Stains & Civitelli, 2016; Batra et ál., 2012; Ishihara et ál., 2013; Klein-Nulend et ál., 2013). Las conexinas son esenciales para las comunicaciones intercelulares en las células óseas, encontrándose en los mamíferos principalmente las isoformas Cx45, Cx26 y Cx43 (Klein-Nulend et ál., 2013; Loiselle et ál., 2013; Batra et ál., 2012). La Cx43 es la conexina predominante en el hueso, y se demuestra en roedores que la supresión de dicha molécula exhibe un incremento en la apoptosis de los osteocitos, lo que lleva a una pérdida neta de tejido óseo con incremento de la reabsorción y la osteoclastogénesis; emergiendo dicha conexina como un modulador clave en el crecimiento y en la homeostasis ósea (Stains y Civitelli, 2016; Loiselle et ál., 2013; Batra et ál., 2012).
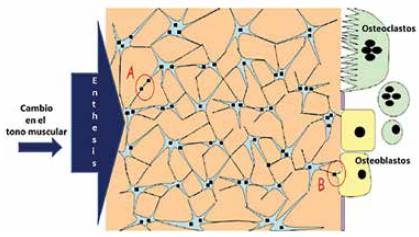
Se observa que las enthesis trasmiten el cambio en el tono muscular, lo cual produce la formación de señales bioquímicas (cuadraditos negros) en los osteocitos y la movilización de dichas señales mediante las uniones comunicantes (A). Además, dichas moléculas son transportadas hasta las células efectoras (B), adaptado de Mason, 2004.
Figura 3 Funcionamiento del tejido óseo como un sincitio
Conclusión
Lo encontrado en la presente revisión nos permite entender algunas de las vías celulares y moleculares que se activan ante la terapia ortopédica funcional, lo cual es muy importante, debido a que dichos mecanismos biológicos podrían explicar las respuestas clínicas que se observan en los pacientes sometidos a dicha terapia; aunque, claro está, que dichos hallazgos se han obtenido de investigaciones in vitro y, principalmente, en animales de experimentación; faltaría realizar diversos estudios clínicos que confirmen lo expuesto en el presente trabajo.
Elías Ernesto Aguirre Siancas,
Filiación institucional: Docente e investigador.
Departamento de Ciencias Básicas.
Facultad de Odontología de la Universidad
Nacional Mayor de San Marcos
Silvia Granados Martínez,
Filiación institucional: Facultad de Odontología
de la Universidad Nacional Federico
Villarreal
País: Perú
Correo: elias_aguirre@yahoo.com /
elias.aguirre@unmsm.edu.pe
Agradecimientos:
Al Dr. Róger López Bellido, por sus importantes sugerencias en la mejora del presente
trabajo