Tabla de contenido
1. Paciente geriátrico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61
Recomendaciones generales para pacientes geriátricos . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61
1.1 Función neurocognitiva . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62
Recomendaciones para función neurocognitiva . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62
1.2 Manejo de hipoglucemia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63
Recomendaciones para manejo de hipoglucemia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63
1.3 Metas de tratamiento . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63
Recomendaciones para metas de tratamiento . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 64
1.4 Manejo del estilo de vida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
Recomendaciones sobre manejo del estilo de vida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
1.5 Terapia farmacológica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
Recomendaciones sobre terapia farmacológica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
1.5.1 Metformina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
1.5.2 Tiazolidinedionas . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 66
1.5.3 Sulfonilureas . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 66
1.5.4 Inhibidores de la dipeptidil peptidasa-4 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 66
1.5.5 Agonistas del receptor del péptido similar al glucagón tipo1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 66
1.5.6 Inhibidores del cotransportador de sodio-glucosa 2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 66
1.5.7 Terapia con insulina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67
1.5.8 Consideraciones para la simplificación y desintensificación / retiro de prescripción del régimen de
tratamiento en adultos mayores con diabetes . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67
1.5.9 Cuidados al final de la vida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 68
Recomendaciones para cuidados al final de la vida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 68
1.5.10 Manejo de la nutrición por inactividad física en adultos mayores con diabetes . . . . . . . . . . . . . . . . . . . . . . . . . . 69
1.5.10.1 Inactividad física . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 70
1.5.10.2 Cambios en el peso corporal . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 70
1.5.10.3 Ingesta adecuada de energía, macro-micronutrientes en adultos mayores con diabetes . . . . . . . . 70
1.5.10.4 La dieta mediterránea y la dieta saludable . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 71
2. Paciente nefrópata . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 71
Recomendaciones para pacientes nefrópatas . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 72
2.1 Diagnóstico . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 72
2.2 Enfermedad renal crónica en paciente diabético . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 72
2.2.1 Consideraciones de tratamiento farmacológico de ERC . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 74
2.2.2 Criterios de referencia para atención renal especializada . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 74
3. Paciente con enfermedad hepática crónica . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 75
3.1 Consideraciones de tratamiento farmacológico de EHC . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 76
REFERENCIAS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 80
Recibido 01-VI-2022. Aceptado 24-VI-2022
Tabla 1 Abreviaturas
| Abreviatura | Significado |
| AINE | Antiinflamatorios no esteroideos |
| BRA | Bloqueador del receptor de angiotensina |
| CHC | Carcinoma hepatocelular |
| CV | Cardiovascular |
| DM | Diabetes mellitus |
| DMT1 | Diabetes mellitus tipo 1 |
| DMT2 | Diabetes mellitus tipo 2 |
| DPP-4 | Inhibidores de la dipeptidil peptidasa |
| ECA | Enzima convertidora de angiotensina |
| ECV | Enfermedad cardiovascular |
| ECVAS | Enfermedad cardiovascular aterosclerótica |
| EHC | Enfermedad hepática crónicas |
| EPA | Ácido eicosapentanóico |
| ERC | Enfermedad renal crónica |
| GLP-1 | Péptido similar al glucagón tipo 1 |
| HbA1c | Hemoglobina glicosilada |
| ICC | Insuficiencia cardíaca congestiva |
| IMC | Índice de masa corporal |
| MCG | Monitoreo continuo de la glucosa |
| PUFA | Ácidos grasos poliinsaturados |
| RAC | Relación albúmina creatinina |
| SGLT-2 | Cotransportador sodio-glucosa tipo 2 |
| TFGe | Tasa de filtración glomerular estimada |
| UACR | Creatinina en orina puntual aleatoria |
| ω-3FA | Ácidos grasos omega-3 |
1. Paciente geriátrico
Recomendaciones generales para pacientes geriátricos
Fuente: Diabetes Care 44.Supplement 1 (2021): S168-S179.
La diabetes es una condición de salud muy prevalente en la población general. Sin embargo, la prevalencia se dispara en la población mayor, ya que más de una cuarta parte de las personas por arriba de los 65 años tienen diabetes y la mitad de los adultos mayores cumplen criterios para intolerancia a los carbohidratos.1,2 Se espera que la cantidad de personas mayores que viven con estas afecciones aumente rápidamente en las próximas décadas y con ellos el número de casos, lo que hace que el manejo clínico integral de la diabetes en este grupo poblacional requiera una evaluación regular de los dominios médicos, psicológicos, funcionales y sociales.3general treatment goals and guidelines, and tools to evaluate quality of care. Members of the ADA Professional Practice Committee, a multidisciplinary expert committee (https://doi.org/10.2337/dc21-SPPC
En los adultos mayores, la diabetes mellitus (DM) se relaciona con una mayor mortalidad, un estado funcional reducido, deterioro cognitivo y un mayor riesgo de institucionalización. Estos pacientes tienen un proceso de envejecimiento acelerado, el cual se relaciona con pérdida de fuerza y masa muscular acentuada y enfermedades coexistentes, como hipertensión arterial, enfermedad coronaria y accidente cerebrovascular, además de un riesgo sustancial de complicaciones microvasculares y complicaciones agudas de la enfermedad.4
La atención de los adultos mayores diabéticos debe realizarse de forma individualizada y periódica para detección temprana de complicaciones de la DM, ya que los resultados de las pruebas de detección pueden afectar los objetivos y los enfoques terapéuticos4-6. Al mismo tiempo, los adultos mayores diabéticos también tienen un mayor riesgo de padecer varios síndromes geriátricos comunes, como la polifarmacia, el deterioro cognitivo, la depresión, la incontinencia urinaria, la malnutrición, la sarcopenia, las caídas lesivas y el dolor persistente; comparado con otros que no tienen diabetes.1
Estas condiciones pueden afectar la capacidad de autocontrol de la diabetes y, por lo tanto, la calidad de vida de los adultos mayores si no se abordan adecuadamente.2,7,8
Es importante realizar una evaluación geriátrica integral, la cual incluya el estado funcional, cognitivo, mental y social del paciente, para identificar sus objetivos glucémicos y la terapia más adecuada con el fin de reducir la glucosa; esta última centrada en las preferencias, las necesidades, la expectativa de vida y los riesgos individuales del paciente,9 incluyendo educación apropiada para el autocontrol de la diabetes, tanto para el paciente como para sus cuidadores. Se debe prestar especial atención a las complicaciones que pueden desarrollarse en períodos cortos y/o que deteriorarían significativamente el estado funcional, como complicaciones visuales y de las extremidades inferiores (vasculares, neuropatía).2
1.1 Función neurocognitiva
Recomendaciones para función neurocognitiva
Fuente: Diabetes Care 44.Supplement 1 (2021): S168-S179.
El deterioro cognitivo varía desde una disfunción sutil hasta pérdida de memoria y demencia manifiesta que implica la pérdida de capacidad para realizar las actividades de la vida diaria de manera independiente.10,11 Los pacientes diabéticos tienen una mayor incidencia de demencia por todas las causas, enfermedad de Alzheimer y demencia vascular, que las personas sin diabetes.12 Un control deficiente de la glucemia se asocia con una disminución de la funcióncognitiva y una mayor duración de la DM se asocia con un empeoramiento de la función cognitiva.
En varios estudios clínicos, se ha evaluado si prevenir o retrasar la aparición de la DM puede ayudar a mantener la función cognitiva en los adultos mayores.13,14 Sin embargo, los estudios en los que se evalúan los efectos del control intensivo de la glucemia y la presión arterial para lograr objetivos específicos no han demostrado una reducción en el deterioro de la función cerebral.15,16 En algunos pacientes, el deterioro cognitivo puede ser secundario a los medicamentos y no a la diabetes en sí; por ejemplo, hipoglucemia asociada con deterioro cognitivo y esto es importante a la hora de evaluar funcionalidad del paciente y escoger un medicamento. En ese contexto, algunos estudios clínicos de intervenciones específicas, incluyendo los inhibidores de la colinesterasa y los antagonistas glutamatérgicos, no han demostrado un beneficio terapéutico positivo para mantener o mejorar significativamente la función cognitiva o prevenir el deterioro cognitivo.17
Los estudios en pacientes con deterioro cognitivo leve que evalúan los beneficios potenciales de la terapia con insulina intranasal y la terapia con metformina brindan información precisa para futuros estudios clínicos y estudio de mecánica cognitiva.18-20
Para tratar la disfunción cognitiva, es fundamental simplificar los regímenes de tratamiento con el propósito de facilitar e involucrar la estructura de apoyo, además de adecuar objetivos terapéuticos de hemoglobina glicosilada (HbA1c) según estratificación previa, para así ayudar al paciente en todos los aspectos del cuidado de su salud.3
Además, es fundamental reducir al máximo la variabilidad glucémica, especialmente las hipoglucemias.
A fin de detectar el deterioro cognitivo de los adultos mayores con diabetes, es preciso realizar evaluaciones y monitoreos21,22 utilizando herramientas disponibles para este fin, tales como:
Estas herramientas pueden ayudar a identificar a los pacientes que requieren una evaluación neuropsicológica, en particular aquellos en los que se sospecha demencia (por ejemplo, que experimentan pérdida de memoria y deterioro en sus actividades básicas e instrumentales de la vida diaria).
También resultan importantes para la detección de cuadros depresivos, ya que hasta un 30 % de los adultos mayores con diabetes presentan síntomas depresivos y entre 12-18 % cumplen criterios de Depresión Mayor.26
En adultos de 65 años o más, debe realizarse una evaluación anual a fin de detectar de forma temprana el deterioro cognitivo leve o demencia. Además, se debe considerar la detección de deterioro cognitivo cuando se observa un deterioro significativo del estado clínico del paciente debido a un aumento de los problemas con las actividades de autocuidado personal, como errores en el cálculo de la dosis de insulina, dificultad para contar los carbohidratos, comidas omitidas, olvido de dosis de insulina y dificultad para reconocer, prevenir o tratar la hipoglucemia. En presencia de un resultado positivo en la detección de deterioro cognitivo, se debe realizar una evaluación de diagnóstico al paciente, incluida la referencia a un proveedor de salud para una evaluación cognitiva / neuropsicológica formal.27,28
1.2 Manejo de hipoglucemia
Recomendaciones para manejo de hipoglucemia
Fuente: Diabetes Care 44.Supplement 1 (2021): S168-S179.
El riesgo de hipoglucemia es mayor en adultos mayores por varias razones: muchos medicamentos necesitan ajuste de dosis por disminución de la tasa de filtración glomerular estimada (TFGe), además de que el uso de insulina es mayor en estos pacientes por contraindicación o fallo de otros fármacos; esto también se ve afectado por los cambios en la alimentación y malnutrición asociada, pues eso lleva a cambios de composición corporal, lo que afecta directamente la respuesta al tratamiento.9,29
Los pacientes mayores de75 años tienen dos veces más riesgo de requerir atención en los servicios de emergencias debido a la hipoglucemia que la población general con diabetes.4
Esto puede ser peligroso en caso de pacientes que vivan solos o que requieran asistencia para sus actividades básicas y no sean capaces de resolver la hipoglucemia por sí mismos.
Como se describió anteriormente, tasas elevadas de deterioro cognitivo no identificado y demencia en adultos mayores dificultan el cumplimiento de actividades de cuidado personal (por ejemplo: control de glucosa, ajuste de la dosis de insulina, actividad física, etc.). Existe una relacionada bidireccional entre la hipoglucemia y la disfunción cognitiva: el deterioro cognitivo aumenta el riesgo de hipoglucemia y los antecedentes de hipoglucemia severa están relacionados con la incidencia de demencia.30-33 Por ende, es importante realizar evaluaciones frecuentes y rutinarias a los adultos mayores a fin de detectar de forma temprana el deterioro cognitivo y la demencia, así como para discutir los resultados de estas evaluaciones con los pacientes y sus cuidadores.
Para el Centro de Control y Prevención de Enfermedades, es importante detectar cuando el paciente salta tiempos de comida o repite dosis de su medicación, ya que podría requerirse un ajuste en los objetivos de glucemia y los regímenes farmacológicos según estratificación previa.2
Múltiples estudios controlados aleatorios, como el estudio Action to Control Cardiovascular Risk in Diabetes (ACCORD)34 y el Veterans Affairs Diabetes Trial (VADT),35 demostraron que los protocolos de tratamiento intensivo con esquemas de tratamiento complejos, con meta de HbA1c en valores <6.0 %, aumentaron significativamente el riesgo de hipoglucemia que requería asistencia en comparación con el tratamiento estándar. Estos regímenes de tratamiento intensivo incluían un uso extensivo de insulina y un uso mínimo de agonistas del receptor del péptido similar al glucagón tipo 1 (GLP-1). No obstante, en esa época no estaban disponibles los inhibidores del cotransportador de sodio-glucosa tipo 2 (SGLT-2).3
Para los pacientes diabéticos mayores, la monitorización continua de la glucosa (MCG) y el acompañamiento en programas de educación tanto para familiares como pacientes son herramientas útiles para el correcto manejo y la prevención de hipoglucemias.
1.3 Metas de tratamiento
Debido a la heterogeneidad clínica, cognitiva y funcional de los adultos mayores diabéticos, su manejo podría complicarse. Algunos adultos mayores pueden haber sido diagnosticados con diabetes muchos años antes y haber desarrollado complicaciones importantes; otros pueden tener diagnóstico reciente, pero una diabetes no diagnosticada desde muchos años antes, lo que implica más complicaciones; mientras que otros pueden tener una enfermedad de inicio realmente reciente con pocas o ninguna complicación.36 Otros adultos mayores diabéticos tienen diferentes comorbilidades asociadas, deterioro en funcionamiento cognitivo o físico limitado o fragilidad.37,38 También hay adultos mayores diabéticos que son robustos, con mínima comorbilidad y que son activos. La expectativa de vida de cada uno es muy variable, pero a menudo es más larga de lo que los médicos estiman. (Tabla 2)
Existen diferentes herramientas para el pronóstico de la esperanza de vida incluso para los adultos mayores diabéticos.39,40 También se tienen disponibles marcadores en la evaluación de desempeño, como la velocidad de marcha, donde velocidades de la marcha menores de 0.8 m/segundo sugieren deterioro cognitivo y mayor riesgo de caídas.41
Es importante tomar en cuenta esta heterogeneidad y establecer objetivos de tratamiento dependiendo de la condición particular de los pacientes adultos mayores diabéticos.3,9
Las metas glucémicas pueden ser menos intensivas para algunos adultos mayores diabéticos, pero es importante considerar las complicaciones avanzadas de la diabetes y sus comorbilidades que limitan la vida, así como deficiencias cognitivas y funcionales. Por esta razón, es importante evaluarlos de forma individualizada, ya que estos pacientes tienen mayores probabilidades de sufrir efectos adversos graves por hipoglucemia y menor beneficio con la reducción del riesgo de complicaciones microvasculares que ofrece el control intensivo:3
Para pacientes con una diabetes mal controlada que presentan complicaciones agudas (deshidratación, mala cicatrización de heridas y coma hiperosmolar hiperglucémico), los objetivos glucémicos se deben orientar a evitar estas complicaciones.
Para los pacientes que reciben cuidados paliativos y cuidados al final de la vida, el enfoque debe ser evitar la hipoglucemia y la hipoglucemia sintomática, mientras se reducen las cargas del manejo glucémico.
Para pacientes con falla de órganos, hay que reducir dosis o suspender varios fármacos.
Para el paciente terminal, pueden eliminarse la mayoría de los hipoglucemiantes para el manejo de la diabetes mellitus tipo 2 (DMT2), pero no existe consenso para el manejo de la DMT1 en este escenario.42
Tabla 2 Objetivos de glucemia, presión arterial y dislipidemia en adultos mayores diabéticos
| Características del paciente/ estado de salud | Racional | Objetivos de HbA1c | GPA o GP-2h | Glucosa a la hora del sueño | Presión arterial | Lípidos |
| Saludable (pocas enfermedades crónicas coexistentes, estado cognitivo y funcional intactos) | Mayor esperanza de vida (> 10 años). | <7.0-7.5 % (53-58 mmol/mol) | 80-130 mg/ dL (4.4-7.2 mmol/L) | 80-180 mg/ dL (4.4-10.0 mmol/L) | <140/90 mmHg | Estatinas, a menos que estén contraindicadas o no sean toleradas. |
| Complicado / intermedio (múltiples enfermedades crónicas coexistentes o discapacidades de 2+ actividades de la vida diaria o discapacidad cognitiva leve o moderada). | Expectativa de vida intermedia (5-10 años), carga alta de tratamiento, vulnerabilidad a hipoglucemia, riesgo de caída. | <8.0 % (64 mmol/mol) | 90-150 mg/ dL (5.0-8.3 mmol/L) | 100-180 mg/ dL (5.6-10.0 mmol/L) | <140/90 mmHg | Estatinas, a menos que estén contraindicadas o no sean toleradas. |
| Muy complicado (enfermedad crónica terminal) o deterioro cognitivo moderado a severo o discapacidades de 2+ actividades de la vida diaria. | Esperanza de vida restante limitada, hace que los beneficios sean inciertos (< 5 años). | Evitar dependencia de HbA1c. Las decisiones de control glicémico deben basarse en evitar la hipoglucemia y la hiperglucemia sintomática | 100-180 mg/ dL (5.6-10 mmol/L) | 110-200 mg/dL (6.1-11.0 mmol/L) | <150/90 mmHg | Considerar la probabilidad de beneficios con estatinas |
Adaptado de Diabetes Care 44. Supplement 1 (2021): S168-S179.
El control de la hiperglucemia puede ser importante en los adultos diabéticos mayores, pero el control de otros factores de riesgo CV, como la hipertensión, podría ser más efectivo en la reducción de la morbilidad y la mortalidad de estos pacientes.43,44 Con respecto a la reducción de lípidos y terapia de prevención primaria con aspirina, hay menos evidencia.3
Recomendaciones para metas de tratamiento
Fuente: Diabetes Care 44.Supplement 1 (2021): S168-S179.
1.4 Manejo del estilo de vida
Recomendaciones sobre manejo del estilo de vida
Fuente: Diabetes Care 44.Supplement 1 (2021): S168-S179.
En la población de pacientes adultos mayores, la diabetes también se relaciona con una reducción de la fuerza muscular, una calidad muscular deficiente y una pérdida acelerada de masa muscular, lo que puede provocar osteopenia y/o sarcopenia.45,46
Adicionalmente, la diabetes se considera un factor de riesgo independiente de fragilidad, caracterizada por un menor rendimiento físico y un mayor riesgo de mala salud debido a la vulnerabilidad fisiológica y los factores estresantes funcionales o psicosociales. Esto se ve aumentado por una ingesta nutricional inadecuada de proteínas, lo que aumenta el riesgo de sarcopenia y fragilidad en los adultos mayores, por lo que, en adultos mayores diabéticos, es importante la intervención en el estilo de vida de forma personalizada y eficaz.
Para ello se debe considerar las necesidades específicas de cada paciente, sus posibilidades y limitaciones. También debe incluirse un programa de nutrición, con una ingesta adecuada de proteínas y un programa de actividad física equilibrado y monitoreado, considerando entrenamiento aeróbico y de resistenciapara ayudar al control del peso y controlar el sobrepeso u obesidad (ver más detalles en módulo 5).3
El estudio Look AHEAD, realizado con pacientes de entre 45 y 74 años de edad, el cual requería que pudieran realizar una prueba de esfuerzo máxima, reportó múltiples beneficios clínicos importantes para la calidad de vida de los pacientes mayores; como pérdida de peso, mejor condición física, aumento del colesterol HDL (cHDL), disminución de la presión arterial sistólica, reducción de los niveles de HbA1c y reducción de la circunferencia de la cintura con la intervención intensiva en el estilo de vida del paciente.47 Además, demostró que con la intervención en el estilo de vida de los pacientes, se podían controlar los factores de riesgo con dosis reducidas de medicamentos antihipertensivos, estatinas e insulina, y este beneficio fue similar en los pacientes mayores (de 60-70 años) comparado con los pacientes más jóvenes.
La intervención en el estilo de vida también mejoró función física y calidad de vida de estos pacientes.48,49
1.5 Terapia farmacológica
Recomendaciones sobre terapia farmacológica
Fuente: Diabetes Care 44.Supplement 1 (2021): S168-S179.
Las opciones terapéuticas hipoglucemiantes para los adultos mayores diabéticos son similares a las de la población adulta, pero al prescribirlos es importante tener presente las capacidades cognitivas del paciente, las interacciones medicamentosas potencialmente mortales y el riesgo CV. Por tanto, es importante monitorearlos para principalmente evitar la hipoglucemia.9
La polifarmacia, que aumenta el riesgo de reacciones adversas y de interacciones medicamentosas potencialmente mortales, es otro factor importante por considerar en esta población de pacientes, debido a los cambios en la farmacocinética y la farmacodinamia relacionados con el envejecimiento,4,50 por lo que el tratamiento farmacológico deben prescribirse con precaución y control adecuado.
1.5.1 Metformina
La metformina es el fármaco de primera línea para los adultos mayores con DMT2 de peso adecuado, sobrepeso u obesidad.3 Inzucchi y colaboradores reportaron que la metformina se puede usar de forma segura en pacientes con una TFGe ≥ 30 ml/min/1.73m2. 51 La metformina es segura en todas las etapas de IC con fracción de eyección estable o moderadamente preservada.52 Sin embargo, está contraindicada en pacientes con insuficiencia renal avanzada y debe usarse con precaución en pacientes con insuficiencia hepática así como en pacientes mayores de bajo peso, en riesgo nutricional o con desnutrición proteico-calórica.3
Aunque la metformina no se ha asociado con efectos hipoglucémicos significativos o pérdida de peso,53 se han reportado efectos secundarios gastrointestinales y una reducción del apetito, que deben tomarse en consideración en algunos adultos mayores. En caso de hospitalizaciones, la metformina se puede suspender temporalmente antes de los procedimientos, así como cuando una enfermedad aguda pueda comprometer la función renal o hepática del paciente.3
1.5.2 Tiazolidinedionas
Debe tenerse mucha precaución al usar de este grupo de medicamentos en pacientes diabéticos tratados con insulina, que presentan o tienen riesgo de insuficiencia cardíaca congestiva (ICC), osteoporosis, caídas o fracturas y / o edema macular.54,55
1.5.3 Sulfonilureas
Las sulfonilureas son particularmente efectivas en la reducción de glucemias y HbA1c, sin embargo se asocian a altas tasas de hipoglucemia y aumento de peso,9 por lo que deben usarse con precaución.3
Este grupo farmacológico está compuesto por fármacos muy distintos en su perfil de seguridad, las sulfonilureas no específicas de larga acción, gliburida y glimepirida no presentan mayor incremento en riesgo de eventos CV comparadas con las sulfonilureas específicas de acción corta, como gliclazida, glipizida y tolbutamida. No obstante, tanto gliburida como glimepirida tienen un riesgo mayor de hipoglucemia grave.56
Si se usan, se prefieren sulfonilureas con una duración de acción más corta. La glibenclamida es una sulfonilurea de acción más prolongada y debe evitarse en los adultos mayores,57 de hecho, la Sociedad Estadounidense de Geriatría ha catalogado la glibenclamida como potencialmente inapropiado para adultos mayores57 y la Organización Mundial de la Salud han reemplazado la glibenclamida por glicazida en la lista de medicamentos esenciales.9
1.5.4 Inhibidores de la dipeptidil peptidasa-4
Los inhibidores de la dipeptidil peptidasa 4 (DPP-4) orales generalmente son bien tolerados y presentan pocos eventos adversos, así como una hipoglucemia insignificante. Sin embargo, su costo puede ser una barrera para algunos pacientes mayores.3,9 Su dosificación diaria debe ajustarse según la TFG del paciente.
Varios estudios realizados en adultos mayores diabéticos demostraron la eficacia y la seguridad de los inhibidores de la DPP-4 con eventos hipoglucémicos mínimos,58-63 sin riesgo de fracturas64,65 y sin aumento de los eventos adversos CV importantes,66 incluso no parece haber interacción por grupo de edad,67-69 lo que los convierte en una alternativa terapéutica eficaz y más segura para los adultos mayores con diabetes, en comparación con otros agentes antihiperglucémicos.9
1.5.5 Agonistas del receptor del péptido similar al glucagón tipo1
Los agonistas del receptor de GLP-1 (AR GLP-1) no se han asociado con hipoglucemia cuando se utilizan como monoterapia y pueden usarse también terapia combinada con insulina.9
A su vez, han demostrado beneficios CV en pacientes con enfermedad cardiovascular aterosclerótica (ECVAS) establecida.3
En estudios clínicos estratificados de los GLP-1, se ha reportado una interacción compleja con la edad. En el estudio LEADER con liraglutida, las personas ≥ 50 años con enfermedad cardiovascular (ECV) al inicio del estudio tuvieron una reducción en el resultado primario, mientras que los de sesenta años o más, sin ECV establecida, tuvieron un resultado significativamente adverso, a excepción de los mayores de 75 años.70,71 De igual manera, en el estudio Harmony Outcomes con albiglutide, el cual comparó participantes <65 años con aquellos de 65 a 75 años y un grupo más pequeño de >75 años, los resultados fueron similares.72
Los efectos adversos más comunes de este grupo de medicamentos son náuseas, diarrea y pérdida de peso, por lo que hay que tener precaución con adultos mayores frágiles, que sufren desnutrición o caquexia.9
A excepción de la semaglutida oral, estos medicamentos vienen en formas farmacéuticas inyectables (con la excepción de la semaglutida oral) y para una administración adecuada requieren habilidades visuales, motoras y cognitivas, por lo que esta clase terapéutica AR GLP-1 pueden no ser aconsejables en pacientes de edad avanzada,3 excepto en pacientes mayores obesos con diabetes y en pacientes diabéticos con deterioro cognitivo leve o enfermedad de Alzheimer temprana, ya que se han demostrado efectos neuroprotectores con exenadina,73 liraglutida74 y lixisenatida.75
1.5.6 Inhibidores del cotransportador de sodio-glucosa 2
Los inhibidores de SGLT-2 se administran por vía oral, y producen una hipoglucemia insignificante,9 han demostrado eficacia, tolerabilidad y un resultado CV favorable.76-79
Específicamente, canagliflozina,80 empagliflozina81 y dapagliflozina82-84 se asociaron con efectos beneficiosos sobre el riesgo CV en pacientes mayores diabéticos, lo que puede ser conveniente para este grupo de pacientes.
También se ha reportado que esta clase terapéutica es beneficiosa para los pacientes con insuficiencia cardíaca.85,86
En el estudio EMPA REG OUTCOMES, la empagliflozina se asoció con menor riesgo de desarrollar nefropatía;87 en el estudio CANVAS, con canagliflozina se observó una mayor protección renal.88,89 En el estudio realizado por Martínez y colaboradores, la dapagliflozina redujo el empeoramiento de los episodios de IC y en todas las categorías de edad, con mayores beneficios absolutos en pacientes de edad avanzada.
No hubo un desequilibrio significativo en la tolerabilidad o eventos de seguridad entre dapagliflozina y placebo, incluso en personas de edad avanzada.90
Si bien es cierto que los SGLT-2 pueden ser una buena opción para los pacientes diabéticos de edad avanzada, estos deben usarse con precaución en esta población. Por ejemplo, debido a los efectos CV y renales, antes de iniciar tratamiento con inhibidores SGLT-2 en pacientes adultos hipertensos en tratamiento con diuréticos, es recomendable ajustar las dosis del diurético antes de iniciar un tratamiento con inhibidores del SGLT-2, con el fin de reducir el riesgo de hipotensión y deshidratación.9
Además, debe tomarse la precaución de medir natremia y realizar urianálisis de manera frecuente por riesgo de hiponatremia,91 infección urinaria,92 vaginitis en mujeres93 y balanitis en hombres,94 así como la tendencia a agravar incontinencia urinaria previa.95 Estos efectos adversos suelen reducirse significativamente con recomendaciones y educación sobre el uso del fármaco.94
1.5.7 Terapia con insulina
La insulina puede utilizarse sola o en combinación con otros hipoglucemiantes orales. Se debe evitar regímenes complejos para reducir errores de dosificación.96 En general, el adulto mayor puede requerir de la ayuda de un cuidador para administrarse la insulina, ya que requiere buenas habilidades visuales, motoras y cognitivas.3
Asimismo, los regímenes de insulina deben revisarse con regularidad, ajustando la dosis de acuerdo con los objetivos glucémicos individuales del paciente y considerando sus condiciones particulares como ingesta de alimentos, actividad física y fragilidad.96
La insulina basal una vez al día se asocia con menor riesgo de hipoglucemia que las insulinas premezcladas. La administración de varias dosis diarias de insulina pueden ser demasiado complejas para el adulto mayor diabético con complicaciones avanzadas, enfermedades crónicas coexistentes que limitan la vida o un estado funcional limitado.
31.5.8 Consideraciones para la simplificación y desintensificación / retiro de prescripción del régimen de tratamiento en adultos mayores con diabetes
En la elaboración del plan de atención personalizado del adulto mayor diabético, se deben considerar las necesidades del paciente y sus cuidadores, la situación de vida del paciente y la dependencia funcional, esto con el propósito de garantizar el manejo adecuado de la diabetes sin afectar su calidad de vida.3
La tabla 3 resume las consideraciones para el tratamiento de adultos mayores, estas toman en consideración su estado de salud y las características propias de cada paciente.
Tabla 3 Consideraciones para el régimen de simplificación de tratamiento o desintensificación / retiro de prescripción en adultos mayores diabéticos
| Características del paciente / estado de salud | HbA1c razonable / meta de tratamiento | Racional / consideraciones | ¿Cuándo podría ser necesario simplificar el régimen? | ¿Cuándo podría ser necesario desintensificar / retirar la prescripción? |
| Saludable (coexisten pocas enfermedades crónicas, estatus funcional y cognitivo intacto). | HbA1c,7.0-7.5 % (53-58 mmol/mol). | Generalmente, los pacientes pueden realizar tareas complejas para mantener un buen control glicémico y la salud es estable. Durante la enfermedad aguda, los pacientes están en mayor riesgo de administración y dosis que pudieran resultar en hipoglucemia, caídas, fracturas, etc. | Si la hipoglucemia es severa o recurrente en pacientes con terapia de insulina (aún si la HbA1c es adecuada). Si se observa una variación amplia de glucosa. Si decae la función cognitiva o funcional después de una enfermedad aguda. | Si la hipoglucemia es severa o recurrente en pacientes con terapias sin insulina con alto riesgo de hipoglucemias (aún si la HbA1c es adecuada). Si se observa una variación amplia de glucosa. En presencia de múltiples tratamientos (polifarmacia). |
| Complicado / Intermedio (coexisten múltiples enfermedades crónicas terminales o disfunción cognitiva moderada a severa o discapacidad de 2+ actividades de la vida diaria). | HbA1c 8.0 % (64 mmol/mol). | Las comorbilidades pueden afectar las habilidades de auto manejo y la capacidad para evitar la hipoglucemia. Los medicamentos de larga acción podrían disminuir la carga y complejidad de tomar los regímenes de medicamentos. | Si la hipoglucemia es severa o recurrente en pacientes con terapia de insulina (aún si la HbA1c es adecuada). Si no es posible manejar la complejidad del régimen de insulina. Si hay un cambio social significativo tal como: pérdida del cuidador, cambio en la forma de vida o dificultades financieras. | Si la hipoglucemia es severa o recurrente en pacientes con terapias sin insulina con alto riesgo de hipoglucemias (aún si la HbA1c es adecuada). Si se observa una variación amplia de glucosa. En presencia de múltiples tratamientos (polifarmacia). |
| Vivienda comunitaria para pacientes que reciben atención de enfermería especializada para rehabilitación a corto plazo. | Evite depender de la meta de glucosa HbA1c: 100-200 mg/dL (5.55-11.1 mmol/L). | El control glicémico es importante para la recuperación, con el fin de que sanen las heridas y evitar infecciones. Los pacientes recuperándose de enfermedades podrían no regresar a sus niveles cognitivos basales al momento del alta. Considere el tipo de apoyo que el paciente recibirá al llegar a casa. | Si se incrementa la complejidad del régimen de tratamiento durante la hospitalización, en muchos casos es razonable reinstalar durante la rehabilitación el régimen de medicamentos usados antes de la hospitalización. | Si la hospitalización por enfermedad aguda resultó en una pérdida de peso o apetito, disminución cognitiva de corto plazo y/o pérdida de la función física. |
| Muy complicado / pobre salud (el cuidado en el largo plazo o en etapas terminales de enfermedades crónicas o disfunción cognitiva de moderada a severa o discapacidad de 2+ actividades de la vida diaria). | Evite depender del HbA1c. Evite la hipoglucemia y la hiperglucemia sintomática. | No hay beneficios de un control estricto en esta población. Debe evitarse la hipoglucemia. El resultado más importante es mantener el estado funcional y cognitivo | Si se tiene un régimen de insulina y el paciente quisiera disminuir el número de inyecciones o del monitoreo de glucosa con punción en los dedos. Si el paciente tiene un patrón inconsistente de alimentación. | Si se usan agentes no insulínicos con un alto riesgo de hipoglucemia, en el contexto de disfunción cognitiva, depresión, anorexia o alimentación inconsistente. Si se toma cualquier medicación sin un beneficio claro |
| Al final de la vida. | Evite la hipoglucemia y la hiperglucemia sintomática. | La meta es proveer comodidad y evitar las tareas o intervenciones que causen dolor o incomodidad. Los cuidadores son importantes para proveer el cuidado médico y mantener la calidad de vida. | Si hay dolor o incomodidad causada por el tratamiento (ejemplo: inyecciones o punzadas en los dedos). Si hay un estrés excesivo del cuidador debido a la complejidad del tratamiento | Si se toma cualquier medicamento sin notar un claro beneficio o mejora de los síntomas y/o comodidad. |
Adaptado de Diabetes Care 44. Supplement 1 (2021): S168-S179.
1.5.9 Cuidados al final de la vida
Recomendaciones para cuidados al final de la vida
Fuente: Diabetes Care 44.Supplement 1 (2021): S168-S179.
La medicina paliativa promueve la comodidad, el control y la prevención de los síntomas (dolor, hipoglucemia, hiperglucemia y deshidratación), así como la preservación de la dignidad y la calidad de vida en pacientes con esperanza de vida limitada.3
Los objetivos generales de la atención de pacientes diabéticos en etapa van orientados a mejorar y mantener la dignidad y la calidad de vida del paciente, por lo que es necesario hablar con el paciente, la familia o cuidador sobre el pronóstico y las preocupaciones, los objetivos y la intensidad de tratamiento en el ámbito de los cuidados paliativos. En estas circunstancias, es importante la integración de personal especializado en cuidados paliativos al equipo multidisciplinario de atención del paciente diabético, con el propósito de tomar las decisiones adecuadas para la elaboración del plan de atención, el cual considere las necesidades individuales del paciente en etapa terminal.3,96 La implementación temprana de los cuidados paliativos mejora el manejo de los síntomas, la comorbilidad y la calidad de vida y, a menudo, reduce la carga de morbilidad y el tratamiento innecesario.97
Kutner y colaboradores realizaron un estudio multicéntrico para evaluar la seguridad clínica de la suspensión de estatinas en pacientes con cuidados paliativos y reportaron que esta práctica mejoraba la calidad de vida de los pacientes en etapa terminal,98 pero en la actualidad, no se cuenta con datos sobre el control de la glucosa y la presión arterial en estos pacientes.3
Por su parte, los objetivos de glucemia se deben orientar a la prevención de hipoglucemia o hiperglucemias, por lo que hay que monitorear la ingesta oral. La terapia farmacológica en esta etapa, dependiendo de la condición del paciente,99 puede incluir hipoglucemiantes orales como primera línea, seguida de un régimen de insulina simplificado y, en caso necesario, se puede agregar insulina basal en combinación con hipoglucemiantes orales. Para ello, se debe evitar el uso de insulina de acción rápida y medicamentos que causen síntomas gastrointestinales, como náuseas o pérdida excesiva de peso. También es importante monitorear los niveles de glucosa y ajustar la dosis de la terapia a medida que avanzan los síntomas, ya sea con una reducción o suspenderlos completamente en caso necesario.3
Angelo y colaboradores proponen el manejo de la diabetes en pacientes con enfermedad avanzada mediante la clasificación en tres categorías (Tabla 4):100
Tabla 4 Manejo de diabetes en pacientes mayores con enfermedad avanzada
| Categoría de paciente | Manejo del paciente |
| Paciente estable | Continuar con el régimen del paciente, con un enfoque en la prevención de la hipoglucemia y el manejo de la hiperglucemia mediante la prueba de glucosa en sangre, manteniendo los niveles por debajo del umbral renal de glucosa. El control y la reducción de la HbA1c desempeñan un papel muy pequeño. |
| Paciente con falla de órganos | Prevenir la hipoglucemia y la deshidratación. En pacientes con DMT1, reducir la insulina a medida que disminuye la ingesta de alimentos, pero no interrumpir. En pacientes con DMT2, reducir los medicamentos que puedan causar hipoglucemia. El objetivo principal es evitar la hipoglucemia, con el fin de que permita valores de glucosa superior al objetivo deseado. |
| Paciente en etapa terminal | Para pacientes con DMT2, puede considerarse la interrupción de los hipoglucemiantes por la reducción de la ingesta oral. En DMT1 puede utilizarse una pequeña cantidad de insulina basal para mantener los niveles de glucosa y prevenir hiperglucemias agudas. |
1.5.10 Manejo de la nutrición por inactividad física en adultos mayores con diabetes
Debido a la alta prevalencia de diabetes en los ancianos que frecuentemente presentan deterioro físico o cognitivo y no tienen buen autocuidado de la diabetes, es importante el manejo adecuado de estos pacientes por su edad.
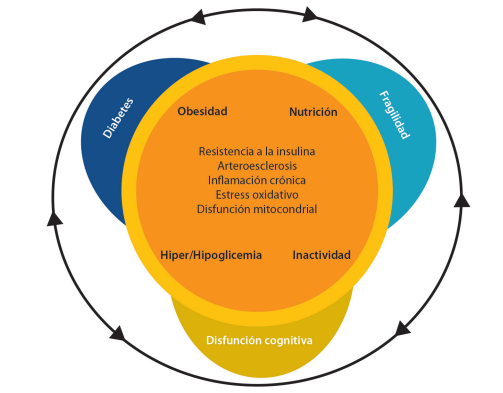
La secreción reducida de insulina, la resistencia a la insulina, la arteriosclerosis, la inflamación crónica, el estrés oxidativo, la disfunción mitocondrial, el mal control glucémico, la disminución de la actividad física y la desnutrición en la diabetes son causas potenciales de fragilidad y deterioro cognitivo observado en estos pacientes (Figura 1).
La fragilidad puede prevenirse con una ingesta calórica apropiada, que incluya un plan dietético saludable con ingesta adecuada de proteínas y vitaminas; esto combinado con ejercicio y control glicémico óptimo y apoyo para prevención de la fragilidad puede extender la esperanza de vida y mantener la calidad de vida en adultos mayores con DM.101
En adultos mayores diabéticos, se recomiendan dietas adaptadas a su cultura, preferencias y objetivos personales, las cuales ayuden en cuanto a la calidad de vida, la satisfacción con las comidas y el estado nutricional del paciente. Se deben evitar las dietas terapéuticas, pues estas pueden afectar la ingesta de alimentos, al promover pérdida de peso y desnutrición involuntarias de estos pacientes.3
1.5.10.1 Inactividad física
La inactividad física es un factor de riesgo independiente de demencia, sarcopenia y fragilidad, y favorece la acumulación de grasa visceral, lo que puede estar involucrado en la patogénesis de la resistencia a la insulina, aterosclerosis, deterioro cognitivo y fragilidad. El ejercicio regular ayuda a reducir la grasa visceral. También reduce los factores de riesgo CV implicados en la patogenia de la demencia, mejora la resistencia a la insulina, la inflamación y el estrés oxidativo asociados con la cognición deteriorada.101,102
Durante la evaluación inicial, es importante realizar batería corta de desempeño y dinamometría, con lo que se puede objetivizar el desempeño físico de paciente y orientar su programa de entrenamiento físico. A su vez, los pacientes diabéticos deben saber que el ejercicio interfiere con la homeostasis de la glucosa. El ejercicio anaeróbico puede elevar la glucemia, mientras que el ejercicio aeróbico podría provocar una disminución de esta durante y en el periodo posejercicio.103
1.5.10.2 Cambios en el peso corporal
El estudio de salud cardiovascular (CHS por sus siglas en inglés) considera la pérdida de peso involuntaria como un criterio de diagnóstico de fragilidad.104,105 Por lo tanto, es importante controlar regularmente el peso de los pacientes en busca de una detección temprana incluso de una reducción de peso leve.106 Si la pérdida de peso es intencional y se obtiene con una modificación en el estilo de vida por restricción calórica y aumento de la activad física, se logra un efecto positivo en el rendimiento físico, como se demostró en el estudio Look AHEAD, en adultos mayores y de mediana edad con sobrepeso, obesidad y DMT2, quienes no solo redujeron su peso, sino que también presentaron mayor función física y reducción del riesgo de velocidad de marcha lenta.107
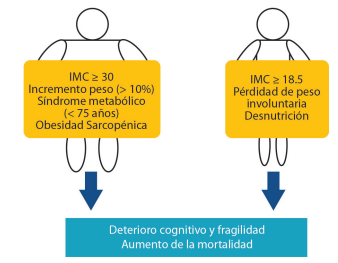
Para prevenir el deterioro cognitivo la fragilidad y la mortalidad en los adultos mayores diabéticos, es recomendable evitar los extremos en los estados nutricionales del paciente, como se muestra en la Figura 2.101
1.5.10.3 Ingesta adecuada de energía, macro micronutrientes en adultos mayores con diabetes
La Sociedad Europea de Nutrición Clínica y Metabolismo sobre nutrición clínica e hidratación en geriatría recomien dan una ingesta energética de aproximadamente 30 kcal / kg de peso corporal / día para las personas mayores,108 pero este valor debe ajustar individualmente en función del estado nutricional, nivel de actividad física, estado de la enfermedad y tolerancia del paciente, y esto también aplica para adultos mayores diabéticos.
Al respecto, Yoshimura y colaboradores en el estudio J-EDIT informaron que una menor ingesta energética se asoció con un menor IMC en adultos mayores con diabetes y que la ingesta diaria de energía fue significativamente menor en aquellos con un IMC de <18,5 k / m2 (promedio, 27,7 kcal / kg de peso corporal / día) en comparación con aquellos con un IMC ≥ 18,5 kg / m2 (promedio de todos los grupos, > 30 kcal / kg de peso corporal / día).109 De acuerdo con estos resultados, la disminución de la ingesta energética en pacientes mayores con diabetes podría conducir a un menor IMC y esto podría asociarse a un mayor riesgo de fragilidad y mortalidad.101
1.5.10.3.1 Proteínas
Varios estudios han demostrado que la ingesta adecuada de proteínas previene la fragilidad y la sarcopenia.101,110-112
En este aspecto, la Sociedad Europea de Nutrición Clínica y Metabolismo recomiendan una ingesta mínima de proteínas de 1.0 g / kg de peso corporal / día. En el caso de adultos mayores con enfermedad aguda o crónica, se recomiendan 1.2-1.5 g / kg de peso corporal / día, pero estos valores deben ajustarse de acuerdo con los condiciones específicas de cada paciente.112
Park y colaboradores también reportaron que una ingesta mayor de proteínas (1.5 g / kg de peso corporal / día) mejoró la masa muscular y el rendimiento físico sin efectos adversos en ancianos frágiles o con riesgo de desnutrición, por lo que se puede recomendar una mayor ingesta de proteínas para este grupo de pacientes,112 excepto en pacientes con insuficiencia renal en etapa terminal.101
1.5.10.3.2 Vitaminas
La vitamina D acelera la absorción intestinal de calcio, lo que aumenta la densidad mineral ósea, reduce el riesgo de fracturas y tiene un impacto positivo en la masa y la fuerza muscular. La deficiencia de vitamina D se correlaciona con el deterioro cognitivo, la sarcopenia y la fragilidad.101 Patel y Shah reportaron que la vitamina D podría desempeñar un papel protector en la enfermedad de Alzheimer, ya que previene su aparición o retarda la progresión de la enfermedad, basado en la mejora de aclaramiento de amiloide beta en pacientes.113
Por su parte, las vitaminas C y E, así como el caroteno, tienen propiedades antioxidantes. Las vitaminas B folato, B6 y B12 están involucradas en el metabolismo de la homocisteína, que participa en la patogenia de la aterosclerosis y la enfermedad de Alzheimer.101
Varios estudios observacionales han investigado las asociaciones entre la ingesta de estas vitaminas y la fragilidad.
Balboa-Castillo y colaboradores informaron que una menor ingesta de vitaminas B 6, C y E, y folato se asoció con un mayor riesgo de fragilidad114, pero no hay evidencia clara que demuestre la asociación entre la ingesta de vitaminas y la fragilidad o discapacidad funcional en pacientes con diabetes.
Aunque las vitaminas B y las vitaminas antioxidantes teóricamente pueden prevenir el deterioro cognitivo, los resultados de estudios observacionales y estudios aleatorizados que investigan los efectos de la suplementación con vitaminas en el deterioro cognitivo dieron resultados inconsistentes.101
1.5.10.3.3 Ácidos grasos
La ingesta de ácidos grasos puede afectar la fragilidad y la sarcopenia, como se demostró Jayanama y colaboradores en un estudio observacional realizado en 2020. Ellos reportaron que el consumo de ácidos grasos saturados (AGS) se asoció con un mayor riesgo de fragilidad y mortalidad, mientras que el consumo de ácidos grasos poliinsaturados PUFA y omega 3 (ω-3FA) se asoció con un menor riesgo de mortalidad en pacientes mayores de cincuenta años.115
Bhatt y colaboradores reportaron que en pacientes con triglicéridos elevados a pesar del uso de estatinas, el riesgo de eventos CV (eventos isquémicos, muerte CV) se redujo con altas dosis de ácido eicosapentanóico (EPA) (4 g / día).116
Este efecto también se observó en el subanálisis de pacientes mayores (> 65 años) con diabetes.
1.5.10.4 La dieta mediterránea y la dieta saludable
Se sabe que la dieta mediterránea, rica en verduras, pescado, nueces, aceite de oliva y vino, reduce el riesgo de episodios CV. Bonaccio y colaboradores reportaron en un metaanálisis de estudios prospectivos que una alta adherencia a la dieta mediterránea se asoció con una supervivencia prolongada de los adultos mayores, una reducción de mortalidad por todas las causas, incluso en pacientes mayores (≥ 65 años)117. Además, en otros estudios se demostró que la dieta mediterránea se relaciona con una reducción significativa de riesgo de fragilidad y discapacidad funcional en adultos mayores,118,119 pero no para sarcopenia.119 Tepper y colaboradores, por su parte, observaron una asociación similar específicamente en pacientes mayores de 75 años.120
Fard y colaboradores realizaron un metaanálisis de estudios longitudinales y transversales, en el cual incluyeron países mediterráneos y no mediterráneos, ellos informaron que una dieta saludable con una mayor ingesta de verduras, frutas y cereales integrales se asoció con un menor riesgo de fragilidad.121
La Organización Mundial de la Salud (OMS), en las guías para Reducción del riesgo de deterioro cognitivo y demencia de 2019, también recomienda una dieta mediterránea y alimentos saludables y equilibrados (frutas, verduras, legumbres, nueces y cereales integrales con menos azúcares, grasas, y sal) en adultos mayores y no recomiendan suplementos por cada micronutriente.122 (Figura 3)
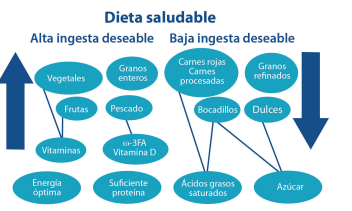
Figura 3 Dietas saludables para adultos mayores diabéticos. Adaptado de Nutrients 12.11 (2020): 3367. Paciente nefrópata.
2. Paciente nefrópata
La nefropatía diabética (DN) también conocida como enfermedad renal diabética (ERD) es la pérdida crónica de la función renal producida en los pacientes que padecen DM123 y es una de las complicaciones más comunes de la diabetes, así como la principal causa de enfermedad renal en etapa terminal.124
La DM es la principal causa de enfermedad renal crónica (ERC) en todos los países desarrollados y se está convirtiendo rápidamente en la principal causa de ERC en los países en desarrollo.125 Se estima que aproximadamente el 20 % de las personas con DMT2 desarrollan nefropatía diabética en un período de veinte años desde la aparición de la diabetes.126
La proteinuria y la TFGe reducida se han asociado con un mayor riesgo de enfermedad CV importante. En este contexto, Currie y colaboradores reportaron que el riesgo de eventos cardiovasculares mayores en pacientes en el mismo estado de TFGe fue entre 2.4 a 4.6 veces mayor en personas diabéticas comparado con personas sin diabetes.126
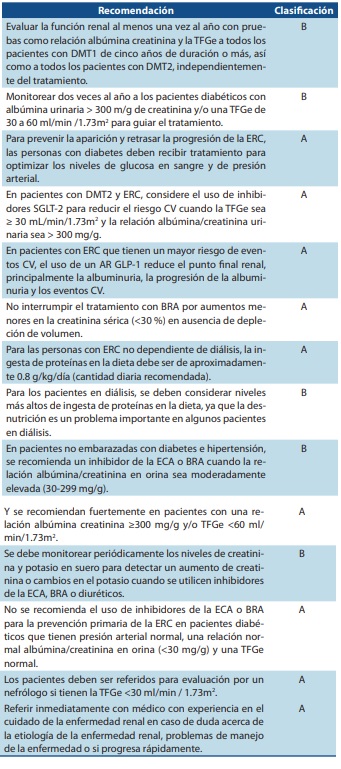
Recomendaciones para pacientes nefrópatas
ECA, enzima convertidora de angiotensina; BRA, bloqueador del receptor de angiotensina; ERC, enfermedad renal crónica; ECV, enfermedad cardiovascular; TFGe: tasa estimada de filtración glomerular; AR GLP-1, agonista del receptor del péptido similar al glucagón tipo 1; SGLT-2, cotransportador de sodio y glucosa tipo 2.
Fuente: Diabetes Care. 2021;44:S151-S167. doi:10.2337/dc21-S011.
2.1 Diagnóstico
La enfermedad renal crónica (ERC) se diagnostica por la presencia persistente albuminuria (relación albúmina urinaria: creatinina > 3 mg / mmol), TFGe < 60 ml/min/1.73m2 u otras manifestaciones de daño renal.52,127
El tratamiento de la ERC en las primeras etapas reduce la progresión del daño renal, la morbilidad y la mortalidad,96 por lo que es recomendable realizar pruebas a los pacientes diabéticos y repetir estas pruebas con regularidad para detectar indicios tempranos de daño renal y hacer los ajustes necesarios en el tratamiento. El mejor indicador de riesgo de ERC en la DMT2 es el valor de la presión arterial sistólica; sin embargo, no se ha definido claramente el límite inferior óptimo.96
Aproximadamente, el 30 % de los pacientes con DMT1 y el 40 % con DMT2 desarrollarán ERC.52 Por esta razón, es importante evaluar la función renal mediante análisis de sangre y orina como parte del control y monitorización de la DM.
Una disminución en la TFGe hace más complicado el control glucémico y aumenta los riesgos de eventos adversos inducidos por fármacos como la hipoglucemia.
El cribado de la ERC se puede realizar mediante cualquiera de las siguientes pruebas de laboratorio:96
Relación albúmina / creatinina en orina puntual aleatoria (UACR; método preferido).
Creatinina sérica convertida en TFGe.
En pacientes adultos mayores encamados o con demencia (no hay cooperación), es difícil recoger orina de 24 horas, por lo que se debe hacer un estimado basado en resultados de examen en sangre y general de orina. Ver valores en Figura 4. Asimismo, cualquier resultado positivo de UACR debe confirmarse con una recolección repetida y se debe considerar otros posibles contribuyentes a la albuminuria transitoria, tales como:97
Infección del tracto urinario, pulmonares o cutáneas, ya que pueden alterar la función renal.
Insuficiencia cardíaca congestiva descompensada.
Menstruación.
Elevación grave aguda de la glucosa en sangre o la presión arterial.
Ejercicio importante reciente.
Enfermedad febril.
2.2 Enfermedad renal crónica en paciente diabético
Para el manejo adecuado de la ERC en personas con DMT2, puede considerarse el siguiente enfoque:96
Revisar los medicamentos prescritos.
Excluir causas tratables de enfermedad renal, como estenosis de la arteria renal, nefropatía obstructiva y lesión renal aguda debido a deshidratación.
Realizar una evaluación del riesgo CV.
Referir al paciente con nefrólogo en caso de que el paciente presente alguna complicación. (ver detalle en 2.2.2)
Referir a geriatría a pacientes elegibles (adultos mayores con deterioro cognitivo, fragilidad, sarcopenia y con trastorno de marcha por riesgo de caída).
Referir a los pacientes elegibles a programas de atención multidisciplinaria, incluido un nutricionista y un educador en diabetes acreditado para que los ayude con las recomendaciones nutricionales renales.
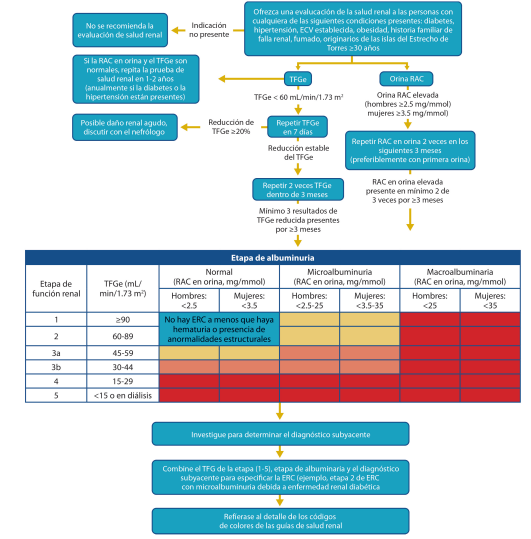
RAC: relación albúmina / creatinina; ERC: enfermedad renal crónica; ECV: enfermedad cardiovascular; TFGe: tasa de filtración glomerular estimada.
Nota: Es posible que se requiera un control más frecuente de la función renal en personas con glomerulonefritis, lupus eritematoso sistémico o personas que toman medicamentos nefrotóxicos.
Fuente: Adaptado de The Royal Australian College of General Practitioners and Diabetes Australia, 2020.2
Figura 4. Algoritmo inicial para la detección de enfermedad renal crónica.
2.2.1 Consideraciones de tratamiento farmacológico de ERC
Metformina: La metformina debe considerarse como primera línea de tratamiento para todos los pacientes con DMT2, incluyendo a los pacientes con ERC127 mediante el control frecuente de la TFG, pero debe suspenderse en casos de empeoramiento de la condición clínica, deshidratación e hipoxemia.128 De acuerdo con los lineamientos de la FDA, la metformina está contraindicada en pacientes con TFGe < 30 ml/min/1.73m2 y la TFGe debe monitorearse frecuentemente cuando se administra metformina a estos pacientes. A la vez, debe evaluarse el riesgo beneficio del tratamiento continuo cuando TFGe < 45 ml/min/1.73m2. 127 En estas condiciones, Davies y colaboradores recomiendan reducir la dosis.66 Inzucchi y colaboradores propusieron una dosis máxima diaria con base en valores de TFG: 2000mg con TFGe de 45-60 ml/min/1.73m2 y 1000 mg con TFGe de 30-45 ml/min/1.73m2, con la advertencia de evitar su uso cuando la función renal sea inestable51 (diarrea o inestabilidad hemodinámica).129
Sulfonilureas: La hipoglucemia (efecto secundario más común de esta clase de medicamentos) se presenta con mayor frecuencia en pacientes con ERC debido a la disminución de la gluconeogénesis renal y la acumulación.52,129 Debe tenerse precaución en pacientes con edad avanzada y pacientes con ERC, pues ellos son los de mayor riesgo de hipoglucemia.66
Inhibidores de la dipeptidil peptidasa-4 (DPP-4): En pacientes con función renal disminuida, con TFGe <60 ml / min / 1.73m2, se requiere reducción de dosis de alogliptina, saxagliptina, sitagliptina y vildagliptina, debido a acumulación farmacológica sin toxicidad.96 La Linagliptina no requiere ajuste de dosis porque tiene mínima excreción renal.66 No se recomienda la saxagliptina con TFGe <15 ml/min/1.73m2, mientras que otros pueden usarse con un ajuste de dosis apropiado.96
Inhibidores del cotransportador 2 de glucosa sódica (SGLT-2): La eficacia hipoglucemiante de este grupo de medicamentos depende de la función renal, por lo que su uso está restringido por TFGe y requiere un control intermitente de la función renal. Dapagliflozina, empagliflozina y canagliflozina se asocian con un menor riesgo de criterios de valoración renales y se recomiendan si TFGe es de 30 - <90 ml / min / m2. 52 Asimismo, se consideran como opción para pacientes diabéticos con ERC que requieran otro fármaco adicional a la metformina para alcanzar los objetivos de HbA1c o en pacientes que no pueden usar o no toleran la metformina.127
Los beneficios de uso en pacientes con nefropatía han sido explorados con detalle en estudios como el DAPACKD, recientemente publicado. Este estudio incluyo 4304 pacientes con tasas glomerular de 25 a 75ml por min por 1.73 ASC o datos de proteinuria, fueron aleatorizados a recibir Dapagliflozina o placebo. El punto primario eran desenlaces renales (caída TFG, diálisis, muerte renal o muerte cardiovascular). EN el estudio se logró demostrar una menor incidencia del evento clínico primario (9.2% vs 14.5% en placebo) con un NNT de solo 19 pacientes para prevenir un evento compuesto.130
Glitazonas: no es necesario ajustar la dosis en pacientes con ERC. Las glitazonas no deben usarse en personas en diálisis, ya que no se ha establecido la seguridad en este grupo de pacientes.96
Agonistas del receptor del péptido similar al glucagón tipo 1 (AR GLP-1): Tienen efectos directos sobre el riñón y se ha informado que mejoran los resultados renales en comparación con el placebo, así como que se deben considerar para pacientes diabéticos con ERC que requieran otro fármaco adicional a la metformina para alcanzar de HbA1c o en pacientes que no pueden usar o no toleran la metformina.127 Se recomienda evitar el uso de exenatida y liraglutida si CrCl <30 ml / min. Iniciar y aumente la dosis de exenatida con precaución si CrCl 30-50 ml / min. La dulaglutida se puede usar hasta 15 ml / min, sin necesidad de ajustar la dosis.96 Scheen reportó que el uso de los AR GLP-1 reduce significativas la albuminuria y TFGE.131
Insulina: A medida que se deteriora la función renal, el uso de insulina en lugar de regímenes orales ayuda a obtener un mejor control glucémico, principalmente cuando los pacientes requieren terapia de reemplazo renal.52
Se recomienda una revisión periódica de la dosis, ya que la ERC aumenta los riesgos de hipoglucemia.96
Evitar cualquier medicamento potencialmente nefrotóxico, como los medicamentos antiinflamatorios no esteroideos (AINE) o antibióticos usados frecuentemente en infecciones del tracto urinario, como los aminoglucósidos.
Considerar la posibilidad de referir al paciente con un educador en diabetes, nutricionista, o terapeuta físico acreditados, para que puedan asesorar al paciente y al cuidador sobre los ajustes necesarios en la enfermedad renal diabética avanzada.
2.2.2 Criterios de referencia para atención renal especializada
Es importante considerar la referencia del paciente diabético con un nefrólogo cuando el paciente presente:96
Tasa de filtración glomerular estimada (TFGe) <30 ml/min/1.73m2
3. Paciente con enfermedad hepática crónica
La DM juega un papel importante en el desarrollo y la progresión de las enfermedades hepáticas crónicas (EHC).
Chung y colaboradores reportaron que cuando se presentan como enfermedades concurrentes, se asocian con peores resultados clínicos: supervivencia reducida, desarrollo de insuficiencia hepática severa y sus complicaciones, mayor incidencia de carcinoma hepatocelular (CHC), mortalidad específica por CHC y complicaciones posteriores al trasplante de hígado.132
Con la progresión de la EHC a etapa terminal, la presencia de DM predice peores resultados clínicos. La prevalencia de DM está directamente relacionada con la gravedad de la enfermedad hepática según la clasificación de la clase Child-Pugh o el modelo de enfermedad hepática en etapa terminal.133,134 Los pacientes con cirrosis compensada / descompensada de diversas etiologías tienen menor supervivencia (hasta un 40 % de reducción en cinco años) en el grupo de pacientes diabéticos en comparación con el grupo de no diabéticos.135-137
Al respecto, Marceau y colaboradores reportaron que la resistencia a la insulina, que se produce en el contexto del síndrome metabólico, es un factor fisiopatológico independiente para el desarrollo de la enfermedad del hígado graso no alcohólico.138
Igualmente, se ha reportado una relación bidireccional entre la DM y la infección por virus de hepatitis C (VHC): Guo y colaboradores reportaron como resultado de su metaanálisis, que los pacientes con DMT2 tienen casi 3.5 veces más riesgo de contraer la infección por VHC que los no diabéticos,139 y la infección por VHC se asocia con un aumento de riesgo de 1.5 a 1.7 veces de presentar DMT2 de nueva aparición.140,141
Adicionalmente, la presencia de DMT2 aumenta 2-5 veces el riesgo de desarrollar hígado graso no alcohólico.
Estudios transversales han demostrado que hasta un 69-87 % de los pacientes diabéticos tienen evidencia de enfermedad por hígado graso no alcohólico y entre 21-45 % de los pacientes con hígado graso no alcohólico también tenían diabetes. Asimismo, la presencia de DMT2 aumenta de 2-5 veces el riesgo de desarrollar hígado graso no alcohólico.132
Cabe señalar que marcadores glucémicos tradicionales, incluida la glucosa en ayunas, la prueba de tolerancia a la glucosa oral y la hemoglobina HbA1c no son precisos en pacientes con EHC grave.13
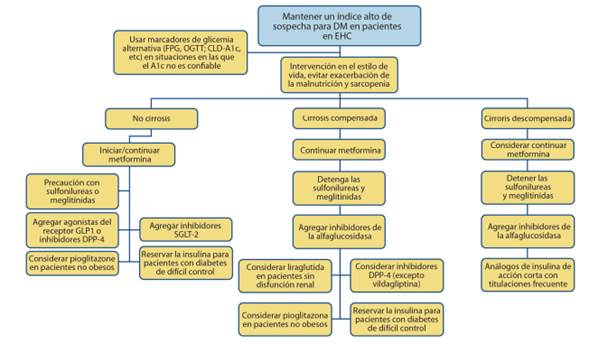
Figura 5 Propuesta de algoritmo de tratamiento de la diabetes en pacientes con enfermedades hepáticas crónicas.
EHC: enfermedad hepática crónica; DM: diabetes mellitus. GPA: glucosa plasmática en ayunas; PITO: prueba de tolerancia oral a la glucosa, SGLT-2: cotransportador de sodio-glucosa-2; GLP-1: péptido 1 similar al glucagón; DPP-4: dipeptidil peptidasa-4.
Adaptado de World Journal of Hepatology, 12(9), 533-557.
3.1 Consideraciones de tratamiento farmacológico de EHC
El manejo de pacientes diabéticos con enfermedades hepáticas es un desafío, ya que es preciso identificar tratamientos seguros y efectivos en esta población médicamente complicada, especialmente en presencia de cirrosis descompensada:132
Metformina: Si es necesaria la terapia farmacológica para control glucémico, se debe considerar la metformina, por su perfil de seguridad favorable, reducciones en el riesgo de CHC entre un 50-70 % y reducción de hasta ocho veces del riesgo de encefalopatía hepática. Además, continuar con metformina después del diagnóstico de cirrosis aumenta la supervivencia media general.
Los AR GLP-1, inhibidores de DPP-4 e inhibidores de SGLT-2: Pueden ejercer un efecto protector hepático independientemente del grado de control glucémico, por lo que se pueden considerar incluso en pacientes con insuficiencia hepática leve a moderada, dado su bajo riesgo de hipoglucemia, perfil metabólico de peso neutro y efecto protector sobre el hígado, esteatosis y fibrosis hepática. La terapia con insulina debe reservarse para pacientes en los que fallaron otros medicamentos hipoglucemiantes y debe implicar una monitorización estrecha de la glucosa, así como un ajuste frecuente de la dosis para minimizar el riesgo de hipoglucemia.
Debe evitarse el uso las sulfonilureas y las meglitinidas en esta población de pacientes.
Tabla 5 Resumen de dosificación de hipoglucemiantes orales en poblaciones especiales
| Producto | Dosis normal | Dosis en edad avanzada | Dosis en insuficiencia renal (IR) | Dosis en insuficiencia hepática |
| Biguanidas | ||||
| Metformina142 | Dosis inicial: 500 mg u 850 mg 2 o 3 v/día, durante o después de las comidas. Tras 10-15 días, ajustar dosis en función de los niveles de GP. Dosis máxima: 3 g/día, dividida en 3 tomas | En pacientes de edad avanzada, la posología de metformina debería ajustarse según la función renal. | En IR moderada, estadio 3a (aclaramiento de creatinina 45-59 ml/min o tasa estimada de filtrado glomerular 45-59 ml/min/1.73m2 ), solamente en ausencia de otras condiciones que puedan aumentar el riesgo de acidosis láctica y con ajustes de dosis: Dosis inicial es 500 mg o 850 mg una vez al día. Dosis máxima es de 1000 mg/día dividida en 2 tomas. Controlar la función renal cada 3-6 meses. Suspender el tratamiento si el aclaramiento de creatinina o la TFGe es < 45 ml/min o < 45 ml/ min/1.73m2 respectivamente. | Contraindicado en insuficiencia hepática. |
| Sulfonilureas | ||||
| Glipizida143 | Dosis inicial: 5 mg/día, antes del desayuno o de la comida. Ajuste de dosis gradual, aumentar de 2.5 a 5 mg en intervalos de 3-7 días. La dosis máxima: 40 mg/día dividida en dos tomas. | Ajustar dosis de 2.5 o 5 mg en función de la respuesta. Deben pasar varios días antes de proceder a un nuevo escalado de dosis | Ajustar las dosis iniciales y de mantenimiento, iniciando con 2.5 mg/día en caso de IR. | Ajustar las dosis iniciales y de mantenimiento, iniciando con 2.5 mg/día en caso de insuficiencia hepática. |
| Glimepirida144 | Dosis inicial: 1 mg/día. Dosis máxima: 6 mg /día. | Contraindicado en alteraciones graves de la función renal (en estos casos se recomienda utilizar insulina). | Contraindicado en alteraciones graves de la función hepática (en estos casos, se recomienda utilizar insulina). | |
| Gliclazida145 | Dosis inicial: 30mg/día una vez/día con el desayuno. Dosis máxima: 120 mg. | Dosis: igual a la de ≤ 65 años. | Se puede utilizar la misma dosis monitorizando al paciente. Contraindicado en insuficiencia renal grave (en estos casos, se recomienda utilizar insulina). | Contraindicado en IR o hepática grave (en estos casos, se recomienda utilizar insulina). |
| Gliburida 146 (glibenclamida) | Dosis inicial: 2.5-5 mg/d. En caso necesario, incrementar dosis en intervalos de 1-2 semanas. Dosis máxima: 15mg/d | Iniciar tratamiento con dosis mínima posible: 1.25-2mg/d para evitar hipoglucemia. | Contraindicado en IR grave (recomienda utilizar insulina). | Contraindicado en insuficiencia hepática grave (se recomienda utilizar insulina). |
| Tiazolidinedionas | ||||
| Pioglitazona147 | Dosis inicial: 15 mg o 30 mg una vez/día. Dosis máxima: 45 mg una vez/día. | No es necesario hacer ningún ajuste de dosis. Iniciar tratamiento con la menor dosis posible. | No es necesario ajuste de dosis en IR (aclaramiento de creatinina >4ml/min). | Contraindicado en pacientes con insuficiencia hepática. |
| Inhibidores de la α glucosidasa | ||||
| Acarbosa148 | Adultos. Dosis inicial 50mg 3v/día ajustar dosis en intervalos de 4-8 semanas. Dosis máxima: 200mg 3v/ día (600mg/d). | No es necesario ningún ajuste de la dosis. | Contraindicado en IR grave (aclaramiento de creatinina < 25 ml/min). | No es necesario ningún ajuste de la dosis en pacientes con insuficiencia hepática. Contraindicado en cirrosis hepática. |
| Inhibidores de la dipeptidil peptidasa-4 | ||||
| Vildagliptina149 | Dosis diaria recomendada: 50 mg 2v/día. Dosis máxima: 100mg. | No se requiere ajuste de dosis. | IR grave o moderada o con ERT, la dosis recomendada de 50 mg una vez/día. | No debe utilizarse en pacientes con insuficiencia hepática, esto incluye pacientes con valores pretratamiento de alanina aminotransferasa (ALT) o aspartato aminotransferasa (AST) > 3 veces el límite superior de la normalidad (LSN). |
| Sitagliptina150 | Dosis: 100 mg una vez/día. | No requiere ajuste de dosis en función de la edad. | Se recomienda una evaluación de la función renal antes de iniciar el tratamiento y posteriormente de forma periódica. En IR moderada (TFG ≥ 30 a < 15 ml/min), incluyendo pacientes que requieren hemodiálisis o diálisis peritoneal, la dosis es 25 mg una vez/día. El tratamiento puede ser administrado sin tener en cuenta el tiempo de diálisis. | No se requiere un ajuste de dosis en pacientes con insuficiencia hepática leve o moderada. No se ha estudiado sitagliptina en pacientes con insuficiencia hepática grave y se debe tener cuidado. |
| Saxagliptina151 | Dosis: 5mg, una vez/día. | No requiere ajuste de dosis, pero debe usarse con precaución en pacientes de edad avanzada por posible disminución de la función renal. | Se recomienda una evaluación de la función renal antes de iniciar el tratamiento y posteriormente de forma periódica. IR moderada con TFG < 45ml/min y pacientes con IR grave: 2.5mg una vez al día. No se recomienda en pacientes con ERT que requieran hemodiálisis. | Debe usarse con precaución en insuficiencia hepática moderada y no se recomienda en insuficiencia hepática grave. |
| Linagliptina152 | Dosis: 5 mg una vez/día. | No se precisa un ajuste de dosis. | No se requiere un ajuste de dosis de linagliptina en pacientes con IR. | No se requiere un ajuste de dosis de linagliptina en pacientes con insuficiencia hepática, pero no se dispone de experiencia clínica en estos pacientes. |
| Alogliptina153 | 25mg una vez/día como terapia adicional a metformina, tiazolidindiona, una sulfonilurea o insulina. | No requiere ajuste de dosis en función de la edad, pero tener precaución por potencial disminución de la función renal en esta población. | Se recomienda evaluación de la función renal antes de iniciar el tratamiento, y posteriormente de forma periódica. En pacientes con IR moderada (aclaramiento de creatinina ≥30 a ≤ 50 ml/min), debe administrarse la mitad de la dosis recomendada (12.5 mg una vez al día). En pacientes con IR grave (aclaramiento de creatinina < 30 ml/min) o ERT que requiere diálisis, se debe administrar un cuarto de la dosis recomendada (6.25 mg una vez al día). Deberá utilizarse con precaución en pacientes que requieran diálisis | No debe utilizarse en pacientes con insuficiencia hepática leve o moderada. No se recomienda en pacientes con insuficiencia hepática grave. |
| Agonista del receptor del péptido similar al glucagón tipo 1 | ||||
| Exenatida154 | Dosis: 5 μg dos veces/día durante al menos un mes con el objeto de mejorar la tolerabilidad. Dosis máxima: 10 μg dos veces/día. | Debe ser utilizada con precaución en pacientes >70 años y se debe escalar cuidadosamente la dosis de 5 μg a 10 μg. La experiencia clínica en pacientes mayores de 75 años es muy limitada. | En pacientes con IR moderada (aclaramiento de creatinina entre 30-50 ml/min), se debe proceder escalar cuidadosamente la dosis de 5 μg a 10 μg. No está recomendado en pacientes con ERT o grave (aclaramiento de creatinina < 30 ml/min). | No se requiere ajuste de dosis en pacientes con insuficiencia hepática |
| Liraglutida155 | Dosis inicial es de 0.6 mg/ día. Transcurrida al menos una semana, debe incrementarse la dosis a 1.2 mg en función de la respuesta clínica. Dosis máxima: 1.8 mg/día | No es necesario un ajuste de dosis en función de la edad. | No es necesario un ajuste de dosis en pacientes con IR leve, moderada o grave. No se recomienda su uso en pacientes con ERT. | No requiere ajuste de dosis en insuficiencia hepática leve o moderada. No se recomienda su uso en pacientes con insuficiencia hepática grave. |
| Lixisenatida156 | Dosis inicial: 10 µg una vez/ día, durante 14 días. Dosis de mantenimiento a partir del día 15: 20 µg una vez/día. | No es necesario ajustar la dosis en función de la edad. | No es necesario ajustar la dosis en pacientes con IR leve o moderada. No se recomienda en pacientes con IR grave (aclaramiento de creatinina <30 ml/min) o ERT. | No es necesario ajustar la dosis en pacientes con insuficiencia hepática. |
| Dulaglutida157 | Dosis en monoterapia: 0.75 mg una vez/sem. Dosis en combinación: 1.5 mg una vez/sem. La dosis puede aumentarse en 1.5 mg después de mínimo 4 semanas. Dosis máxima: 4.5 mg una vez a la semana. | No es necesario un ajuste de dosis en función de la edad. | No es necesario un ajuste de dosis en IR leve, moderada o grave. No se recomienda en pacientes con ERT (<15 ml/min/1.73m2). | No es necesario un ajuste de dosis en pacientes con insuficiencia hepática. |
| Semaglutida157 | Dosis inicial: 0.25 mg una vez/sem. Después de 4 semanas, aumentar a 0.5 mg una vez/ sem. Dosis máxima: 1 mg una vez/semanales | No es necesario un ajuste de dosis en función de la edad. La experiencia terapéutica en pacientes ≥75 años es limitada. | No es necesario un ajuste de dosis en pacientes con IR leve, moderada o grave. No se recomienda en pacientes con ERT. | No es necesario un ajuste de dosis en pacientes con insuficiencia hepática. La experiencia en pacientes con insuficiencia hepática grave es limitada, por lo que se debe extremar la precaución en estos pacientes. |
| Inhibidores del cotransportador sodio-glucosa tipo 2 | ||||
| Canagliflozina158 | Dosis inicial: 100 mg una vez/día. Dosis máxima: 300 mg una vez/ día si la función renal es normal. | Se deben tener en cuenta la función renal y el riesgo de depleción del volumen. | Para el tratamiento de la ER diabética, como complemento al tratamiento de referencia (ej. IECA o BRA), se debe utilizar una dosis de 100 mg de canagliflozina una vez/día. Debido a que la eficacia hipoglucemiante de la canagliflozina se reduce en pacientes con IR moderada y probablemente sea nula en pacientes con IR grave, si se necesita un control adicional de la glucemia, se puede considerar la posibilidad de añadir otros hipoglucemiantes. En pacientes con TFGe <60 ml/min/1.73m2 mantener dosis de 100mg y en caso necesario, añadir otro hipoglucemiante. En pacientes con TFGe <30 ml/min/1.73m2 continuar su uso hasta diálisis o trasplante renal. No iniciar en pacientes con TFGe <30 ml/ min/1.73m2 . | No es necesario ajustar la dosis en pacientes con insuficiencia hepática leve o moderada. No se ha estudiado en pacientes con insuficiencia hepática grave y no se recomienda su uso en estos pacientes. |
| Dapagliflozina159 | Dosis para DMT2: 10 mg una vez/día. Dosis para DMT1: 5 mg una vez/día solo como complemento a la insulina. | No se recomienda ajuste en relación con la edad. | En pacientes con IR, como la eficacia glucémica es dependiente de la función renal, no se debe iniciar dapagliflozina en pacientes con una TFG <60 ml/min y debe interrumpirse con TFG persistente <45 ml/min. Se recomienda monitorizar la función renal antes de iniciar el tratamiento y al menos una vez al año. En pacientes con TFG <60 ml/min, al menos 2 a 4 veces al año | No es necesario ajustar la dosis en pacientes con insuficiencia hepática leve o moderada. En pacientes con insuficiencia hepática grave, se recomienda una dosis de inicio de 5 mg y si es bien tolerada, se puede aumentar a 10 mg. |
| Empaglifozina160 | Dosis: 10 mg una vez/día. Dosis máxima: 25 mg una vez/día en pacientes con función renal normal | No se recomienda un ajuste de dosis en función de la edad. En pacientes ≥75 años, debe tenerse en cuenta que existe un mayor riesgo de hipovolemia. | En pacientes que toleran la empagliflozina y cuya TFGe desciende sistemáticamente por debajo de 60 ml/min/1.73m2 o con un CrCl por debajo de 60 ml/min, la dosis debe ajustarse o mantenerse en 10 mg una vez al día. El tratamiento con empagliflozina debe interrumpirse cuando la TFGe se encuentre sistemáticamente por debajo de 45 ml/min/1.73m2 o el CrCl se encuentre sistemáticamente por debajo de 45 ml/min. No debe iniciarse en pacientes con una TFGe <60 ml/min/1.73m2 o un CrCl <60 ml/min. No debe utilizarse en pacientes con ERT ni pacientes sometidos a diálisis. | No se precisa un ajuste de dosis en pacientes con insuficiencia hepática. La experiencia terapéutica en pacientes con insuficiencia hepática grave es limitada y, por lo tanto, no se recomienda su uso en esta población |
| Ertugliflozina161 | Dosis inicial: 5 mg una vez/ día. Dosis máxima: 15mg una vez/d | No se recomienda ajustar la dosis de ertugliflozina en función de la edad. Se debe tener en cuenta la función renal y el riesgo de hipovolemia. La experiencia en pacientes ≥ 75 años es limitada. | Se recomienda evaluar la función renal antes de iniciar el tratamiento y de forma periódica a partir de este momento. No se recomienda iniciar el tratamiento en los pacientes con una TFGe <60 ml/min/1.73m2 o CrCl inferior a 60 ml/min. Se debe suspender cuando la TFGe sea de forma persistente <45 ml/min/1.73m2 o el CrCl sea de forma persistente inferior a 45 ml/min. No se debe utilizar en pacientes con IR grave, ERT o pacientes con diálisis. | No es necesario ajustar la dosis de ertugliflozina en pacientes con insuficiencia hepática leve o moderada. No se ha estudiado el uso de ertugliflozina en pacientes con insuficiencia hepática grave y no se recomienda su uso en estos pacientes. |
Fuente: ADHOC con información obtenida de ficha técnica de cada producto emitida por la Agencia Española de medicamentos y productos sanitarios.