Introducción
Los síndromes hipereosinofílicos (SHE) son entidades poco frecuentes que engloban una amplia gama heterogénea de patologías que se presentan con sobreproducción e infiltración de eosinófilos y daño orgánico, dentro de las cuales se incluye la fibrosis endomiocárdica. Esta patología suele ser muy infrecuente y fue descrita en 1936 por Wilhelm Löeffler durante una autopsia cardiaca, considerándolo un suceso adverso asociado al uso de drogas. Luego comparó los hallazgos con la fibrosis endomiocárdica inducida por eosinófilos1,2.
Se considera SHE a la presencia de un conteo de eosinófilos mayor a 1500/mm3 en sangre periférica en dos hemogramas separados por un periodo mayor a un mes y que persisten por al menos 6 meses, la confirmación patológica de hipereosinofilia tisular (biopsia de médula ósea con más de 20% de eosinófilos y/o infiltración tisular extensa observada por un patólogo y/o depósitos grandes de gránulos eosinofílicos en un tejido detectados por inmunofluorescencia), junto con hallazgos que sugieran patología sistémica o daño a órgano blanco1,3,4.
La fibrosis endomiocárdica (FEM), conocida también como endocardiomiofibrosis, es una cardiopatía restrictiva asociada a síndromes hipereosinofílicos que generan fibrosis del endocardio apical de uno o ambos ventrículos, con su consecuente restricción del llenado ventricular y eventual insuficiencia cardiaca. Su prevalencia es mayor en países tropicales y subtropicales de bajo ingreso económico como Uganda, Nigeria, el sur de India, Venezuela y Brasil1,2,5,6. Esta condición conlleva una gran morbimortalidad que puede llegar a ser refractaria al tratamiento médico. Su etiología es desconocida, sin embargo, se han descrito múltiples posibles causas, las cuales pueden ser drogas, de origen neoplásico, idiopático o en relación con algún trastorno subyacente, como lo es la atopia1,5.La infiltración eosinofílica al endocardio conlleva en la fibrosis endomiocárdica de Löeffler, siendo esta la manifestación cardiaca más característica del síndrome hipereosinofílico1,4.
La incidencia de los síndromes hipereosinofílicos es de alrededor de 0.36 a 6.3 por cada 100.000 habitantes. Predomina en el sexo masculino con una relación hombre:mujer de 9:11. Los hombres entre 20 y 50 años, con pico a los 41 años, corresponden al grupo etario mayormente afectado, sin embargo, algunos casos también han sido reportados en pacientes pediátricos. Se conoce que estos síndromes suelen ser subdiagnosticados, y aproximadamente el 50% cursa con afectación cardíaca severa y se describe una edad media de supervivencia de 2 años después del diagnóstico1,4,5,6.
Materiales y métodos
Se realiza el reporte de caso clínico de una paciente de 31 años, en el que se realizó el diagnóstico de insuficiencia cardiaca derecha en relación con una miocardiopatía restrictiva por fibrosis endomiocárdica biventricular de predominio derecho debida al daño eosinofílico crónico secundario a su leucemia eosinofílica crónica.
Para la elaboración del artículo, se realizó la revisión de literatura médica con artículos científicos tanto en idioma español como inglés, comprendidos desde el año 2013 a 2022 de revistas científicas como Cardiology in Review, Revista Clínica de la Escuela de Medicina UCR-HSJD, Blood Reviews, Journal of the American Society of Echocardiography, Current Problemas in Cardiology, Cardiology The Clinics, Department of Health & Human Services USA, Cardiology Clinical, Journal of the American College of Cardiology, The American Journal of Medicine, Sociedad Americana de Ecocardiografía y de la Asociación Europea de Imagen Cardiovascular, Jornal of the American College of Cardiology y última guía de manejo para Insuficiencia Cardiaca de European Society of Cardiology (2021), y con la excepción del artículo “A population study of endomyocardial fibrosis in a rural area of Mozambique” publicado en el 2008, correspondiente a criterios diagnósticos y clasificación de severidad de la fibrosis endomiocárdica utilizados en la actualidad y el artículo “Endomyocardial fibrosis: Why is there striking ascites with little or no peripheral oedema?” publicado en 1996 como única fuente que explica la ausencia de edema periférico en esta condición; y se utilizó base de datos como UpToDate para información complementaria.
Presentación del caso clínico
Presentamos el caso clínico de un paciente masculino de 31 años, costarricense, con historia de consumo de cocaína desde hace 10 años, sin alergias conocidas y sin antecedentes heredofamiliares de importancia, con antecedente personal patológico de vasculopatía de sistema nervioso central secundaria al consumo de cocaína y neurosífilis, el cual presenta un trastorno eosinofílico marcado, evidenciado en el siguiente hemoleucograma:
Eritrocitos 4.47x10^6/ul, hemoglobina 13.3 g/dl, sin alteraciones en volumen corpuscular medio ni hemoglobina corpuscular media, hematocrito 39.4%
Recuento plaquetario de 130.000/ul.
Leucocitosis de 51810/ul con 0/ul bandas, basofilia de 259.05/ul, segmentados 8890/ul, monocitos 1110/ul, linfocitos 3280/ul y eosinofilia marcada de 36992.34/ul que corresponde al 71.4% de la totalidad de leucocitos.
Al microscopio de campo luminoso, se observan eosinófilos hipogranulares, con granulación final e hipersegmentación y vacuolización citoplasmática.
Considerando lo anterior, y además en relación con la continuidad de este trastorno celular por un periodo mayor de 6 meses, se planteó la sospecha de un SHE, por lo que se realizaron estudios subsecuentes en donde se descartó eosinofilia de origen farmacológico, alérgico o por parasitosis adquirida.
En búsqueda del origen de este hallazgo, el caso fue valorado por el Servicio de Hematología, quienes realizan completan estudios, en donde se deduce que el SHE es secundario a una leucemia eosinofílica crónica de variante mieloproliferativa en relación con el gen de fusión asociado con FIP1L1/PDGFRA con actividad tirosin kinasa, por lo que se inició tratamiento farmacológico con Imatinib 400 mg cada día vía oral, el cual presenta efecto inhibidor en la proteína tirosin kinasa. Al momento de este diagnóstico, no se evidenció compromiso orgánico.
Posterior a esto, el paciente permaneció en control estricto con los servicios de Hematología y Medicina Interna, completando estudios en búsqueda de lesiones en órgano blanco. Dos años después del diagnóstico se decide realizar ecocardiograma transtorácico control, en donde se documenta el hallazgo de una miocardiopatía restrictiva bilateral de predominio derecho con obliteración de ambos ápices ventriculares y retracción de ambas válvulas atrioventriculares, sugestivo de una fibrosis endomiocárdica.
Al momento de este hallazgo, el paciente se encuentra estable, a la exploración física, sin datos de inestabilidad hemodinámica o respiratoria, no presenta cianosis periférica ni datos de retracción subcostal, pulsos periféricos normales con llenado capilar adecuado, sin embargo, presenta ingurgitación yugular a 45º y a la revisión abdominal presenta ascitis, con onda ascítica positiva. A la auscultación cardiaca, se evidencia soplo sistólico grado III-IV según escala de Levine, predominante en focos cardiacos pulmonar y mitral, de intensidad variable, sin irradiaciones e intensificado a la inspiración profunda. Signos vitales: presión arterial 85/61 mmHg, frecuencia cardiaca 85 latidos por minuto, frecuencia respiratoria de 16 respiraciones por minuto, saturación de oxígeno del 93% al aire ambiente.
Consecuente a lo anterior, se realizó orden de internamiento en el Servicio de Cardiología para completar estudios.
En exámenes sanguíneos control, se evidencia:
1. Hemoleucograma:
Eritrocitos 3.62x10^6/ul, hemoglobina 11.4 g/dl sin alteraciones en volumen corpuscular medio ni hemoglobina corpuscular media, hematocrito 33.1%
Recuento plaquetario normal para 191.000/ul.
Leucocitosis de 8790/ul con 0/ul bandas, basofilia de 87.9/ul, segmentados 6407.91/ul, monocitos 826.26/ ul, linfocitos 1072.38/ul y eosinofilia 369.18/ul.
2. Bioquímica sanguínea:
Nitrógeno ureico sérico 16 mg/dl, creatinina sérica 1.33 mg/dl, fósforo sérico 2.8 mg/dl, calcio sérico 9.3 mg/dl, potasio 3.36 mmol/l, cloro 102.2 mmol/l, magnesio 2.1 mg/dl.
3. Pruebas de función hepática:
Bilirrubinas totales 2.9 mg/dl (directa: 0.53 mg/dl e indirecta 2.37 mg/dl), aspartato aminotransferasas 25 U/l, alanina aminotransferasa 19 U/l, fosfatasa alcalina 147 U/l.
4. Pruebas de coagulación:
Tiempo de protrombina 13.6s con un porcentaje de actividad de 69%, tiempo de tromboplastina activada de 28.7s, dímero D 1223 ng/ml e INR de 1.27%.
5. Inmunología:
6. Cribado toxicológico en orina, y se evidencia: a. Presunto positivo para anfetaminas y opiáceos.
Se realizó ecocardiograma transtorácico en reposo que reflejó lo siguiente:
Membrana obliterante del ápex ventricular bilateral de predominio derecho (ver Figura 1).
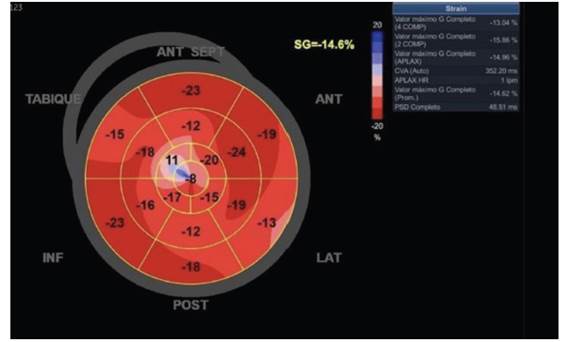
Ventrículo izquierdo (VI) de dimensiones normales, diámetro diastólico ventricular izquierdo de 51 mm y grosor de pared de 9mm. Contractilidad global y segmentaria del VI conservada. Función sistólica del VI con fracción de eyección (FE) por método Simpson conservada en 54%, con strain global longitudinal promedio reducido en -14.6% (ver figuras 2, 3 y 4). La diastología del VI muestra un patrón restrictivo, con relación entre la onda de llenado ventricular temprano y la contracción auricular (E/A) de 2, un tiempo de desaceleración de 135ms y una relación E/E’ de 15, con velocidad de la onda E en 1.3 m/s.
Dilatación auricular izquierda leve (área de 20.3 cm2, volumen total 58 ml, volumen indexado de 34 ml/m2) (ver figura 5).
Ventrículo derecho dilatado (diámetro basal 46 mm, diámetro medio 32 mm y diámetro longitudinal 50 mm) con caída de la función sistólica longitudinal (excursión sistólica del anillo tricuspídeo (TAPSE) de 11 mm, onda S’ del anillo tricuspídeo de 13 cm/seg, cambio de área fraccional de 29.8%) (ver figuras 6, 7, 8 y 9).
Dilatación auricular derecha severa (área de 29.2 cm2, volumen total 126 ml, volumen indexado de 74 ml/m2) (ver figura 5).
Válvula aórtica trivalva con gradiente sistólico pico transvalvular en 6 mmHg, con raíz aórtica de tamaño normal (30 mm). Sin insuficiencia aórtica.
Retracción de la válvula tricuspídea con un defecto de coaptación valvular anatómico de 14 mm (ver figura 10) y un jet de insuficiencia tricuspídea masiva, con una velocidad pico de insuficiencia tricuspídea de 1.31 m/s para un gradiente transtricuspideo (GTT) de 7 mmHg.
Retracción de la válvula mitral predominantemente a niel de la valva posterior con defecto de coaptación, con insuficiencia mitral severa secundaria clasificación Carpentier IIIA (vena contracta de 6 mm, con radio pisa de 9 mm para una orificio efectivo regurgitante estimado en 0.4 cm2 y un volumen regurgitante de 64 ml). Sin estenosis mitral asociada.
Derrame pericárdico leve sin repercusión hemodinámica o datos de taponamiento cardiaco.
Se descarta la presencia de masas intracardiacas, defectos del septum interatrial o interventricular, vegetaciones, pseudoaneurismas, o coartación aórtica.
11. Baja probabilidad de hipertensión pulmonar.
En relación con los datos proporcionados anteriormente, se establece que, para el momento en que se realizan los estudios, el linfoma mieloproliferativo del paciente se encuentra en remisión (último hemograma con niveles normales de eosinófilos). Sin embargo, con los datos ecocardiográficos y por su hipereosinofilia previa, se concluye que el paciente presenta una insuficiencia cardiaca derecha en relación con una miocardiopatía restrictiva por fibrosis endomiocárdica biventricular de predominio derecho debida al daño eosinofílico crónico secundario a su patología hematológica de base.
Finalmente, en vista de su fibrosis endomiocárdica causal, actualmente el paciente se encuentra en control médico en el Servicio de Hematología, Medicina interna y Cardiología, con los siguientes medicamentos: Furosemida 40 mg dos veces al día vía oral y con Espironolactona 25 mg dos veces al día vía oral; mientras que para el control de su leucemia eosinofílica crónica se mantiene con Imatinib 400 mg cada día VO. Además, debido a su severidad, se encuentra en lista de espera como posible receptor de trasplante cardiaco.
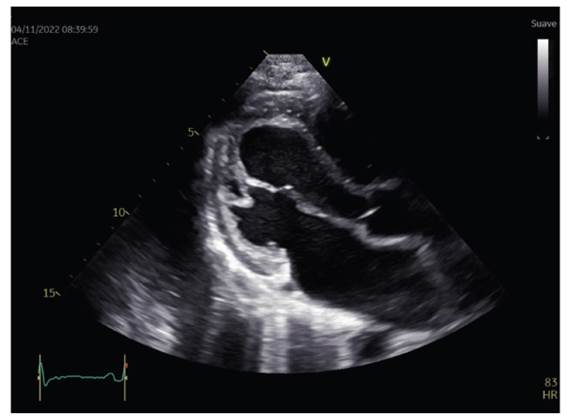
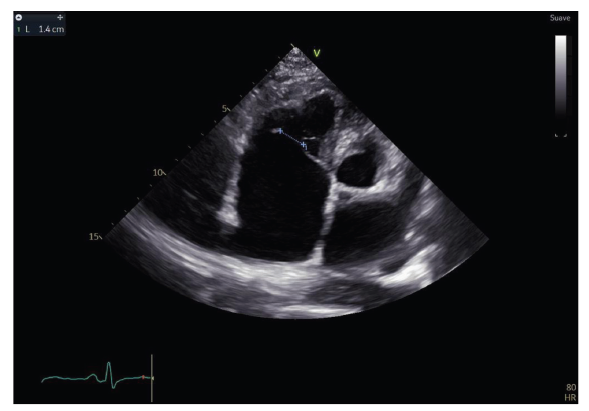
Figura 1 Eje largo paraesternal del ventrículo izquierdo. Se observa obliteración apical del ventrículo izquierdo y un endocardio engrosado de aspecto infiltrativo.
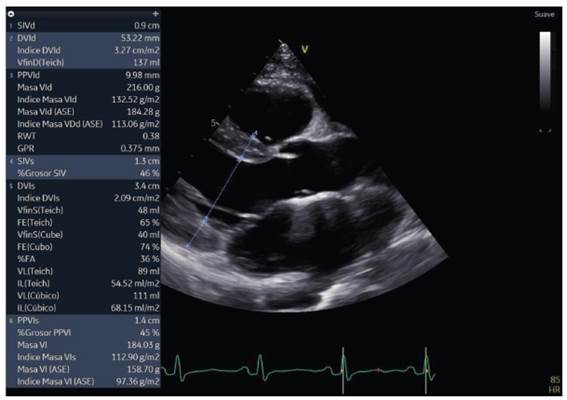
Figura 2 Eje largo paraesternal del ventrículo izquierdo en telediástole. El ventrículo izquierdo no se encuentra dilatado.
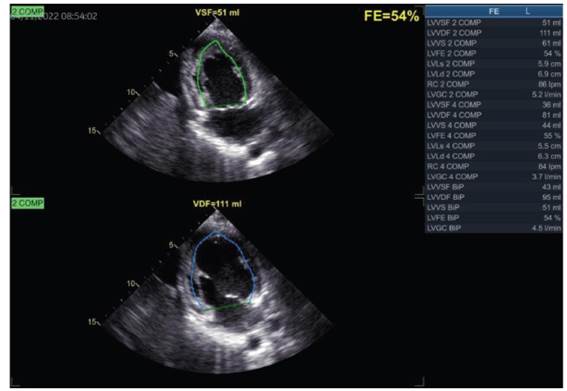
Figura 3 Medición de la función sistólica del ventrículo izquierdo por método Simpson biplano, la cual se encuentra conservada (FEVI 54%).
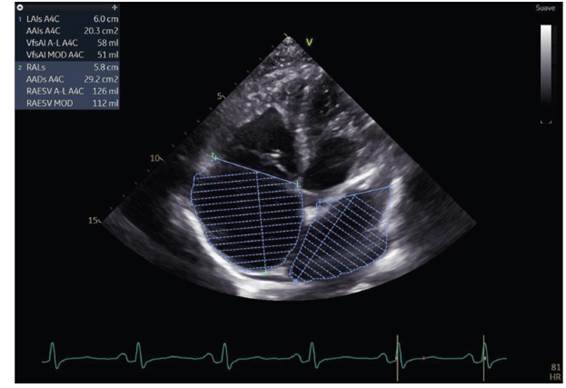
Figura 5 Vista apical 4 cámaras con medición de volúmenes de ambas aurículas. Con dilatación severa de la aurícula derecha y dilatación leve de la aurícula izquierda.
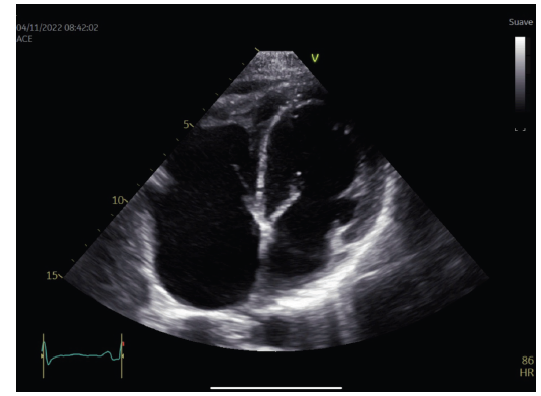
Figura 6 Vista apical 4 cámaras con enfoque hacia el ventrículo derecho, con obliteración apical derecha marcada, sin trombos visibles, con miocardio de aspecto infiltrativo. Se observa leve derrame pericárdico.
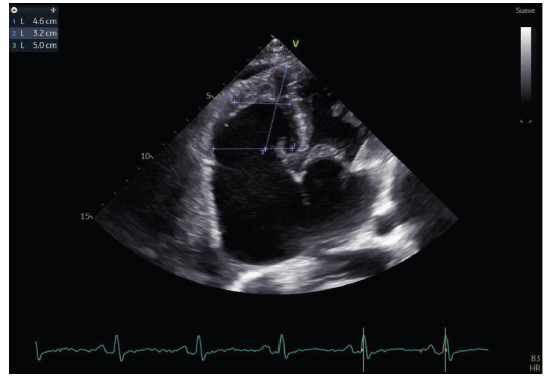
Valores de referencia: diámetro basal (25 a 41 mm), medio (19 a 35 mm) y longitudinal (59 a 83 mm) 7
Figura 7 Dimensiones del ventrículo derecho. Con aumento de los diámetros basal y medio, y disminución (retracción) del diámetro longitudinal.
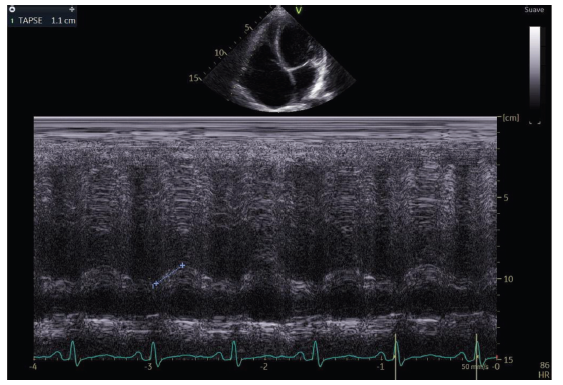
Figura 8 Función sistólica longitudinal del ventrículo derecho disminuida, medida en Modo M con la longitud de la excursión sistólica del anillo tricuspídeo (TAPSE).
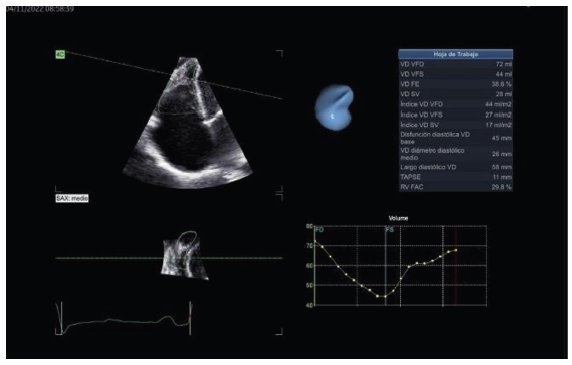
Figura 9 Reconstrucción en 3D del ventrículo derecho, donde se puede observar la obliteración apical, así como la caída de la función sistólica ventricular derecha.
Discusión
Según la literatura actual, se describe que la endomiocardiofibrosis está relacionada con los síndromes hipereosinofílicos (SHE), los cuales pueden desencadenarse por parasitosis endémicas, factores ambientales, malignidades hematológicas o por, predisposición genética. Además, este síndrome, puede ser provocado por reacciones de hipersensibilidad inducidas por fármacos o por enfermedades reumatológicas, como la granulomatosis eosinofílica con poliangeítis y con menos frecuencia el lupus eritematoso sistémico. Sin embargo, se describe que en aproximadamente un tercio de los casos no es posible identificar una etiología5,6,8.
Dentro de los fármacos principalmente relacionados con estas reacciones de hipersensibilidad se encuentran los siguientes5,8:
Antibióticos: derivados de beta-lactámicos, minociclina.
Sulfonamidas.
Antipsicóticos: clozapina.
Antiinflamatorios no esteroideos.
Diuréticos: acetazolamida, espironolactona, tiazidas.
Anticonvulsivantes: carbamazepina.
Por otra parte, se describen algunas causas nutricionales como el déficit de magnesio, el exceso de vitamina D, y la dieta alta en toxinas (como cerio, glucósidos cianógenos y serotonina), los cuales también pueden provocar la activación eosinofílica5,6.
Sobre las parasitosis, se reporta a causa de infecciones por toxocariasis, filariasis, malaria, esquistosomiasis y por helmintos5,6,8.
De igual manera, la eosinofilia puede ser a causa de malignidades hematológicas como la leucemia eosinofílica, este último descrito en el caso clínico presentado. Por otra parte, de igual modo puede estar en relación con mutaciones genéticas del receptor tipo 1 del factor de crecimiento de fibroblastos, y del receptor del factor alfa y beta de crecimiento derivado de plaquetas8.
La descripción de progresión de la enfermedad cardiaca va a variar dependiendo de la literatura, sin embargo, se han sugerido las siguientes etapas conforme la enfermedad avanza1,5,9,10.
1. Etapa de necrosis aguda
2. Etapa intermedia:
3. Etapa fibrótica:
Con respecto a la fase necrótica, se describe un proceso de degranulación eosinofílica que va a llevar a liberación de proteínas catiónicas tóxicas y especies reactivas de oxígeno, lo cual provocará daño inflamatorio directo a las células cardiacas y consecuentemente desencadenará procesos de muerte celular. Durante las fases iniciales, como la fase de necrosis aguda y miocarditis eosinofílica subsecuente, típicamente el paciente cursaría asintomático, sin embargo, se podrían evidenciar cambios mínimos a nivel electrocardiográfico como ecocardiográfico. No obstante, los valores de las troponinas estarían elevados, reflejando el daño miocárdico1,9,10.
Cabe destacar que las capas internas miocárdicas (como el endocardio) y las pequeñas arterias intramurales son las que van a estar en mayor riesgo de sufrir inflamación y arteritis, por lo que, en relación con esto, surge la duda si la vasculopatía por drogas diagnosticada en nuestro paciente era relacionada por el consumo de cocaína o más bien correspondía a un hallazgo temprano de la endomiocardiofibrosis eosinofílica que pasó desapercibida debido a su rara incidencia1. Además, según la literatura, se describe que, durante estadíos intermedios de la enfermedad, la degranulación hipereosinofílica llevará a la liberación de componentes, como los ya antes mencionados, que van a unirse a la trombomodulina endotelial, generando daño a las propiedades inherentes de las proteínas anticoagulantes de la membrana endotelial como lo es el colágeno subendotelial y el factor de von Willebrand, los cuales van a contribuir a un estado protrombótico. Se menciona que esta etapa ocurre luego de un periodo de 24.5 meses de hipereosinofilia, pero también puede ocurrir en fases iniciales de la enfermedad1,9.
Finalmente, durante la etapa de fibrosis, ocurre una proliferación de fibroblastos inducida por los mismos procesos inflamatorios, con el posterior depósito de este, principalmente mediado por el factor de crecimiento tipo B y la interleucina B, que va a provocar la fibrosis tisular focal o difusa el tejido cardíaco. Esta fibrosis afecta principalmente el ventrículo derecho, pero podría comprometer a ambos ventrículos en casi el 50% de los casos, distorsionando severamente al ventrículo izquierdo hasta en un 40% de estos. Por otro lado, la afectación podría verse en cualquier otra estructura anatómica1,5.
Asimismo, la fibrosis cardiaca puede extenderse desde el ápex cardiaco hasta la valva posterior de la válvula mitral, cuerdas tendinosas y los músculos papilares5. Estas últimas, junto con el endocardio subyacente van a estar comprometidas en la mayoría de los casos, lo que propicia el desarrollo de una cardiopatía de tipo restrictiva9.
En algunos ocasiones se ha demostrado que la formación de trombos superpuestos en etapas intermedias puede persistir hasta las etapas tardías, provocando mayor obliteración de la cavidad ventricular1.
Finalmente, estos procesos progresivos de necrosis, inflamación y posterior fibrosis se superponen entre sí, dando como resultado una miocardiopatía de tipo restrictiva con disfunción diastólica, retracción de cuerdas tendinosas con subsecuente insuficiencia valvular, principalmente de las válvulas atrioventriculares (tricuspídea o mitral). En un tercio de los pacientes, habrá afectación bivalvular1,5,8,9.
Respecto a la presentación clínica, las manifestaciones pueden ir desde un cuadro sistémico inespecífico como una enfermedad febril con eosinofilia e insuficiencia cardiaca aguda y en algunos casos presentarse con datos sugestivos de shock cardiogénico5. En la mayoría de los pacientes presentan sintomatología de insuficiencia cardiaca (predominantemente derecha), por lo que los pacientes presentarán fatiga, dolor torácico, poca tolerancia al ejercicio, aumento de la presión venosa yugular, hepatomegalia, ascitis, y esplenomegalia congestiva5,11. Paradójicamente, los pacientes con endocarditis eosinofílica que desarrollan fibrosis endomiocárdica, suelen presentar edemas en las extremidades inferiores solo en etapas avanzadas de la enfermedad en donde la función ventricular esta severamente afectada. Esto se debe a que, en etapas tempranas, los estudios del líquido acumulado en el abdomen sugieren que la expansión del volumen extracelular es de tipo exudativo, es decir, de origen inflamatorio, lo que hace que se comporte como la ascitis de origen tuberculoso.
En este caso, la acumulación de líquido en el abdomen no afecta directamente la circulación sanguínea de las extremidades inferiores, lo que explica por qué los pacientes no presentan edemas podálicos en las etapas tempranas de la enfermedad1,6,12. Algunos pacientes con fibrosis endomiocárdica también pueden desarrollar derrame pleural y/o pericárdico significativo y presentar trastornos del ritmo, como lo es la fibrilación auricular, la cual además es predictora de mal pronóstico6,13.
No existe un examen de laboratorio específico para el diagnóstico de la miocardiopatía restrictiva por fibrosis endomiocárdica, sin embargo, algunos pacientes pueden presentar eosinofilia marcada en las etapas tempranas, siendo este un hallazgo inespecífico6.
El electrocardiograma puede ser normal durante la etapa necrótica aguda o evidenciar hipertrofia biauricular e hipertrofia ventricular principalmente derecha, con desviación del eje cardíaco en el mismo sentido1,5,6. La fibrosis cardiaca en sí puede ocasionar interferencias en la conducción cardiaca y, por ende, dentro de los posibles hallazgos electrocardiográficos se encuentra el bloqueo atrioventricular de primer grado y la fibrilación atrial. Esta última usualmente es más frecuente en pacientes con dilatación de la aurícula izquierda, sin embargo, esto se da hasta etapas más avanzadas de la enfermedad1,4,6.
Como fue mencionado anteriormente, durante fases iniciales de la FEM pueden evidenciarse datos de crecimiento auricular. En casos de hipertrofia auricular derecha se observan ondas P de alto voltaje junto con patrón QR o una onda R dominante en V1, mientras que durante procesos de endocardiomiofibrosis ventricular izquierda, se puede revelar ensanchamiento de onda P, reflejando agrandamiento atrial izquierdo, y algunas veces ligado a la depresión del segmento ST e inversión de onda T en derivadas laterales 6.
De igual importancia, y en relación con estudios por imágenes convencionales como lo son los estudios por rayos x, se pueden ver signos inespecíficos de cardiomegalia, este como consecuencia a la dilatación ventricular derecha o biauricular. Además, pueden observarse calcificaciones endocárdicas lineales6.
Tabla 1 Criterios para diagnóstico y de severidad para fibrosis endomiocárdica14.
| Placas endomiocardiocárdicas >2 mm de espesor | 2 |
| Placas endomiocárdicas delgadas <1 mm que afectan a más de una pared ventricular | 3 |
| Obliteración del ventrículo derecho o ápex del ventrículo izquierdo | 4 |
| Trombo espontáneo o eco contraste sin presencia de disfunción ventricular | 4 |
| Retracción del ápex del ventrículo derecho | 4 |
| Disfunción de válvulas AV por adhesión del aparato subvalvular a la pared del ventrículo | 1-4* |
| Criterios Menores | Puntos |
| Parches delgados de endomiocardio localizados en una pared ventricular | 1 |
| Patrón restrictivo a través de las válvulas atrioventriculares | 2 |
| Apertura en diástole de la válvula pulmonar | 2 |
| Engrosamiento difuso de la valva anterior mitral | 1 |
| Crecimiento de la aurícula con ventrículos normales | 2 |
| Realce en la densidad de la banda moderadora o de las trabéculas | 1 |
| En modo M: movimiento del septum interventricular y la pared posterior | 1 |
*El puntaje es asignado acorde a la severidad de la regurgitación atrioventricular. Obtenida de: Mocumbi AO, Ferreira MB, Sidi D, et al.
A population study of endomyocardial fibrosis in a rural area of Mozambique. N Engl J Med 2008;359(1):46.
El ecocardiograma transtorácico (2D, 3D), el ecocardiograma transesofágico, la ecocardiografía contrastada y el strain longitudinal global son considerados los estudios de elección para la detección de esta enfermedad, con los cuales se puede detectar: engrosamiento endocárdico, dilatación biauricular severa (asociado comúnmente con trombos libres o murales), retracción de los ventrículos (en algunos casos con trombos apicales) y disfunción de las válvulas atrioventriculares (por retracción anular)4,9,12. Además, se describe alteración de la geometría ventricular, hipercontractilidad basal y obliteración fibro-trombótica del ápex cardiaco, este último evidenciado en nuestro paciente5.
Durante el año 2008 se crearon los criterios diagnósticos específicos para la FEM, que, además, clasifican la enfermedad según su severidad, como se puede observar en la tabla 1. El diagnóstico requiere la presencia de dos criterios mayores, o uno mayor y dos menores; la severidad se determina en cuanto a su puntuación (puntuación <8: leve, 8-15 moderada y >15 severa)13,14.
Además, se han descrito 5 patrones de FEM por ecocardiograma4:
Tipo 1, limitada al ápex.
Tipo 2, extensión desde el ápex hasta el músculo papilar posterior de la válvula mitral o tricuspídea.
Tipo 3, fibrosis única de válvulas atrioventriculares.
Tipo 4, extensión únicamente del ápex y de válvulas atrioventriculares.
Tipo 5, endocardiomiofibrosis dispersa.
En estos casos, la resonancia magnética es utilizada como un estudio complementario. Se ha demostrado que detecta la fibrosis durante todas las etapas de la enfermedad y, además, visualiza el daño cardíaco durante la etapa temprana de inflamación eosinofílica miocárdica. Por otra parte, el realce con gadolinio detecta zonas de obliteración fibrotrombótica e hipertrofia apical con más sensibilidad que el ecocardiograma, lo cual es útil para guiar la mejor estrategia terapéutica4,5.
Finalmente, la biopsia cardiaca brinda el diagnóstico definitivo y es considerada la prueba de referencia, sin embargo, cuando la fibrosis cardiaca es difusa podría conducir a falsos negativos. Además, este procedimiento es sumamente invasivo y en ciertas ocasiones dificultoso, especialmente, cuando el engrosamiento endocárdico es severo o hay trombos intracavitarios5,6. Está indicada en casos de: insuficiencia cardiaca aguda de aparición fulminante asociado a compromiso hemodinámico o insuficiencia cardiaca aguda sin explicación de 2 semanas a 3 meses de duración asociado a dilatación ventricular izquierda y arritmia ventricular de reciente aparición, además, se recomienda en casos de insuficiencia cardiaca asociada a cardiomiopatía dilatada y sospecha de reacción alérgica o eosinofilia8.
De forma similar, se deben descartar otros diagnósticos diferenciales de miocardiopatías restrictivas de aspecto infiltrativo, como lo son la amiloidosis, la hemocromatosis, la sarcoidosis, la cardiopatía de origen reumático y la anomalía de Ebstein6.
El manejo en el contexto agudo de una miocarditis eosinofílica no infecciosa suele incluir el uso de terapias inmunosupresoras, siendo los corticosteroides la primera línea de tratamiento. Sin embargo, en el caso de nuestro paciente este tratamiento no fue indicado, ya que, aunque existe evidencia de su uso para el manejo agudo del SHE con el fin de evitar el daño cardiaco mediado por eosinófilos, para el momento en el que se realiza el diagnostico de la FEM, el paciente ya se encontraba en remisión de su condición de fondo y por ende no presentaba hipereosinofilia. Cabe mencionar que aquellos pacientes que presenten un desorden clonal asociado a mutación FIP1L1/PDGFRA con actividad tirosin kinasa y su consecuente SHE, tienen una peor respuesta al tratamiento esteroideo, por lo que se recomienda el tratamiento coadyuvante con un inhibidor de la tirosina quinasa, como lo es el Imatinib, en el que se describe una mejoría considerable1,3,8,15,16,17.
Por otra parte, para el manejo de pacientes con poca respuesta a las primeras lineas de tratamiento, se han descrito el uso de otras terapias como interferón alfa, azatioprina, hidroxiurea y mepolizumab. Otro punto relevante es que algunas veces, en etapas intermedias de la enfermedad, se pueden desencadenar procesos trombóticos por lo que es necesario incluir tratamientos adicionales, como lo son los anticoagulantes.
Sin embargo, la anticoagulación de rutina no está recomendada, a excepción de pacientes con evidencia de trombo atrial o ventricular, afección severa de la función ventricular y/o fibrilación atrial asociada, con el fin de reducir la posibilidad de complicaciones de origen cardioembólicas1,9,17.
En caso de que el paciente con FEM desarrolle síntomas de insuficiencia cardiaca, se deben instaurar terapias con el fin de lograr la compensación del cuadro agudo (basándose en guías internacionales) y eventualmente alcanzar las dosis optimas de tratamiento médico (tomando en cuenta la estabilidad hemodinámica del paciente), así como asegurar un adecuado control de arritmias y tomar medidas para la prevención y reducción de eventos cardiovasculares. Esto puede incluir el uso de diuréticos, antiarrítmicos, antagonistas del sistema renina-angiotensina-aldosterona, beta bloqueadores, inhibidores del SGLT2, y dispositivos intracardíacos.
En casos fulminantes que se presenten con disfunción ventricular severa y/o shock cardiogénico, se plantea el uso de dispositivos de soporte circulatorio avanzado (como dispositivos de asistencia ventricular o de oxigenación por membrana extracorpórea) como un puente a recuperación o a un eventual trasplante cardiaco15,16,18. En el caso de nuestro paciente, al presentar una insuficiencia cardiaca con fracción de eyección preservada, pero con sintomatología congestiva, se inició tratamiento con diuréticos de asa y espironolactona, este último debido a que se ha observado un efecto antifibrótico cuando se utiliza en pacientes con fibrosis endomiocárdica (FEM), brindado mayor beneficio y asociándose a un mejor pronostico1,6.
Cabe resaltar que los estudios que definen el uso de tratamiento medico optimo en insuficiencia cardiaca no incluyen a pacientes con esta patología. Por lo que el beneficio de utilizarlos es teórico y no se ha estudiado a profundidad.
En estadíos avanzados de la enfermedad (NYHA III-IV) se toman en consideración algunos procedimientos quirúrgicos, como la resección endomiocárdica o el reemplazo valvular. Estos procedimientos podrían llevar a una mejoría paliativa de los síntomas, que no siempre son exitosos y asocian mortalidad postoperatoria alta, variando de un 15 a 30% (principalmente el reemplazo valvular tricuspídeo). Además, se han descrito recurrencias postoperatorias. En casos seleccionados, con compromiso severo irreparable, inclusive puede ser necesario el trasplante cardiaco, como lo es en el caso de nuestro paciente6,8,15.
Por último, un tratamiento temprano con corticosteroides e Imatinib, en los casos indicados, conlleva una supervivencia hasta del 80% a los 5 años. De no ser así, el pronóstico es más reservado, con una mortalidad del 50% en estadíos avanzados y una supervivencia de 2 años luego del diagnóstico5,17.
El seguimiento debe procurar un control seriado con exámenes de sangre y estudios de gabinete como ecocardiograma o resonancia magnética para vigilar el progreso de la enfermedad15,17.
Conclusiones
Presentamos el caso de un paciente joven con fibrosis endomiocárdica secundaria a un proceso neoplásico de origen hematológico, una leucemia eosinofílica crónica. Esta condición se presentó como un cuadro de insuficiencia cardiaca dos años después del diagnóstico inicial de su condición hematológica, documentándose fibrosis endomiocárdica severa con compromiso biventricular, por lo que actualmente se encuentra a la espera de un trasplante cardiaco.
La fibrosis endomiocárdica (FEM) es una miocardiopatía restrictiva rara y potencialmente letal de predominio en hombres entre los 20 y 50 años que generalmente es consecuencia de un síndrome hipereosinofílico de base. Es una entidad muy poco frecuente, con mayor incidencia en países tropicales, como lo es Costa Rica. Lo anterior condiciona a la excentricidad del caso, y su relevancia.
Pese a los avances en el tratamiento médico de las miocardiopatías, el pronóstico de los pacientes con fibrosis endomiocárdica sigue siendo pobre, con un alto riesgo de recurrencias, progresión de la enfermedad y un alto índice de mortalidad a 2 años. Es por esto por lo que el diagnóstico oportuno y el abordaje temprano de su condición aguda y de su patología de fondo resultan esenciales. Se requiere de más estudios que nos permitan entender las causas de esta condición, para eventualmente desarrollar terapias más efectivas que disminuyan la progresión de la enfermedad y mejoren el pronóstico de estos pacientes.
Declaración y conflicto de intereses
Las autoras y autores manifiestan que no hay conflictos de interés para este artículo.
Financiamiento
No existen fuentes de financiamiento públicas o privadas para este artículo.