Introducción
El estudio de la cardiología se ha centrado desde hace mucho tiempo en el análisis de la estructura, función, patologías y tratamiento del ventrículo izquierdo. Por el contrario, el ventrículo derecho ha sido considerado una región del corazón con una importancia secundaria, siendo visto en algunos casos como el hermano pequeño del ventrículo izquierdo.
En la década de los 40 Starr et al. reportaron que no había repercusiones hemodinámicas significativas con la destrucción total de la pared libre del ventrículo derecho en perros(1) e incluso en los 70´s se llegó a hablar de que el ventrículo derecho era perfectamente dispensable (2).
Este concepto ha venido cambiando desde los últimos treinta años, donde se ha investigado más acerca de patologías exclusivas de cámaras derechas, la participación y valor pronóstico que tiene la disfunción ventricular derecha en la falla cardiaca global, así como avances en la aplicación de métodos diagnósticos fiables para la cuantificación de las cavidades derechas, así como abordajes terapéuticos enfocados a mantener su función. Toda esta floreciente investigación ha permitido ver que el esta área del corazón no es un simple expectante en la enfermedad cardiovascular, tal como lo mostró en 2006 el “National Heart, Lung and Blood Institute” de EE.UU., al declarar como prioritaria la investigación sobre el ventrículo derecho (3).
La presente revisión pretende repasar conceptos fisiológicos y anatomopatológicos del ventrículo derecho para posteriormente profundizar en la falla cardiaca derecha, susetiologías, repercusiones, herramientas diagnósticas y por último el abordaje terapéutico, con el fin de tener presente la importancia del Ventrículo derecho para la práctica de la cardiología actual.
Anatomía del ventrículo derecho
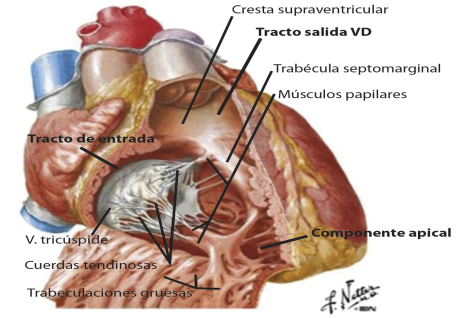
El ventrículo derecho se extiende desde el anillo tricuspídeo hasta el ápex, abarcando la región anterior, derecha e inferior de la silueta cardiaca. A diferencia del ventrículo izquierdo cuya forma es elipsoide, el ventrículo derecho posee una anatomía más intrincada pues adquiere una forma triangular en el plano longitudinal y forma de media luna que abraza el ventrículo izquierdo al ser visto en el plano axial (4).
Posee tres partes: el trato de entrada (comprende el aparato subvalvular tricuspídeo y trabeculaciones), la región apical con trabeculaciones gruesas y el tracto de salida que abarca desde la crista supraventricular hasta la válvula pulmonar.
Histologicamente está compuesto por dos capas de fibras musculares que corren la interna de forma longitudinal y la externa en sentido circunferencial, carece de la tercera capa de fibras espirales que sí posee el ventrículo izquierdo.
La diferencia en el grosor de la pared del ventrículo derecho es notoriamente menor que la del izquierdo siendo apenas un tercio de ella (3-4mm) lo cual provoca que su masa sea tan solo un sexto de la masa del ventrículo izquierdo. (5)
Por otra parte, el ventrículo derecho posee características únicas a saber: 1) posee trabeculaciones gruesas, 2) presenta una banda moderadora, 3) falta de continuidad fibrosa entre la válvula de entrada (tricúspide) y la de salida (pulmonar) ya que esta última se encuentra en el infundíbulo del VD y no forma parte del aparato fibroso del corazón. Estas características anatómicas permiten fácilmente ubicar el ventrículo derecho ante patologías congénitas con gran distorsión de la arquitectura ventricular. (6)
Embriología del ventrículo derecho
Embriológicamente el corazón primitivo está formado por la fusión de territorios de células precursoras miocárdicas provenientes del mesodermo esplácnico (Figura 1). Según estudios realizados en ratones por Zafran et al., el ventrículo derecho de los mamíferos se forma a partir de un grupo de dichas células precursoras cardiacas provenientes específicamente del mesodermo faríngeo que forma el campo cardiaco anterior o secundario, las cuales inicialmente son ajenas al tubo cardiaco primitivo que forma el ventrículo izquierdo y que posteriormente se fusionan a él. Dicho campo cardiaco anterior da origen al bulbo cardiaco (que origina el tracto de entrada y región apical del ventrículo) y tronco arterioso (que origina el tracto salida).(7)
Durante el periodo embrionario la masa ventricular derecha se asemeja a la izquierda, esto debido a las altas presiones de la circulación pulmonar fetal, cuando |se produce elnacimiento y las presiones de las cámaras derechas caen de forma súbita, la masa ventricular derecha se reduce gradualmente hasta su grosor adulto.
Fisiología ventricular derecha
El comportamiento fisiológico de las cámaras derechas está, sin caer en razonamientos teleológicos, en estrecha relación con las bajas presiones provenientes de la circulación pulmonar a las que está sometido (6).
El ventrículo derecho debido a las características anatómicas antes mencionadas, desarrolla presiones sistólicas mucho menores que las del ventrículo izquierdo. Presenta una contractilidad menor que la de su homólogo izquierdo (FEVD 45-60% vs FEVI 50-70%) sin embargo, dicha diferencia es compensada por un mayor volumen (precarga) lo que resulta en que el gasto cardiaco a ambos lados del corazón sea el mismo. (8)
La mayoría de la fuerza contráctil del ventrículo derecho se origina de las fibras longitudinales subendocárdicas principalmente y no tanto de las circunferenciales epicardicas; esto a diferencia de su contraparte izquierda en donde la mayor fuerza contráctil provienen de las circunferenciales y espirales.
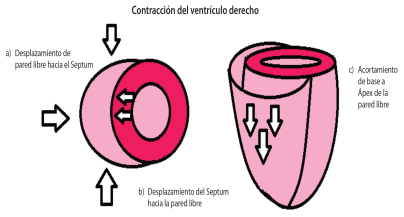
Según Boulpaep et al., el ventrículo derecho se contrae en forma de un fuelle (Figura 2) y consta de tres movimientos:
1) acortamiento del eje longitudinal desde la base hacia el ápex, 2) acortamiento de la pared libre en dirección hacia el tabique interventricular, 3) la contracción del ventrículo izquierdo fuerza un abombamiento del tabique que a su vez estira sobre él mismo la pared libre del ventrículo derecho. Estos tres movimientos generan la acción de fuelle que permite impulsar grandes cantidades de volumen hacia la circulación pulmonar. (9)
En cuanto a la circulación coronaria, el ventrículo derecho se irriga en su gran mayoría por la coronaria derecha y en menor medida por flujo proveniente de la circunfleja y en ocasiones la descendente anterior. Las diferencias de presiones entre uno y otro ventrículo originan diferentes curvas de flujo coronario; a nivel de la arteria coronaria izquierda el flujo cesa completamente e incluso se invierte durante la protosístole ventricular y se reanuda en el resto del ciclo; en la coronaria derecha por su parte, el flujo coronario no cesa durante protosístole pues las presiones ventriculares derechas nunca superan a la presión aórtica y por ende hay flujo durante todo el ciclo cardiaco.(9)
Fisiopatología de la falla cardiaca derecha
Múltiples patologías agudas o crónicas ya sean del ventrículo izquierdo, de la circulación pulmonar o intrínsecas del ventrículo derecho pueden hacer que éste disminuya su eficiencia contráctil y por ende reduzca el flujo sangíneo a lacirculación pulmonar, situación que se conoce como falla cardiaca derecha. (8)
Existen cinco mecanismos fisiopatológicos principales por los que se puede progresar a insuficiencia cardiaca derecha a saber: 1) sobrecarga de presión, 2) sobrecarga de volumen, 3) isquemia miocárdica, 4) enfermedes intrínsecas del ventrículo derecho y 5) compresión por enfermedad pericárdica. (10)
Dichos mecanismos originan una discincronía inicial, dilatación, aumento en la tensión parietal y del consumo de oxígeno que conducen a una caída en la función contráctil del ventrículo derecho. La sobrecarga de presión y volumen empujan el septum hacia la izquierda por un mecanismo llamado interdependencia ventricular. Esto conlleva una disminución de la precarga y postcarga del ventrículo izquierdo y el gasto cardiaco cae. Al caer el gasto cardiaco se ve limitado el flujo coronario lo cual agrava la disfunción del ventrículo derecho. (11)
Por otra parte, si el proceso se prolonga se produce falla orgánica como consecuencia de un doble hit: por un lado hipoperfusión por caída del gasto cardiaco, y retrógradamente congestión sistémica por aumento en las presiones venosas centrales; esto origina daño orgánico en mayor medida que la caída sola del gasto cardiaco. (11, 14)
El ventrículo izquierdo es capaz de enfrentarse a cambios súbitos de presión con una caída en su volumen de eyección de menos del 10% al pasar de 100 a 140mmHg. Por el contrario, el derecho tiene un mal desempeño al enfrentarse a cambios súbitos de presión debido a que es más una cámara de capacitancia; presenta caídas en el volumen de eyección de hasta un 30% al enfrentarse a un cambio de presión de 10 a 30mmHg. (12)
Los cambios más solapados son compensados de forma transitoria con una hipertrofia de la pared ventricular derecha, que permite de acuerdo a la Ley de Laplace, soportar el aumento de la postcarga; sin embargo, si la injuria persiste el miocardio derecho inexorablemente culminará en falla ventricular. (15)
La causa más frecuente de sobrecarga de presión al ventrículo derecho es por falla ventricular izquierda; esto aumenta las presiones de llenado de forma retrógrada, genera hipertensión pulmonar y por ende repercute en la postcarga derecha. (10)
Otras causas comunes de sobrecarga de presión de cámaras derechas son las que afectan la circulación y parénquima pulmonares, como es el caso de la hipertensión arterial pulmonar, la enfermedad tromboembólica aguda y crónica, las neumopatías (enfisema, intersticiopatías, neumonías, atelectasias, derrames pleurales), la ventilación mecánica con presión positiva, causas metabólicas causantes de vasoconstricción pulmonar (hipercapnia, acidosis, hipoxia, hipotermia), entre otras causas. (8, 12)
El aumento desmedido de la precarga (volumen) también origina falla cardiaca derecha, ejemplos de esto ocurre en patologías como insuficiencia tricuspídea y pulmonar, shunts pretricuspídeos, etc. A su vez, la caída en la precarga también va a comprometer el volumen sistólico ventricular derecho como ocurre en el caso de síndrome de vena cava superior, estenosis tricuspídea, fuga capilar, hipovolemia, enfermedades del pericardio (taponamiento cardiaco, pericarditis constrictiva), etc. (13).
Otras causas de falla cardiaca derecha incluyen la isquemia miocárdica (secundaria a sobrecarga de presión o infarto de miocardio), cardiopatías congénitas con copromiso derecho (anomalía de Ebstein, Tetralogía de Fallot, Transposición de grandes vasos), Cardiomiopatía Arritmogénica del Ventrículo derecho y otras cardiomiopatías en general, arritmias y sepsis. (8, 12, 13, 14).
Evaluación clínica del paciente con falla cardiaca derecha
El abordaje inicial del paciente con falla cardiaca derecha depende de la rapidez con la que se instaura el cuadro así como la etiología desencadenante, ya que los escenarios pueden ser tan variados como un cuadro súbito de disnea y colapso hemodinámico como en el caso de un tromboembolismo pulmonar masivo, hasta casos más insidiosos como la hipertensión pulmonar, incompetencias valvulares, progresión de cardiopatías congénitas, etc; en donde la clínica puede ser mínima o con síntomas leves como fatiga y disnea de esfuerzos.
De cualquier forma, independientemente de la etiología subyacente, existe una serie de signos y síntomas que, si bien pueden observarse en falla cardiaca biventricular son más comúnmente asociados a falla cardiaca derecha. Entre los síntomas podemos mencionar: saciedad temprana, dolor en cuadrante superior derecho por congestión hepática, fatiga, disnea de esfuerzos, palpitaciones, entre otros. (16)
Los signos frecuentes en falla cardiaca derecha son ganancia de peso, edemas podálicos y en zonas de declive como el escroto, aumento de la circunferencia abdominal por ascitis y hepatoesplenomegalia, soplo de insuficiencia tricuspídea, ingurgitación yugular y reflejo hepatoyugular. (16)
Estudios de laboratorio y gabinete
El electrocardiograma puede ser de gran utilidad en las enfermedades de cámaras derechas, ya que existen hallazgos propios que pueden orientar a una deterinada patología causante de la falla cardiaca. Así por ejemplo es posible identificar pacientes jóvenes con voltajes bajos en v1-v4 y ondas épsilon en v1 y v2 que alertarán sobre la presencia de cardiomiopatía arritmogénica del ventrículo derecho. (17)
Trastornos de repolarización, criterios de Sokolov-Lyon derecho (Rv1+Sv5≥10,5mm) R>S en v1, Rv1 ≥7mm, eje desviado derecha, entre otros signos, orientan a hipertrofia ventricular derecha. (18)
El infarto del ventrículo derecho se origina por oclusión de la arteria coronaria derecha a nivel proximal y se presenta en el 50% de pacientes con infarto inferior; los hallazgos electrocardiogáficos más destacados son elevación de ST en derivadas derechas V3R-V4R en pacientes con infarto inferior (hST DII, DIII, AVF). (19)
En la radiografía de tórax, el ventrículo derecho ocupa la parte basal de la silueta cardiaca en PA, y mostrará, en casos de dilatación, un crecimiento de la silueta cardiaca que adquirirá forma de bota; esto originado por el desplazamiento lateral del ápex al agrandarse el ventrículo derecho. Además, en la proyección lateral llega incluso a rellenar el espacio retroesternal.(16)
En cuanto a los estudios de laboratorio existen marcadores de falla cardiaca (tanto izquierda como derecha) que son de utilidad.
El BNP y NT-pro BNP son marcadores de distensión atrial los cuales son casi indetectables en condiciones normales pero se elevan de forma sustancial ante falla cardiaca aguda.
El BNP con un punto de corte de 100pg/ml tiene una sensibilidad de 90%, especificidad de 76% y una veracidad de 83% para diferenciar falla cardiaca de otras causas de disnea.(20)
En el estudio PRIDE, valores de NT-proBNP en 900pg/ml fueron tan útiles como BNP≥100pg/ml para el diagnóstico de insuficiencia cardiaca y se logra incluso mejor desempeño discriminatorio si se estratifica según edad y sexo. (21)
Ambos marcadores deben ser usados en un contexto clínico apropiado para apoyar el diagnóstico de insuficiencia cardiaca derecha. Es de destacar que ambos marcadores tienen alto valor predictivo negativo si se encuentran por debajo de los puntos de corte establecidos (<100pg/ml para BNP y <300pg/ml para NT-proBNP. (20-21).
Como es de suponer, las troponinas también tienen un papel en las patologías del ventrículo derecho. Se ha demostrado su utilidad para pronosticar o excluir disfunción ventricular derecha y riesgo elevado de resultados adversos en el tromboembolismo pulmonar (un TEP con elevación de troponinas se considera submasivo), siendo además útil para guiar las pautas terapéuticas. (22, 23, 24)
Las elevaciones en transaminasas han sido utilizadas como predictores independientes de mortalidad y demás resultados adversos en pacientes con falla cardiaca así como el lactato ≥2mmol/l es predictor independiente de mortalidad al ingreso hospitalario en pacientes con TEP. (25,26)
Ecocardiografía del ventrículo derecho
El estudio imagenológico, pese a ser una técnica útil en el diagnóstico múltiples patologías del ventrículo derecho, históricamente también ha sufrido la marginación y no en todos los estudios ecocardiográficos se lleva a cabo una evaluación sistemática de esta cámara, debido en parte al exceso de atención que se le presta al ventrículo izquierdo así como la falta de familiaridad del ecografista con muchos de los parámetros nuevos de cuantificación de cámaras derechas (27).
Sin embargo, la Sociedad Americana de Ecocardiografía y la Sociedad Europea de Imagen Cardiovascular en años recientes han hecho un esfuerzo monumental en la estandarización de parámetros cuantitativos para la medición de la función ventricular derecha. (28)
A la hora de evaluar el ventrículo en cuestión se debe reportar teniendo en cuenta parámetros cuantitativos>cualitativos obtenidos de las múltiples ventanas acústicas (paraesternal largo y corto, eje largo del tracto de entrada VD, 4 cámaras, 4 cámaras modificado en VD, subxifoideo, etc.) en las que se puede observar las diversas caras del ventrículo derecho (anterior, posterior y lateral). (28, 29)
Según estas guías, las mediciones que se deben tomar son:
Diámetros de ventrículo y atrio derechos.
Función sistólica del ventrículo derecho con al menos uno de los siguientes parámetros:
Cambio de área fraccional
Excursión sistólica del anillo tricuspídeo (TAPSE por sus siglas en Inglés)
Onda Sistólica medida en Doppler Tisular TDI. (S´tricuspídea)
Índice de desempeño miocárdico del VD (RVIMP por siglas en Inglés).
Presión sistólica de arteria pulmonar.
Volúmenes y fracción de eyección cuando hay disponibilidad de eco 3D.
Strain de ventrículo derecho (28)
Los diámetros del ventrículo derecho deben estimarse en una vista apical 4 cámaras enfocada en el ventrículo derecho con cuidado de evitar acortamiento; esto debido a que la orientación usual de la vista 4 cámaras convencional subestima su verdadero diámetro máximo. Se debe determinar el diámetro basal, medio y longitudinal en telediástole(29).
Otros valores que deben medirse son las dimensiones del tracto de salida del ventrículo derecho proximal (la cual se realiza en eje paraesternal largo y en eje corto) y el tracto de salida distal (en eje corto paraesternal inmediatamente proximal a la válvula pulmonar), además se debe procurar medir el grosor de la pared libre en telediástole por medio de una vista subxifoidea, con cuidado de evitar incluir grasa, trabéculas ni pericardio (28).
Aparte de los valores antes mencionados, una relación entre el diámetro diastólico del VD / diámetro diastólico del VI mayor a 1 (DDVD/DDVI>1) indica dilatación del ventrículo derecho. Los diámetros de cámaras derechas se resumen según las guías Americanas de Cuantificación de cámaras en la tabla 1.
Tabla 1 Valores normales para cuantificación de ventrículo derecho según las guías de cuantificación de cámaras de la Sociedad Americana de Ecocardiografía (ASE por sus siglas en Inglés). SD: desviación estándar. TSVD: tracto de salida del Ventrículo Derecho. VD: ventrículo derecho.
| Parámetro | Rango medio+SD | Valores normales: +/-2SD |
|---|---|---|
| Diámetro basal | 33+/-3 | 25-41 |
| Diámetro medio | 27+/-4 | 19-35 |
| Diámetro longitudinal | 71+/-6 | 59-83 |
| TSVD eje paraesternal | 25+/2,5 | 20-30 |
| TSVD proximal | 28+/-3,5 | 21-35 |
| TSVD distal | 22+/-2,5 | 17-27 |
| Grosor pared VD | 3+/-1 | 1-5 |
El área del ventrículo en diástole y en sístole es otro parámetro que debe ser tomado en cuenta. Se ha notado diferencias en cuanto a sexo en los valores de normalidad para ambas medidas y se estableció como límite máximo de normalidad un área telediastólica de 87ml/m2 y telesistólica en 44ml/m2 en hombres, y 74ml/m2 de área telediastólica y 33ml/m2 de área telesistólica en mujeres. (28)
En cuanto a la función sistólica del ventrículo derecho, el TAPSE (Figura 3) es una medición fácil de realizar mediante modo M, bien validada a través de los años y que valora la contracción en sentido longitudinal del ventrículo derecho (la que aporta mayor fuerza contráctil) con adecuada estimación de la función contráctil global del mismo. Se realiza colocando el cursor del modo M desde el ápice hasta el anillo tricuspídeo y midiendo el desplazamiento de diástole a sístole de dicho anillo. Un desplazamiento menor a 17mm se considera anormal (29).
El cambio de área fracionada, que se obtiene de la siguiente ecuación: ((área telediastólica del VD- área telesistólica VD)/( área telediastólica del VD))x100, es un parámetro que estima el componente radial y longitudinal de la contracción.
Su valor normal es ≥35%. Valores inferiores indican disfunción sistólica.
El doppler tisular es de utilidad en la función sistólica debido a que por medio de éste es posible determinar el valor de la onda S (velocidad sistólica pico) a nivel del anillo tricuspídeo el cual ha sido validado y con fácil reproducibilidad. Su valor normal es ≥9,5cm/s. Aparte de lo anterior, el Doppler tisular tiene otra aplicación en función sistólica a través del Índice de Desempeño Miocárdico, conocido antiguamente como “Índice de Tei”; dicho parámetro toma en cuenta el tiempo de contracción y relajación isovolumétrica así como el tiempo de eyección en la siguiente ecuación: (contracción isovolumétrica-relajación isovolumétrica)/tiempo de eyección.
El índice de Tei se puede estimar también por Doppler pulsado sin embargo es másengorroso pues requiere de dos ventanas para su estimación. Valores de >0,43 para doppler pulsado y >0,54 para doppler tisular se consideran anormalesy correlacionan con sobrevida menor a 4% a 5 años. (15)
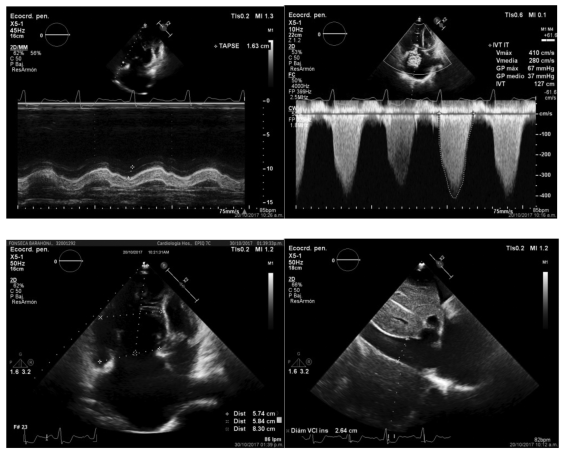
Figura 3 A) Excursión sistólica del anillo tricuspídeo (TAPSE) disminuida, B) Gradiente pico transtricuspídeo en 61mmHg, C) dilatación de diámetros basal,medio y longitudinal del ventrículo derecho y D) vena cava inferior >21mm no colapsable, indicativa de presiones atriales elevadas, hallazgos en unapaciente con hipertensión pulmonar severa debido a Enfermedad tromboembólica crónica. Cortesía de Dr. Farnández González.
La cuantificación volumétrica del ventrículo derecho mediante 3D es una técnica que ha venido desarrollándose cada vez más en los últimos años, con las mejoras en la adquisición y el procesamiento de imágenes que ha hecho las cuantificaciones más confiables y ha sido extensamente validada contra resonancia magnética y es de especial utilidad en casos posteriores a cirugía cardiaca en donde la S tricuspídea o el TAPSE están disminuidos. Sin embargo, es de destacar que el eco 3D subestima los volúmenes y la FE comparado con la resonancia según un metaanálisis de 23 estudios con 807 pacientes.(30)
En la actualidad la RMN es el método ecocardiográfico de elección para la medición de la fracción de eyección del ventrículo derecho cuyo valor normal debe ser ≥45%, siendo la técnica de rastreo semiautomático de bordes la que ha resultado en menos sesgos. (30)
El estudio de deformación miocárdica “Strain” por 2D en cámaras derechas, conocido también como strain por rastreo de puntos “speckle tracking”, es un área que está en desarrollo actualmente y su conocimiento se ha tomado prestado y adaptado de la experiencia obtenida en el Strain de ventrículo izquierdo.
En años recientes se ha demostrado la utilidad pronóstica del Strain longitudinal Global (SLG) en hipertensión pulmonar, falla cardiaca, infarto de miocardio y otras patologías (31,32); los valores límite de normalidad del SLG han variado en los diversos estudios (-19 a -22) y las guías de la ASE han definido con base en ellos un punto de corte de normalidad para el SLG en -20 (es decir un acortamiento de >20% de la longitud inicial); por arriba de este valor (o sea menos negativo) se considera patológico. (28, 33)
Tratamiento de la falla cardiaca derecha
En el manejo de pacientes con falla cardiaca derecha, el abordaje oportuno es esencial; se debe prestar atención a la búsqueda y tratamiento de etiologías reversibles/tratables (sepsis, infarto de coronaria derecha, TEP, arritmias, etc.) y al mismo tiempo instaurar medidas para disminuir la postcarga y aumentar o mantener la precarga, con el fin de conservar el gasto cardiaco pero sin sobrecargar de volumen al paciente.
También se debe procurar mantener en lo posible el ritmo sinusal, proporcionar oxígeno suplementario de ser necesario, evitar o reducir al mínimo noxas adicionales que aumenten todavía más la presión pulmonar (como ventilación mecánica) y proporcionar soporte inotrópico y vasopresor de ser necesario mientras se resuelve la causa desencadenante.(13).
Manejo de la precarga
En algunos pacientes con insuficiencia cardiaca derecha descompensada pueden presentar, al inicio del cuadro, situaciones que asocian baja volemia como en los casos de sepsis (fuga capilar) o sangrado; en estas situaciones, la falla cardiaca derecha es dependiente de precarga y mejora con la reposición cautelosa de volumen (250-500cc), hasta normalizar la precarga.
En otras ocasiones como en el infarto agudo del ventrículo derecho, se presenta falla cardiaca con presión pulmonar normal; en este escenario, mantener el gasto cardiaco, los pacientes requieren de una reposición de volumen un tanto mayor para mantener presiones de llenado del ventrículo derecho superiores a lo normal.
Sin embargo, fuera de los escenarios antes mencionados, la mayoría de los pacientes presentan presiones pulmonares elevadas por lo que una reposición descuidada de volumen no solo será ineficaz sino más bien deletérea, pues el aumento de las presiones de llenado en estos pacientes causará mayor dilatación del ventrículo, mayor insuficiencia tricuspídea, más consumo miocárdico (más isquemia) y también disminuirá el gasto cardiaco izquierdo por la conocida interdependencia ventricular.
Por tal razón se debe procurar mantener una presión venosa central entre 8-12mmHg y para ello se puede hacer uso de estimaciones por ecocardiografía o bien mediante la monitorización hemodinámica avanzada por medio de catéter (34). En casos en los que más bien haya presiones anormalmente elevadas se puede recurrir a diuréticos de asa con el fin de reducir precarga.
Control de la postcarga
La mayoría de pacientes con falla cardiaca derecha presentan incrementos en la postcarga que empeoran su cuadro, por desgracia con gran frecuencia están asociados a procesos cardiacos o pulmonares crónicos los cuales son difíciles de revertir.
A pesar de estos factores irreversibles de base, durante una descompensación es usual encontrar otros agravantes que exacerban la postcarga los cuales, a diferencia de los primeros, si son corregibles; tal es el caso de la hipoxia, la acidemia y la hipercapnia, los cuales si se mejoran mediante el uso de terapias como oxígeno suplementario y ventilación mecánica en caso de requerirla, pueden disminuir la vasoconstricción hipóxica y disminuir la postcarga, con el consecuente beneficio hemodinámico en cámaras derechas.
Hay que tener en mente los efectos deletéreos de la ventilación mecánica con presión positiva sobre las cámaras derechas sin embargo, son peores los daños causados por la hipoxia y la hipercapnia a nivel de las resistencias pulmonares y sus consecuencias en la postcarga por tal razón, si el paciente lo requiere, no se debe retrasar la ventilación mecánica.
Los pacientes que necesitan un ventilador deben alcanzar una saturación de O2 por encima de 90-92%, con estrategias de ventilación mecánica que permitan una adecuada corrección de la acidosis y la hipercapnia sin sobredistender el pulmón, lo cual se logra usualmente con volúmenes pulmonares menores y frecuencias respiratorias altas; en esto se diferencia de las estrategias usuales de protección pulmonar que usan hipercapnia permisiva. Se debe vigilar constantemente para evitar la aparición de AutoPEEP y se debe procurar una presión meseta de 27mmHg o menos.
En los pacientes que presentan disfunción ventricular derecha por hipertensión pulmonar, el uso de vasodilatadores pulmonares como óxido nítrico, inhibidores de fosfodiesterasa 5 (tadalafil, sildenafil), prostaglandinas (epoprostenol) y sus análogos (Iloprost, teprostinil), han resultado en mejoría de la oxigenación, función contráctil del ventrículo derecho y calidad de vida, sin influir en mortalidad.
Optimización de la contractilidad
En algunas ocasiones las resistencias vasculares pulmonares (RVP) superan a la presión de perfusión coronaria y ocurre isquemia miocárdica del ventrículo derecho que puede a su vez empeorar el gasto cardiaco. Por esta razón en ocasiones se hace necesario el uso de inotrópicos y vasopresores con el fin de reducir la relación entre resistencias pulmonares y resistencias sistémicas, para así mejorar la perfusión coronaria al ventrículo derecho y mantener el gasto cardiaco. El uso de norepinefrina está indicado como primera línea de acuerdo con la evidencia actual en caso de requerir soporte vasopresor ya que aumenta la relación aporte/demanda de oxígeno del ventrículo derecho, mejora el acoplamiento entre el ventrículo y la arteria pulmonar, y mejora el gasto cardiaco derecho en casos agudos como TEP. 35
Soporte mecánico
En casos en los que el tratamiento médico óptimo no sea suficiente, se ha usado con éxito la oxigenación de membrana extracorpórea, en su modalidad venoarterial, la cual permite un soporte temporal de circulación y ha sido utilizada con éxito en tromboembolismo pulmonar masivo, en insuficiencia cardiaca derecha después de cirugía cardiaca, en enfermedad tromboembólica crónica y en hipertensión arterial pulmonar, como terapia puente a endarterectomía o a trasplante cardiopulmonar. 36
Conclusiones
Los avances en los estudios sobre el ventrículo derecho logrados en los últimos 30 años han permitido conocer de mejor manera su fisiología, embriología y fisiopatología así como marcar diferencias con el ventrículo izquierdo lo cual, junto con la investigación y validación de herramientas diagnósticas enfocadas en dicha cámara han permitido mejorar el abordaje de pacientes con compromiso de ésta sin embargo, las opciones terapéuticas actuales están lejos de ser curativas en la mayoría de los casos y es por esta razón que se debe profundizar en las investigaciones al respecto en los próximos años.