Introducción
En respuesta al desarrollo de nuevos métodos diagnósticos y protocolos de tratamiento más efectivos, el número de sobrevivientes de cáncer ha presentado un incremento significativo en los últimos años. Los pacientes oncológicos que reciben quimioterapia presentan un mayor riesgo de desarrollar complicaciones cardiovasculares, e incluso la enfermedad cardiovascular es la segunda causa de morbilidad y mortalidad en sobrevivientes de cáncer1.
La Lista Oficial de Medicamentos (LOM) de la Caja Costa rricense del Seguro Social (CCSS) muestra los medicamentos disponibles en nuestro sistema de salud público. En el con texto de la terapéutica oncológica, las únicas antraciclinas disponibles son la Epirubicina y la Idarubicina, en sus presentaciones de Epirubicina Hidrocloruro (50 mg o 2 mg/ml) y de Idarubicina Hidrocloruro (5 mg), ambas como polvo iofilizado. Aparte de estos medicamentos, la Mitoxantrona, un derivado de antraciclinas, es utilizada en protocolos pediátricos y la Doxorubicina puede solicitarse para compra a pesar de ser un medicamento no LOM2.
Pese a su alta efectividad contra procesos neoplásicos, el uso de antraciclinas se ve limitado por su alta cardiotoxicidad, presente entre un 5% a un 23% de los casos, de los cuales se observa principalmente falla cardiaca y disfunción del ventrículo izquierdo (VI)3. De hecho, se consideran las drogas antineoplásicas más comúnmente asociadas a cardiotoxicidad, seguidas por el Trastuzumab1,4.
Lamentablemente, no existe a nivel de la Caja Costarri cense del Seguro Social estadística sobre la prevalencia de cardiotoxicidad; aunque se cuenta con la posibilidad de re portar a los diferentes comités de farmacología, existe un su breporte importante de los casos.
Objetivo
El objetivo de esta revisión es dar a conocer los mecanismos de cardiotoxicidad de las antraciclinas disponibles para el tratamiento de pacientes oncológicos de la CCSS según la LOM.
Discusión
Las antraciclinas corresponden a una clase de antibióticos derivados del Streptomyces bacterium cuyo efecto quimio terapéutico las ha convertido en uno de los antineoplásicos más utilizados desde hace más de 50 años como parte del tratamiento de múltiples malignidades, incluyendo cáncer de mama, neoplasias hematológicas y sarcomas3,4.
Estos medicamentos producen su efecto antineoplásico por cuatro mecanismos distintos. Generan disrupción en la síntesis de ARN y ADN al intercalarse entre pares de bases, inhiben la toposiomerasa 2 (), alteran la morfología de las histo nas atenuando la reparación del ADN y crean radicales libres mediados por hierro los cuales dañan el ADN3.
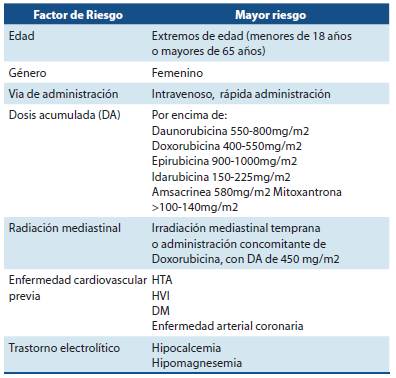
Este riesgo de toxicidad a corto o largo plazo responde a la exposición acumulada de la antraciclina, por lo tanto, una dosis acumulada de 400 mg/m2 corresponde a un riesgo de cardiotoxicidad del 5% mientras que con dosis acumuladas de 700mg/m2 este riesgo incrementa hasta un 25%3.
En pacientes con factores de riesgo asociados, como los extremos de edad (menores de 18 años o mayores de 65 años), patología cardiaca previa (hipertensión arterial (HTA), hipertrofia de ventrículo izquierdo (HVI), enfermedad arterial coronaria), diabetes mellitus (DM), hipocalcemia, hipomagnesemia o exposición previa a radiación, se recomienda una dosis acumulada no mayor a 450 mg/m2 con el fin de reducir el riesgo de disfunción del ventrículo izquierdo (ver tabla 1)1,3,4,5.
Inclusive con dosis acumuladas bajas, como en pacientes que reciben quimioterapia a dosis estándar para el tratamiento de cáncer de mama, aproximadamente un 20% de los casos desarrollan reducción en la función sistólica del ventrículo izquierdo (definida como una caída de >10 puntos por centuales de la fracción de eyección del VI (FEVI) basal o una FEVI menor a 50%) en los primeros 6 meses de tratamiento. Inclusive, más de 1/3 de los pacientes tratados con antraciclinas no recuperan su FEVI basal luego de que esta se haya deteriorado. Por lo tanto, se puede concluir que cualquier exposición a antraciclinas acarrea cierto riesgo de desarrollar insuficiencia cardiaca1,3.
Los mecanismos de cardiotoxicidad inducida por antraciclinas han sido estudiados por décadas. Se ha demostrado que estos medicamentos generan daño directo al miocito cardiaco y las células endoteliales por la producción excesiva de radicales libres inducida por el grupo quinona que las con forma, con la subsecuente activación de procesos de apoptosis y la eventual pérdida de miocardiocitos. El aumento en el estrés oxidativo provoca la peroxidación de los lípidos de la membrana, llevando a vacuolización, daño irreversible y re emplazo de los miocitos por tejido fibroso5,6.
Estudios recientes mencionan un segundo mecanismo de cardiotoxicidad debido a la inhibición de la Top 2. Existen dos isoenzimas Top 2 expresadas en los seres humanos: la Top2α que es altamente expresada en células de rápida proliferación, y la Top2βque se expresa en células quiescentes, ta les como los cardiomiocitos. Ratones con ausencia de Top2β presentan una notable protección contra el daño en el ADN y la muerte de los cardiomiocitos3,5,7.
Como tercer mecanismo, se ha demostrado que alte raciones en las proteínas de eflujo multidroga resistentes (MDR) llevan a mayores niveles intracardiacos de antraciclinas. Finalmente, existe un cuarto mecanismo de cardiotoxicidad donde la exposición a este quimioterapéutico genera una disminución de las células progenitoras mesenquimales, reduciendo la capacidad de reparación del corazón ante el estrés. Este último mecanismo es probablemente el que explica la insuficiencia cardiaca de aparición tardía que se observa en población pediátrica expuesta a antraciclinas. Otros mecanismos propuestos que contribuyen a su cardiotoxicidad incluyen la acumulación de hierro mitocondrial y la desregulación de la autofagia de los cardiomiocitos7,8.
Definición:
Al no contar con una definición clara o estandarizada de un cuadro de cardiotoxicidad inducido por antraciclinas, este debe sospecharse en todo paciente expuesto a algún régimen quimioterapéutico que contenga dichos medicamentos y en quien se documenten datos clínicos de insuficiencia cardiaca de aparición reciente o una disminución de la FEVI. Sin embargo, puede existir daño cardiaco sin que ocurra una disminución franca de la FEVI, por lo que existen marcadores más sensibles de daño miocárdico, como los niveles séricos de biomarcadores (troponina), el “strain” miocárdico (una medida de deformación) por ecocardiograma o presencia de fibrosis miocárdica en una RM cardiaca4,9.
Manifestaciones clínicas:
La toxicidad cardiaca inducida por antraciclinas clásicamente se ha clasificado según la aparición de los procesos patológicos en aguda/temprana (efectos generalmente reversibles que ocurren durante el tratamiento, subaguda (efectos detectados durante el primer año de exposición) y crónica (efectos que surgen años después de la exposición). Esta clasificación se basa en observaciones de estudios retrospectivos, ya que la aparición y la frecuencia de esta toxicidad varía según los criterios que se establezcan y el centro donde se reporte a nivel mundial1,5.
La cardiotoxicidad aguda inducida por antraciclinas es rara, temporal y dosis dependiente. Dentro de las manifestaciones tempranas se encuentran anormalidades electro cardiográficas tales como trastornos de la repolarización ventricular, arritmias supraventriculares o ventriculares y bloqueos atrioventriculares. También puede presentarse con el síndrome de pericarditis-miocarditis (principalmente con el uso de mitoxantrona). Algunos pacientes incluso presentan deterioro de la función ventricular de manera temprana, el cual puede no estar acompañado de signos o síntomas de falla cardiaca. Otros estudios sugieren que manifestaciones tempranas de daño al miocardio como la elevación de los niveles de troponinas o una disminución leve de la función ventricular pueden predecir el desarrollo a futuro de disfunción ventricular. Estas manifestaciones agudas generalmente se observan desde el inicio de la terapia hasta 14 días posteriores a su finalización1,10,11.
Las manifestaciones subagudas (disminución de la FEVI, fibrilación atrial, edema agudo de pulmón o isquemia miocárdica) se presentan en 11 a 21% de los pacientes, principalmente aquellos que reciben el esquema CHOP o R-CHOP (Rituximab, Riclofosfamida, Clorhidrato de Doxorubicina o Hidroxidaunorubicina, Sulfato de Vincristina y Prednisona) para el tratamiento del linfoma difuso de células B1,12.
Por último, las manifestaciones tardías de la cardiotoxicidad por antraciclinas incluyen los signos o síntomas clásicos de la insuficiencia cardiaca (disnea, ortopnea, fatiga, edema periférico) y una depresión de la FEVI con o sin clínica de insuficiencia cardiaca. Los síntomas tienden a aparecer durante el segundo a tercer año posterior a la exposición. Estudios menos recientes determinaron que el pronóstico de la miocardiopatía sintomática inducida por antraciclinas es pobre, con una mortalidad a un año de más del 60%. No obstante, la prevalencia de patología asintomática es mucho mayor, con rangos que varían entre 7% utilizando la FEVI hasta el 45% si se detecta utilizando el “strain” miocárdico por ECO1,4,12,13.
La prevalencia de esta cardiotoxicidad de aparición tardía varía ampliamente dependiendo del grupo etario, la dosis administrada de antraciclina, historia de cáncer hematológico, presencia de factores de riesgo cardiovascular y la duración del seguimiento que se le dé al paciente o los criterios que se utilicen para definir esta condición1,13,14.
Prevención:
Es fundamental que a todo individuo en quien se vaya a iniciar algún protocolo de quimioterapia que incluya antraciclinas se realice una adecuada historia clínica enfocada en factores de riesgo cardiovasculares y para cardiotoxicidad (como los extremos de edad o antecedente de radiación), junto con un correcto examen físico cardiaco, electrocardio grama (ECG) basal y un ecocardiograma para establecer la FEVI basal9,15.
Posteriormente, se le debe de dar seguimiento a su condición cardiovascular antes de cada nuevo ciclo. Incluso al gunos expertos sugieren que el seguimiento de la función cardiaca depende de la dosis acumulada de la antraciclina, por lo que, en el caso de la doxorrubicina, si se tuviese una do sis ≤240 mg/m2 la función cardiaca debe evaluarse al iniciar y al completar la terapia. Mientras que, si la dosis acumulada excede este valor, un ecocardiograma debe realizarse al al canzar los 240mg/m2 y con cada 50 mg/m2 adicionales. Luego de completar el tratamiento, se debe dar un seguimiento anual que incluya una revisión por aparatos y sistemas y un examen físico completo. En ausencia de síntomas o hallazgos al examen físico de miocardiopatía, no hay evidencia que respalde el uso rutinario de estudios de imagen o de laboratorio para estos pacientes9,15.
El dexarazoxane, un derivado del EDTA, quela el hierro y provee protección contra cardiotoxicidad inducida por antraciclinas al reducir los niveles intramitocondriales de hierro y los niveles séricos de radicales superóxidos. Inclusive, información reciente hace referencia a un mecanismo alternativo, donde dexrazoxane se une y degrada la Top2β, sin embargo, no es utilizado de rutina por temor a generar disminución en el efecto antitumoral del quimioterapéutico3,7. Este medicamento actualmente no está disponible en Costa Rica.
Conclusión
El desarrollo de disfunción cardiaca durante o luego de finalizar el tratamiento con antraciclinas en los pacientes oncológicos es una preocupación creciente que debe abordar se de manera prioritaria y bajo un contexto multidisciplinario para potenciar las probabilidades de prevenir estas complicaciones y lograr reducir la tan alta tasa de mortalidad por eventos cardiovasculares en esta población. Se deben desarrollar técnicas de monitoreo cardiaco en todos los pacientes con múltiples factores de riesgo para definir cuáles serán las mejores estrategias de tratamiento, incluyendo el manejo de la falla cardiaca asociada. Esta revisión busca exponer la importancia de esta problemática e impulsar a profesionales de la salud involucrados en el tratamiento de pacientes oncológicos para desarrollar más Unidades Cardio-oncológicas y lograr eventualmente estandarizar el abordaje multidisciplinario que se requiere.
Conflictos de interés. No existen conflictos de interés o relación alguna entre los autores de este artículo y ningún ente público o privado.