Introducción
La fibrilación auricular es la arritmia más frecuente y su tratamiento es difícil en la mayoría de los casos.1-3 La terapia farmacológica ha demostrado ser poco efectiva, se acompaña de efectos adversos y tiene potencial pro-arrítmico.
Durante las últimas tres décadas, la ablación mediante catéter de la fibrilación auricular ha evolucionado y representa, en la actualidad, una opción terapéutica efectiva. Esto la ha llevado a convertirse en el procedimiento de ablación con catéter más frecuentemente realizado a nivel mundial.
Generalidades del tratamiento
La terapia de la fibrilación auricular está dirigida a tres objetivos principales: reducción de riesgo cardioembólico, prevención de cardiomiopatía inducida por taquicardia y el alivio de los síntomas. Para el primer objetivo, se utiliza la anticoagulación en pacientes con riesgo trombótico evaluado mediante la escala CHA2DS2-VASc. Para controlar los otros dos, se utilizan estrategias orientadas al manejo de la frecuencia y el ritmo cardíaco.
La estrategia de control de la frecuencia cardíaca consiste en el uso de drogas que disminuyan la velocidad de conducción a través del nodo auriculoventricular (betabloqueantes, antagonistas del calcio o digoxina). También se puede recurrir a la ablación del nodo auriculoventricular e implantación de marcapasos permanente en aquellos pacientes que no lo gran adecuado control con la terapia farmacológica.
La estrategia de control del ritmo se puede llevar a cabo mediante tratamiento médico antiarrítmico, ablación con catéter o quirúrgica. Los pacientes en quienes se escoja esta estrategia, se recomienda el uso concomitante de drogas bradicardizantes, para disminuir el riesgo de fibrilación auricular de alta respuesta, en caso de recidiva
Los estudios AFFIRM y RACE demostraron que ambas estrategias de tratamiento eran similares en cuanto a la prevención de ictus y mortalidad.4-5 Otros estudios han de mostrado mejoría en control de síntomas y calidad de vida con la estrategia de control del ritmo.6 Un subanálisis del estudio AFFIRM, mostró que el uso de fármacos antiarrítmicos se asociaba a un aumento no significativo de la mortalidad no cardiovascular, pero los pacientes que lograron mantener el ritmo sinusal, mostraron disminución de la mortalidad en forma significativa.7Esto sugiere que mantener el ritmo sinusal podría ser beneficioso si se logra mediante estrategias más efectivas y seguras que los fármacos antiarrítmicos actuales. Otro factor a tomar en cuenta en ambos estudios, es que su diseño permitió suspender la anticoagulación en los pacientes que lograron mantener ritmo sinusal mediante la estrategia de control del ritmo, independiente del riesgo cardioembólico, una conducta que en la actualidad no se recomienda y que pudo incidir en un aumento de la mortalidad en este grupo.
Cómo se mencionó antes, cuando se escoge la estrategia de control del ritmo, existe la opción de llevarla a cabo mediante fármacos antiarrítmicos o ablación con catéter. El obje tivo del tratamiento es reducir la frecuencia y duración de los episodios así como los síntomas asociados.8-9 Los fármacos antiarrítmicos pueden presentar efectos adversos potencialmente graves, particularmente la inducción de arritmias, por lo que deben ser utilizados con precaución. La tasa libre de arritmia al final de un año mediante el uso de fármacos antiarrítmicos oscila entre 30 a 60%.
Recientemente se presentaron los primeros resultados del estudio CABANA, el estudio randomizado más grande de ablación en fibrilación atrial, con objetivos primarios de mortalidad y riesgo de ictus, en pacientes sometidos a ablación con catéter vrs manejo con antiarritmicos.13 Se incluyeron pacientes mayores de 65 años o menores de 65 años con al menos un factor de riesgo de ictus, con fibrilación atrial documentada y que pudieran ser elegibles para ablación con catéter o tratamiento médico. Se incluyeron tanto pacientes con fibrilación atrial paroxística cómo persistente y persistente de larga duración. El objetivo primario (mortalidad total, ictus incapacitante, sangrado mayor o parada cardíaca) mostró una disminución no significativa de 14% a favor del grupo de ablación (8.0% vrs 9.2%, HR 0.86, p=0.30). Sin embargo durante el estudio, un 25.7% de los pacientes en la rama de tratamiento farmacológico, recibió una ablación en algún momento del seguimiento, a pesar de su randomización inicial. El análisis de los datos tomando en cuenta ese factor, identificó una disminución significativa de 40% (4.4% vs 7.5%, HR 0.60, p=0.005) en mortalidad y de 33% (7.0% vs 10.9%, HR 0.67, p =0.006) en el objetivo primario. El riesgo de muerte cardiovascular y hospitalización mostró una reducción significativa de 17% en el grupo de ablación (51.7% vrs 58.1%, HR 0.83, p=0.001). También se observó reducción significativa de 47% en recurrencia de fibrilación atrial y, en el subanálisis de subgrupos, se identificó un mayor beneficio de la ablación con catéter en pacientes jóvenes (< 65 años) y pacientes con insuficiencia cardíaca.
Los resultados del estudio CABANA en el subgrupo de pacientes con insuficiencia cardíaca, viene a reforzar lo publicado recientemente en el estudio CASTLE-AF.14 Dicho estudio incluyó pacientes con fibrilación atrial paroxística o persistente, con antecedente de mala respuesta a antiarrítmicos, efectos adversos inaceptables o deseo de realizarse ablación con catéter. Todos los pacientes tenían implantado un desfibrilador automático, la fracción de eyección era menor o igual a 35% y se encontraban en clase funcional NYHA II, III o IV. Mostró reducción significativa en el objetivo primario (mortalidad y hospitalización por insuficiencia cardiaca) de 38% (28.5% vrs 44.6%, HR 0.62, p=0.007) en pacientes sometidos a ablación de fibrilación atrial vrs tratamiento farmacológico. Además demostró disminución de mortalidad por cualquier causa (13.4% vrs 25.0%, HR 0.53, p=0.01), mortalidad cardiovascular (11.2% vrs 22.3%, HR 0.49, p=0.009) y hospitalización por insuficiencia cardíaca (20.7% vrs 35.9%, HR 0.56, p=0.004).
Consideraciones técnicas
Existe consenso, en que para la aparición de fibrilación atrial son necesarios la presencia de un factor desencadenante que inicie la arritmia y un sustrato que permita su mantenimiento. La ablación con catéter, pretende eliminar el desencadenante (trigger/gatillo) y/o modificar el sustrato arritmogénico. Para esto, la técnica más comúnmente utilizada consiste en la creación de lesiones circunferenciales alrededor de las venas pulmonares (tanto derechas como izquierdas), de manera que éstas queden aisladas eléctricamente del atrio izquierdo.10-12 De esta forma, se bloquea la propagación de estímulos provenientes de las venas pulmonares que inician la fibrilación auricular mientras que las lesiones transmurales producidas en el atrio modifican el sustrato arritmogénico, responsable de la reentrada. Para lograrlo, las fuentes de energía más utilizadas son la radiofrecuencia o la crioterapia.
Varios estudios han comparado la eficacia y seguridad de ambas fuentes de energía. No se han encontrado diferencias significativas entre ellas.15-18 El estudio FIRE and ICE,19 incluyó pacientes con fibrilación atrial paroxística sintomática, refractaria a tratamiento médico y los randomizó a ablación con criobalón o ablación con radiofrecuencia. No hubo diferencia significativa en el objetivo primario del estudio (recurrencia de fibrilación atrial, uso de antiarrítmicos o necesidad de nuevo procedimiento). El objetivo primario de seguridad del procedimiento (muerte, evento cerebrovascular, eventos adversos mayores) tampoco mostró diferencia significativa.
La eficacia del procedimiento depende de varios factores y varía según la definición de recurrencia utilizada por los diferentes estudios. En general, se suele aceptar que existe un “período de cegamiento” durante los primeros tres meses post ablación, durante los cuales aparecen recurrencias tempranas que van desde un 17 % en ablación con criobalón,20 hasta un 40% en ablación con radiofrecuencia.21 Las recurrencias tempranas, no se suelen considerar como fallo en la eficacia del procedimiento, ya que pueden deberse a diversos mecanismos tales como a pericarditis estéril, recuperación de conducción de las venas pulmonares, efectos pro-arrítmicos de la ablación per se.22 Las recidivas tardías son aquellas que suceden después de 3 meses y son consideradas como falla terapéutica del procedimiento. La tasa de recurrencia durante el primer año tras la realización de un procedimiento de ablación oscilan entre un 15 a 30% en pacientes con fibrila ción paroxística.23
La efectividad de La efectividad de un procedimiento es significativamente menor cuando se trata de una fibrilación atrial persistente y oscila entre un 50 a un 60% al año.24 Existen varios predictores de recidiva tras el procedimiento de la ablación, entre los que se pueden mencionar: enfermedad cardiovascular subyacente (hipertensión, valvulopatía), mayor edad, dilatación atrial izquierda, apnea obstructiva del sueño no tratada y niveles de péptido natriurético tipo B elevados.25-30 Cabe destacar la importancia de evaluar el volumen del atrio izquierdo, ya que se ha demostrado que volúmenes mayores a 130 ml (medido mediante TAC) predicen recurrencias de hasta un 90% en el primer año post ablación.31
Indicaciones de ablación con catéter
Si tomamos en cuenta, que el principal beneficio de la ablación de fibrilación atrial es la mejoría en calidad de vida, esto debido a la mejoría de los síntomas principales tales como las palpitaciones, la fatiga y la intolerancia al ejercicio, entonces el primer criterio de selección para decidir realizar la ablación, debe ser la presencia de síntomas moderados. Para tomar la decisión de realizar el procedimiento, se deben tomar en cuenta el tipo de fibrilación atrial (paroxística, persistente o persistente de larga evolución), el antecedente o no de tratamiento antiarrítmico farmacológico, las preferencias del paciente y las presencia de predictores de recidiva tras el procedimiento.
El consenso de expertos de HRS/EHRA/ECAS/APHRS/SO LAECE sobre ablación de fibrilación atrial,32 resume las indicaciones de la siguiente manera:
1. Indicaciones Clase I: (Se recomienda su uso)
-Pacientes con fibrilación atrial paroxística sintomática refractaria o intolerante a al menos un antiarrítmico de clase I o III.
2. Indicaciones Clase II a: (Es razonable su uso)
-Pacientes con fibrilación atrial persistente sintomática refractaria o intolerante a al menos un antiarrítmico de clase I o III.
-Pacientes con fibrilación atrial paroxística o persistente síntomatica, sin uso previo de antiarrítmicos (ablación cómo terapia de primera línea).
-Pacientes con síndrome de Taquicardia-Bradicardia, es razonable tratar la taquiarritmia con ablación de la fibrilación atrial, como alternativa al implante de un marcapasos.
-Terapia de primera línea en atletas de alto rendimiento con fibrilación atrial, en quienes los antiarrítmicos pueden tener efectos indeseables sobre su rendimiento atlético.
3. Indicaciones Clase IIb:(Se pude considerar su uso)
-Pacientes con fibrilación atrial persistente de larga evolución sintomática, refractaria o intolerante a al menos un antiarrítmico de clase I o III.
-Pacientes con fibrilación atrial paroxística o persistente asintomática.
En dicho consenso, se considera razonable (Clase IIa) utilizar las mismas indicaciones para ablación, en poblaciones especiales cómo: pacientes con insuficiencia cardiaca, mayores de 75 años, menores de 45 años y pacientes con miocardiopatía hipertrófica.
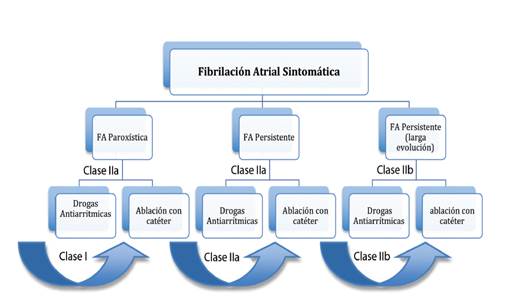
Figura 1 Indicaciones de ablación con catéter en pacientes con fibrilación atrial sintomática. Se muestra la clase de indicación según se trate de ablación tras falla terapéutica con antiarrítmicos o terapia de primera línea. Algoritmo basado en consenso de expertos para ablación con catéter HRS/EHRA/ECAS/APHRS/ SOLAECE.
Complicaciones
La ablación de fibrilación atrial es uno de los procedimientos más complejos en electrofisiología y el riesgo asociado al mismo, es mayor que el asociado a la ablación de otras arritmias menos complejas. El porcentaje global de complicaciones es de 4-6% y la mortalidad asociada al procedimiento es de 0.1%.33
Las complicaciones más frecuentes son las vasculares en el sitio de acceso y se presentan en 2-6% de los procedimientos,34-35 incluyen hematoma en el sitio de acceso, pseudoa neurisma, fístula arteriovenosa y sangrado retroperitoneal.
El taponamiento cardiaco es la complicación seria más frecuente y la principal causa de mortalidad, ocurre en 1% de los casos.34,36-37 Se puede asociar a perforación durante las aplicaciones de energía o debido a la punción transeptal. Suele ser más frecuente en la ablación con radiofrecuencia que con crioablación.
La fístula atrioesofágica es una complicación poco frecuente (0.03-0,2%) sin embargo es la más temida debido a su alta mortalidad (15.6%) por lo que es la segunda causa de mortalidad asociada al procedimiento.35,37
El tromboembolismo sistémico, es una complicación seria, con una incidencia reportada de 0.5-2.8%. Los eventos cerebrovasculares aparecen en 0,25% y la isquemia cerebral transitoria en 0.66%, suelen aparecer en las primeras 24 horas post procedimiento, pero el período de riesgo se extiende hasta 2 semanas posteriores al mismo. Los pacientes con antecedente de ictus previo, tienen hasta 9 veces más riesgo de desarrollar un nuevo episodio y la incidencia peri-operatorio de ictus aumenta proporcionalmente a mayor puntaje de CHADS-Vasc.38
La estenosis de venas pulmonares, es una complicación que se asocia principalmente a aplicaciones dentro de las venas pulmonares y la aparición de síntomas depende de la severidad de la estenosis y el número de venas afectadas. Los síntomas suelen aparecer meses después del procedimiento y puede aparecer disnea, tos, hemoptisis e infecciones pulmonares recurrentes. En la actualidad, para el aislamiento de las venas pulmonares se recomienda hacer lesiones mucho más antrales, por lo que la frecuencia del estenosis de venas pulmonares ha disminuido significativamente y actualmente aparecen en 1.0-1.4% de los procedimientos.39,40
Otras complicaciones menos frecuentes son la lesión del nervio frénico, gastroparesia asociada a lesión periesofágica del nervio vago, oclusión aguda de una arteria coronaria y persistencia de defecto septal atrial posterior a punción transeptal (sin repercusión clínica).
Conclusiones
La terapia de la fibrilación auricular debe ir dirigida a tres objetivos principales: reducción de riesgo cardioembólico, prevención de cardiomiopatía inducida por taquicardia y el alivio de los síntomas.
El objetivo principal del control del ritmo en la fibrilación atrial, es reducir la frecuencia y duración de los episodios, así como los síntomas asociados.
La ablación de fibrilación atrial es en la actualidad un procedimiento seguro y efectivo para el tratamiento de la fibrilación atrial.
El beneficio principal de la ablación, es la mejoría en la calidad de vida, debido a la disminución de los síntomas, pero también podría disminuir mortalidad y número de hospitalizaciones, especialmente en pacientes con insuficiencia cardiaca.
Realizar la ablación tempranamente en la evolución de la enfermedad, idealmente cuando no hay evidencia de remodelado auricular y la fibrilación atrial es paroxística, es importante para mejorar el porcentaje de éxito del procedimiento.














