Introducción
Los antagonistas de la vitamina K (AVKs) han sido la piedra angular de la prevención antitrombótica en la fibrilación auricular (FA) durante más de sesenta años (1*). A pesar de su indiscutible impacto en la prevención de accidentes cerebrovasculares, los AVKs cuentan con importantes limitaciones; entre ellas cabe destacar las frecuentes interacciones con otros medicamentos o alimentos, unas características farmacodinámicas poco predecibles con gran variabilidad interindividual y un estrecho margen terapéutico que conlleva un riesgo no despreciable de hemorragias, requiriendo en todos los casos una monitorización periódica para el ajuste de dosis. En los últimos cinco años, la terapia anticoagulante está siendo testigo de una revolución después de la finalización de los grandes ensayos clínicos en fase III sobre los comúnmente denominados nuevos anticoagulantes orales (NACOs). Las ventajas de estos nuevos agentes, que incluyen el uso de una dosificación fija sin necesidad de controles, es casas interacciones, un efecto anticoagulante predecible, un rápido comienzo de acción y una ventana terapéutica amplia contrarrestan con sus inconvenientes actuales. La falta de un antídoto eficaz, su coste, o reservas en los pacientes con enfermedad renal avanzada pueden explicar su lento ritmo de expansión.
Tras el inevitable entusiasmo inicial, la comunidad médica debe asegurar el uso apropiado de estos nuevos agentes, el cual depende en gran medida del conocimiento de sus indicaciones y particularidades en escenarios clínicos concretos.
Esta revisión discute los nuevos anticoagulantes: dabigatrán, edoxabán, rivaroxaban y apixaban y proporciona al goritmos prácticos y fáciles de usar para la aplicación en la práctica clínica especialmente centrado en la profilaxis anti trombótica de la fibrilacion auricular no valvular (FANV).
Nuevos anticoagulantes orales
Actualmente se encuentran disponibles dos clases de NACOs, los inhibidores directos de la trombina (dabigatrán) y los inhibidores directos del factor Xa (rivaroxabán, apixabán, edoxabán). A diferencia de los AVKs, que bloquean la forma ción de múltiples factores de la coagulación dependientes de vitamina K activa (factores II, VII, IX y X), estos fármacos bloquean sus dianas terapéuticas (la trombina o el factor Xa) directamente, resultando en un inicio de acción rápido, como el de las heparinas subcutáneas.
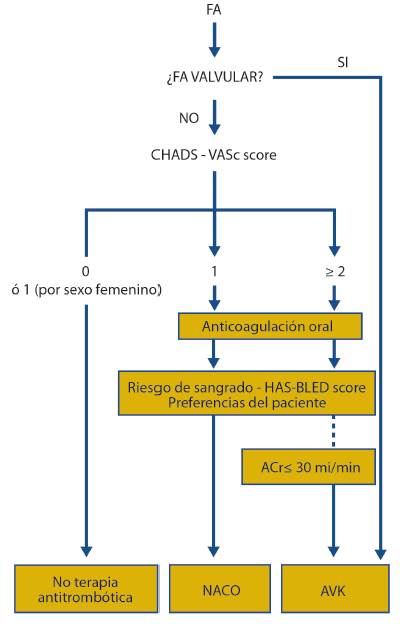
La correcta prescripción de la terapia antitrombótica en pacientes con FANV dependerá de una valoración cuidadosa a las características clínicas de los pacientes (figura 1).
Datos recientes procedentes de siete países europeos muestran una mejoría en la adherencia de la comunidad médica a la evidencia y a las recomendaciones sobre anticoagulación oral (2). Curiosamente, los NACOs eran principalmente prescritos a pacientes más jóvenes, y a tan sólo el 6% de las poblaciones de estudio, reflejando tanto una tendencia a prescribir estas nuevas terapias con gran prudencia inicial como las limitaciones inherentes de su coste.
Las figuras 2-4 muestran algoritmos prácticos que recogen las particulares indicaciones/contraindicaciones, principales interacciones y dosificación terapéutica de cada agente. En el momento de publicación de esta revisión dabigatrán, rivaroxabán, y apixabán están aprobados para la prevención antitrombótica en la FANV por la Agencia Europea del Medicamento (EMA) y la FDA (3-5). Los tres NACOs suponen una opción razonable a los AVKs previo a la cardioversión electiva (6-8). Edoxabán ha sido aprobado recientemente por la FDA, pero aún no por la EMA. Recientemente, rivaroxabán, dabigatrán y apixabán se han aprobado para el tratamiento del tromboembolismo venoso (TEV) o de pulmón, después de mostrar la no inferioridad en términos de eficacia en ensayos clínicos en fase III en comparación con el régimen estándar de heparina/AVKs (9-16). Existen diferencias en la dosificación de cada agente según estén indicados para la profilaxis de FANV o para el tratamiento del tromboembolismo venoso (ver figuras 2, 3 y 4).
Dabigatrán
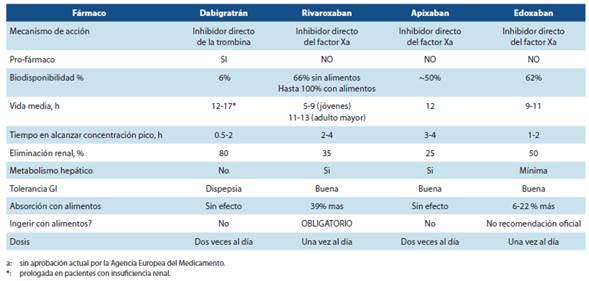
El dabigatrán etexilato fue el primer NACO estudiado y aprobado por la FDA, en base a los resultados del ensayo clí nico RE-LY (Randomized Evaluation of Long-term anticoagu lant therapY with dabigatran etexilatetrial (3)). El dabigatrán es un inhibidor directo de la trombina altamente específico y competitivo, que se administra por vía oral como un fármaco inactivo y después de la conversión mediada por esterasas a su forma activa, alcanza niveles plasmáticos pico a las 2-3 horas (17). Tiene un inicio de acción rápido (0.5-2 horas), una vida media corta (12-17 horas) y el 80% se elimina por vía renal sin metabolizar.
En comparación con los AVK, el dabigatrán tiene pocas interacciones con los alimentos o con otros fármacos. Sin embargo la administración concomitante con los inhibidores de la glucoproteína-P o inductores de la glicoproteína-P está contraindicado (figura 2) (18). Aunque, la administración con comitante de dabigatrán y pantoprazol puede reducir el efecto anticoagulante, por el momento no se considera necesaria el ajuste de la dosis (17,19).
La dosis habitual aprobada tanto por la FDA y la EMA para dabigatrán es de 150 mg dos veces al día. Una dosis inferior de 110 mg dos veces al día, ha sido aprobado única mente por la EMA para pacientes mayores de 80 años o con alto riesgo de sangrado (figura 2). La FDA, pero no la EMA, aprobó la dosis de 75 mg cada 12 horas para los pacientes con aclaramiento de creatinina (ACr) de 15-30 ml/min basado en los resultados publicados en modelos farmacocinéticos, pero esa dosis no se ha estudiado en el estudio principal de dabigatrán.
RE-LY, RELY-ABLE
El estudio RE-LY fue un ensayo en fase III prospectivo, aleatorizado, que comparaba dos dosis de dabigatrán etexilato (110 mg o 150 mg dos veces al día) con warfarina en 18.113 pacientes con FANV y al menos 1 factor de riesgo (media de puntuación CHADS: 2,1) (3). Los pacientes con función renal severamente alterada (ACr <30 ml/min), enfermedad hepática activa, accidente cerebrovascular en los 14 días previos, o con un alto riesgo de hemorragia fueron excluidos.
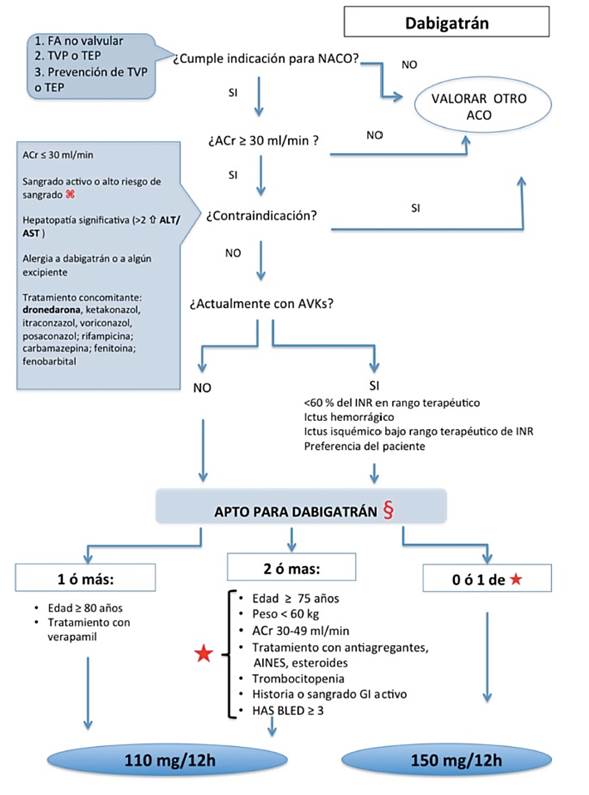
Figura 2. Algoritmo para el inicio del tratamiento con Dabigatrán. ⌘: úlcera gastrointestinal activa o reciente, neoplasias de alto riesgo hemorrágico, lesión cerebral o medular reciente, cirugía cerebral, espinal u oftálmica reciente, sangrado intracraneal reciente, varices esofágicas, malformaciones A-V, aneurismas o anomalías vasculares intracerebrales o intraespinales. §: Dosis para TEP/TVP: 150 mg dos veces al día; para prevención TVP tras cirugía de reemplazo de rodilla o de cadera (14 or 30 días, respectivamente): 110 mg (dosis inicial durante 1-4 días tras la cirugía) despues 220 mg diarios. TVP: trombosis venosa profunda; TEP: tromboembolismo pulmonar, ACO: anticoagulante oral. ACr: aclaramiento de creatinina (preferiblemente por método Cockroft) . AVKs: antagonistas de la vitamina K. INR, international normalized ratio.
Para el objetivo principal de eficacia de prevención de ictus y embolia sistémica, dabigatrán 150 mg fue superior a la warfarina (p<0.001), sin diferencias significativas en las hemorragias mayores. El sangrado gastrointestinal (GI) fue más frecuente con dabigatrán 150 mg. Dabigatrán 110 mg no fue inferior a la warfarina para el objetivo principal, con una re ducción del 20% en las hemorragias mayores (p=0.003). En el grupo de warfarina, los niveles de INR se encontraban dentro del rango terapéutico en el 64% del período de estudio más allá de la primera semana. Un análisis post hoc de 1.989 cardioversiones eléctricas en 1.270 pacientes no mostró diferencias significativas en la tasa de accidentes cerebrovasculares dentro de los 30 días después del procedimiento entre warfarina y dabigatrán etexilato 110 o 150 mg. El 25% de los pacientes fueron sometidos a un estudio transesofágico antes de la cardioversión. No hubo diferencias significativas en la incidencia de trombos en la aurícula izquierda (1,1% para la warfarina, 1,2% para dabigatrán 150 mg y 1,8% para dabigatrán 110 mg) (6).
La posterior extensión del ensayo multicéntrico a largo plazo de tratamiento con dabigatrán en pacientes con FA (RELY-ABLE) proporcionó información adicional sobre los efectos a largo plazo de las 2 dosis de dabigatrán en pacientes que completaron el RE-LY extendiendo el seguimiento de una media de 2 años a finales de RE-LY por un período adicional de 2,3 años (20). Ninguno de los pacientes en el brazo de warfarina participaron de este estudio. Los resulta dos de RELY-ABLE confirmó los datos publicados en RE-LY. Por otra parte, no hubo diferencias significativas en la tasa de accidentes cerebrovasculares o mortalidad entre dabigatrán etexilato 110 y 150 mg, pero si una mayor tasa de hemorragias mayores con la dosis más alta de dabigatrán.
Recientemente, ha sido publicada el perfil de seguridad de dabigatrán (150 mg y 75 mg) en la práctica clínica real de Estados Unidos en una cohorte de ancianos Medicare con FANV (21). En comparación con warfarina, dabigatrán se asoció con menor tasa de accidente cerebrovascular isquémico, hemorragia intracraneal, y menor mortalidad, pero un ma yor riesgo de hemorragia GI mayor. Estos resultados fueron más potentes en el subgrupo tratado con dabigatrán 150 mg. Alrededor de 16% de los pacientes recibieron 75 mg de dabigatrán y entre ellos, ninguno de los resultados del estudio fueron significativamente diferentes de la warfarina a excepción de un menor riesgo de hemorragia intracraneal con dabigatrán. Desafortunadamente, tan solo un 7% del subgrupo de dabigatrán 75 mg presentaba insuficiencia renal severa y por tanto los resultados en este contexto deben interpretarse con cuidado.
RIVAROXABÁN
Rivaroxabán es un inhibidor directo, competitivo y dosis-dependiente del factor Xa y es el segundo NACO aprobado por la FDA y EMA basado en los resultados del estudio ROC KET-AF (4). Se absorbe rápidamente, alcanzando niveles plasmáticos pico a las 2-4 horas de su administración oral. Tiene una vida media de 9-13 horas con un aclaramiento renal del 35% (22-27) (Tabla 1). Aproximadamente dos tercios de la dosis es metabolizado por el hígado a través de enzimas del citocromo P450 (CYP3A4 y CYP2J2). Por este motivo, el tratamiento concomitante con isoenzimas del citocromo P450 o con inhibidores de glicoproteína-P, como itraconazol y voriconazol está contraindicado debido a un aumento del riesgo de hemorragia (figura 3). Dado que un tercio del fármaco se elimina por vía renal, rivaroxaban está contraindicado en pa cientes con insuficiencia renal severa.
Se administra en dosis única de 20 mg junto a los alimentos para aumentar la biodisponibilidad. Se recomienda una dosis inferior, de 15 mg diarios, en pacientes con insuficiencia renal leve, alto riesgo de sangrado y/o potenciales interaccio nes farmacológicas (figura 3)
ROCKET AF
El estudio ROCKET AF fue un ensayo clínico doble ciego en el que 14 264 pacientes con FANV y puntuaciones de CHADS2 ≥2 (media 3.5) fueron aleatorizados a recibir rivaro xabán 20 mg una vez al día o warfarina; los pacientes con ACr de 30 a 49 ml/min recibieron 15 mg de rivaroxabán. Los pa cientes con aclaramientos de creatinina inferior a 30 ml/min, enfermedad hepática significativa, accidente cerebrovascular dentro de 14 días previos (o ictusgrave en los 3 meses previos), infección por VIH, tratamiento concomitante con anti-inflamatorios no esteroideos, inhibidores del citocromo P450 3A4 o inductores del citocromo P450 3A4 o con alto riesgo de sangrado fueron excluidos.
Tras una mediana de seguimiento de 1,93 años, rivaroxabán fue no inferior a la warfarina para la prevención del ictus o embolia sistémica; sin embargo, el rivaroxabán no pudo demostrar superioridad sobre la warfarina en el análisis por intención de tratar (p = 0,12). No hubo diferencias en el riesgo de hemorragia mayor, aunque la hemorragia intracraneal y fatal ocurrió con menos frecuencia en el grupo de rivaroxaban. La tasa de hemorragia GI y la necesidad de transfusión fue mayor con rivaroxaban. La mortalidad total no fue signifi cativamente diferente entre los grupos.
APIXABÁN
Apixaban es un inhibidor selectivo, reversible, directo y competitivo, del factor Xa y el último NACO aprobado por la EMA para la prevención de ictus y la embolia en FANV. Pre senta buena absorción, alcanzando concentraciones plasmáticas pico a las 3-4 horas (28-30). La dosis recomendada es de 5 mg dos veces al día para los pacientes con función renal normal y 2,5 mg (dos veces al día, igualmente) para los pacientes con dos de las siguientes características: edad ≥ 80 años, peso ≤ 60 kg, creatinina sérica ≥ 1,5 mg/dl (figura 4). Se metaboliza predominantemente por el hígado y de manera similar al rivaroxabán, apixabán está contraindicado con el uso concomitante con fármacos capaces de inducir o inhibir el CYP3A4 (5).
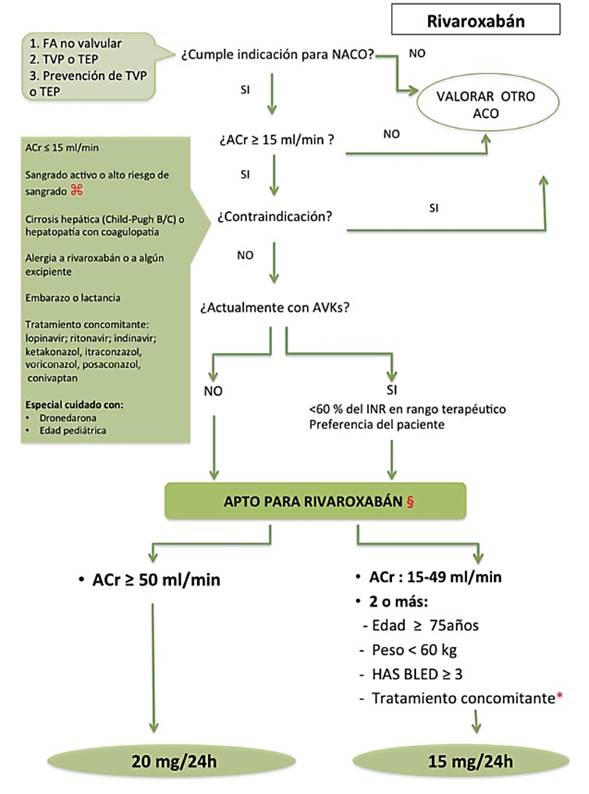
Figura 3: Algoritmo para el inicio del tratamiento con Rivaroxabán. ⌘: úlcera gastrointestinal activa o reciente, neoplasias de alto riesgo hemorrágico, lesión cerebral o medular reciente, cirugía cerebral, espinal u oftálmica reciente, sangrado intracraneal reciente, varices esofágicas, malformaciones A-V, aneurismas o anomalías vasculares intracerebrales o intraespinales. *Tratamiento concomitante: quinidina, fluconazol, ciclosporina, tacrolimus, claritromicina, erithromicina, rifampicina, carbamazepina, fenitoina, fenobarbital. §: Dosis para TEP/TVP: 20 mg diarios, (15 mg dos veces al día los primeros 21 días); para prevención TVP tras cirugía de reemplazo de rodilla o de cadera (14 or 30 d, respectivamente: 10 mg diarios. TVP: trombosis venosa profunda; TEP: tromboembolismo pulmonar, ACO: anticoagulante oral. ACr: aclaramiento de creatinina (preferiblemente por método Cockroft). AVKs: antagonistas de la vitamina K. INR, international normalized ratio.
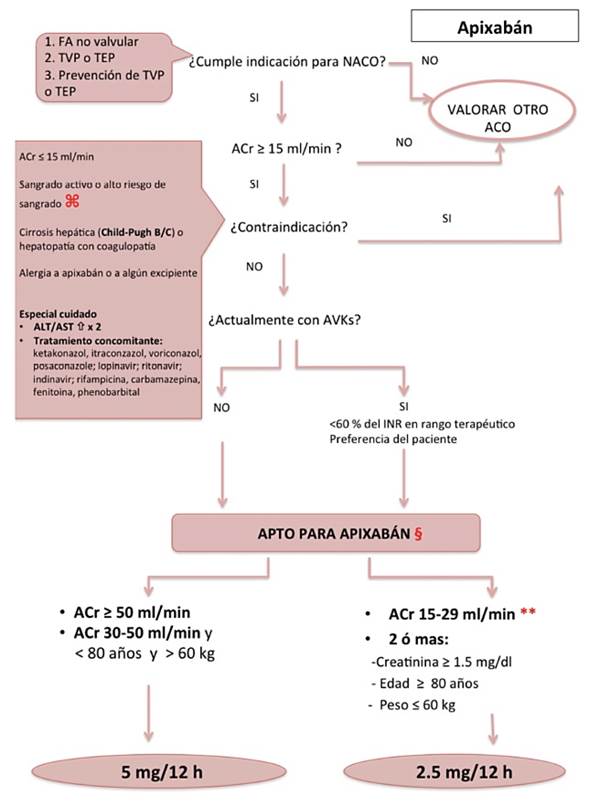
Figura 4: Algoritmo para el inicio del tratamiento con Apixabán. ⌘: úlcera gastrointestinal activa o reciente, neoplasias de alto riesgo hemorrágico, lesión cerebral o medular reciente, cirugía cerebral, espinal u oftálmica reciente, sangrado intracraneal reciente, varices esofágicas, malformaciones A-V, aneurismas o anomalías vasculares intracerebrales o intraespinales. §: Dosis para TEP/TVP: 5 mg cada 12 horas, (10 mg cada 12 horas los primeros 7 días); para prevención TVP tras cirugía de reemplazo de rodilla o de cadera (14 or 30 días, respectivamente) : 2.5 mg cada 12 horas. ** Pacientes con creatinina de >2.5 mg /dl o ACr <25 ml /min fueron excluidos del ARISTOTLE. TVP: trombosis venosa profunda; TEP: tromboembolismo pulmonar, ACO: anticoagulante oral. ACr: aclaramiento de creatinina (preferiblemente por método Cockroft). AVKs: antagonistas de la vitamina K. INR, international normalized ratio.
ARISTOTLE Y AVERROES
El estudio ARISTOTLE fue un ensayo en fase III aleatoriza do doble ciego que comparó apixabán (5 mg dos veces al día) con warfarina en 18.201 pacientes con FANV (puntuación me dia CHADS2: 2,1) (5). Una dosis inferior de apixabán de 2,5 mg dos veces fue utilizado entre los pacientes con ≥ 2 de las si guientes condiciones: ≥ 80 años de edad, peso ≤60 kg, o creatinina sérica ≥1,5 mg/dl. Después de un seguimiento medio de 1,8 años, el apixabán fue significativamente superior a la warfarina, con menor tasa de eventos primarios (ictus totales-tanto hemorrágicos como isquémicos- y de embolias sisté micas), y con una menor mortalidad total (p=0.01 y p>0.05 respectivamente). Los pacientes tratados con apixabán tuvieron significativamente menor tasa de hemorragias mayores (p<0.001) y hemorragias intracraneales, aunque las hemorragias GI fueron similares entre ambos grupos.
Por otro lado, el apixabán también se comparó con la aspirina en monoterapia en el estudio AVERROES, un ensayo doble ciego de 5.599 pacientes que no eran candidatos para el tratamiento con AVKs (puntuación media CHADS2: 2) (31). Después de un seguimiento medio de 1,1 años, el estudio fue interrumpido prematuramente debido a un claro beneficio a favor de apixabán. El resultado primario de ictus o embolia sistémica fue significativamente menor en el grupo de apixabán frente a la aspirina, mientras que el riesgo de sangrado (hemorragia grave y hemorragia intracraneal) entre los 2 gru pos fue similar.
Los pacientes con insuficiencia renal grave (creatinina sérica> 2,5 mg / dl o aclaramiento de creatinina <25 ml/ min) fueron excluidos de los ensayos ARISTOTLE y AVERROES (5,31). Los criterios adicionales de exclusión fueron ictus en los últimos 7 días, y el tratamiento concomitante con ácido acetilsalicílico a dosis de >165 mg al día, o de tratamiento concomitante de aspirina y clopidogrel.
EDOXABÁN
Edoxaban es otro inhibidor reversible del factor Xa, recientemente aprobado por la FDA, y en fase de revisión por la EMA. Se absorbe rápidamente y alcanza la concentración plasmática pico a las 1-2 horas. Hasta el 50% de edoxabán es eliminado por los vía renal. Dado que es un sustrato de la glicoproteína-P, la administración concomitante con quinidina, o verapamilo puede dar lugar a un aumento significativo de los niveles plasmáticos de edoxabán (32-35). La dosis recomendada es 60 mg, una vez al día; en pacientes con insuficiencia renal moderada-grave (aclaramiento de creati nina <50 ml / min), la dosis edoxabán debe reducirse en un 50% (figura 5).
ENGAGE AF-TIMI
ENGAGE AF-TIMI 48 fue ensayo clínico de fase III ciego, aleatorizado que comparó los dos regímenes de dosis de edoxabán (30 mg y 60 mg una vez al día) con warfarina (36) en un total de 21.105 pacientes con FANV. Para los pacientes en ambos grupos de edoxabán, la dosis se redujo a la mitad en cualquiera de las siguientes situaciones: CrCL de 30 a 50 ml/min, un peso corporal de 60 kg o menos, o el uso conco mitante de verapamilo o quinidina.
Después de un seguimiento de 2,8 años, ambos regímenes de edoxabán no fueron inferiores a la warfarina con respecto a la prevención del ictus o embolia sistémica; sin embargo, la dosis más baja tendió hacia la inferioridad, con un cociente de riesgo de 1,13 en comparación con la warfarina y fue inferior en la prevención del accidente cerebro vascular isquémico. Ambas dosis de edoxabán se asociaron con tasas más bajas de hemorragia, incluyendo hemorragia grave, hemorragia intracraneal y hemorragia potencialmente mortal. Una excepción fue la hemorragia GI, que ocurrió más frecuentemente con dosis altas de edoxabán, pero con menos frecuencia con dosis bajas de edoxabán en comparación con warfarina. Por último, la incidencia de accidente cerebrovascular hemorrágico y la tasa de muerte por causas cardiovasculares fueron significativamente menores con ambas dosis de edoxabán.
Se excluyeron los pacientes con insuficiencia renal grave (aclaramiento de creatinina inferior a 30 ml/min), alto riesgo de sangrado, tratamiento concomitante con doble antiagregación, síndrome coronario agudo o revascularización coronaria y accidentes cerebrovasculares en los 30 días previos.
Comparación entre nacos
Por el momento, no se han diseñado estudios que comparen directamente la eficacia y seguridad de los diferentes NACOs, y hasta ahora la extrapolación de los datos de los ensayos principales es la mejor estrategia disponible para su prescripción médica. Sin embargo, las diferencias en el dise ño de los estudios, en la tasa de riesgo de ictus en cada población de estudio así como en la definición de los criterios de variables de eficacia y seguridad hacen que las comparaciones directas sean complejas. La elección de uno u otro NACO para un paciente concreto está influenciada por las caracte rísticas individuales de cada paciente, incluyendo el riesgo de accidente cerebrovascular o enfermedad tromboembólica venosa, el riesgo de sangrado, y la comorbilidad, especialmente la presencia de insuficiencia renal.
La figura 6 muestra la eficacia comparativa entre altas dosis de NACOs y warfarina (37). El análisis comparativo de los cuatro NACOs confirmó que estos nuevos agentes reduje ron significativamente la combinación de ictus o eventos embólicos sistémicos en un 19% en comparación con warfarina, en gran parte debido a una significativa reducción en la tasa de accidentes cerebrovasculares hemorrágicos. Los datos de los cuatro NACOs a altas dosis demostraron una reducción no significativa del 14% de las hemorragias mayores (37).
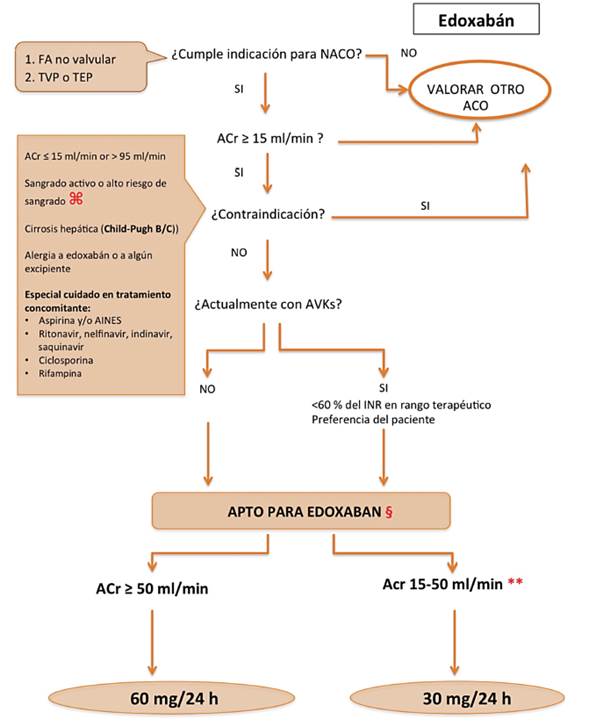
Figura 5: Algoritmo para el inicio del tratamiento con Edoxabán. ⌘: historia de sangrado intracraneal, intraocular, espinal, retroperitoneal o intraarticular; hemorragia GI o úlcera active en el año previo; trauma reciente grave, cirugía mayor, o una biopsia de órganos profundos en los 10 días previos; endocarditis infecciosa activa; hipertensión no controlada (>170/100 mm Hg); o trastorno hemorrágico /coagulopatía congenital o adquirida. **Pacientes con ACr <30 ml/min fueron excluidos del ENGAGE AF-TIMI 48. §: Edoxaban esta indicado en TEP/TVP tras 5 -10 días de tratamiento anticoagulante parenteral. La dosis para TVP y TEP: 60 mg o 30 mg una vez al día si el ACr 15 to 50 mL/min, peso es menor a 60 kg, o en pacientes con inhibidores del GP-P. TVP: trombosis venosa profunda; TEP: tromboembolismo pulmonar, ACO: anticoagulante oral. ACr: aclaramiento de creatinina (preferiblemente por método Cockroft). AVK: antagonistas de la vitamina K. INR, international normalized ratio.
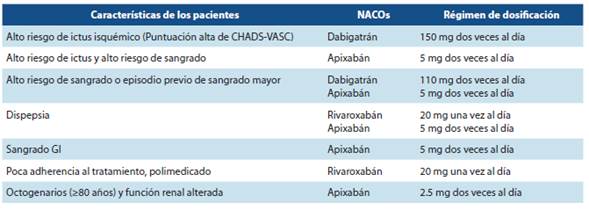
Aunque no hay suficiente evidencia para recomendar un NACO sobre otro, la tabla 2 resume recomendaciones gene rales basadas en las características del paciente, su adherencia al tratamiento y tolerancia. Así por ejemplo, dabigatrán puede producir dispepsia, pero ha sido el único agente (con dosis de 150 mg) que ha demostrado una reducción en la tasa de accidente cerebrovascular isquémico. El apixabán es el único NACO que ha mostrado significación estadística en la reducción de ictus (isquémicos o hemorrágicos) y eventos embólicos así como una menor tasa de sangrado mayor. Todos los NACOs excepto apixabán se asociaron con más sangrado GI que la warfarina. Tanto rivaroxabán como apixabán son menos dependientes de la eliminación renal que dabigatrán. Rivaroxabán y edoxabán tienen el beneficio de una única administración al día, que puede ser atractivo para aquellos pacientes que son menos cumplidores del tratamiento. Por lo tanto, el médico puede inclinarse a prescri bir un NACO particular ante pacientes con alguna de estas características. Sin embargo, es importante destacar que en la actualidad todos los NACOs están clínicamente indicados en FANV independientemente del riesgo estimado de ictus o hemorragias.
Por último, los AVKs siguen siendo el tratamiento anticoagulante de primera línea para pacientes con prótesis valvulares mecánicas o valvulopatías reumáticas y para aquellos con insuficiencia renal severa, en los que los NACOs están contraindicados. Aunque la dosis baja de rivaroxabán y apixa bán han sido aprobadas por la EMA y la FDA (dabigatrán 75 mg únicamente por la FDA) para ACr entre 15-30 ml, no hay suficientes datos centrados en esta población vulnerable y por el momento, las últimas guías europeas no recomiendan su uso en este escenario (38). En pacientes con insuficiencia renal terminal, tanto las guías europeas como americanas coinciden en que los AVKs son los anticoagulantes de elección (39,40). De acuerdo a las preferencias del paciente, los AVKs siguen siendo una opción razonable para aquellos con valores de INR bien controlados.
¿Cómo medir el efecto anticoagulante?
Una ventaja clínica de los nuevos anticoagulantes orales es su administración a dosis fijas sin necesidad de controles rutinarios, dado que su efecto anticoagulante es altamente predecible. Sin embargo, la falta de un método fiable o un marcador claro de la actividad anticoagulante hace difícil asegurar el cumplimiento. Además, la estimación del nivel de an ticoagulación podría ser útil en escenarios concretos, como en casos de sangrado agudo, accidente cerebrovascular o cuando los pacientes necesitan una cirugía urgente.
La tabla 3 recoge de manera resumida los resultados esperados de diferentes test de coagulación durante el tratamiento con NACOs. En la interpretación de estos resultados, es fundamental tener en cuenta cuando se administró la última dosis dado que su máximo efecto coincidirá con la concentración plasmática máxima. Además, la vida media dependerá de las características del paciente, especialmente de su función renal, sobre todo para aquellos NACOs con una elevada tasa de aclaramiento renal.
Aunque existen pruebas que permiten cuantificar los niveles plasmáticos tanto de los inhibidores directos de la trombina y de los inhibidores del factor Xa, por el momento son técnicas costosas y no disponibles en la mayoría de los hospitales. Alternativamente, otras pruebas habituales de la boratorio pueden evaluar cualitativamente, al menos en parte, la actividad anticoagulante de estos agentes. En el caso del dabigatrán el tiempo de trombina (TT), el TT diluido (TTd), el tiempo tromboplastina parcial activado (TTPa) y el tiempo de ecarina (TE) puede ser útil; un nivel TTPa (12 a 24 h después de la ingestión) de ≥2 veces el límite superior de la normalidad o la TE ≥3 veces los valores normales están asociados con un mayor riesgo de sangrado (41, 42). Un TTPa normal sugiere razonablemente que la presencia de dabigatrán en plasma es mínima. Existe disponible un TTd con calibradores apropiados para dabigatrán (Hemoclot®) y un TTd con Hemo clot®> 200 ng / ml tras 12 horas de la última dosis también se asocia con mayor riesgo de sangrado. Cada inhibidor del factor Xa (rivaroxabán, apixabán, edoxabán) afecta el tiempo de protrombina (TP) y TTPa en distinta medida, y ninguna de estas pruebas está diseñada ni es ideal para valorar el grado de anticoagulación. El TTPa tiene una prolongación débil bajo este tipo de NACOs, y presenta una respuesta paradójica a bajas concentraciones. Por otro lado, el TP se prolonga de forma lineal con los niveles plasmáticos de estos agentes; sin embargo, el grado de prolongación del TP de una misma muestra puede variar dependiendo del reactivo utilizado. Podría ser útil para rivaroxabán, para el cual un TP normal prácticamente excluye la presencia de rivaroxabán en plasma en niveles de anticoagulación. En particular, Neoplastin Plus tiene una estrecha correlación con las concentraciones plasmáticas de rivaroxabán. En este momento hay pocos datos disponibles para edoxabán y apixabán. Por último, la actividad anti-Xa se puede evaluar específicamente a través de los ‘ensayos cromogénicos’ ya comercializados, con buena precisión entre laboratorios. Por desgracia, añadido a su alto coste, los datos prácticos para asociar un nivel o parámetro de anticoagulación con el riesgo de sangrado aún no están disponibles. (Figura 6)
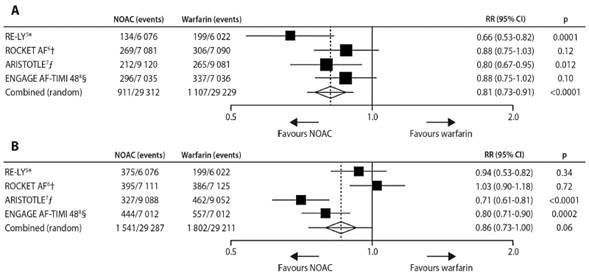
Figura 6: A. Ictus y eventos embólicos . B. Sangrados mayores. Los datos son n/N, salvo que se indique diferente. Heterogeneidad: I2=47%; p=0·13. NACO: nuevos anticoagulantes orales, RR=riesgo relativo. *Dabigatran 150 mg dos veces al día. †Rivaroxaban 20 mg una vez al día. ƒApixaban 5 mg dos veces al día. §Edoxaban 60 mg una vez al día. Reproducido de Ruff C et al. Lancet 2014 Mar 15;383(9921):955-62 con autorización.
Manejo y protocolos de actuación en determinados escenarios
A. Manejo en caso de sangrado
Por el momento, las estrategias para revertir el efecto anticoagulante de los NACOs son limitadas. Aunque este hecho se considera un gran inconveniente para su uso, un reciente meta-análisis sobre el manejo y las consecuencias tras los eventos de sangrado mayor en 5 ensayos de fase III (dabigatrán vs. AVKs) mostró un mejor resultado en aquellos pacientes que recibieron dabigatrán, reflejado como menor estancia en la unidad de cuidados intensivos y una tendencia a la menor mortalidad total a los 30 días (43). El tiempo es la mejor ventaja de NACOs, dada su relativa corta vida media.
Si se produce una complicación de sangrado mayor, deben iniciarse las medidas estándar de soporte. Estas incluyen compresión mecánica, hemostasia quirúrgica, reposición de líquidos y soporte hemodinámico.
La hemodiálisis puede acelerar la eliminación del agente en los pacientes que recibieron dabigatrán, debido a su relativa baja unión a proteínas plasmáticas; sin embargo, su beneficio en las hemorragias graves no ha sido establecida. Por el contrario, la diálisis no es eficaz para los inhibidores del factor Xa debido a su alta unión a proteínas plasmáticas y su menor tasa de aclaramiento renal. A pesar de la falta de evidencia, en casos graves se puede plantear la administración de concentrados de complejo protrombínico (comenzar con una dosis de 25 U / kg, repitiendo la administración según la situación clínica) o de complejo protrombínico activado (comenzar con 50U/kg -máx. 200 U/kg/día). Otros pro-coa gulantes como antifibrinolíticos o desmopresina también pueden ser útiles, pero de nuevo no hay evidencia clínica sobre su eficacia.
Tabla 4 Manejo con los nuevos anticoagulantes orales pre y postquirúrgico.
| Cirugía menor* | Cirugía mayor** | ||||
| NACO | Función renal | Manejo pre-operatorio | Manejo post-operatorio | Manejo pre-operatorio | Manejo post-operatorio |
| Dabigatrán | Normal o levemente afectada (ACr >50 mL/min) | Suspender 2 días antes de la cirugía (omitir 2 dosis) | Re-iniciar 24 h tras la cirugía | Suspender 3 días antes de la cirugía (omitir 4 dosis | Re-iniciar 48 h tras la cirugía |
| Moderadamente afectada (ACr 30-50 mL/min) | Suspender 3 días antes de la cirugía (omitir 4 dosis) | Suspender 4-5 días antes de la cirugía (omitir 6-8 dosis) | |||
| Rivaroxabán | Normal, leve/moderadamente afectada (ACr >30 mL/min) | Suspender 2 días antes de la cirugía (omitir 1 dosis) | Re-iniciar 24 h tras la cirugía | Suspender 3 días antes de la cirugía (omitir 2 dosis) | Re-iniciar 48 h tras la cirugía |
| Apixabán | Normal, leve/moderadamente afectada (ACr >30 mL/min) | Suspender 2 días antes de la cirugía (omitir 1 dosis) | Re-iniciar 24 h tras la cirugía | Suspender 3 días antes de la cirugía (omitir 4 dosis) | Re-iniciar 48 h tras la cirugía |
* Cirugía Menor: Endoscopia con biopsia; Biopsia de próstata o de la vejiga; Estudio electrofisiológico o ablación con radiofrecuencia de taquicardias simples; Angiografía; Implante de marcapasos o de DAI.
** Cirugía mayor: Ablación con radiofrecuencia de taquicardias izquierdas complejas (aislamiento de venas pulmonares, ablación de taquicardia ventricular); Anestesia espinal o epidural; Punción lumbar diagnóstica; Cirugía Torácica; Cirugía abdominal; Cirugía ortopédica mayor; Biopsia hepática; Resección transuretral de próstata; Biopsia renal.
Recientemente, Idarucizumab un fragmento de anticuerpo monoclonal de administración intravenosa dirigido contra dabigatrán, ha demostrado ser eficaz y seguro en un grupo de 90 pacientes con necesidad de revertir el efecto anticoagulante por sangrado importante (grupo A) o por la necesidad de cirugía urgente (grupo B) (44-46).El objetivo primario del estudio se definió como el porcentaje máximo de reversión del efecto anticoagulante de dabigatrán a las 4 horas de la administración del antídoto, basado en determi naciones del TTd o de TE. Como objetivo secundario se evaluó la restauración de la hemostasia. Idarucizumab revirtió rápida y completamente el efecto anticoagulante de dabigatrán en 88 -98% de los pacientes en pocos minutos. La hemostasia se recuperó a las 11,4 horas de mediana entre los 35 pacientes del grupo A que pudieron ser evaluados. Entre los 36 pacien tes del grupo B que fueron sometidos a un procedimiento, la hemostasia normal intraoperatoria fue reportada en 33, que dando únicamente 2 pacientes con leves alteraciones de la hemostasia y 1 con alteraciones moderadas.
Por último, también se encuentran en fase de desarrollo antídotos específicos para neutralizar el efecto anticoagulan te de los inhibidores directos del Factor Xa (Andexanet alfa, proteína recombinante modificada de la molécula del factor Xa, Aripazine o Anivamersen) y parecen ser prometedores en el manejo de sangrados mayores o cirugías urgentes en pacientes tratados con este tipo de fármacos (47).
B. Manejo antes de programar una intervención
El manejo más apropiado antes de ser sometido a una intervención debe ser individualizado para cada paciente en función del NACO que reciba, el tipo de cirugía, el régimen anestésico requerido y las características del paciente, en par ticular, según su función renal.
Para los pacientes sometidos a intervenciones menores, los NACOs pueden mantenerse durante el procedimiento, de manera similar a los pacientes tratados con AVKs. Algu nos ejemplos incluyen la cirugía de cataratas, la extracción de piezas dentarias o infiltraciones articulares, en las cuales es habitual conseguir una hemostasia local adecuada. La intervención no debe realizarse durante las concentraciones pico del fármaco sino 12 o 24 horas después de la última dosis, en función de se trate de una dosificación única o dos veces al día.
Sin embargo, en cirugías mayores en las que se puede producir un sangrado importante, el paciente debe suspen der el fármaco 1-2 días antes del procedimiento y reiniciar al día siguiente del mismo. La tabla 4 recoge una guía del manejo de los NACO antes y después del procedimiento depen diendo del tipo de cirugía, tipo de NACO y la función renal. El inicio del tratamiento debe ser retrasada por lo menos 24 horas tras el procedimiento, dado el rápido inicio de acción de estos agentes.
C. Cambio entre tratamiento anticoagulantes
La Tabla 5 resume cómo realizar el cambio entre diferen tes regímenes anticoagulantes. Es importante individualizar algunas precauciones, sobre todo en aquellos pacientes con insuficiencia renal.
Conclusión
Los nuevos anticoagulantes orales han demostrado un mejor perfil de eficacia y seguridad en comparación con los clásicos AVKs; las ventajas incluyen su menor interacción con medicamentos o alimentos, su rápido inicio de acción y la posibilidad de una dosis fija sin necesidad de controles periódicos. La individualización del tipo de tratamiento an ticoagulante debe basarse principalmente en la edad del paciente, su riesgo embólico/hemorrágico, su función renal y sus tratamientos concomitantes. La adherencia del pacien te resulta clave para asegurar cuestiones de eficacia y se guridad, independientemente del régimen anticoagulante prescrito, por lo que es crucial una educación específica para asegurar el correcto cumplimiento terapéutico. La velocidad a la que los AVKs serán reemplazados por los NACOs depen derá de la experiencia clínica, la tolerancia de los pacientes a estos nuevos fármacos, los datos de futuros estudios, y las políticas de mercado. Continúan diseñándose estudios para desarrollar medidas cada vez más fiables y accesibles para la monitorización de los efectos anticoagulantes, así como antídotos con la capacidad de revertir de manera efectiva el efecto anticoagulante.