I. Introducción
Se ha informado desde el final del último milenio que la falla cardíaca (FC) es un importante problema de salud pú blica, con una prevalencia de más de 5,8 millones de pacien tes en los Estados Unidos y más de 23 millones en todo el mundo.1 En 1997, la FC fue identificada como una epidemia emergente. Esta epidemia puede explicarse por un aumento de la incidencia (cada vez más casos nuevos), mayor supervi vencia secuelada de la patología cardiovascular, que lleva a una mayor prevalencia, un aumento de la expectativa de vida de la población en riesgo (adulto mayor) o la combinación de todos estos factores.1,2
Tras el diagnóstico de FC en países desarrollados, las es timaciones de supervivencia en el 2013 eran del 50 % a los 5 años y 10 % a los 10 años.3,4 Está claramente establecido que la disfunción ventricular izquierda se asocia con un aumento en el riesgo de muerte súbita o repentina.5
La FC representa un carga clínica y económica sustancial, en Centroamérica y República Dominicana; tanto a nivel ins titucional de los sistemas de Seguridad Social, Ministerios de Salud, como en el sector privado de la atención de la salud.
No hay un registro adecuado de la enfermedad FC en nuestros países y existen escasos datos de incidencias repor tadas. Si bien, conocemos sobre el impacto de la evolución natural sobre la mortalidad general, creemos que esta tasa puede estar aumentada en nuestra región por el uso des coordinado e inapropiado de los fármacos y la policonsulta a diferentes miembros de la comunidad médica. También, des conocemos el impacto económico que provoca en nuestros países. Sin embargo, producto de nuestra observación clíni ca, sabemos que la gran mayoría de los pacientes ingresan por descompensación y tienen estancias hospitalarias pro longadas en nuestro sistema de salud, las cuales impactan en los costos de hospitalización y de atención en general.
Algunos datos sugieren una incidencia anual creciente de FC en medio de un incremento en la mortalidad por enfer medades cardiovasculares y costos, que se incrementan por el número de hospitalizaciones y el consumo de fármacos con costo elevado y que está cada vez más relacionada con el uso de medicamentos antiinflamatorios no esteroides (AINE) o dosis bajas de ácido acetilsalicílico (AAS), lo cual aunado al mal cumplimento de las recomendaciones médicas o un mal apego a esquemas complejos de manejo, complica la situa ción general e individual.6
Metodología
Las Asociaciones Médicas de Cardiología de Centroamé rica y Caribe seleccionaron representantes de sus respectivas asociaciones para conformar el grupo de Consenso Centroa mericano y Caribe de Sociedades de Cardiología para el diag nóstico y manejo de la Falla Cardíaca (CONSENSO CA y CAR), la reunión tuvo lugar el 18 y 19 de septiembre 2015.
El grupo de expertos representa a las asociaciones mé dicas de Cardiología de Guatemala, El Salvador, Honduras, Nicaragua, Costa Rica, Panamá y República Dominicana, para ofrecer en forma consensuada una serie de guías clínicas y el compromiso de realizar un registro electrónico sobre FC hecho a la medida de las necesidades de la región. Los datos utilizados para generar este CONSENSO reflejan el estado del arte hasta septiembre de 2015.
No hay datos epidemiológicos regionales recientes que podamos homogenizar, por lo que este nuevo registro se iniciará y se le dará un cierre parcial en agosto, para poder presentar un dato preliminar en el Congreso Centroamerica no de Cardiología por realizarse a finales de agosto de 2016 en San José, Costa Rica. Queremos que nuestras sugerencias, avaladas por nuestras asociaciones, se conviertan en una guía validada para los médicos generales y especialistas en medicina interna. Adicionalmente, se distribuya a los residen tes que trabajan tanto en el sector privado como en el sector público. Las recomendaciones que hemos vertido en este documento se detallan utilizando nombres genéricos de los fármacos, no marcas registradas.
Alcance y propósitos
Es de interés del grupo crear una herramienta práctica para el manejo de la FC, la cual esperamos que tenga aplica ción tanto para el sector público como privado. La intención de esta guía es unificar criterios, coincidir en el registro único a nivel centroamericano y lograr una publicación en la litera tura médica, junto con un resumen de bolsillo, para distribuir ampliamente entre los profesionales de la salud.
Como todo CONSENSO tiene objetivos claros y alineados a la Organización Mundial de la Salud (OMS).6
La FC es un problema importante y creciente de salud pública.
Es común, costosa, incapacitante y mortal.
El diagnóstico temprano y el tratamiento eficaz reducen la morbilidad, la mortalidad y el costo social.
Las diferentes guías y recomendaciones que surjan deben ser un resumen conciso especialmente para los médicos de atención primaria (médicos generales).
Deben guiar sobre el diagnóstico y terapéutica moderna que permita un abordaje adecuado al evaluar un paciente con sospecha de FC.
Estos médicos asisten a un grupo de pacientes que gene ran un número considerable de consultas y hospitalizaciones de las diferentes áreas de la medicina como medicina general y ramas de la medicina interna, entre ellas se encuentran la de cardiología, cuidado intensivo, medicina interna, geriatría, medicina familiar, especialistas en emergencia; esto también impacta los servicios que ofrecen otros profesionales del área de salud, entre lo que podemos mencionar: microbiólogos, farmacéuticos, técnicos en rehabilitación y enfermeros.
II. Epidemiología
Si bien, nuestras estadísticas no están bien establecidas, es de conocimiento general que los factores de riesgo aso ciados a FC en América Latina (AL) sí se conocen de forma general. El gran reto que tenemos todos en AL ocurre porque, aparte de la prevalencia de los factores de riesgo compara bles a los países desarrollados en cierta áreas, la epidemiolo gía de FC también puede ser influenciada por ciertos factores de riesgo que son más frecuentes en AL.
A continuación se presentan datos reportados a la fecha en AL:
En el año 2007, los datos del Ministerio de Salud de Brasil mostraron que el 39,4 % de los ingresos hospitalarios se re lacionaron con FC. Esta proporción fue del 70 % en el grupo de edad de mayores de 60 años, fenómeno que no ocurre en otros continentes, con tan alta prevalencia.
La FC descompensada es la principal causa de hospitali zación cardiovascular en AL.7 La prevalencia de la FC sistólica varía del 64 % al 69 %. Coincidimos con los autores del infor me latinoamericano en que AL se encuentra bajo la terrible paradoja de tener los factores de riesgo de FC con una epi demiología típica de los países desarrollados, con los factores añadidos de Hipertensión Arterial Sistémica, Enfermedad de Chagas y Fiebre Reumática.8
En el caso de Colombia las enfermedades cardiovascu lares son la primera causa de muerte. Para el período 2000- 2010, la mortalidad de origen cardiovascular en hombres fue de 136 por 100 000 personas, mientras en mujeres fue de 125 por 100 000 personas, fenómeno en el que la FC fue uno de los contribuyentes principales.8
En el 2012, según datos del Ministerio de Salud y Protec ción Social de Colombia, la prevalencia de la enfermedad en la población general era de un 2,3 %; es decir casi 1 100 000 colombianos sufren la condición; de estos un 59,7 % son hombres y un 40,3 % mujeres. Entre los años 2009 y 2012 el número de pacientes con FC en las salas de urgencia aumen tó en un 50 %, al igual que lo hicieron los pacientes seguidos con el diagnóstico en los servicios ambulatorios, con un 10 % y los pacientes con FC descompensada hospitalizados, que pasaron de 7 154 a 10 288, aproximadamente un 30 %.
La mortalidad atribuible a la FC depende de la severidad, la etiología, el tratamiento, el momento de la detección y la población evaluada; en términos generales, la mortalidad a cinco años según el estadío de la enfermedad va desde 3 % en estadío A, 4 % en estadío B, 25 % en estadío C y hasta de un 80 % en estadío D. De igual forma, el pronóstico puede verse sustancialmente modificado mediante intervenciones médicas, uso de dispositivos y trasplante de corazón.8
El desconocimiento de padecer de FC es de importan cia, puesto que aunque igualmente las enfermedades cardio vasculares representan la primera causa de muerte en Costa Rica, al igual que en muchos países desarrollados del mundo y otros con economías en transición, participan en forma im portante en la reducción de la expectativa de vida saludable de 73,8 años a 62,6 años en Costa Rica.9-10
Para medir el nivel de comprensión de lo que implica la enfermedad desde la perspectiva de los pacientes y otros profesionales de áreas ajenas a la salud y valorar cuánto se entiende de las enfermedades originadas en los vasos arte riales y enfermedades cardíacas, se realizó una encuesta en el 2002 a 400 personas. Ellos estaba en una relación 1/100,00 habitantes y se agruparon de la siguiente manera: cuatro gru pos de 100 pacientes cada uno:
Grupo de Enfermos Cardiovasculares.
Grupo de población urbano-marginal.
Grupo de población profesional.
Grupo de Educación Universitaria.
En esta encuesta se encontró que la población no enten día bien el origen o la prevención de la enfermedad isqué mica y veían los factores de riesgo como algo individual y no interrelacionado.
Las conclusión general de esta evaluación es que el ni vel educativo de los encuestados influye en forma negativa, pues cuanto más educados, tienen ideas menos claras sobre el origen y manejo de estas enfermedades. Por lo tanto, fue muy revelador el conocimiento de la responsabilidad de la carga familiar, con 72 % de los encuestados, con anteceden tes familiares. Un 62 % consideran la enfermedad ateroescle rótica como hereditaria, pero solo 16 % cree en la influencia del papel colectivo de los antecedentes patológicos y un 74 % considera la enfermedad ateroesclerótica no prevenible desde edad temprana.
Esto crea una serie de incertidumbres, en el hecho de cómo se ha educado a la población por varias décadas, pro vocando un actitud pasiva, con una visión fatalista tardía de la enfermedad, totalmente carente de la dosis de responsa bilidad individual y colectiva en los estilos de vida saludable.
Además, se encontró que se reconocieron los factores de riesgo coronario: colesterol elevado 86 %, fumado (tabaco) 60 %, estrés 82 %, Hipertensión Arterial 45 %, antecedentes heredofamiliares 72 %, Índice de Masa Corporal 45 %, Diabe tes Mellitus 68 %, antecedentes personales patológicos 16 %. La conclusión de esa encuesta fue que se falló en la parte conceptual del impacto per se de algunos de los factores, así como en la detección y control adecuado de dichos factores. El grupo de esa investigación considera necesario tener ideas claras en la población para la lucha apropiada contra la epide mia de enfermedad ateroesclerótica.10
Ya se había publicado en el año 2004, que la presencia de lípidos anormales, el fumar, la hipertensión, la diabetes, la obesidad abdominal, factores psicosociales, dieta inadecua da y el alcohol, más la poca cantidad de actividad física en forma regular, aportan la mayor parte del riesgo de infarto de miocardio en todo el mundo, en ambos sexos, en todas las edades y en todas las regiones. Este hallazgo sugiere que los enfoques de prevención pueden ser basados en principios similares en todo el mundo y tiene el potencial de prevenir casos más prematuros de infarto de miocardio.11
Creemos que la alta prevalencia de FC en Centroaméri ca y el Caribe acontece por el fenómeno ya descrito en Ar gentina, el infarto agudo de miocardio es una enfermedad de incidencia elevada en nuestra área y en la que diferentes estimaciones indican que no se aplican adecuadamente las estrategias validadas que permiten mejorar su morbimortali dad. En una revisión realizada en Argentina durante 18 años se observó un incremento progresivo de la incidencia de IAM tipo no Q (16,7 % en 1987 versus 39,8 % en 2005; p de ten dencia < 0,001 OR: 3,24).12
Aunque, existe conciencia sobre el abordaje y las medi das de tratamiento por parte de todas las sociedades cientí ficas, esto no se traduce en su correcta aplicación, ni en áreas rurales o metropolitanas.
Generalmente, en las capitales de nuestras naciones, en la atención del infarto agudo de miocardio se han logrado grandes avances que permiten reducir su morbimortalidad, en particular, a través de las estrategias tempranas de reper fusión coronaria: la trombólisis farmacológica y la angioplas tia primaria. Es evidente que los pocos datos epidemiológicos regionales y las prácticas de alto alcance poblacional sugiere que el uso real de agentes trombolíticos y de la angioplastia, está limitado a un grupo pequeño de pacientes y nos permi ten diferir que un porcentaje elevado de los infartos no son asistidos con estas estrategias de reperfusión.
Sin embargo, la aplicación real de estas medidas de gran impacto poblacional se ha visto limitada por una multiplici dad de obstáculos que requieren estrategias adecuadas de corrección. Es nuestra opinión que como consecuencia de ese actuar, solo el 34,9% de infartos de miocardio con eleva ción del segmento ST recibe al menos trombólisis.13 En gene ral los problemas más comunes son:
Falta de aplicación de estrategias de reperfusión, aun en pacientes internados o con diagnóstico de infarto.
Falta de disponibilidad de recursos.
Establecer como estándar básico de asistencia del infarto que todo paciente con dolor precordial prolongado y elevación del segmento ST debe recibir estrategias de reperfusión, medida que debe considerarse el objetivo primario en esa condición y lograr más altos índices.13
Otra problemática regional se está dando en relación con los Síndromes Coronarios Agudos (SCA), esto como con secuencia del manejo tardío o desacertado del Infarto Agudo de Miocardio, las complicaciones mecánicas pueden ser ma yores en AL.7
Estos datos indican que podrían existir importantes dife rencias regionales en los desenlaces de los pacientes. Algunas de estas diferencias podrían ser efecto del azar, pero las tasas de mortalidad mayores en AL que en Norteamérica, son un hallazgo concordante entre varios estudios. Esto podría tener causa en características específicas diferenciales de la enfer medad en sí, las comorbilidades basales de la población, los tratamientos, el uso de procedimientos cardíacos invasivos o quizá variables no medidas (características socioeconómicas de la población, calidad de los sistemas de salud, etc.).14-16
Enfermedad de Chagas
La enfermedad de Chagas es la mayor causa de disca pacidad secundaria a enfermedades tropicales en adultos jóvenes de LA y es una causa común de FC en muchos países de LA. Esta enfermedad es causada por el Trypanosoma cruzi, endémico en América Central y del Sur, donde se estima que 18 millones de personas están infectadas y 100-120 millones están en riesgo de contraerla.
La cardiomiopatía crónica es la manifestación más im portante y grave de la enfermedad, que afecta a aproxima damente un 20-30 % de los sujetos en la fase crónica y causa FC, arritmias, bloqueos cardíacos, tromboembolia y muerte súbita. Se estima que cada año ocurren 21 000 muertes rela cionadas con Chagas solo en la región del cono sur de LA.17-19
La historia natural de la enfermedad de Chagas, de bida a la presencia del Trypanosoma cruzi en los corazones de los pacientes afectados se caracteriza por una fase agu da, seguida de un período indeterminado o de transición y una etapa terminal arrítmico-congestiva. Es una enfermedad de evolución lenta en la que, aproximadamente, el 20-30 % de los pacientes afectados puede llegar a tener síntomas y signos de falla cardíaca crónica (FCC). En estos pacientes, la alteración estructural cardíaca es inicialmente segmentaria y al igual que en otras cardiopatías, se instala de manera gra dual un proceso de remodelado cardíaco excéntrico, carac terizado por dilatación progresiva de las cavidades cardíacas con adelgazamiento de sus paredes y deterioro de la función ventricular sistólica.
Los síntomas de FC aparecen generalmente en indivi duos de ambos sexos en la cuarta y quinta década de la vida.
La supervivencia de los pacientes chagásicos es apenas del 25 % a los 60 meses de haber aparecido los síntomas de FC. Por el contrario, la supervivencia de pacientes no chagásicos, en el mismo lapso de seguimiento, es cercana al 50 %. Estas marcadas diferencias serían debidas a que la enfermedad de Chagas, como causa subyacente de FC, implica un mayor ries go de muerte. Sin embargo, estos mismos estudios destacan que el tratamiento de los pacientes chagásicos no es homo géneo. En efecto, por ser una enfermedad de origen infeccio so y por tener aparentemente alteraciones primarias de los mecanismos de control de la presión arterial y de los líquidos corporales, estos pacientes no recibían, hasta ahora, trata miento para contrarrestar la activación neurohormonal.20-25
Investigaciones más recientes, con énfasis en el trata miento moderno del síndrome de FC, demuestran:
El factor predictivo de muerte más importante en pacientes con FC de etiología chagásica, es la no administración de bloqueadores beta-adrenérgicos.
La mortalidad del paciente chagásico, que recibe estos fármacos es semejante a la del síndrome de FC de pacientes con otras enfermedades cardíacas.
Siendo la enfermedad de Chagas endémica principal mente en países de Latinoamérica, es imperativo un registro que pueda determinar qué porcentaje de pacientes con FC, corresponde a una etiología chagásica.
Enfermedad reumática
En nuestros países, es necesario considerar la enferme dad reumática valvular como causa de daño miocárdico, que pudiese en algún momento degenerar en Falla Cardíaca con Fracción de Eyección Reducida (FCFER).
Mortalidad
La mortalidad por FC no está bien determinada en los países Centroamericanos. Derivado de estudios internacio nales,1,2 para tener una perspectiva, en los Estados Unidos de América se diagnostican 650 000 nuevos casos cada año, con dición que empeora según la edad, siendo de 20 por 1 000 personas entre los 65 y 69 años de edad, hasta más de 80 por 1 000 personas después de los 80 años, con una prevalencia del 0,4 al 2% en la población total general. En Europa se esti ma una prevalencia aproximada del 1 al 2% en la población general y de más del 10% en aquella mayor de 70 años.
III. Revisión y clasificación de evidencia
El grupo acordó utilizar en este documento las clases de recomendación y los niveles de evidencia basados en las guías Europeas para el diagnóstico y tratamiento de FC, como se indica en las tablas 1 y 2.26-27
IV. Definiciones
Se escoge la definición clínica de la sesión conjunta de las entidades: Colegio Americano de Cardiología ACC (por sus siglas en inglés) y la Asociación Americana del Corazón AHA (por sus siglas en inglés).28 “FC es un síndrome clínico complejo que resulta de cualquier deterioro estructural o funcional de llenado ventricular o eyección de la sangre. Las manifestaciones cardinales de la FC son: disnea y fatiga, lo que puede limitar la tolerancia al ejercicio y retención de líquidos, lo que puede conducir a congestión pulmonar y/o esplácnica y/o edema periférico”.
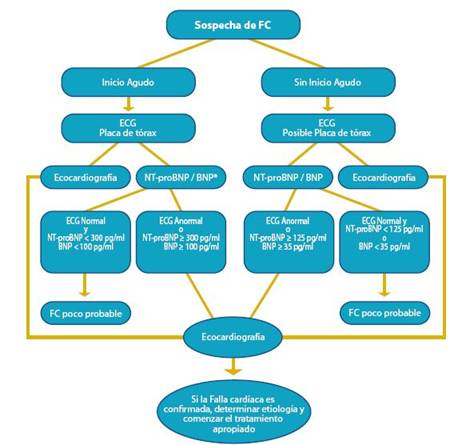
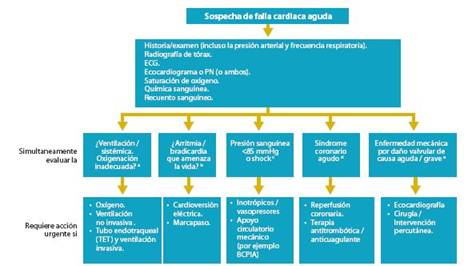
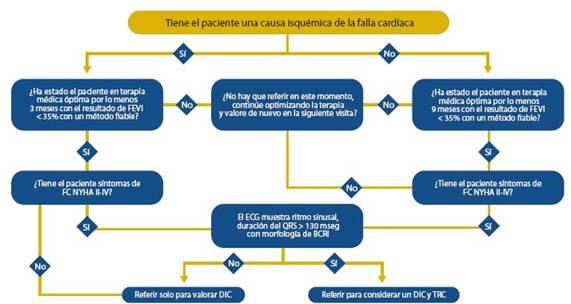
El proceso diagnóstico que ha demostrado tener la mejor relación costo beneficio cuando hay sospecha de FC se resume en figura 1. En esta definición hay dos modali dades clínicas importantes, que permiten al médico afinar el proceso de clasificación, diagnóstico y futura secuencia de tratamientos:
1. FC con Fracción de Eyección Reducida (FCFER)
En aproximadamente la mitad de los pacientes con FCFER, se encuentran grados variables de dilatación del Ven trículo Izquierdo (VI). Esta se define como el diagnóstico clíni co de la FC y FE ≤ 40 %.29-30
2. FC con Fracción de Eyección (FE) Preservada (FCFEP)
En los pacientes con FC clínica, los estudios estiman que la prevalencia de FCFEP es de aproximadamente 50 % (rango 40 % a 71 %).26-28
Estas estimaciones varían en gran medida debido a los diferentes criterios de donde hacer el corte de FE.
La definición de FCFEP ha variado, con las directrices de la Fracción de Eyección Ventricular Izquierda (FEVI) ≤ 35 %, < 40 % y en la actualidad ≤ 40 %.28
Fisiopatología en breve, tomado de diferentes fuentes y de las Guías Europeas.29-31
La FC se puede definir como una anormalidad de la es tructura cardíaca o la función que lleva a la insuficiencia del corazón para entregar oxígeno a un ritmo acorde con los requisitos del metabolismo tisular. Todo esto a pesar de las presiones de llenado normales (o sólo a expensas de un au mento de las presiones de llenado).32
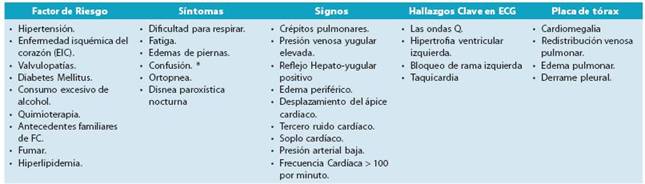
FC se define clínicamente como un síndrome en el que los pacientes tienen síntomas típicos (por ejemplo: dificul tad para respirar, edema de los tobillos y fatiga) y signos (por ejemplo: elevada presión venosa yugular, crepitantes pulmo nares y los desplazamiento del ápice cardíaco) como resulta do de una anomalía cardíaca de estructura o función.
El diagnóstico de FC puede ser difícil pues muchos de los síntomas no logran discriminar por sí mismos y por tanto, son de valor diagnóstico limitado.33-35
Muchos de los signos son el resultado de la retención de sodio y agua y resuelven rápidamente con el tratamiento diu rético, es decir, puede haber ausencia de signos típicos en los pacientes que reciben este tipo de tratamiento.
Es fundamental demostrar una causa subyacente para el diagnóstico de FC. En general, la enfermedad miocárdica es causada por la disfunción ventricular sistólica, sin embargo, las siguientes situaciones anómalas pueden causar FC:
Disfunción ventricular diastólica
Función valvular anormal
Afectación del pericardio.
Compromiso del endocardio.
Trastornos del ritmo cardíaco.
Trastornos de la conducción.
Pueden coexistir más de una de las condiciones mencionadas anteriormente.36
Es importante llegar a identificar la causa en cada pa ciente, para identificar cuál es su problema subyacente, para buscar una solución específica y personalizada, por ejemplo: cirugía de válvula para enfermedad valvular, terapia farma cológica específica para disfunción sistólica del ventrículo izquierdo, etc. 29-31
V. Clasificaciones
Existen cuatro maneras de clasificar la FC y hemos es cogido tomarlas todas, para poder ilustrar adecuadamente cada una de ellas, puesto que al clínico se le presentan los pacientes como una incógnita a resolver.
1. De acuerdo con la manera que se presenta en el tiempo.
1.1 Aguda:
Se define la Falla Cardíaca Aguda (FCA) como un cuadro de inicio rápido o gradual de signos y síntomas de FC, que re quiere tratamiento urgente, resultando en hospitalizaciones o consultas no planeadas.37 Se manifiesta por congestión pul monar debido a presiones de llenado del ventrículo izquier do elevadas, acompañándose de disnea en más del 90% de los casos.38
1.2 Crónica:
Habitualmente congestiva, es con frecuencia el estadío final de muchas cardiopatías. A pesar de los indudables avan ces en el tratamiento, continua teniendo una elevada morta lidad y son frecuentes los ingresos y reingresos. Para intentar abordar esta entidad en sus estadíos iniciales y prevenir o re trasar el desarrollo del síndrome en su máxima expresión, es muy importante conocer la historia natural.39
2. Clasificación funcional de la Asociación del Corazón de New York (NYHA por sus siglas en inglés) basada en la gravedad de los síntomas y actividad física.19,(40-41
Como parte del abordaje inicial del paciente con sospe cha de FC, además de diagnosticar se debe clasificar su estado funcional según NYHA y hacer el estadiaje, ya que esto nos permite en forma simple recolectar información pronóstica muy importante, para explicar a otros colegas, familiares y en especial al paciente.
Comúnmente utilizada como método para la clasificación funcional de pacientes FC, fue propuesta en 1928 y revisada en varias ocasiones, la última en 1994. Designa 4 clases: I, II, III y IV (Tabla 3), basándose en las limitaciones en la actividad física del paciente ocasionadas por los síntomas cardíacos.
Para aumentar la objetividad de la clasificación, se aña dieron, a las anteriores, 4 nuevas clases (A, B, C y D) en 1994, en función de la evidencia o no de enfermedad cardiovascu lar, (Tabla 4).39,41
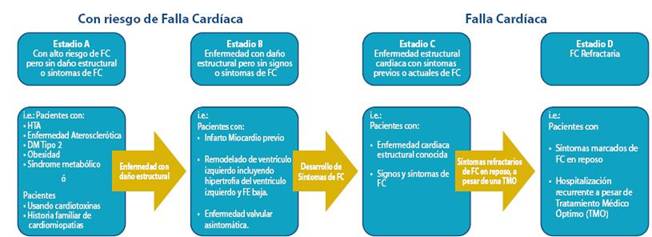
3. Clasificación por estadíos (Tabla 5 y Figura 2 26)
Esta clasificación describe distintos estadíos de FC basa dos en cambios estructurales y síntomas. Todos los pacientes con FC declarada están en los estadíos C y D. La clasificación por los estadíos de la FC enfatiza el desarrollo y progresión de la enfermedad, mientras que la clasificación de la NYHA se enfoca en la capacidad del ejercicio y el estado sintomático de la enfermedad. 41-46
Una de las ventajas de las definiciones de FC utilizadas en este CONSENSO es su sentido práctico; además ofrecen una mayor precisión tanto en la práctica clínica como en el desarrollo de estudios observacionales y epidemiológicos, lo mismo que ensayos clínicos.
4. Clasificación de acuerdo con la Fracción de Eyección (FE).
Dado que en nuestros países en general se cuenta con los servicios de cardiólogos capacitados en ecocardiografía, nos parece de suma importancia incluir la clasificación por FE.
4.1 Falla Cardíaca con Fracción de Eyección Reducida (FCFER)
En aproximadamente la mitad de los pacientes con FCFER, se encuentran grados variables de dilatación del Ven trículo Izquierdo (VI). Esta se define como el diagnóstico clíni co de la FC y FE ≤ 40%.29-31
4.2 FC con Fracción de Eyección Preservada (FCFEP)
En los pacientes con FC clínica, los estudios estiman que la prevalencia de FCFEP es de aproximadamente 50% (rango 40% a 71%) como hemos mencionado previamente. La defi nición de FCFEP en la actualidad >40 %.26,28 (Tabla 6).
Estas estimaciones varían en gran medida debido a los diferente criterios de donde hacer el corte de FE y se ha tra tado de limitar en FE > 40%, > 45%, > 50% y ≥ 55%, debido a que algunos de estos pacientes no son completamente pre servados, pero tampoco tienen reducción importante de la función sistólica.
Los pacientes con una FE en el rango de 40 % a 50 % re presentan un grupo intermedio. Estos pacientes a menudo son tratados por factores de riesgo y comorbilidades subya centes y con DM Tipo 2.
Se han incluido criterios clínicos para colaborar en la buena clasificación de los pacientes. Estos incluyen:
Signos clínicos o síntomas de FC.
Pruebas de que se conserva o FEVI normal.
La prueba de disfunción diastólica de VI que puede ser determinada por ecocardiografía bidimensional (ECO 2D), ECO 3D, Resonancia cardíaca o cateterismo cardíaco. Por su disponibilidad y coste económico en nuestra región centroamericana la técnica más utilizada para cuantificar la FEVI es la ECO 2D.
Un dato importante es que en general los pacientes con FCFEP son femeninas, adultas mayores, con antecedentes de hipertensión, obesidad, enfermedad coronaria, Diabetes Me llitus, Fibrilación Auricular (FA) e hiperlipidemia. No tenemos datos de nuestra área por lo que es importante que hagamos un registro de FC.
Es urgente caracterizarlos más detalladamente para po der comprender los mecanismos subyacentes en el síndro me de FC e identificar dianas terapéuticas adecuadas que finalmente permitan mejorar los resultados obtenidos en este grupo de enfermos. La tabla 6 describe los hallazgos más importantes.
VI. Diagnóstico
Aunque existen muchas maneras de evaluar la función cardíaca, no hay un examen diagnóstico único para FC, de allí la importancia de una cuidadosa historia clínica y un meticu loso examen físico que serán de utilidad no solo para diag nosticar el paciente, sino también para clasificarlo y tener una aproximación al pronóstico y al tratamiento.41 En 1933, Sir Thomas Lewis afirmó en su libro de texto sobre enfermedad cardíaca que “La verdadera esencia de la medicina cardiovas cular está en la identificación de la FC en su fase inicial”.44
A continuación se describe el orden de pruebas para ha cer el diagnóstico de la manera más costo-efectiva.
1. Historia clínica
1.1 Síntomas y signos de la FC
Los síntomas y signos de la FC son la clave para la de tección precoz de la enfermedad, ya que son estos los que impulsan al paciente a buscar atención médica.
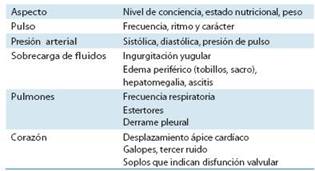
Realizar una historia médica completa y una exploración física exhaustiva, son habilidades imprescindibles que debe mos dominar (tabla 7).
La falta de aire, el cansancio y la fatiga son síntomas ca racterísticos; sin embargo, obtener y evaluar esta información requiere experiencia y habilidad, especialmente cuando se trata del paciente de edad avanzada. Durante el examen clí nico deben evaluarse los síntomas clínicos de la FC (tabla 8) mediante la observación, la palpación y la auscultación.
Al igual que los síntomas, los signos de la FC inicial son difíciles de interpretar tanto en el paciente anciano como en el obeso. Por lo tanto, la sospecha clínica de FC debe confir marse mediante estudios diagnósticos objetivos, especial mente los que nos permiten evaluar la función cardíaca.
Recomendaciones generales:
El examen físico en pacientes con FC, siempre se debe realizar correctamente, porque nos aporta información valio sa del estado hemodinámico del paciente y nos permite es tratificar el riesgo del paciente, aunque presenta limitaciones.
Con respecto al examen físico la toma de presión arterial es el principal dato que proporciona el pronóstico, nos permi te guiar el tratamiento vasodilatador, orienta hacia el estado de la resistencia vascular periférica.
La frecuencia cardíaca aumentada es un signo de FC des compensada, una frecuencia cardíaca mayor de 70 lpm, es un marcador de riesgo y una variable que guía el tratamiento con los beta-bloqueantes (por cada 5 lpm menos en pacien tes con FC, la mortalidad disminuye un 18 %).
El peso, talla y perímetro abdominal. El incremento de peso >2 kg en 72 horas nos sugiere congestión sistémica y en este caso, los diuréticos podrían recomendarse siempre y cuando tratemos la causa de la descompensación.
El perímetro abdominal guarda relación con la presencia de ascitis que algunos pacientes pueden presentar. Determi nar perfusión periférica: piel (fría, sudorosa o caliente, seca), cianosis, oliguria (hipoperfusión renal), hipoperfusión cere bral (trastornos de la conducta, desorientación) nos orienta la evaluación del gasto cardíaco anterógrado.
La auscultación cardíaca: ritmo, presencia de soplos y extratonos. Sospechar arritmias cardíacas como la FA, soplos secundarios a cardiopatía valvular como etiología de la FC, o sospechar Insuficiencia Mitral Secundaria o regurgitación en pacientes con hipertensión pulmonar.
Explorar signos de hipertensión venocapilar pulmonar: crepitantes y disminución del murmullo vesicular en bases pulmonares. Explorar signos de hipertensión venosa sistémi ca: pulso venoso yugular a 45 grados, reflujo hepatoyugular, hepatomegalia, signos de ascitis, edemas en miembros infe riores bilaterales.47
1.2 Causas de los síntomas de la FC
No se conoce el origen de los síntomas de la FC. Si bien el aumento de la presión capilar pulmonar causa el edema pul monar y la falta de aire, en el contexto de la FCA son eviden cia de sobrecarga de fluidos, en casos frecuentes los datos obtenidos en las pruebas de esfuerzo realizadas en pacientes con FCC demuestran que no existe una relación significativa entre la presión capilar y la capacidad de ejercicio.
Es conocido que la FC es una entidad que finalmente produce enfermedad en todos los órganos del cuerpo.
El cansancio y la fatiga son síntomas que se observan fre cuentemente, pero no son específicos y pueden tener múl tiples causas subyacentes. La pérdida de masa y fuerza del músculo esquelético es una manifestación tardía. El cerebro interpreta las señales enviadas por el músculo esquelético como falta de aire o fatiga. Esto explicaría la lenta respues ta al tratamiento de los pacientes con FC, ya que primero es preciso restablecer la calidad del músculo esquelético. Las variaciones en el grado de regurgitación mitral y la arritmia transitoria, comunes en la FC, exacerban también la falta de aire.45-46,48-49
1.3 Síntomas y gravedad de la FC
Hay poca relación entre los síntomas y la gravedad de la disfunción cardíaca. Los síntomas guardan una relación más fuerte con el pronóstico si persisten tras el tratamiento. En ese caso nos sirven para clasificar la gravedad de la FC y con trolar los efectos del tratamiento. No obstante, no se tendrá en cuenta únicamente los síntomas para instaurar la dosis óptima de inhibidores neurohormonales, como inhibidores de la enzima de conversión de angiotensina (IECA), antago nistas de los receptores de la angiotensina (ARA), bloqueado res beta o antagonistas de la aldosterona, ya que el impacto de estos fármacos en la mortalidad no guarda una relación importante con los síntomas y sus beneficios se incrementan paralelo a la utilización de dosis tituladas y máximas.
El diagnóstico de la FC no es suficiente por sí solo. De ben realizarse pruebas adicionales para establecer la causa subyacente de la FC porque, aunque el tratamiento suele ser similar en la mayoría de los pacientes, algunas causas poten cialmente reversibles requieren tratamientos específicos. Los pacientes deben recibir la dosis máxima tolerada.
La gravedad de la FC se clasifica normalmente ba sándose en la clase funcional de NYHA. Otra clasifi cación recientemente aparecida se basa tanto en la estructura cardíaca como en los síntomas y ayuda a estable cer un pronóstico personalizado.
2. Orientación rápida para distinguir entre FCA y FCC
Considerando que el clínico cuenta con poco tiempo para evaluar a cada paciente, es importante acoplarse a dos tipos de metodología.
En lo que compete a diagnóstico consideramos que es mejor enfocarse en el punto de vista de lo agudo o crónico del proceso.
Para el tratamiento es mejor considerar el estadío clínico y el grado de preservación de la fracción de eyección.
2.1 Bases del diagnóstico de FCA
Diagnóstico, evaluación e investigación.
El diagnóstico de la FCA se basa en una variedad de síntomas (por ejemplo: ortopnea y disnea de esfuerzo) y signos (por ejemplo: el edema y estertores crepitantes pul monares). Al examen físico, evaluar la perfusión sistémica y la presencia de congestión (piel fría o caliente, húmeda o seca) son fundamentales.
Las pruebas de laboratorio, electrocardiograma (ECG), radiografía de tórax y ecocardiograma son muy importantes para obtener una evaluación del paciente en general. Por ejemplo: una leve elevación de la troponina cardíaca se ob serva con alguna frecuencia en la descompensación aguda y no necesariamente es indicativa de infarto de miocardio (IM).
El examen de los péptidos natriuréticos (PN) no está dis ponible en algunos centros médicos del área, pero ya está bien establecido que si se cuenta con él, sirve para excluir o confirmar el diagnóstico en la clínica.
Cuando el diagnóstico es incierto; se ha establecido una escala de valores internacionalmente conocida. Entonces la clínica, apoyada de valores de los PN elevados ayuda a afinar el diagnóstico del cuadro.49-55
2.2 Bases del diagnóstico de FCC
Diagnóstico, evaluación e investigación
El diagnóstico de FC se hace considerando los síntomas y signos físicos de congestión y la reducción de la perfusión tisular que documentan la función cardíaca, sistólica y / o diastólica anormal (es).
Hacer un diagnóstico de FC puede ser difícil porque la tríada cardinal de edema, fatiga y disnea no son manifes taciones sensibles ni específicas y presentaciones atípicas, deben ser reconocidas en particular en la evaluación de las mujeres, los pacientes obesos y personas de edad avanzada.
Se debe realizar una buena historia clínica y el examen físico a todos los pacientes.
Se deben identificar o descartar trastornos sistémicos (por ejemplo: disfunción tiroidea) que pueden ser etiológicos o afectar potencialmente a la progresión de la enfermedad.
Hemos mencionado que cuantificar los PN es útil cuando el diagnóstico inicial o diagnóstico de descompensación y la ecocardiografía no dan certeza.
Es muy útil evaluar la función sistólica y diastólica, la anatomía cardíaca (por ejemplo: volumen, geometría y masa del ventrículo izquierdo) y descartar o confirmar en fermedad pericárdica.
La capacidad funcional se debe evaluar y anotar en el ex pediente, la clasificación de acuerdo al NYHA es simple y de gran ayuda para poder validar la gravedad clínica de FC.56-62
Nota especial:
ACC recomienda incluir bendopnea como un nuevo sig no de FC. “Bendopnea” (del inglés “dyspnea when bending forward”) es el término propuesto para un síntoma frecuente de los pacientes con FC avanzada: disnea cuando se inclinan hacia delante (ejemplo: cuando se ponen los zapatos).
El mecanismo de la bendopnea es un mayor aumento en las presiones de llenado durante la inclinación hacia adelante en un paciente en que dichas presiones están muy elevadas, en particular si el índice cardíaco está reducido. Por tanto, la presencia de este síntoma debe de alertar de una situación más avanzada de la FC que precisa probablemente, una mo dificación terapéutica. Es probable por tanto, que nos sea muy útil en la práctica clínica diaria.62
3. Técnicas diagnósticas
3.1 Pruebas diagnósticas esenciales en la FC
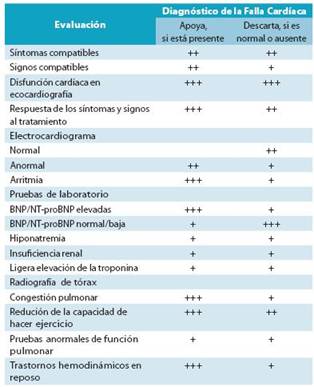
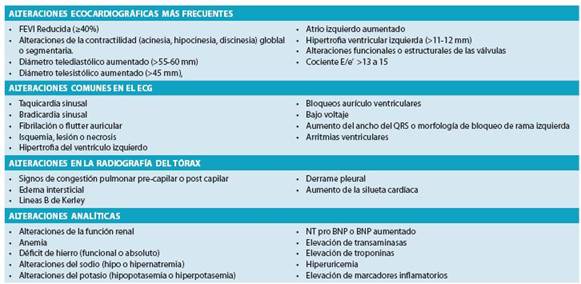
En la práctica clínica habitual se emplean distintas prue bas diagnósticas para confirmar o descartar el diagnóstico de FC (Tabla 9). Estas pruebas generalmente son más sensibles en la detección de la FCFER y serán brevemente descritas en este segmento.
Los hallazgos diagnósticos suelen ser menos concluyen tes en los pacientes con FCFEP. En general es muy importante procurar un ecocardiograma pues es el método más eficaz para la evaluación de la disfunción sistólica y diastólica.
Consideramos que las siguientes pruebas son de valor diagnóstico y hasta de valor pronóstico.
Resumimos en tabla 10 los desencadenantes frecuentes de estas condiciones.
3.1.1 Electrocardiograma
Se realizará un electrocardiograma (ECG) a todos los pa cientes con sospecha de FC, ya que los cambios electrocar diográficos son frecuentes en estos pacientes.
Un ECG anormal tiene poco valor predictivo para deter minar la presencia de FC. Si el ECG es completamente normal, especialmente los parámetros relativos a la función sistólica, la presencia de FC es poco probable (< 10%).
3.1.2 Radiografía de tórax
La radiografía de tórax es una herramienta fundamental en el proceso diagnóstico de la FC.
Permite evaluar:
Congestión pulmonar.
Revelar causas pulmonares o torácicas que expliquen la disnea.
Detectar cardiomegalia.
Acumulación de líquido pleural.
Presencia de enfermedad o infección pulmonar que podría causar o contribuir a la disnea.
Los hallazgos de la radiografía de tórax sólo tienen un va lor predictivo de FC cuando haya signos y síntomas típicos de esta enfermedad.
La cardiomegalia puede estar ausente tanto en la FCA como en su forma crónica.
3.1.3 Pruebas de laboratorio
Exámenes necesarios:
Hemograma completo (hemoglobina, leucocitos y plaquetas).
Electrolitos séricos (sodio, potasio, calcio y magnesio).
Creatinina y nitrógeno uréico séricos.
Tasa de filtración glomerular estimada (TFG).
Glucosa.
Pruebas de la función hepática.
Hormona tiroidea.
Ácido úrico.
Ferritina y porcentaje de saturación de transferrina.
Microalbuminuria
Análisis de orina.
Dependiendo del cuadro clínico del paciente, se consi derarán otras pruebas.
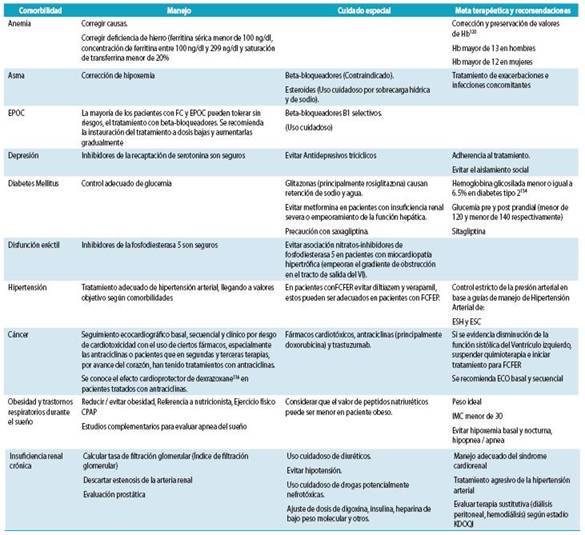
Las alteraciones hemáticas o electrolíticas no son fre cuentes en la FC leve o moderada que no ha sido tratada; sin embargo, son comunes la anemia leve, la hiponatremia, la hiperpotasemia y una función renal reducida, especial mente en pacientes tratados con diuréticos e inhibidores neurohormonales (inhibidores de la enzima de conversión de angiotensina [IECA], antagonistas de los receptores de angiotensina [ARA], antagonistas de la aldosterona, también conocidos como Antagonistas de Receptores de Mineralo corticoides, ARM).
Es fundamental controlar adecuadamente al paciente durante las fases de instauración, ajuste y seguimiento del tratamiento de la FC.
3.2 Biomarcadores
3.2.1 Péptidos natriuréticos (PN)
Las concentraciones plasmáticas de PN son útiles en el diagnóstico de la FC y en el manejo de los pacientes con FCC establecida.
La evidencia disponible respalda su uso en el diagnóstico y en la planificación de las distintas fases de tratamiento, a la hora de tomar decisiones respecto a ingresos y decidir dar el alta hospitalaria y en la identificación de pacientes con riesgo de complicaciones clínicas.
Su uso en el seguimiento y el ajuste del tratamiento far macológico está bien establecido.
Una concentración plasmática normal en un paciente sin tratar tiene un alto poder predictivo de exclusión de la enfer medad; por lo tanto, en estos casos la FC es una causa poco probable de los síntomas.
Por otro lado una concentración elevada de PN pese a un tratamiento óptimo indica un mal pronóstico.
La determinación del PN tipo B (BNP) y el pro-BNP ami noterminal (NT-proBNP) se introdujo como herramienta de diagnóstico63 y manejo64 de la FC. El aumento de estrés en la pared miocárdica eleva las cifras de estos biomarcadores.
Normalmente se observan títulos más bajos en los pa cientes con la función sistólica ventricular izquierda conser vada. No se ha establecido un valor de corte definitivo para ninguno de los dos péptidos, cuyas concentraciones suelen determinarse en el servicio de urgencias durante el diagnós tico de la FC.
La utilidad del uso de los péptidos es para descartar rápi damente la FC, o confirmarla, pero no se debe usar para clasi ficar o establecer un estadío.65
Debido a su vida media relativamente larga, los cambios abruptos en las presiones de llenado del ventrículo izquierdo, no aparecen reflejados de forma inmediata como cambios rá pidos en las concentraciones de péptidos.
Otras entidades asociadas a una elevación de los valores de PN son:
Hipertrofia ventricular izquierda.
Taquicardia.
Sobrecarga del ventrículo derecho.
Isquemia miocárdica.
Hipoxemia.
Disfunción renal
Edad avanzada.
Cirrosis hepática.
Sepsis e infección.
Fibrilación atrial.
Situaciones que complican la interpretación: Obesidad y su tratamiento pueden reducir los valores de PN.
La determinación de PN puede ser útil en la valoración del pronóstico antes de pensar en darles de alta hospitalaria a los pacientes y en el seguimiento de los efectos del trata miento de la FC.66-68
3.2.2 Troponinas
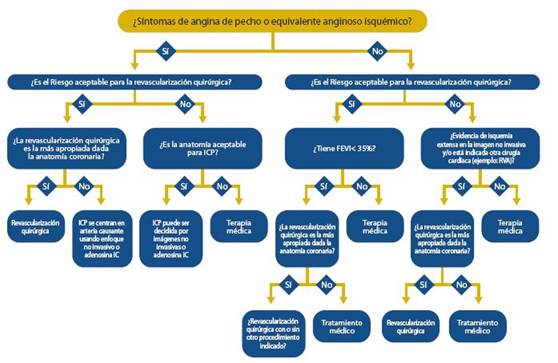
Ante la sospecha de FC y cuando el cuadro clínico indi que un Síndrome Coronario Agudo (SCA), se determinarán las troponinas I o T. Dado que las isoenzimas troponinas I (TnI) y T (TnT) son prácticamente exclusivas del miocardio (a diferencia de la troponina C, que puede encontrarse en el músculo esquelético), estas proteínas pueden medirse en la sangre periférica mediante anticuerpos monoclonales dirigi dos hacia los epítopos, que sólo están presentes en las formas cardíacas. El aumento de troponinas cardíacas es un indica dor de necrosis de miocitos, en cuyo caso y si está indicado, debe considerarse la posibilidad de revascularización, para lo cual se realizarán las pruebas diagnósticas necesarias.
Se sabe que hay concentraciones anormales circulantes de troponina cardíaca en pacientes con FC, a menudo se ele van aún sin infarto u obvia isquemia y con frecuencia se ele van en aquellos sin enfermedad coronaria subyacente.
La producción de troponinas cardíacas, por parte del paciente, se asocia con una alteración de la hemodinámi ca o disfunción progresiva del VI y aumento de los índices de mortalidad.
Del mismo modo, en los pacientes con FCA descom pensada, la elevación de los niveles de troponina cardía ca se asocia con peores resultados clínicos e incremento de la mortalidad.
Por el contrario la disminución en los niveles de tropo nina a lo largo del tiempo y con el tratamiento médico, se asocia con un mejor pronóstico que aquellos que mantienen elevación persistente.
Dada la estrecha asociación entre SCA y elevación de tro ponina, así como la relación entre el IM y el desarrollo de FCA, debe ser rutinaria la medición de la troponina I o T en pacien tes que presentan FCA descompensada.
La miocarditis aguda produce también un aumento de las troponinas. También puede observarse un ligero aumen to de las troponinas cardíacas en los pacientes con FC grave o durante episodios de FC descompensada, en pacientes sin signos de isquemia miocárdica secundaria a SCA y en cua dros de sepsis. La elevación de las troponinas es un importan te factor pronóstico en la FC, especialmente en presencia de elevados valores de PN.26,28,69-74
3.3 Ecocardiografía
El término ecocardiografía se utiliza para referirse a todas las técnicas de imagen cardíaca por ultrasonidos e incluye el Doppler pulsado y de onda continua, el Doppler color y el Doppler tisular (TDI).
La confirmación del diagnóstico de FC o disfunción car díaca mediante ecocardiografía es imprescindible y debe rea lizarse con prontitud ante la sospecha de FC.
La ecocardiografía es una técnica no invasiva y segura que proporciona abundante información sobre la anatomía cardíaca (volúmenes, geometría, masa), la movilidad de las paredes y la función valvular. Esta prueba proporciona infor mación fundamental sobre la etiología de la FC. En general, el proceso diagnóstico para determinar la FC debe incluir la realización de una ecocardiografía.
Cuando se pretende valorar la función ventricular, la de terminación de la FEVI (Conservada > 45-50 %) es la prueba más práctica porque permite diferenciar a los pacientes con disfunción sistólica de los que tienen la función sistólica con servada. Consideramos que el algoritmo de la figura 3 debe ser tomado como una base simple para diferenciar y utilizar los elementos clínicos en forma oportuna y secuenciada. En dicho algoritmo se presentan las opciones recomendadas de pruebas en caso de sospecha de FC.
Todos estos conceptos integrados, clínica, pruebas de gabinete y laboratorio las encontramos resumidos en la tabla 11.26,28,75
Otras pruebas sólo se requieren si el diagnóstico aún no es claro, por ejemplo si:
Imágenes ecocardiográficas son subóptimas
Se sospecha de la condición del paciente
Causa cardíaca inusual
Causa no cardíaca
Requiere una evaluación adicional de la causa subyacente
Tabla 11 (Continuación) Si se mantiene la sospecha de FC

Los valores corresponden a la insuficiencia cardíaca descompensada y no se aplican para el diagnóstico de la insuficiencia cardíaca estable.
En estos casos generalmente se podría indicar, imágenes de perfusión o una angiografía por sospecha de Enferme dad Arterial Coronaria o tomar biopsia endomiocárdica, so bre todo en ciertas enfermedades infiltrativas del miocardio como amiloidosis, sarcoidosis y hemocromatosis, así como en la miocarditis eosinofílica y en la miocardiopatía restrictiva de origen desconocido.
3.4 Según fracción de eyección
3.4.1 Fracción de eyección Preservada (FCFEP)
En la tabla 12 se presenta un resumen sobre el diagnós tico diferencial de FCFEP, propuesto por las Guías de Prácti cas Clínicas de FC de ACC / AHA76 y la figura 4 muestra los criterios diagnósticos del FEFEP de la Sociedad Europea de Cardiología26 y de la AHA / ACC.
Tabla 12. Diagnóstico Diferencial de FCFEP.76

ACC/AHA: American College of Cardiology/American Heart Association.
3.4.2 Fracción de Eyección Reducida (FCFER)
Síntomas y signos
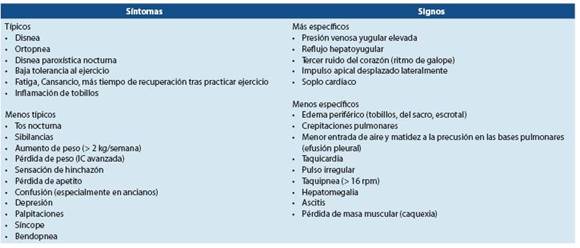
El diagnóstico de la FC puede ser difícil, especialmente en las etapas iniciales. Aunque los síntomas llaman la aten ción del clínico, muchos de los síntomas de la FC no son es pecíficos y por lo tanto, no ayudan a distinguir entre la FC y otros problemas. Los síntomas más específicos (ortopnea y disnea paroxística nocturna) son menos comunes, especial mente en pacientes con síntomas más leves, por lo que no son sensibles.
Muchos de los signos de la FC resultan de la retención de sodio y agua, por lo que tampoco son específicos. El edema periférico también tiene otras causas que no son precisamen te específicas. Los signos como consecuencia de la retención de sodio y agua (p. ej: edema periférico) desaparecen rápida mente con la terapia diurética (es decir, podrían no darse en pacientes que reciben este tipo de tratamiento, lo que hace más difícil evaluar a los pacientes a los que ya se está tratando así). Los signos más específicos, como la presión venosa yu gular elevada, que provoca ingurgitación de las venas yugu lares y el desplazamiento del impulso apical a la auscultación o a la palpación.
Los síntomas y signos pueden ser especialmente difíciles de identificar e interpretar en obesos, personas mayores y pa cientes con enfermedad pulmonar crónica.
La historia clínica del paciente también es importante. La FC es poco común en un sujeto sin historia clínica relevan te (ej: una causa potencial de daño cardíaco), mientras que ciertas características, especialmente el infarto de miocardio anterior, aumentan considerablemente la probabilidad de FC en un paciente con síntomas y signos correspondientes.
Estos puntos destacan la necesidad de obtener eviden cias objetivas de una anomalía cardíaca funcional o estruc tural que se cree que representa los síntomas y signos del paciente para asegurar el diagnostico de FC.
Resumen de clínica, laboratorio y gabinete
En la tabla 13 presentamos un resumen adaptado de la guía de Práctica Clínica de la ESC sobre diagnóstico y trata miento de la FCA y FCC 2012.77
VII. Estratificación y evaluación del riesgo
Los pacientes con FC pueden fallecer como consecuen cia de un fallo progresivo de bomba o de muerte súbita (MS).
El grupo de expertos reunido para esta revisión reco mienda la valoración que da “The Seattle Heart Failure Model” (SHFM), que consiste en una calculadora de la supervivencia proyectada al inicio de la evaluación de un paciente. Es decir que busca pronosticar la condición del paciente desde que un médico lo valora y después, se vuelve a cuantificar para valorar el efecto de las intervenciones para los pacientes con FC (Figura 6). SHFM está diseñado para ser usado por profe sionales de la salud con conocimientos en cardiología. Cada intervención tiene su valor y cada una impacta de diferentes maneras en el factor de riesgo.
Este modelo proporciona una estimación precisa de la supervivencia de 1, 2 y 3 años fácilmente obtenida en la rea lidad de los pacientes.
El uso de este modelo tanto por profesionales de la salud y sus pacientes puede facilitar la estimación de pronóstico, mejorar el cumplimiento y aumentar el uso de medicamen tos y dispositivos de salvamento.75)-(88
VIII. Tratamiento
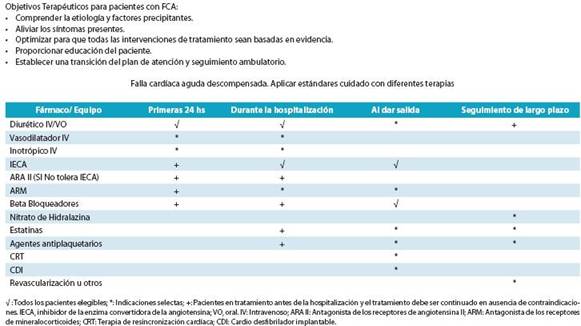
1. Falla Cardíaca Aguda
El médico se enfrenta a un paciente con cuadro agudo de FC y se deben priorizar las secuencias de manejo, por lo que es recomendable compartir estos objetivos del tratamiento, con el equipo de trabajo:
Tabla 13. (Continuación)
* Usualmente el médico cardiólogo hace otras determinaciones complementarias más específicas.
Inmediatos (urgencias/UCC/UCI):
Mejorar los síntomas.
Restablecer la oxigenación.
Mejorar la perfusión orgánica y hemodinámica.
Limitar el daño cardíaco y renal.
Minimizar el tiempo de estancia en la UCI.
Intermedios (en el hospital):
Estabilizar al paciente y optimizar la estrategia de tratamiento.
Iniciar tratamiento farmacológico adecuado (para salvar la vida).
Considerar la indicación de dispositivos en los pacientes que lo precisen.
Minimizar el tiempo de estancia en el hospital.
Manejo a largo plazo y antes del alta:
Planificar la estrategia de seguimiento.
Educar al paciente e iniciar las modificaciones necesarias relativas al estilo de vida.
Proporcionar una profilaxis secundaria adecuada.
Mejorar la calidad de vida y la supervivencia.
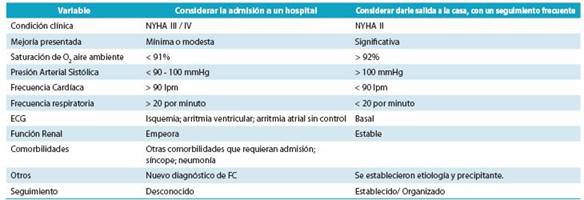
Lo inmediato que debe hacer el médico en su consulta o en emergencias es valorar la necesidad de que el paciente se mantenga en forma ambulatoria o que sea egresado en el caso de encontrarse en servicio de emergencia. Si está en la consulta estatal o privada, saber si ese paciente debe ser enviado a un servicio de urgencias para ser valorado.
En la tabla 14 se resumen los criterios clínicos de significancia para poder tomar una decisión basada en evidencia científica. 75
1.1 Manejo no farmacológico
1.1.1 Autocontrol del paciente
Esto requiere educación para que el paciente logre un tratamiento efectivo de la FC.
Puede tener un impacto significativo en:
El autocontrol se define como las acciones destinadas a mantener la estabilidad física, evitar comportamientos que pudieran empeorar la enfermedad y detectar de forma pre coz cualquier síntoma de deterioro.
Es muy recomendable que sean los profesionales de la sa lud los que proporcionen información y consejos sobre la FC.
1.1.2 Ventilación no invasiva (VNI) en FCA
Indicaciones: el término ventilación no invasiva se re fiere a todas las modalidades de ayuda ventilatoria mediante mascarillas herméticas sin intubación endotraqueal.
Tan pronto como sea posible, se considerará el uso de la VNI con presión al final de la espiración (PEEP) en todos los pacientes con edema pulmonar cardiogénico agudo o con FCA hipertensiva, ya que esta terapia mejora los parámetros clínicos, incluido el trabajo respiratorio.
La VNI-PEEP: Mejora la función ventricular izquierda re duciendo la postcarga ventricular izquierda.
Se tomarán precauciones especiales cuando se utili ce la VNI en el shock cardiogénico y la insuficiencia ventri cular derecha.
Recomendaciones
No utilice rutinariamente la ventilación no invasiva (presión positiva con tinua en las vías respitratorias [CPAP] o ventilación con presión positiva no invasiva [VNI]) en personas con insuficiencia cardíaca aguda y edema pulmonar cardiogénico. Si una persona tiene un edema pulmonar cardiogénico con disnea severa y acidemia, considerar iniciar la VNI sin demora:
En la presentación aguda o
Como un complemento al tratamiento médico si la condición de la persona no ha respondido.
Contraindicaciones:
Pacientes que no pueden cooperar (pacientes inconscientes, con trastorno cognitivo grave o ansiedad).
Necesidad urgente de intubación endotraqueal por hipoxia progresiva que pone en riesgo la vida.
Se tomarán precauciones especiales en pacientes con enfermedad obstructiva grave de las vías aéreas.
¿Cómo se utiliza la ventilación no invasiva?
Inicio: En primer lugar se aplica una PEEP de 5-7,5 cm H2O, que se aumentará gradualmente dependiendo de la res puesta clínica hasta 10 cmH2O; la fracción de oxígeno inspira do (FiO2) deber ser ≥ 0,40.
Duración: Normalmente 30 min a una hora hasta que se observe una mejoría mantenida de la disnea y de la satu ración de oxígeno sin la aplicación de una presión positiva continua en la vía aérea (CPAP).
Efectos adversos potenciales:
Agravamiento de la insuficiencia ventricular derecha grave.
Sequedad de las membranas mucosas con el uso continuo y prolongado.
Hipercapnia.
Ansiedad o claustrofobia.
Neumotórax.
Broncoaspiración.
Factores predictores de éxito:
Pacientes menos graves.
Hipertensión al ingreso.
Pocas secreciones.
Hipercapnia.
Fugas o escapes: mínimos o inexistentes.
Respiración sincrónica.
Respuesta en la primera hora.
Reducción de la frecuencia respiratoria.
Incremento de la PaO2/FiO2.
Corrección del pH.
Implementación de un monitoreo más estricto.
¿Dónde aplicar? Aplicación temprana de ventilación no invasiva en urgencias puede disminuir el riesgo relativo de muerte un 39% y la necesidad de intubación en 57%.
1.1.3 Ventilación invasiva (VI) en FCA
Cuando la FCA progresa y se presenta edema agudo de pulmón, las medidas habituales de tratamiento deben acom pañarse de otras que ayuden a la correcta oxigenación del paciente, siendo la ventilación mecánica el último y más drás tico paso.
Recomendaciones
Considere la ventilación invasiva en personas con falla aguda que, a pesar del tratamiento, está provocando o se aplica por:
1.1.4 Ultrafiltración en FC
Es difícil registrar pacientes para estudios con FCA: los pacientes se presentan en agudo, a menudo en el medio de la noche y frecuentemente están en muy malas condiciones.
Cerca de la mitad de los pacientes que ingresan a los hospitales con falla cardíaca tienen una retención de líqui dos moderada o severa. El manejo tradicional ha sido el de la restricción de líquidos (a menudo con restricción de sal), pero hay curiosamente poca evidencia que muestre que este tratamiento sea efectivo.
La terapia estándar para la retención de líquidos es el uso de diuréticos intravenosos, a menudo recurriendo al uso de infusiones durante varios días. Se podría utilizar la ultrafiltra ción para extraer líquido más rápidamente.
Recomendaciones
No ofrezca de forma rutinaria ultrafiltración para las personas con FCA
Considere la posibilidad de ultrafiltración para las personas con resis tencia diurética confirmada*
1.2 Tratamiento farmacológico
Objetivos terapéuticos del manejo de la FC.89-96 (tabla 15)
El objetivo del diagnóstico y el tratamiento de la FC es la reducción de la morbimortalidad.
En forma resumida:
Pronóstico: Reducir la mortalidad
Morbilidad:
Aliviar los síntomas y los signos.
Mejorar la calidad de vida.
Eliminar el edema y la retención de líquidos.
Aumentar la capacidad de ejercicio.
Reducir la fatiga y la falta de aire.
Reducir la necesidad de hospitalización.
Proporcionar cuidados al final de la vida (paliativos).
Prevención desarrollo de daño miocárdico
Progresión del daño miocárdico.
Remodelado del miocardio.
Recurrencia de los síntomas y acumulación de líquidos.
Hospitalización.
Es necesario considerar que para muchos pacientes y en particular para los ancianos, la capacidad de llevar una vida independiente, libre de síntomas excesivamente limitantes y evitar los ingresos hospitalarios son objetivos que en mu chas ocasiones equivalen al deseo de prolongar al máximo los años de vida.
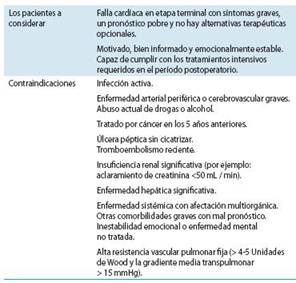
La prevención de la enfermedad cardíaca o su progresión constituye una parte fundamental del manejo de la enferme dad. La mayoría de los ensayos clínicos sobre FC se ha dedi cado al estudio de pacientes con disfunción sistólica y una fracción de eyección < 35-40 %.
Este punto de corte es relativamente arbitrario y no se dispone de suficiente evidencia en cuanto a poblaciones más grandes con FC sintomática y una fracción de eyección del 40 - 50 %.
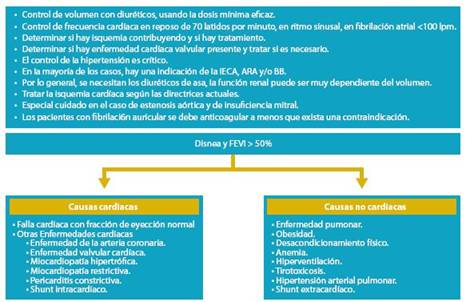
Al valorar a un paciente recomendamos que se siga la secuencia del siguiente algoritmo, porque sucede que el abordaje no puede dejar de ser individualizado y se debe co menzar por valorar si el paciente tiene FCFEP ó FCFER pues las estadísticas dan un 50 % de incidencia para cada condición.
2. Falla Cardíaca con Fracción de Eyección Preservada (FCFEP)
Probablemente el mayor equívoco en FCFEP es pensar que existen estrategias terapéuticas eficaces para ella y que ese tratamiento podrá ser semejante al de la FC sistólica.
A pesar de su relevancia clínica y epidemiológica el tra tamiento de FCFEP permanece ampliamente empírico y no basado en la evidencia, ya que fueron pocos los ensayos clí nicos dirigidos específicamente a esa población de pacientes.
Los pocos ensayos clínicos realizados en la FCFEP evalua ron apenas la eficacia de los inhibidores del eje renina-angio tensina. En todos ellos los resultados fueron decepcionantes, dado que ninguno de los agentes evaluados evidenció un beneficio significativo en términos de aumento de sobre vida de los pacientes. De ese modo, la utilización de otros agentes en la FCFEP sólo puede ser recomendada con base en argumentos teóricos o en datos extraídos de estudios de carácter observacional.
En las últimas décadas, el pronóstico de la FCFEP se ha mantenido inalterado a lo largo del tiempo, contrariamente a lo observado en la FC Sistólica, demostrando que el tratamien to y el abordaje de esos pacientes no son los más correctos.
2.1 Utilización de antagonistas del eje renina-angiotensina
Contrariamente a lo que se observa en la FC sistólica, en la FCFEP el bloqueo del eje renina-angiotensina es poco útil en términos de reducción de los eventos clínicos o de la mortalidad, como fue demostrado en los estudios con perin dopril (PEP-CHF), con irbesartan (I-PRESERVE)82 o candesartan (CHARM-Preserved).106
2.2 Papel de los beta-bloqueantes en la FCFEP
Desde un punto de vista teórico, los beta-bloqueado res (BB) tienen beneficios potenciales en el tratamiento de la FCFEP 90,91:
Al reducir la frecuencia cardíaca aumentan la duración de la diástole y el tiempo de llenado ventricular.
Reducen las necesidades de oxígeno del miocardio.
Disminuyen la presión arterial.
Pueden inducir regresión de la HVI. Por otro lado, esos efectos benéficos podrán ser parcialmente atenuados por el hecho de que los BB atrasan la relajación ventricular y reducen la contractilidad.
A pesar de que no existen estudios clínicos que evalúen específicamente los BB en ese grupo de pacientes, es de esperar que la utilización de BB podrá ser potencialmente benéfica en la FCFEP, sobre todo de aquellos con acción vaso dilatadora asociada (por ejemplo, carvedilol y nebivolol) por su efecto en la reducción de la rigidez arterial.
En relación a la eficacia de los BB en la FCFEP práctica mente sólo hay datos extraídos de estudios observaciona les, que señalan un beneficio en términos de reducción de la mortalidad51. Recientemente, en un subanálisis del estudio SENIORS, se observó que en el subgrupo de pacientes con una FE > 35% los beneficios de los BB fueron semejantes, lo que parece demostrar que la eficacia de este BB es indepen diente de la fracción de eyección. Con tantas incertidumbres es urgente la realización de un ensayo clínico que evalúe la utilización de los BB en la FCFEP.
2.3 Los antagonistas de la aldosterona en la FCFEP
La utilización de los antagonistas de la aldosterona en la FCFEP puede ser benéfica, por lo menos del punto de vista teórico. La aldosterona actúa sobre el miocardio y sobre los vasos sanguíneos, induciendo hipertrofia miocitaria, fibro sis y depósito de colágeno, llevando al aumento de la rigi dez miocárdica y arterial y contribuyendo a la fisiopatología de la FCFEP.
En un pequeño ensayo clínico fue demostrado que la espironolactona mejoró los índices ecocardiográficos de dis función diastólica54.
En el estudio TOPCAT (Treatment of Preserved Cardiac Function Heart Failure with an Aldosterone Antagonist) y otros estudios de gran solidez se ha analizado el papel de la espironolactona en los pacientes con FCFEP.
El TOPCAT es un ensayo clínico que analizó si el trata miento con espironolactona mejora el pronóstico de los pacientes con FC sintomática y FEVI preservada. Fue un es tudio aleatorizadodo, doble ciego, fase 3, multicéntrico e in ternacional (6 países: USA, Canadá, Brasil, Argentina, Rusia y Georgia), patrocinado por el NHLBI. En este estudio, se aleato rizaron 3 445 pacientes con FC sintomática y FEVI ≥ 45% para recibir espironolactona (15-45 mg/ día) o placebo.
La dosis alcanzada de espironolactona en el estudio TOP CAT fue similar a la dosis media utilizada en el estudio RALES y los ajustes en la dosificación fueron limitados por eleva ciones del potasio y creatinina sérica. Aproximadamente un tercio de los pacientes discontinuaron la droga en estudio por estas y otras razones, lo cual fue una limitación adicional del estudio.
Como conclusión interpretamos que al comparar espi ronolactona versus placebo para el tratamiento de FCFEP, la espironolactona no demostró un beneficio estadísti camente significativo en el compuesto final primario res pecto del placebo.97
2.4 Otras estrategias terapéuticas
Ante tan poca evidencia, apenas son recomendados al gunos principios generales para el tratamiento de la FCFEP.26
Control agresivo de la presión arterial, para prevenir la aparición de la FCFEP, para reducir el número de descompensaciones de la FC, para la regresión de la hipertrofia ventricular izquierda y mejorar el acoplamiento ventrículo-arterial.
Reducción de las presiones de llenado ventricular, mediante la restricción de la ingestión de sal y por la administración de diuréticos, una vez que esos pacientes son extremadamente sensibles a variaciones del volumen y de la precarga.
Mantener el ritmo sinusal, para preservar la contracción atrial
En el control de la frecuencia cardíaca, evitar la taquicardia, que acorta el tiempo de duración de la diástole
El tratamiento apropiado de las comorbilidades subyacentes, en un abordaje integrado y multidisciplinario
3. Falla Cardíaca con Fracción de Eyección Reducida (FCFER)
Este es el tipo de FC más estudiada y en la que se en cuentran mejores evidencias objetivas para poder hacer tra tamientos basados en evidencia.
3.1 Guías por grupo terapéutico
3.1.1 Morfina y opioides en la FCFER
Los opiáceos como la morfina pueden ser útiles en al gunos pacientes con edema agudo de pulmón, ya que redu cen la ansiedad y alivian la angustia asociada a la disnea. Se considerará la administración de morfina en las fases iniciales del tratamiento de los pacientes ingresados por FCA grave, especialmente si se observa agitación, disnea, ansiedad o dolor de pecho.98-100
En los pacientes FCA, la morfina alivia la disnea y otros síntomas y puede favorecer la cooperación del paciente du rante la aplicación de la ventilación no invasiva. La evidencia a favor del uso de morfina en la FCA es escasa.
Se puede administrar morfina intravenosa (bolo de 2,5-5 mg), tan pronto como esté disponible la vía intravenosa en los pacientes con FCA. Esta dosis puede repetirse según se requiera.
También se cree que los opiáceos son venodilatado res, reducen la precarga y también puede reducir la con ducción simpática.
Es necesario considerar que los opiáceos inducen náu seas (necesitando la administración concomitante de un antiemético y hay que tener cuidado con ciclizina,99 que tiene actividad vasoconstrictora y deprime la capacidad res piratoria, aumentando potencialmente la necesidad de ven tilación invasiva.
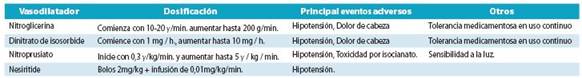
3.1.2 Vasodilatadores
Aunque los vasodilatadores tales como la nitroglicerina reducen la precarga, la postcarga y el aumento del volumen sistólico, no hay pruebas sólidas de que alivian la disnea o mejoran los resultados clínicos.100-102
Los vasodilatadores son probablemente de mayor utili dad en pacientes con hipertensión y deben evitarse en pa cientes con una presión arterial sistólica menor de 110 mmHg. Caídas excesivas en la presión arterial también debe evitarse, porque la hipotensión está asociada a una mayor mortalidad en pacientes con FCA.
Los vasodilatadores se deben utilizar con extrema pre caución en pacientes con estenosis aórtica o mitral significa tiva. (Tabla 16)
3.1.3 Diuréticos e IECA, ARA II o antagonistas de la aldosterona.103-108
La reducción de volumen y la hiponatremia por diuresis excesiva puede aumentar el riesgo de hipotensión y disfun ción renal en el tratamiento con IECA/ARA II.
En caso de administrarse IECA/ARA II/antagonista de la aldosterona en combinación con un diurético, los suplemen tos de potasio no suelen ser necesarios.
Se puede presentar una hiperpotasemia grave cuando se utilizan diuréticos ahorradores de potasio, incluidos los anta gonistas de la aldosterona, en combinación con IECA/ARA II.
Deben evitarse los diuréticos ahorradores de potasio no antagonistas de la aldosterona.
Sólo se utilizará la combinación de un antagonista de la aldosterona y un IECA/ARA II bajo estrecha vigilancia de labo ratorio (Creatinina y potasio séricos).
¿Cómo usar diuréticos en la FC?
Inicio del tratamiento con diuréticos:
Compruebe la función renal y electrolitos séricos.
En la mayoría de los casos se prescriben diuréticos de ASA en lugar de tiacidas, debido a su mayor eficacia al inducir diuresis y natriuresis.
Dosificación de los diuréticos.
Comience con una dosis baja y auméntela gradualmente hasta que observe una mejoría clínica de los síntomas y signos de congestión.
Se ajustará la dosis, especialmente después de que se haya restaurado el peso seco para evitar el riesgo de falla renal y deshidratación. Se intentará mantener el peso seco con la mínima dosis posible.
Se animará al paciente ambulatorio con FC a controlarse su dosis de diuréticos basándose en el peso diario y en otros signos clínicos de retención de líquidos. Para ello es preciso educar al paciente.
En el Estudio Clínico DOSE, se compararon dos estra tegias de tratamiento (bolos vs. perfusión continua) y dosis elevadas vs. dosis bajas. Se trata de un estudio prospectivo, doble ciego,22 aleatorizado, en el que se incluyeron 308 pa cientes con FCA descompensada. Los pacientes fueron alea torizados a recibir furosemida por vía intravenosa a través de un bolo cada 12 horas o infusión continua y también a recibir una dosis baja (equivalente a la dosis oral que toma ba previamente el paciente) o dosis alta (2,5 veces la dosis oral anterior).
Con los resultados de este estudio se puede concluir que el tratamiento de pacientes con FCA con diuréticos de ASA en bolos o perfusión continua, tiene una efectividad similar respecto al control de los síntomas, pero la utilización de do sis elevadas frente a dosis baja favorece una mayor diuresis y existe una tendencia hacia un mejor control de los síntomas, sin diferencias en la función renal a las 72 horas.
Esto es interesante, ya que el tratamiento con bolos siempre es más cómodo para el paciente que la perfusión, ya que le permite una mayor movilidad.
Por otro lado, aunque no se han encontrado diferencias en los objetivos principales del estudio en la comparación de dosis, la utilización de dosis elevadas dio lugar a una mayor diuresis y un mayor alivio de la disnea, que es el principal síntoma de estos pacientes, lo que apoyaría la utilización de dosis elevadas frente a dosis bajas en el periodo inicial del tratamiento del paciente con FCA.109
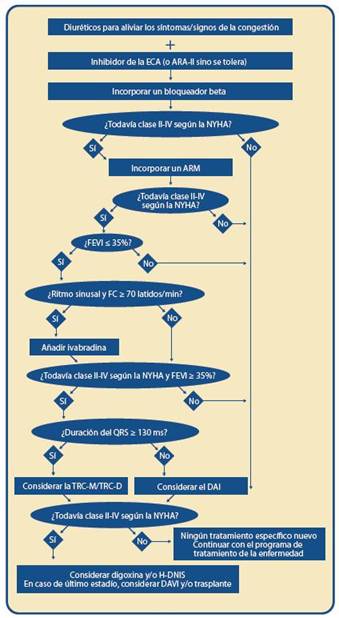
3.1.4 Antagonistas de la aldosterona110-111Excepto cuando esté contraindicado o no se tolere, se considerará la administración de antagonistas de la aldoste-rona a dosis bajas, en todos los pacientes con una FEVI ≤ 35 % y FC grave y sintomática; por ejemplo: pacientes en clase fun-cional III o IV de la NYHA, en ausencia de hiperpotasemia y disfunción renal significativa.
Los antagonistas de la aldosterona (también llamados Antagonistas de los Receptores de Mineralocorticoides, ARM) reducen los ingresos hospitalarios por empeoramiento de la FC y aumentan la supervivencia cuando se añaden al trata-miento prescrito, incluidos los IECA. En pacientes hospitaliza-dos que cumplan estos criterios, se iniciará tratamiento con un antagonista de la aldosterona antes del egreso. ¿Cómo se usa espironolactona (o eplerenona) en la FC? (Tabla 17) Inicio del tratamiento con espironolactona (o eplerenona):
Comprobar la función renal y electrolitos séricos.
Dosis inicial: espironolactona 12.5 a 25 mg/día (o eplerenona 25 mg/día).
Volver a comprobar la función renal y electrolitos séricos en la semana 1 y 4 tras el inicio del tratamiento.
Ajuste de la dosis:
Considere un aumento de la dosis después de 4-8 semanas. En caso de empeoramiento de la función renal o hiperpotasemia, no aumente la dosis.
Vuelva a comprobar la función renal y electrolitos séricos en la semana 1 y 4 tras el incremento de la dosis.
En ausencia de los problemas antes mencionados, intente alcanzar la dosis óptima espironolactona, 50 mg/ día; eplerenona, 50 mg/día o la dosis máxima tolerada.
Vuelva a comprobar la función renal y electrolitos séricos 1, 2, 3 y 6 meses tras haberse alcanzado la dosis de mantenimiento y después, cada 6 meses.
Efectos adversos potenciales:
Hiperpotasemia: en caso de elevación de la concentración de potasio a > 5,5 mmol/l, reduzca la dosis de espironolactona (o eplerenona) a la mitad (por ejemplo, 25 mg en días alternos) y vigile estrechamente la analítica sanguínea. Si el potasio se eleva a 6 mmol/l, interrumpa inmediatamente la administración de espironolactona (o eplerenona) y realice determinaciones en sangre; podría ser necesario un tratamiento específico para la hiperpotasemia.
Empeoramiento de la función renal: si la creatinina se eleva a > 220 μmol/l (~2,5 mg/dl), reduzca la dosis de espironolactona (o eplerenona) a la mitad (p. ej: 25 mg en días alternos) y vigile con atención las determinaciones en sangre. Si la creatinina se eleva a > 310 μmol/l (~3,5 mg/dl), interrumpa inmediatamente la administración de espironolactona (o eplerenona) y vigile las determinaciones en sangre; podría ser necesario un tratamiento específico para la falla renal.
Agrandamiento patológico de glándulas mamarias (ginecomastia): sustituya la espironolactona por eplerenona.
Inhibidor específico de la corriente If112
La ivabradina es un inhibidor específico de la corriente If en el nódulo sinusal que determina una reducción de la velo cidad de la pendiente de despolarización diastólica de dicha estructura y, por tanto, deprime su automatismo y reduce la frecuencia cardíaca de los sujetos en ritmo sinusal. Los re sultados de los estudios llevados a cabo en corazones sanos indican que la ivabradina, a las concentraciones alcanzadas durante su empleo terapéutico, carece de acciones sobre otros canales iónicos cardíacos o el sistema vascular.
En el estudio SHIFT se incluyeron 6 558 pacientes que recibieron ivabradina (3 268) o placebo (3 290). Se dispuso de datos para el análisis en 3 241 pacientes del grupo ivabra dina y en 3 264 del randomizado a placebo. La mediana de seguimiento fue 22.9 (18-28) meses. Un total de 793 (24%) pacientes del grupo ivabradina y 937 (29%) de los asignados a placebo presentaron al menos un evento de los incluidos en el objetivo primario (HR 0,82; IC 95% 0,75-0,90, p<0.0001). El beneficio se debía principalmente a la reducción de los ingresos hospitalarios por agravamiento de la FC (672, 21%, placebo frente a 514, 16%, ivabradina; HR 0,74, 0,66-0.83; p<0.0001) y las muertes causadas por FC (151, 5%, frente a 113, 3%; HR 0,74, 0,58-0,94, p=0.014).
Se produjeron menos acontecimientos adversos graves en el grupo ivabradina (3.388 eventos) que en el grupo place bo (3847; p=0.025). En 150 pacientes (5%) del grupo ivabra dina se documentó bradicardia sintomática, en comparación con 32 (1%) de los tratados con placebo (p<0.0001). Se re gistraron efectos secundarios visuales (fosfenos) en 89 (3%) de los pacientes tratados con ivabradina y en 17 (1%) de los tratados con placebo (p<0.0001). Se resumen los nombres y dosis mínimas y máximas o medianas en estudios clínicos.
3.1.6 Inhibidores de la enzima de conversión de la angiotensina108
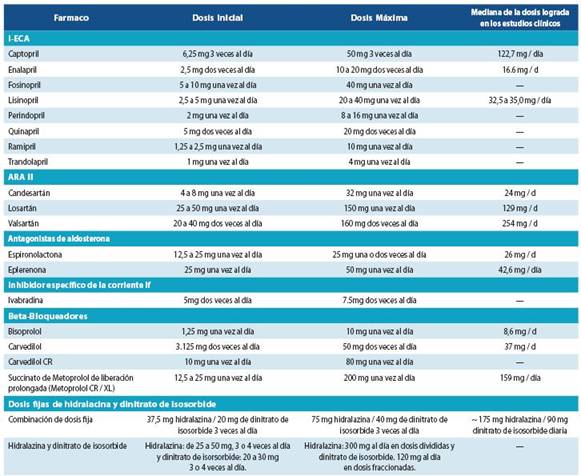
Excepto cuando esté contraindicado o no sea tolerado, se administrarán IECA a todos los pacientes con FC sintomá tica y una FEVI ≤ 40%. El tratamiento con IECA mejora la fun ción ventricular y el estado del paciente, reduce los ingresos hospitalarios por empeoramiento de la FC y mejora la super vivencia. En pacientes hospitalizados, se iniciará el tratamien to con IECA antes de indicar la salida.
¿Qué pacientes deben tratarse con IECA? Basándose en los ensayos clínicos aleatorizados, los IECA están indicados en pacientes con una FEVI ≤ 40%, independientemente de los síntomas.
Contraindicaciones:
Historia de angioedema.
Estenosis bilateral de las arterias renales.
Concentración de potasio sérico > 5 mmol/l.
Creatinina sérica > 220 μmol/l (~2,5 mg/dl).
Estenosis aórtica grave.
¿Cómo deben usarse los IECA en la FC?
Inicio del tratamiento con IECA:
Cuantificar la función renal y de los electrolitos séricos.
Volver a revisar la función renal y electrolitos séricos después de 1-2 semanas del inicio del tratamiento. Ajuste de la dosis:
Considerar un aumento de la dosis tras 2-4 semanas.
En caso de un empeoramiento de la función renal o hiperpotasemia, no se aumentará la dosis.
Volver a revisar la función renal y los electrolitos séricos después de 1 y 4 semanas del aumento de la dosis. Se puede considerar un aumento más rápido de la dosis en pacientes hospitalizados o estrechamente supervisados, siempre que sea tolerada.
En ausencia de los problemas antes mencionados, se intentará alcanzar la dosis óptima basada en la evidencia o la dosis máxima tolerada (tabla 17).
Revisar de nuevo la función renal y los electrolitos séricos después de 1, 3 y 6 meses de alcanzarse la dosis de mantenimiento y en lo sucesivo, cada 6 meses.
Eventos adversos potenciales:
Empeoramiento de la función renal.
Hiperpotasemia.
Hipotensión sintomática (como mareos).
Tos. Si el IECA causa una tos molesta, se cambiará por un ARA II.
Pacientes que deben tratarse con un ARA II. Indicacio nes basadas en los resultados de ensayos clínicos controlados:
FEVI ≤ 40%.
Como tratamiento alternativo en pacientes con síntomas leves a graves (clase funcional II-IV de la NYHA) que no toleran tratamiento con IECA no toleran espironolactona o eplerenona o en pacientes con síntomas persistentes (clase funcional III-IV de la NYHA) a pesar de recibir tratamiento con un IECA y un beta- bloqueador.
Los ARA II pueden causar un empeoramiento de la función renal, hiperpotasemia e hipotensión sintomática, con una incidencia similar a la de los IECA.
No causan tos con tanta frecuencia.
Contraindicaciones:
Las mismas que se aplican a los IECA, a excepción del angioedema.
Pacientes tratados con IECA y antagonistas de la aldosterona.
Los ARA II sólo se utilizarán en pacientes con una función renal adecuada y concentraciones normales de potasio sérico; la monitorización periódica de la función renal y los electrolitos séricos es obligatoria, especialmente con tratamiento combinado de ARA II e IECA.
¿Cómo usar un bloqueador de los receptores de la angio tensina en la FC (Tabla 17)
Inicio del tratamiento con ARA II:
Comprobar la función renal y electrolitos séricos.
Dosis inicial: candesartán, 4-8 mg/día; valsartán, 40 mg/12 h.
Volver a comprobar la función renal y electrolitos séricos durante la primera semana del inicio del tratamiento.
Ajuste de la dosis:
Considere un aumento de la dosis después de 2-4 semanas. En caso de empeoramiento de la función renal o hiperpotasemia, no aumente la dosis.
Vuelva a comprobar la función renal y electrolitos séricos en la semana 1 y 4 tras el incremento de la dosis.
En ausencia de los problemas antes mencionados, intente alcanzar la dosis óptima: candesartán, 32 mg/ día; valsartán, 160 mg/12 h, o la dosis máxima tolerada.
Vuelva a comprobar la función renal y electrolitos séricos 1, 3 y 6 meses tras haberse alcanzado la dosis de mantenimiento y después, cada 6 meses.
Eventos adversos potenciales:
Similares a los eventos adversos de los IECA a excepción de la tos.
3.1.7 Beta-bloqueadores113-115
En pacientes con FCFER que no estén recibiendo un beta-bloqueador, se debe iniciar tan pronto como sea posible des pués de la estabilización, si la presión arterial y la frecuencia cardíaca lo permiten y no se tenga evidencia de congestión pulmonar o edemas periféricos significativos.
Los beta-bloqueadores mejoran la función ventricular y el bienestar del paciente, reducen el número de ingresos por empeoramiento de la FC y aumentan la supervivencia.
La dosis debe ser titulada en lo posible antes de dar sa lida del hospital o valorar a menudo en la consulta externa. Debe hacerse un plan individualizado para completar el in cremento de la dosis.
Se ha observado que el tratamiento con beta-bloquea dores puede continuarse en muchos pacientes durante un episodio de descompensación y comenzar con seguridad después de un episodio de descompensación antes del egre so al paciente.31
¿Cómo usar los beta-bloqueadores en la FC? Inicio del tratamiento con beta-bloqueadores:
Dosis inicial: carvedilol 3,125-6,25 mg cada 12 h., bisoprolol 1,25 mg/día, metoprolol CR/XL 12,5-25 mg/ día o nebivolol 1,25 mg/ día, con supervisión en consulta externa. (Tabla 17)
En pacientes recientemente descompensados, se puede iniciar con precaución el tratamiento con beta-bloqueadores antes del egreso. Ajuste de la dosis:
Consultas cada 2-4 semanas para ajustar la dosis de beta- bloqueadores (en algunos pacientes se aumentará más lentamente).
No debe aumentarse la dosis en presencia de signos de empeoramiento de la FC, hipotensión sintomática (como mareos) o bradicardia excesiva (frecuencia cardíaca < 50/ lpm).
En ausencia de estos problemas, se aumentará al doble la dosis de beta-bloqueadores en cada consulta hasta alcanzar la dosis óptima -carvedilol 25-50 mg cada 12 h., bisoprolol 10 mg/día, metoprolol CR/XL 200 mg/día o nebivolol 10 mg/día- o la dosis máxima tolerada.
Eventos adversos potenciales:
Hipotensión sintomática: por lo general mejora con el tiempo; hay que considerar la reducción de la dosis de otros agentes hipotensores (excepto IECA/ARA), como diuréticos o nitratos. La hipotensión asintomática no requiere ninguna intervención.
Empeoramiento de la FC: se aumenta la dosis de diuréticos (sólo temporalmente) y se continúa tratamiento con bloqueadores beta (normalmente a una dosis menor), si fuera posible.
Bradicardia excesiva: se realiza un ECG (o monitorización ambulatoria si fuera necesario) para descartar un bloqueo cardíaco. Considérese la interrupción de glucósidos digitálicos, si se estuviesen administrando.
Podría ser necesario reducir la dosis de beta-bloqueado res o la interrupción del tratamiento.
3.1.8 Hidralazina y dinitrato de isosorbide116-117
En pacientes sintomáticos con una FEVI ≤ 40%, se puede usar la combinación de hidralazina y dinitrato de isosorbide (H+DNIS) como tratamiento alternativo cuando haya intole rancia a IECA y ARA II. Se considerará la adición de H+DNIS en pacientes con síntomas persistentes a pesar del trata miento con IECA, beta- bloqueadores y ARA II o antagonistas de la aldosterona.
En estos pacientes, el tratamiento con H+DNIS puede re ducir el riesgo de muerte.
Pacientes que deben tratarse con hidrazalina y dinitrato de isosorbide.
Indicaciones basadas en los resultados de estudios clínicos controlados:
Como alternativa al tratamiento con IECA/ARA II cuando no se tolera estos fármacos.
Como tratamiento adicional a los IECA, si no se tolera los ARA II o los antagonistas de la aldosterona.
La evidencia es más convincente en pacientes afroamericanos. Contraindicaciones:
Hipotensión sintomática.
Síndrome lúpico.
Insuficiencia renal grave (podría ser necesario reducir la dosis).
¿Cómo usar la hidralazina y el dinitrato de isosorbide en la FC? Inicio del tratamiento:
Dosis inicial: hidralazina 37,5 mg y DNIS 20 mg tres veces al día.
Ajuste de la dosis:
Considere el aumento de la dosis tras 2-4 semanas de tratamiento. No aumente la dosis en caso de hipotensión sintomática.
Si se tolera, intente alcanzar la dosis óptima: hidralazina 75 mg y DNIS 40 mg tres veces al día, o la dosis máxima tolerada.
Eventos adversos potenciales:
Hipotensión sintomática (mareos) que mejora con el tiempo; considere una reducción de la dosis de otros agentes hipotensores (excepto IECA/ ARA II/beta-bloqueadores /antagonistas de la aldosterona). La hipotensión asintomática no requiere ninguna intervención.
Artralgia/dolor muscular, dolor o inflamación de articulaciones, pericarditis/pleuritis, erupción o fiebre: considere la posibilidad de un síndrome lúpico inducido por fármacos; compruebe la concentración de anticuerpos antinucleares, interrumpa la administración de H+DNIS. 109
3.1.9 Digoxina105
¿Pacientes con FC que deben tratarse con digoxi na? Indicaciones basadas en los resultados de estudios clínicos controlados.
Fibrilación auricular:
Pacientes con una frecuencia ventricular > 80 lat/min en reposo y > 110-120 lat/min. durante el ejercicio.
Ritmo sinusal:
Disfunción sistólica ventricular izquierda (FEVI ≤ 40%).
Síntomas leves a graves (clase funcional II-IV de la NYHA).
Dosis óptima de IECA o/y un ARA II, beta-bloqueador o antagonista de la aldosterona, cuando esté indicado.
Contraindicaciones:
Bloqueo cardíaco de segundo o tercer grado (sin marcapasos permanente); se tomarán precauciones si se sospecha síndrome del seno enfermo.
Síndromes de pre-excitación.
Evidencia previa de intolerancia a la digoxina.
Insuficiencia Renal Severa.
¿Cómo se usa la digoxina en la FC?
Inicio del tratamiento con digoxina:
Dosis inicial: por lo general, en pacientes estables con ritmo sinusal no se requieren dosis de carga de digoxina. En adultos con la función renal normal, se emplea una dosis dia ria de mantenimiento de 0,25 mg.
En ancianos y pacientes con afección renal, se adminis trará una dosis reducida de 0,125 o 0,0625 mg/día.
Se revisarán las concentraciones de digoxina al poco tiempo de iniciarse el tratamiento crónico en pacientes con la función renal normal. Alcanzar un estado estable puede re querir más tiempo en pacientes con afección renal.
No hay evidencia de que la determinación periódica de las concentraciones de digoxina ofrezca mejores resultados. La concentración sérica terapéutica se sitúa entre 0,6 y 0,9 ng/ ml, concentraciones más bajas que las recomendadas previa mente. Algunos fármacos pueden aumentar la concentración plasmática de digoxina (amiodarona, diltiazem, verapamilo, algunos antibióticos, quinidina).
Eventos adversos potenciales:
Bloqueo atrioventricular y sinoauricular.
Arritmias auriculares y ventriculares, especialmente en presencia de hipopotasemia (considere la administración de fragmentos de anticuerpos Fab específicos de la digoxina para las arritmias ventriculares causadas por toxicidad).
Los signos de toxicidad incluyen: estado de confusión, náuseas, anorexia y alteración de la percepción de los colores, arritmia ventricular.26,28,105
3.2 Otros fármacos usados para el tratamiento de la comorbilidad cardiovascular en pacientes con FC
3.2.1 Anticoagulantes (antagonistas de la vitamina K)
Se recomienda la administración de warfarina (u otro anticoagulante oral alternativo) en pacientes con FC y FA permanente, persistente o paroxística, siempre que no haya contraindicaciones para la anticoagulación. Una dosis ajus tada de anticoagulantes reduce el riesgo de complicaciones tromboembólicas, incluidos los accidentes cerebrovasculares.
3.2.2 Antiagregantes plaquetarios
Los antiagregantes plaquetarios no son efectivos como la warfarina en la reducción del riesgo de tromboembolismo en pacientes con FA.
En el análisis conjunto de dos estudios pequeños en que se comparó la warfarina y la aspirina en pacientes con FC, el riesgo de hospitalización por FC fue significativamente ma yor en el grupo de pacientes tratados con aspirina, compara do con el grupo asignado a warfarina.26,28
No hay evidencia de que los antiagregantes plaquetarios reduzcan el riesgo aterosclerótico en pacientes con FC.
3.2.3 Ácidos grasos Omega-3 poliinsaturados
Es razonable utilizar suplemento de la dieta como terapia adyuvante en pacientes con síntomas de clase NYHA II-IV y FCFER o FCFEP, a menos que esté contraindicado, para reducir el riesgo de muerte y hospitalizaciones cardiovasculares.121-122
Debe considerarse 1 g al día para la reducción en la mor bilidad y la mortalidad CV en pacientes con FC leve a grave y FE reducida.26
3.2.4 Nuevos fármacos
Inhibidor de Neprilisina y del Receptor de Angioten sina II (INRA). Conocido como INRA, LCZ696 (Sacubitril / Val sartan) es un inhibidor de Neprilisina y del Receptor AT1 de Angiotensina-II, cuya acción se basa en un doble mecanismo. No sólo bloquea la acción de la angiotensina II (proteína que provoca vasoconstricción y elevación de la presión arterial), sino que además bloquea la acción de la endopeptidasa neu tra llamada neprilisina, favoreciendo vasodilatación a través de disminución de presión arterial, reducción del tono simpá tico, disminución de niveles de aldosterona, menor fibrosis e hipertrofia y aumentando diuresis y natriuresis.
Fisiopatología
La neprilisina corresponde a una enzima encargada de la degradación de diversos péptidos vasoactivos como PN (ANP, BNP, CNP), la bradiquinina, angiotensina II, entre otros. La in hibición de esta enzima demostró favorecer la acumulación de algunos péptidos endógenos que promueven diuresis más pronunciada, atenuación de eje RAA, vasodilatación y por consiguiente reducción de la PA.123
Tabla 18 Tratamientos farmacológicos

ECA= Inhibidor de Enzima Convertidora de la Angiotensina; ARA II= Antagonista del Receptor de Angiotensina II; FE= Fracción Eyección; FC= Falla Cardíaca; ARM= Antagonista de Receptor de Mineralocorticoides; NYHA = New York Heart Association.
Tabla 19 Niveles de evidencia y otros tratamientos a considerar en pacientes con FCFER (NYHA clase II-IV)
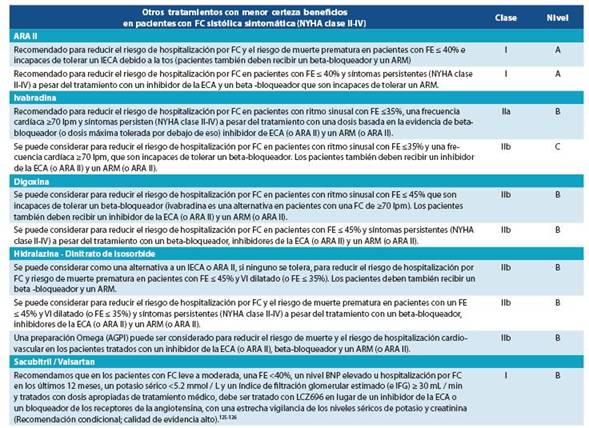
AGPI= Ácido Graso Poliinsaturado.
Sobre LCZ696 (Sacubitril / Valsartan)
LCZ696 es el primer medicamento de esta clase terapéu tica que se ha desarrollado. Es administrado por vía oral BID y contiene una relación molar 1:1 de sus dos componentes (Sacubitril / Valsartán). Su mecanismo de acción corresponde a reducción de la degradación de PNs a través del componen te sacubitril (AHU377), una prodroga que es posteriormente metabolizada al inhibidor activo de neprilisina (LBQ657). Adi cionalmente genera un bloqueo del receptor AT1 de angio tensina II a través de su segundo componente, valsartán.
Tras comprobar su eficacia y cumplir el objetivo pri mario, el estudio PARADIGM-HF se finalizó en plazo inferior a lo previsto. Esto se produce tras dos análisis previos que demostraron que el perfil de seguridad y tolerabilidad de LCZ696 era aceptable. Este estudio clínico aleatorizó 8 442 pacientes clase funcional II-III o IV de la Asociación del Cora zón de Nueva York (NYHA), con fracción de eyección menor o igual al 40% con niveles elevados de BNP o NT pro-BNP. Com paró la administración de LCZ696 200 mg BID vs. enalapril 10 mg BID para evaluar su efecto en el desenlace primario de muerte por causas cardiovasculares u hospitalizaciones por FC. Los pacientes fueron aleatorizados de 47 países.
Después de un seguimiento promedio de 27 meses y luego de realizar tres análisis interinos de seguridad y efica cia, el estudio se suspendió de forma prematura puesto que se demostró una disminución significativa del 20% en la mor talidad o en las hospitalizaciones a favor de LCZ696 (HR: 0,8; IC 0,73 - 0,89; p<0,001) y en cada uno de estos desenlaces de forma individual permitiendo calcular un número necesario a tratar (NNT) de 21 para prevenir un evento primario (muerte por causas cardiovasculares o primera hospitalización por empeoramiento de FCC) y de 32 para prevenir una muerte de origen cardiovascular.124
Concomitantemente demostró mejoría en calidad de vida, medido a través del Cuestionario de Cardiomiopatía de Kansas (KCCQ). El perfil de seguridad demostró un mayor número de pacientes con hipotensión arterial, sin diferencia estadística en el abandono de tratamiento por esta causa. Además, menor deterioro de la función renal, hipercalemia y tos que su comparador.125
Recomendamos que en los pacientes con FC leve a moderada, una FE <40%, un nivel BNP elevado u hospita lización por FC en los últimos 12 meses, un potasio sérico <5.2 mmol / L y un índice de filtración glomerular estimado (e IFG) ≥ 30 mL / min y tratados con dosis apropiadas de tra tamiento médico, debe ser tratado con LCZ696 en lugar de un inhibidor de la ECA o un bloqueador de los receptores de la angiotensina, con una estrecha vigilancia de los niveles séricos de potasio y creatinina (Recomendación condicional; calidad de evidencia alto).125-126
Resumen para el médico, con la estrategia de abordaje
El alivio de los síntomas, la mejora de la calidad de vida y el aumento de la capacidad funcional también son factores primordiales para los pacientes. Estos aspectos son difíciles de medir, pero en mente debe estar siempre el buen manejo farmacológico y las terapias complementarias que mejoran los resultados en general, disminuyendo la mortalidad y los riesgos de hospitalización.
El algoritmo mostrado en la figura 8 recoge una estra tegia de tratamiento para el uso de fármacos y dispositivos en FCFER.
En general recomendamos: tres antagonistas neurohor monales, un IECA, o ARA II, un beta-bloqueador y un anta gonista de aldosterona (ARM; Antagonistas de receptor de mineralocorticoides), ivabradina y LCZ696. Son todos de suma importancia a la hora de modificar la FC de tipo sistóli co y se les debe tener en cuenta en cada paciente.
IX. Comorbilidad y poblaciones especiales
Dentro de las comorbilidades más comunes podemos mencionar:26
1. Anemia
La prevalencia de la anemia aumenta con la gravedad de la FC, la edad avanzada, el sexo femenino, la enfermedad re nal y otras comorbilidades. En pacientes con FC, la anemia se asocia a una considerable disminución de la capacidad aeró bica, una sensación subjetiva de fatiga y peor estado funcio nal y una calidad de vida peor.
Se ha demostrado consistentemente que la anemia es un factor independiente de riesgo de ingresos hospitalarios y mortalidad.
Tabla de dosificación de carboximaltosa de hierro para pacientes con deficiencia de hierro asociada a ICC

Carboximaltosa de hierro debe administrarse únicamente por vía intravenosa, y no debe administrarse por vía subcutánea o intramuscular.
Una dosis única de carboximaltosa de hierro no debe superar los 1 000 mg de hierro (20 ml) al día. Máximo de 20 mg de hierro/Kg de peso corporal.
No administrar más de 1 000 mg de hierro (20 ml) por semana.
Para corregir depósito de ferritina: dósis única de 500 mg de carboximaltosa de hierro.
Las causas subyacentes más importantes son:
Hemodilución.
Disfunción renal.
Desnutrición.
Inflamación crónica.
Afección medular ósea.
Deficiente producción de Eritropoyetina.
Deficiencia de hierro.
Tratamiento farmacológico.
La anemia puede agravar la fisiopatología de la FC:
Efecto negativo en la función miocárdica.
Activa sistemas neurohormonales.
Afecta a la función renal.
Contribuye a la insuficiencia circulatoria. 127-131
2. Asma y enfermedad pulmonar obstructiva crónica (EPOC)
No existen datos de nuestra área, pero en un estudio de registro de pacientes con FC y comorbilidades, Asma y EPOC fueron 17% de los pacientes censados.
Enfermedad pulmonar obstructiva crónica
La EPOC es una comorbilidad frecuente en la FC y su pre valencia alcanza un 20-30%. Las anomalías pulmonares res trictivas y obstructivas son comunes.
Los pacientes con EPOC tienen un riesgo muy elevado de FC y la EPOC es un poderoso factor de riesgo independiente para la morbilidad y la mortalidad cardiovascular. La EPOC empeora el pronóstico de los pacientes con FC.
En la práctica clínica, la evaluación diagnóstica de la FC en presencia de EPOC es un desafío. Hay una importante su perposición de los signos y síntomas, con una sensibilidad relativamente baja de las pruebas diagnósticas como radio grafía de tórax, ECG, ecocardiografía y espirometría.
En estos pacientes, la evaluación de la concentración de PN (BNP o NT-proBNP) puede ser útil, aunque los resultados se suelen situar en valores intermedios. El valor predictivo ne gativo puede ser de más utilidad.
La mayoría de los pacientes con FC y EPOC pueden to lerar sin riesgos el tratamiento con beta-bloqueadores. Se recomienda la instauración del tratamiento a dosis bajas y aumentarlas gradualmente. El deterioro leve de la función pulmonar y de los síntomas no requiere la interrupción inme diata del tratamiento.
En caso de empeoramiento de los síntomas, podría ser necesario reducir la dosis o interrumpir el tratamiento. El uso de beta-bloqueadores selectivos es la opción preferida.
El antecedente de asma es una contraindicación para el uso de cualquier beta-bloqueador. Se administrarán nebuli zaciones con agonistas beta como se requiere en pacientes con EPOC.
La concomitancia de EPOC y FC puede reducir drásti camente la tolerancia al ejercicio. Puede ser aconsejable la realización de programas de rehabilitación supervisados para mejorar la función del músculo esquelético y la fatiga. 26,28,132
3. Diabetes mellitus (DM)
La DM es un importante factor de riesgo de que se de sarrolle enfermedad cardiovascular y FC. Los IECA y ARA son útiles para reducir el riesgo de daño en órganos terminales o llamados blanco, complicaciones cardiovasculares y el consi guiente riesgo de FC en pacientes con DM. 133-134
La DM es una comorbilidad frecuente en la FC que afecta al 20-30% de los pacientes. La DM tiene un impacto negativo en el curso natural de la FC, especialmente en pacientes con miocardiopatía isquémica. La DM y la enfermedad isquémica interactúan acelerando el deterioro de la disfunción miocár dica y la progresión de la FC y tienen una influencia desfavo rable en el pronóstico.
Aunque se ha establecido la relación entre elevadas con centraciones de glucosa y un riesgo de FC más alto en pacien tes con DM, no se ha demostrado de forma convincente un efecto beneficioso directo del tratamiento hipoglucemiante en la reducción del riesgo de FC.26-28
4. Depresión
Numerosos estudios han encontrado una asociación robusta entre los síntomas depresivos o la depresión mayor y un incremento en la morbilidad y la mortalidad cardíaca posterior a un SCA; sin embargo, también se ha reportado evidencia en contra. Debido a esta divergencia, la depresión aún no ha sido aceptada por la AHA como un factor de ries go para un mal pronóstico en pacientes con enfermedades cardiovasculares. Sin embargo en la práctica los pacientes con FC también se deprimen con frecuencia. La depresión se relaciona con un peor pronóstico en estos pacientes, es pecíficamente cuando su presencia es posterior al evento o se trata de un cuadro resistente al tratamiento. Los síntomas cognitivos y somáticos son indicadores de mal pronóstico, así como la presencia de ansiedad comórbida. El apoyo social es entonces de suma importancia.135-136
5. Disfunción eréctil
Hasta hace unos años, las enfermedades crónico-dege nerativas solo eran vistas desde la perspectiva estrictamente médica y no se les relacionaba con los posibles efectos que podrían tener en la vida y el desempeño sexual de las perso nas con alguno o varios de estos padecimientos.
Con el paso del tiempo y el advenimiento de medica mentos específicos para la disfunción eréctil (inhibidores de la fosfodiesterasa 5) se abrieron los espacios y la posibi lidad de conocer y divulgar, por cierto no suficientemente, los efectos de este tipo de enfermedades en la sexualidad de los pacientes.
Los problemas sexuales relacionados con la enfermedad cardiovascular, el tratamiento médico (bloqueadores beta) o con factores psicológicos como fatiga y depresión son fre cuentes en los pacientes con FC.
Hay poca evidencia sobre la influencia de la actividad se xual en el estado clínico de los pacientes con síntomas leves o moderados. Se ha observado un ligero aumento de riesgo de descompensación causado por la actividad sexual en pacien tes en clase funcional III-IV de la NYHA. Rara vez se presentan síntomas cardiovasculares, como disnea, palpitaciones o an gina durante la actividad sexual de pacientes que no sufran los mismos síntomas al realizar un ejercicio que requiera un esfuerzo moderado91. Se aconsejará al paciente el uso profi láctico de nitroglicerina sublingual contra la disnea y el dolor de pecho durante la actividad sexual.
Los inhibidores de la fosfodiesterasa 5 (PDE5, como sildenafilo) reducen las presiones pulmonares, pero ac tualmente no están recomendados para pacientes con FC avanzada. Nunca deben utilizarse en combinación con pre parados de nitratos.137-138
6. Hipertensión arterial
La hipertensión es un importante contribuyente a la FCA, sobre todo entre los pacientes de raza negra, las mujeres y las personas con FCFEP.139-142 En el registro ADHERE, casi el 50% de los pacientes ingresados con FC tenía la presión arterial > 140/90 mm Hg.141 El tratamiento de la hipertensión redu ce considerablemente el riesgo de FC. Por el momento no se han establecido los valores óptimos pero, según las guías de la ESH/ESC.142 La presión sanguínea debería reducirse:
Como mínimo, a menos de 140/90 mmHg (sistólica/ diastólica) o a valores más bajos si se tolera, en todos los pacientes hipertensos.
A < 130/80 mmHg en diabéticos y otros pacientes de alto riesgo, como pacientes con evidencia de daño orgánico importante (accidente cerebrovascular, infarto de miocardio, disfunción renal, proteinuria).
7. Cáncer
Las terapias contra el cáncer trabajan a través de una va riedad de mecanismos para destruir las células cancerosas. Aunque ha habido mejoras en el desarrollo de terapias diri gidas, estos tratamientos a menudo presentan efectos secun darios no deseados y posteriores daños en los órganos.
Mientras que algunas toxicidades se manifiestan en el inicio de la terapia, los demás pueden tener un curso más indolente. El tratamiento con quimioterapia es un riesgo independiente para el desarrollo de la enfermedad car diovascular y por lo tanto, estos pacientes deben ser con trolados cuidadosamente.
De hecho, los pacientes que reciben quimioterapia se consideran FC Estadio A según las guías (ACC / AHA).
No se cuenta con recomendaciones de gestión de con trol específico relacionado con la cardiotoxicidad inducida por quimioterapia.
La Sociedad Americana de Oncología Clínica (ASCO) in formó el potencial de toxicidad cardíaca con antraciclinas, la quimioterapia basada en platino y trastuzumab sin embargo, no proporcionan directrices específicas para la seguimiento y tratamiento de disfunción cardíaca.
Antes de iniciar el tratamiento, los pacientes en riesgo, deben someterse a una evaluación de línea de base por un oncólogo y el cardiólogo para la estratificación del riesgo. Monitoreo de los pacientes durante su tratamiento puede facilitar la intervención temprana con medicamentos cardio protectores143 o ajustes en el régimen de quimioterapia.
En general, la identificación temprana de las personas en situación de riesgo es esencial para limitar las complica ciones futuras. La colaboración entre el médico que valora al paciente, el oncólogo y el cardiólogo puede facilitar la mejor atención para los pacientes con cáncer.144
8. Obesidad y Trastornos Respiratorios durante el sueño (apnea del sueño)
Los pacientes que presentaban FC y obesidad (31 ± 4 kg/m2), lo que junto a la posible coexistencia de alte raciones respiratorias, puede justificar sus síntomas. Los pa cientes con FCFEP presentaron IMC más elevados, próximos a la obesidad (29,8 ± 5,1 kg) frente a los FCFER. Se ha descrito la relación entre obesidad y alteraciones cardíacas como hi pertrofia VI, dilatación de cavidades, disfunción diastólica y semiología de FC.145-147 La obesidad y su tratamiento pueden reducir los valores de PN.
La FC y los trastornos respiratorios durante el sueño son entidades que presentan una elevada prevalencia en la po blación general y es frecuente la presencia de ambas en un mismo paciente.
Diversos estudios epidemiológicos y fisiopatológicos indican que puede haber una relación causal entre dichos trastornos y el desarrollo del síndrome de FC, tanto asociada con la presencia de disfunción sistólica ventricular izquierda como en casos con función sistólica conservada.
La presencia de trastornos respiratorios durante el sue ño en enfermos con FC expone al sistema cardiovascular a hipoxemia intermitente, activación simpática y aumento de la precarga y poscarga ventricular que a su vez, ponen en marcha una serie de mecanismos inflamatorios, oxidativos y neurohumorales que pueden favorecer la progresión de la enfermedad. Aunque aún no disponemos de datos que de muestren que el tratamiento de los trastornos respiratorios durante el sueño en enfermos con FC, disminuye la morta lidad de esta población, diversos trabajos demuestran una mejoría significativa en distintos parámetros de estructura y función cardiovascular.
9. Insuficiencia renal crónica (IRC)
La IRC es un predictor común y potente de mortalidad en pacientes hospitalizados por FC, tanto con FCFEP como con FCFER. La presencia de IRC en este grupo de pacientes se aso cia con un perfil de riesgo cardiovascular más desfavorable, lo que sugiere que en la FC la enfermedad cardiovascular y renal discurren de forma paralela.148
El tratamiento con IECA atenúa el incremento de la mor talidad en presencia de disfunción renal.
Según estos hechos, debería incluirse la valoración de la función renal en la evaluación clínica de los pacientes con FC.
En presencia de IRC, podrían ser necesarias dosis más altas de diuréticos o agentes diuréticos combinados; lo que requiere frecuentes análisis de sangre para controlar de cerca al paciente.
Los pacientes con retención de líquidos recurrentes que son capaces de seguir instrucciones pueden aprender a ajus tar su dosis de diuréticos basado en los síntomas y cambios en el peso corporal al día.
En pacientes que reciben digoxina, debe medirse pota sio sérico y creatinina con los aumentos de dosis de digoxina o diuréticos, la adición o la suspensión de un fármaco que interactúa; o durante una enfermedad deshidratante (p.ej: diarrea) es necesario, para reducir el riesgo de toxicidad de la digoxinemias.
Los pacientes con función renal reducida o fluctuan te, los ancianos, las personas con bajo peso corporal y las mujeres están en mayor riesgo de toxicidad por digoxina y podría requerir más frecuentes monitoreos incluyendo los niveles de digoxina.
Los nitratos solos pueden ser útiles para aliviar la disnea o angina de pecho, su uso continuo debe evitarse, debido al riesgo del desarrollo de la tolerancia farmacológica.141
10. Enfermedad Arterial
La mayor parte de nuestro conocimiento mecanicista de la aterosclerosis se relaciona al desarrollo de placas ateros cleróticas, incluyendo la influencia de las LDL sobre la infla mación vascular, pero si lo queremos dirigir a la prevención primaria, rara vez se inician antes de que se presenten las pri meras complicaciones clínicas de aterosclerosis. En esta eta pa de la enfermedad, se sabe relativamente poco acerca de los procesos biológicos pertinentes contra el que pueden ser posible intervenir. El conocimiento de las causas de adelga zamiento de la capa fibrosa y ruptura de placa es incompleta y las principales lagunas permanecerán en nuestra compren sión de los mecanismos que conducen a trombosis de placas que aún no se han roto.149
Los enfoques a la promoción de la salud tales como: la promoción de la calidad de la dieta, cesación del ta baquismo, la actividad física y el control de peso, se de ben promover a través de la educación y la legislación.
Durante las últimas décadas, los niveles de los factores de riesgo se han incrementado.
El sistema puede ser mejorado considerablemente por el desarrollo de técnicas no invasivas para medir la actividad de la enfermedad aterosclerótica en personas asintomáticas que permiten recomendaciones para los hábitos de estilo de vida. De ahí que cuando se presentan los casos, es necesario acudir en forma pronta a estudios no invasivos.149
En la mayor parte de los registros publicados de FCA, la mortalidad hospitalaria oscila entre el 4 y el 7 % con la excep ción del ALARM-HF, en el que la mortalidad fue alta, hasta un 11 %, debido aparentemente al porcentaje comparativamen te superior de pacientes con shock carcinogénico (alrededor de un 12 % frente a < 4 % en el resto de los registros antes mencionados). La mediana de duración de la estancia en el hospital osciló entre 4 y 11 días.
La mortalidad en los 3 meses siguientes al alta fue de entre el 7 y el 11%, mientras que la mortalidad en el año si guiente al alta descrita en el registro ADHERE fue del 36%. La progresión de la FC en sí constituye la causa de la muerte en menos de la mitad de los pacientes.
Según los datos del ensayo EVEREST, el 41 % de los pa cientes con FCA fallece a causa de un agravamiento de la FC, un 26 % presenta muerte súbita y en el 13 % la muerte se produce como consecuencia de las comorbilidades no car diovasculares. Conviene resaltar que, aunque la mortalidad hospitalaria tiende a ser superior en los pacientes con una reducción de la FEVI en comparación con los que tienen una FEVI preservada, la morbilidad posterior al alta es similar en los 2 grupos.
La enfermedad coronaria es la causa en dos terceras par tes de los pacientes con FC, en especial en los casos de re ducción de la FEVI, mientras que la hipertensión arterial se observa en aproximadamente un 70% de los pacientes, sobre todo en los que tienen una FEVI preservada. En consecuencia, se espera que un tratamiento inmediato y eficaz de los facto res de riesgo de la aterosclerosis, la enfermedad coronaria y la hipertensión arterial limite la aparición de la FC.150
11. Enfermedad Inflamatoria Crónica
Regímenes de AINES en altas dosis se asocian con graves riesgos cardiovasculares y gastrointestinales, cuya gravedad varía de acuerdo con la extensión y duración de la inhibición de la COX-1 y COX-2 por el régimen escogido y para un régi men dado, es proporcional al riesgo basal de un paciente.151
La elección de la mayoría de regímenes analgésicos, adecuados para pacientes particulares con condiciones in flamatorias, se deben determinar después de una evaluación cuidadosa de su riesgos vascular y gastrointestinales y debe ser reevaluado después de un tiempo para contener el riesgo.
La escogencia de la terapia y la determinación precisa del riesgo cardiovascular y las complicaciones gastrointestinales en vías altas y bajas, varían de país a país, por el marco que da cada sistema de salud.
En general, el consejo actual es que los AINES se deben tomar a la dosis eficaz más baja durante el menor tiempo po sible para minimizar estos riesgos.151
12. Hiperuricemia / Gota
Los pacientes con FC son propensos a la hiperuricemia como resultado del tratamiento con diuréticos de ASA y la disfunción renal.
En la tabla 20 se presenta un resumen de las comorbili dades más frecuentes observadas en CA y Caribe, en pacien tes con FC descritas por los participantes.
En la FC, la hiperuricemia se asocia a un mal pronóstico. En los ataques agudos de gota, se considerará la adminis tración de un ciclo corto de colchicina para aliviar el dolor y la inflamación.
Siempre que sea posible se evitará el uso de AINES en pacientes sintomáticos. Se recomienda el tratamiento profiláctico con un inhibidor de la xantina oxidasa (alopuri nol) para prevenir
recurrencias. Considerar el alopurinol en pacientes con gota sintomática, administrar colchicina para aliviar el dolor. Evitar los AINES.26,151
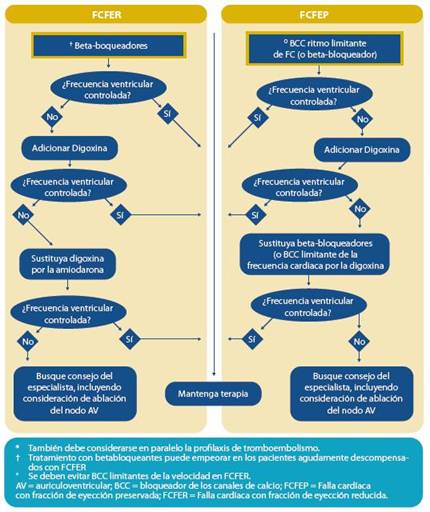
Figura 9 Recomendaciones para controlar la frecuencia ventricular en pacientes con FC y Fibrilación Atrial persistente/permanente y sin evidencia de descompensación aguda26
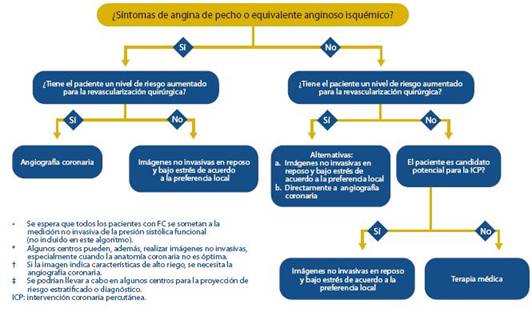
Figura 10 Flujograma para el abordaje de la evaluación de la Enfermedad Arterial Coronaria en pacientes con FC
Evaluación de la enfermedad coronaria en pacientes con FC de cuyas arterias coronarias se desconoce el estado (Figura 10)
FCFEP es un síndrome común en Latinoamérica y la prin cipal etiología es heterogénea de acuerdo a cada país y se encuentra bajo la influencia del nivel socioeconómico.
La hipertensión arterial y la enfermedad de las arterias coronarias son las principales causas. En general, el cumpli miento de las directrices es baja en la práctica clínica, excepto en algunos países y en centros seleccionados.
Recomendaciones generales:
No se recomienda la realización sistemática de coro nariografía. Pacientes con bajo riesgo de enfermedad co ronaria: Los resultados de las pruebas no invasivas pueden determinar la indicación posterior de angiografía (ECG de esfuerzo, ecocardiografía de estrés, gammagrafía de perfusión miocárdica).16), (26
Angiografía coronaria Se recomienda en pacientes con alto riesgo de enfermedad coronaria para establecer el diagnóstico y planificar la estrategia de tratamiento, siempre que no esté contraindicada.75
Detección de miocardio viable La detección de miocardio viable como objetivo de la revascularización debe considerarse en el proceso diagnóstico de los pacientes con FC y enfermedad coronaria.
Se pueden utilizar varias técnicas de imagen con una precisión diagnóstica similar para la detección de miocardio disfuncional pero viable (ecocardiografía con dobutamina, imagen nuclear con SPECT o PET, RM con dobutamina y/o medios de contraste, TC con medios de contraste).152
3. Revascularización en pacientes con FC
En algunos pacientes con FC y enfermedad coronaria se considerará la indicación de bypass aortocoronario (CABG) o intervencionismo coronario percutáneo (ICP). La elección del método de revascularización debe basarse en la evaluación exhaustiva de la comorbilidad, en el riesgo del procedimien to y la anatomía coronaria, en la evidencia de la extensión de miocardio viable en el área a revascularizar, función ventricu lar izquierda y en la presencia de valvulopatía hemodinámi camente significativa.75 (Figura 11)
4. Marcapasos
Las indicaciones convencionales para pacientes con la función ventricular izquierda normal se pueden apli car también a los pacientes con FC. En pacientes con FC y ritmo sinusal, puede ser importante el mantenimiento de una respuesta cronotrópica normal y la coordinación de la contracción auricular y ventricular mediante un marcapasos bicameral (DDD).
En pacientes con FC e indicación concomitante de mar capasos permanente (primer implante o sustitución de mar capasos convencional), con síntomas de clase funcional II-IV de la NYHA, con una FEVI baja (≤ 35%) o dilatación ventri cular izquierda, se considerará la terapia de resincronización cardíaca mediante la implantación de un marcapasos biven tricular (TRC-P). En estos pacientes, el uso de marcapasos ventricular derecho puede ser perjudicial y puede causar o aumentar la desincronización.26,28,153
En la figura 12 presentamos la guía de referencia para la terapia con dispositivos en pacientes con FCC y la ta bla 21 muestra un detalle de los pacientes potencialmen te elegibles para la implantación de un dispositivo de asistencia ventricular.
5. Terapia de resincronización cardíaca
Se recomienda la TRC-P en pacientes en clase funcio nal III-IV de la NYHA que permanecen sintomáticos a pesar de tratamiento médico óptimo y que tienen una fracción de eyección disminuida (FEVI ≤ 35 %) y prolongación QRS (an cho QRS ≥ 130 mseg) para reducir la morbimortalidad.
La TRC se utiliza para sincronizar la contracción inter ventricular e intraventricular en pacientes con FC en los que hay evidencia de desincronización eléctrica (ancho QRS ≥ 130 mseg). En relación con la selección de pacientes, varios estudios monocéntricos observacionales indican que la determinación de uno o más parámetros de desincroni zación mecánica identificaría a los pacientes en que la TRC sería beneficiosa. Aunque se han implantado dispositivos de TRC en pacientes sin evidencia electrocardiográfica de des incronización (ancho QRS < 130 mseg) y en función de los hallazgos ecocardiográficos, no hay evidencia que respalde esta práctica.
Tabla 21 Pacientes potencialmente elegibles para la implantación de un dispositivo de asistencia ventricular.26

IC= índice cardíaco; FC= falla cardíaca; I.V.= intravenosa; FEVI = fracción de eyección de ventrículo izquierdo; PEAP =presión enclavada en arteria pulmonar; PAS = presión arterial sistólica; VO2= volumen máximo de consumo de oxígeno.
6. Desfibrilador automático implantable (DAI)
Se recomienda la implantación de un DAI para la pre vención secundaria en pacientes que han sobrevivido a fibrilación ventricular (FV) y en pacientes con taquicardia ventricular (TV) documentada y hemodinámicamente inesta ble y/o TV con síncope, una FEVI ≤ 40%, tratamiento médico óptimo y una expectativa de vida con buen estado funcional > 1 año.26,28
7. Trasplante cardíaco
El trasplante cardíaco es el tratamiento aceptado para la FC terminal. Aunque no se han realizado estudios contro lados, hay consenso en que el trasplante, comparado con el tratamiento convencional y siempre que se apliquen criterios adecuados de selección, aumenta significativamente la super vivencia, la capacidad de ejercicio, la reincorporación laboral.
En la tabla 22 se presenta un resumen de las indicaciones y contraindicaciones de trasplante cardíaco.
8. Cuidados paliativos en pacientes con FC
Los pacientes con las características clínicas de FC avanza da que continúan con síntomas a pesar de recibir tratamiento óptimo basado en la evidencia, tienen un mal pronóstico a corto plazo y deben ser considerados para un tratamiento pa liativo estructurado. Se atenderán los síntomas psicológicos, como la ansiedad.
La FC avanzada tiene una reducida tasa de superviven cia al año y su pronóstico es peor que en la mayoría de las formas de cáncer. Sin embargo los pacientes con FC en fase terminal no son referidos a la unidad especializada de cuida dos paliativos.
La FC tiene un curso impredecible y normalmente es di fícil identificar el momento en que se deben iniciar los cuida dos paliativos.
Las intervenciones médicas deben centrarse en mejorar la calidad de vida, controlar los síntomas, la detección tem prana y el tratamiento de los episodios de deterioro, siguien do una estrategia holística que considere el bienestar del paciente, desde el punto de vista:
En una estrategia de atención compartida, el equipo de cuidados paliativos y el equipo de FC o el médico de atención primaria, deben coordinar sus esfuerzos y atender de forma óptima a las necesidades del paciente.
El equipo idealmente contará con:
Coordinador
Médico general
Cardiólogo
Personal de enfermería
Médico de cuidados paliativos
Psicólogo / psicoterapeuta
Fisioterapeuta
Nutricionista
Consejero espiritual.
Aunque el pronóstico y la gravedad de los síntomas pue den variar, los componentes esenciales de un programa de cuidados paliativos eficiente son similares a los que se inclu yen en los programas de manejo de la FC.26
Se consideran pacientes elegibles para cuidados paliativos:
Admisión frecuente en el hospital u otros episodios graves de descompensación a pesar del tratamiento óptimo.
Se descartó trasplante de corazón y apoyo mecánico circulatorio.
Mala calidad crónica de vida, con síntomas NYHA clase IV.
Caquexia cardíaca / albúmina sérica baja.
Dependencia en la mayoría de las actividades de la vida diaria.
Es considerado clínicamente como que se encuentra cerca del final de la vida.
Conclusiones:
Dada la falta de información regional, es necesario llevar un registro de pacientes.
FC avanzada y la descompensación aguda de FCC es el síndrome cardiovascular más costoso en el campo de la medicina.
Para optimizar las indicaciones de terapia, se ha hecho el 1er Consenso Centroamericano y El Caribe de Sociedades de Cardiología para el Diagnóstico y Manejo de la Falla Cardíaca, en el que llegamos a la conclusión que:
Se debe individualizar tratamiento del paciente.
Se debe considerar el manejo de FC en un Programa multidisciplinario para reducir la morbilidad y la mortalidad.
El tratamiento y el diagnóstico precoz mejora el pronóstico de los pacientes con FCA.
Después de la compensación con IECA, no olvidar el manejo a largo plazo, para evitar las recurrencias y mejorar el pronóstico de la FC.
Resumimos en las tablas 23 y 24 los conceptos de mayor interés en la práctica clínica.26,28,155-157
Tabla 23 Aspectos fundamentales en la educación del paciente con las habilidades necesarias y comportamientos adecuados de autocontrol.

Tabla 24 Resumen de conceptos relevantes: ¿cómo hacer seguimiento, qué observar, cuándo y por qué referir al cardiólogo los pacientes?
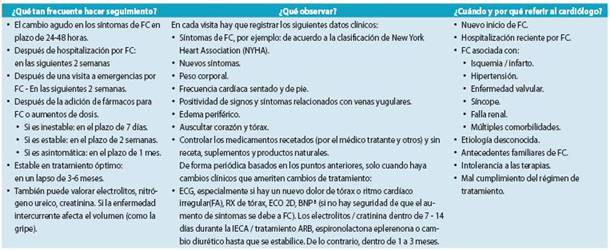
4. Implementación
Las Sociedades de Cardiología Nacionales se encargaran de la difusión y la capacitación para la implementación de registro en cada país.
A los médicos involucrados en el tratamiento de la FC que acepten usar el registro, se les asignara un código de acceso para su uso.
Se hará una revisión trimestral del registro para obtener cortes parciales de los datos recogidos.
Se plantea como meta presentar los datos preliminares obtenidos por el registro en el Consenso de Centroamericano y del Caribe de Cardiología a tener lugar en agosto del 2016.
Conflicto de Intereses
La Doctora Alexandra Paulino ha sido investigadora y Advisor Board de la compañía Novartis Farmacéutica. El Doc tor Baldomero ha sido consultor, Investigador y presentador de: Stendhal, Astra Zeneca, Sanofi, Servier, Lilly, Merck, MSD, Novartis. La doctora Iris Beatriz Rodriguez ha sido consultora Advisor Board de la compañía Astra Zeneca. El resto de par ticipantes no ha declarado ningún conflicto de intereses. Los doctores Ricardo Iglesias y Luis Echeverría participaron como revisores independientes del presente documento.
Este primer Consenso Centroamericano y El Caribe de Sociedades de Cardiología para el Diagnóstico y Manejo de la Falla Cardíaca ha sido posible gracias a la iniciativa de la Asociación Costarricense de Cardiología (ASOCAR), agradecemos a su presidente Dr. Luis Fernando Valerio, también agradecemos el patrocinio sin restricciones de la empresa Novartis y finalmente a EDU-Pharma por el apoyo científico brindado para la elavoración de este documento. Ninguna de las opiniones incluidas en este documento fue influenciada por ninguna de las dos empresas.