Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Costarricense de Cardiología
versão impressa ISSN 1409-4142
Rev. costarric. cardiol vol.9 no.1 San José Jan. 2007
Ablación con radiofrecuencia de fibrilación atrial y taquicardias atriales izquierdas. Reporte de los primeros casos realizados en Costa Rica
Dra. Vivien Araya Gómeza, Dr. Oswaldo Gutiérrez Sotelob, Dr. Mario Gonzálezc, Dr. Mohammad Abed R.d
a. Cardióloga - Electrofisióloga, Coordinadora de la Clínica de Arritmias y Sala de Electrofisiología del Hospital Clínica Bíblica, San José, Costa Rica. Tel. (506) 221-29-21. vivien@ice.co.cr.
b. Cardiólogo – Electrofisiólogo, Clínica de Arritmias y Sala de Electrofisiología del Hospital Clínica Bíblica, San José, Costa Rica. Cardiólogo Hospital México, San José, Costa Rica. Profesor de medicina, Universidad de Costa Rica
c. Cardiólogo - Electrofisiólogo, Jefe del Servicio de Electrofisiología, Penn State Milton S. Hershey Medical Center. Penn State Heart & Vascular Institute. EEUU
d. Anestesiólogo, Hospital Clínica Bíblica, Hospital México, San José, Costa Rica.
Resumen
El objetivo de este reporte es presentar los primeros casos de fibrilación atrial que han sido tratados en Costa Rica mediante ablación con radiofrecuencia. Se trata de 3 hombres de 54, 55 y 50 años de edad, el primero con disfunción sinusal y corazón estructuralmente normal, el segundo hipertenso arterial y el tercero portador de miocardiopatía hipertrófica septal asimétrica no obstructiva. Los atrios izquierdos midieron 41, 48 y 47 mm respectivamente. La forma de presentación de la arritmia fue paroxística en los 3 casos, muy repetitiva a pesar de tratamiento médico. Se realizó abordaje del atrio izquierdo en busca de potenciales de venas pulmonares las que indican la presencia de focos ectópicos de activación anormal, sitios en los que se aplicó radiofrecuencia. En 2 pacientes se documentó además flúter atrial común, que fue también eliminado al aplicar radiofrecuencia en el istmo cavo-tricuspídeo. Los pacientes toleraron bien el procedimiento y no hubo complicaciones. Los 3 han permanecido libres de arritmia a 30 días del procedimiento.
Palabras clave: fibrilación atrial, flúter, ablación, radiofrecuencia, potenciales de venas pulmonares.
Abstract
We present the first 3 cases of atrial fibrillation treated by radiofrequency ablation in Costa Rica. They were males, 54, 55 and 50 years of age, the first had sinus node dysfunction and a normal structured heart, the second was hypertensive and the third had non-obstructive asymmetric septal hypertrophy. The left atrium measured 41, 48 and 47 mm respectively. Their presentation was one of paroxistic and repetitive arrhythmias, even under pharmacological treatment. We accessed the left atrium searching for pulmonary vein potentials, which indicate the presence of ectopic foci of activation, and radiofrequency was applied. In 2 cases we also documented atrial flutter that was successfully treated with ablation at the cavo-tricuspid isthmus. The patients tolerated the procedures well and they all are arrhythmia free 30 days after the intervention.
Key words: atrial fibrillation, flutter, ablation, radiofrequency, pulmonary vein potentials.
Introducción
La fibrilación atrial (FA) es la taquiarritmia sostenida más común en la práctica clínica, tanto en la consulta cardiológica como en la de medicina interna, la de medicina familiar y la geriátrica. Su prevalencia tiende a aumentar conforme avanza la edad1 y usualmente acompaña otras enfermedades cardiovasculares concomitantes, pero también se presenta en individuos jóvenes, especialmente en su forma paroxística. Aunque la FA no amenaza inmediatamente la vida, puede causar complicaciones serias como los eventos vasculares cerebrales. En los últimos años ha sido necesario hacer cambios en el manejo de esta arritmia: hasta hace poco su tratamiento fue muy conservador, ya que se tenía la idea de que era una arritmia relativamente benigna. Sin embargo, el concepto de que la FA genera más FA, creando una serie de desenlaces desfavorables, ha hecho que las estrategias actuales de manejo sean más agresivas para su reversión dentro de lo posible, a ritmo sinusal (RS), para el control de la respuesta ventricular aunado a la anticoagulación oral crónica.
Dentro de los tratamientos no farmacológicos para mantener el RS tenemos los procedimientos quirúrgicos, los que fueron los primeros en emplearse2, y la ablación con radiofrecuencia por medio de catéter, técnica actualmente más utilizada, cuyo mejor resultado se obtiene cuando se detecta un solo foco de origen en las venas pulmonares, hallazgo más frecuente en pacientes con FA paroxística, tal como es el caso de estos primeros pacientes que tratamos en nuestro país.
Casos clínicos
Caso 1
Hombre de 54 años de edad, atleta, con crisis de taquicardias desde 3 años antes y sensación de pulso irregular, documentado en su reloj de monitoreo de frecuencia cardiaca. En el registro electrocardiográfico de Holter de 24 horas se encontró bradicardia sinusal, pausas sinusales no significativas, extrasístoles supraventriculares muy frecuentes y colgajos de taquicardia atrial no sostenida. Las dimensiones por ecocardiograma fueron (en mm) DDVI=553, SIV=11, PP=99, VD=21, AI=41 y la fracción de eyección, 62%. El eco-estrés no mostró isquemia. Posteriormente se documentó flúter atrial paroxístico, motivo por el cual se le planteó la ablación con radiofrecuencia, intervención que se realizo hace un año, pero la arritmia recurrió 3 tres meses después. Se decidió reiniciar los medicamentos antiarrítmicos, pero la propafenona, no controló los síntomas y la amiodarona, empeoró la disfunción sinusal (bajo gasto y falla cardiaca), se implantó entonces un marcapaso permanente bicameral. El cuadro se estabilizó y se pudo reiniciar el medicamento antiarrítmico. En registros de Holter posteriores se documentaron episodios de FA paroxística, a pesar del tratamiento con amiodarona. Se recomendó y realizó una nueva ablación (27/V/2007). Un mes antes se inició anticoagulación con warfarina, manteniendo el INR de 2 a 3 y 3 días antes del procedimiento fue sustituido por enoxaparina subcutánea hasta la noche previa. Los antiarrítmicos fueron suspendidos 10 días antes y en la semana anterior se realizó un ecocardiograma transesofágico para descartar la presencia de trombos en la orejuela del atrio izquierdo, lo cual contraindicaría el procedimiento
Metodología de la ablación. Mediante la punción venosa femoral bilateral, yugular interna derecha y punción arterial femoral izquierda, utilizando la tecnica de Seldinger se introdujeron múltiples catéteres intracardiacos bajo control fluoroscópico. Un catéter tetrapolar fue alojado en el ápex del ventrículo derecho para su registro y estimulación, otro en la unión atrioventricular (AV) para obtener el hisiograma, otro en el atrio derecho para su registro y estimulación y un catéter decapolar en el seno coronario, con el mismo fin. Se realizó estimulación ventricular y atrial, tanto asincrónica como programada, utilizando un amperaje igual al doble del valor umbral. Las diferentes pruebas de estimulación fueron realizadas con un estimulador multiprogramable Medtronic (Mn, EEUU). La exploración fue realizada bajo sedación consciente con propofol. Posteriormente se realizó una punción transseptal desde el atrio derecho al izquierdo con una aguja de Brockenbrough (St. Jude Medical, CA, EEUU) y se colocaron 2 introductores largos SL1 para el paso de un catéter decapolar circular lasso® (Biosense-Webster, EEUU) y de un catéter de ablación irrigado tetrapolar thermocool® (Biosense-Webster, EEUU). Para el mapeo del flúter se utilizó un catéter halo® (Biosense-Webster, EEUU) y para ablación en el istmo cavo-tricuspídeo, se utilizó un introductor SL3 y un catéter de ablación thermocool® (Biosense-Webster, EEUU) con punta de 8 mm. Se utilizó un equipo emisor de radiofrecuencia Stockert® de hasta 70 W de potencia (Biosense-Webster, EEUU), con control de temperatura, potencia e impedancia.
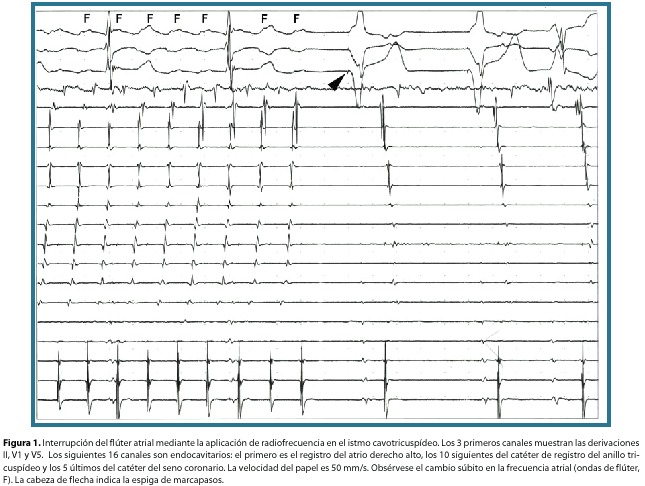
Hallazgos. Al inicio del estudio se documentó un flúter atrial típico con conducción AV variable 3:1 ó 4:1. Se confirmó el circuito del mismo mediante mapeo del anillo tricuspídeo y por técnica de encarrilamiento (del inglés entrainment) en el istmo cavo-tricuspídeo, sitio en el cual se aplicó radiofrecuencia, deteniéndose la arritmia desde los primeros segundos de aplicación, pasando a ritmo sinusal estable (figura 1). Se confirmó la línea de bloqueo mediante estimulación desde el seno coronario.
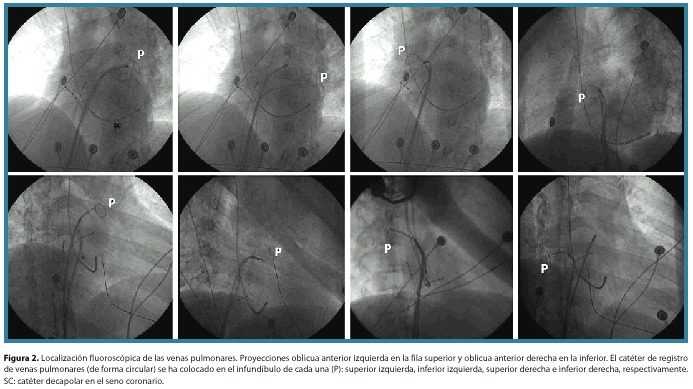
Seguidamente se realizó un mapeo de las 4 venas pulmonares mediante control fluoroscópico (figura 2) y ablación en el antro de cada una, guiada por la presencia de potenciales de venas pulmonares (PVP). Las aplicaciones se mantuvieron hasta lograr la pérdida de los potenciales de las mismas o bien hasta crear aislamiento eléctrico de cada una de las venas manifestado por disociación de los PVP (figura 3). Se aplicó radiofrecuencia un promedio de 3 minutos en cada vena y energía de 10 a 30 watts con control de impedancia. El paciente se mantuvo en ritmo sinusal hasta el final del procedimiento y no se logró reinducir ningún tipo de arritmia atrial con estimulación atrial rápida y programada luego del procedimiento. Se indicó continuar la anticoagulación y antiarrítmicos por un mes luego de la intervención.

En conclusión, el paciente tenía flúter típico recurrente sintomático y episodios paroxísticos de FA exitosamente ablacionados con bloqueo del istmo cavotricuspídeo y aislamiento de venas pulmonares.
Caso 2
Paciente masculino de 55 años de edad, hipertenso de 15 años de evolución, en tratamiento con irbesartan 300 mg/d y atenolol 50 mg bid. A los 30 años de edad presentó la primera crisis de FA documentada, aislada y luego crisis esporádicas cada 5 años, generalmente en relación con episodios de estrés emocional importante y se le agrego digoxina. Durante los últimos 2 años las crisis fueron más frecuentes y prolongadas. Las dimensiones por ecocardiograma fueron (en mm): DDVI:48, DSVI:31, SIV y PP:12, AI:48 y fracción de eyección de 65%; la prueba de esfuerzo fue negativa por isquemia. Se sustituyó la digoxina por amiodarona, con lo cual inicialmente disminuyeron los episodios pero en el último año reaparecieron a pesar del tratamiento y desarrolló hipersensibilidad a la amiodarona, ésta se reemplazó por propafenona, pero las crisis aumentaron. Se planteó la posibilidad de ablación con radiofrecuencia, procedimiento que se llevó a cabo el 27/V/2007. Las indicaciones previas al procedimiento y la metodología fueron similares al caso anterior.
Hallazgos. Los Intervalos de conducción al inicio del estudio en ritmo sinusal fueron normales. Se realizó el mapeo de las venas pulmonares y ablación en el antro de cada una, guiada por la presencia de PVP. Las aplicaciones se mantuvieron hasta encontrar pérdida de los potenciales o bien hasta crear un aislamiento de cada una de las venas manifestado por disociación del PVP. Posteriormente se indujo FA mediante estimulación atrial asincrónica rápida y se realizó nuevamente mapeo y ablación durante la FA. El tiempo de aplicación fue 3 minutos en cada vena, con energía entre 10 y 30 watts, bajo control de impedancia. Al final del procedimiento se cardiovirtió eléctricamente, quedando el paciente en ritmo sinusal. No hubo complicaciones.
Caso 3
Hombre de 50 años de edad, con crisis de palpitaciones frecuentes desde hacía 5 años. En una evaluación inicial se documentó un episodio de flúter atrial, el cual desapareció con cardioversión eléctrica; se mantuvo con amiodarona por 6 meses y al suspenderla, presentó recurrencias esporádicas. Durante los últimos 3 años ha presentado crisis de taquicardia atrial y luego FA documentadas. Se reinició tratamiento con amiodarona sin mayor cambio. El ecocardiograma de esfuerzo fue negativo por isquemia y mostró dimensiones (en mm) de: DDVI:=48, DSVI=35, SIV:14, PP:10, AI:47 y fracción de eyección de 55%; las presiones pulmonares estaban en límites altos normales; había hipertrofia septal asimétrica de tipo no obstructivo, regurgitación mitral y aórtica ligera a moderada de tipo degenerativo. Ante la recurrencia de la FA, cada vez más frecuente, prolongada y con alta respuesta ventricular, se decidió anticoagular al paciente con warfarina, se aumentó la dosis de amiodarona a 200 mg bid y se agregó diltiazem (180 mg/d). Se le planteó entonces la ablación con radiofrecuencia (2 años antes), y se realizó el 28/V/2007. Las indicaciones previas al procedimiento y la metodología son similares al primer caso.
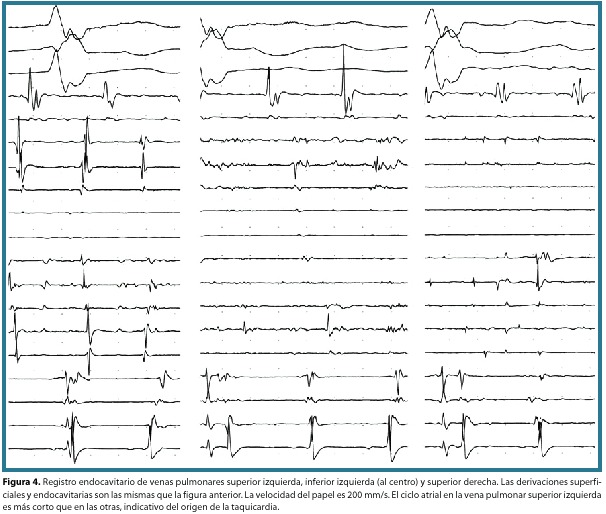
Hallazgos. Se estableció taquicardia atrial de diferentes focos tanto del atrio izquierdo como del derecho, por la secuencia de activación atrial y ciclo de la taquicardia variables (figura 4). Se documentó la presencia de potenciales de bajo voltaje sugestivo de daño difuso del tejido atrial (remodelado anatómico y eléctrico). Se realizó mapeo de las venas pulmonares y ablación en el antro de cada una, guiada por la presencia de PVPs pulmonares. Se amplió la aplicación de la RF en diferentes puntos en el atrio izquierdo. Posteriormente se presentó flúter atrial típico de activación antihoraria, por lo que se procedió a realizar mapeo del anillo tricuspídeo, aplicándose radiofrecuencia en el istmo tricuspídeo, lográndose un cambio en el patrón de activación atrial, quedando remanente la taquicardia atrial del lado izquierdo; se volvió a mapear el atrio izquierdo y se hicieron nuevas aplicaciones de radiofrecuencia. Se buscaron potenciales en la vena cava superior derecha y en el seno coronario, sin encontrarlos. Al final se realizó cardioversión eléctrica y se egresó al paciente en ritmo sinusal. No hubo complicaciones del procedimiento. Sus diagnósticos finales fueron taquicardia atrial de focos múltiples a nivel de atrio izquierdo, flúter atrial típico con activación antihoraria, ablación con radiofrecuencia de potenciales de venas pulmonares con aislamiento del antro y del flúter atrial.
Discusión
El mecanismo exacto de la FA aún está en investigación, sin embargo lo que actualmente sabemos es que hay varios factores implicados y no uno solo, tal como lo demuestran las diferentes técnicas de ablación de esta arritmia. Algunos investigadores concuerdan en que el principal mecanismo en la FA, al igual que muchas otras arritmias, es la reentrada y en este caso, podría tratarse de múltiples circuitos de microreentrada3, favorecidos por alteraciones atriales anatómicas y electrofisiológicas (por ejemplo el acortamiento de periodos refractarios observado por cambios en el tono vagal).
Otros investigadores como Pachón en Brasil4 refutan la teoría de la microreentrada y más bien sugieren que puede ser causada por actividad disparada independiente desde varios "nidos de FA". Estudios anatomopatológicos en pacientes con FA han demostrado pérdida del músculo contráctil atrial e incremento del tejido fibroso; en ocasiones estos cambios son primarios y son los que han generado la FA, pero a veces son secundarios a la misma arritmia (miocardiopatía atrial por taquicardia y remodelado eléctrico debidos a la FA persistente), por lo cual se dice que la "FA genera más FA". Cuando tales cambios son secundarios, es un hecho que se pueden prevenir manteniendo el itmo inusal.
Se ha propuesto también la existencia de focos ectópicos como generadores de FA5. En algunos individuos se han identificado principalmente cerca de las venas pulmonares superiores en el atrio izquierdo, lo cual ha hecho posible que en esos casos, la arritmia sea susceptible de tratamientos no farmacológicos como ablación o cirugía. Los trastornos que producen incremento de volumen y de presión en el atrio izquierdo (hipertensión arterial, valvulopatía mitral) favorecen la activación de estos focos automáticos, que inicialmente producen FA paroxística, pero que luego, con el remodelado anatómico y eléctrico, se convierte en FA persistente. O sea que al inicio (FA paroxística) lo que existe son factores "gatillo" que inician los episodios, por ejemplo, focos en venas pulmonares o "nidos de FA"; generalmente en estos casos hay muchas extrasístoles atriales antes del inicio del episodio con ciclos corto-largo y son episodios autolimitados, de corta duración, a veces post-ejercicio o estrés; posteriormente, la misma recurrencia de la arritmia o los otros factores asociados crean una alteración anatómica (sustrato) que la hace permanente6. Lo ideal sería no dejar evolucionar al paciente hasta que se establezca ese sustrato anatómico.
Debido a estos diferentes mecanismos, las técnicas de ablación varían de acuerdo al tipo de FA4,7,8. Por ejemplo, en la FA paroxística básicamente lo que se hace es un aislamiento de cada una de las venas pulmonares en su antro, a veces se encuentran focos también en la vena cava superior. Estos sitios arritmogénicos tienen que ver con el desarrollo embrionario de los tejidos cardiacos, el sistema eléctrico y remanentes anormales. La FA permanente es más compleja para curar con ablación debido al remodelado anatómico y eléctrico que señalamos anteriormente, razón por la que generalmente se utilizan técnicas combinadas, es decir producir lesiones lineares en el atrio (semejantes a las de la cirugía de Maze), aislamiento de las venas pulmonares, aislamiento de la vena cava superior, ablación septal izquierda y ablación en sitios atriales de electrogramas complejos fraccionados. También se ha postulado que se puede aumentar la efectividad del procedimiento mediante la denervación vagal por ablación de los plexos gangliónicos debido a que en muchos pacientes con FA existe hiperactividad en esas estructuras9. Recientemente se publicó un estudio del grupo del Dr. Pappone en Milán10 sobre la ablación circunferencial de las venas pulmonares para la FA crónica; ellos reportan un 70% de éxito con esta técnica, sin embargo, un tercio de los pacientes requirieron una segunda ablación para aumentar ese porcentaje.
Las posibles complicaciones de este procedimiento incluyen derrame pericárdico, taponamiento cardiaco, accidente vascular cerebral, isquemia cerebral transitoria, fístula atrio-esofágica, estenosis de venas pulmonares y taquicardia atrial incisional10. De todas ellas, la más temida es la estenosis de venas pulmonares, lo que causa hipertensión pulmonar de muy difícil manejo; afortunadamente esta complicación es muy rara pues en la actualidad ya no se hace la ablación dentro de la vena como al principio, sino que se hace en el antro, con lo cual se evita este problema. La fístula atrio-esofágica es una complicación fatal, es más frecuente en las FA crónicas en las que se requiere producir lesiones lineales del atrio; hoy se sabe que esta grave lesión es menos factible si se utiliza no más de 30 watts de energia en dichas zonas.
A diferencia de la aguda, la FA crónica es un terreno en donde todavía falta experiencia en su manejo con ablación y cada caso debe ser individualizado. Por ejemplo, algunos pacientes de edad avanzada y con FA crónica de difícil manejo con antiarrítmicos, podrían beneficiarse solo con ablación del nodo AV con colocación de marcapaso permanente y anticoagulación crónica11.
La ablación con radiofrecuencia de la FA es una terapia de segunda línea para el paciente que no ha sido posible controlarlo con fármacos. El candidato ideal para este procedimiento es el paciente joven (menor de 65 años), con FA paroxística (mecanismo de "gatill " focal en venas pulmonares), con cardiopatía mínima (atrio izquierdo menor de 45-50 mm), con fracaso de uno o 2 antiarrítmicos o en quien estén contraindicados y que su arritmia sea muy sintomática o mal tolerada. En estos casos la efectividad del procedimiento es aproximadamente entre 75% y 80%.
Hoy día con el mejor conocimiento de los mecanismos fisiopatológicos implicados en la génesis de esta arritmia, principalmente el remodelado atrial, es posible tomar medidas tendientes a su prevención, tanto primaria como secundaria12.
Referencias
1. Falk Rodney H, Atrial Fibrillation. In: Podrid P, ed.Cardiac Arrhythmia Mechanisms, diagnosis, and management. Baltimor Maryland: William & Wilkins ed, 1995; 803-827. [ Links ]
2. Cox JL. The surgical treatment of atrial fibrillation. J Thorac Cardiovasc Surg 1991; 101 596-574. [ Links ]
3. Mandapati R, Skanes A, Chen J y col. Stable microreentrant sources as a mechanism of atrial fibrillation in the isolated sheep heart. Circulation 2000; 101: 194-199. [ Links ]
4. Pachon M JC, Pachon M EI, Pachon M JC, Lobo TJ, Pachon MZ, Vargas RN y cols. A new treatment for atrial fibrillation based on spectral analysis to guide the catheter RF-ablation. Europace 2004; 6: 590-601. [ Links ]
5. Chen YJ, Chen SA. Electrophysiology of pulmonary veins. J Cardiovasc Electrophysiol 2006; 17: 220-224. [ Links ]
6. Hobbs WJ, Fynn S, Todd DM, Wolfson P, Galloway M, Garratt CJ. Reversal of atrial electrical remodeling after cardioversion of persistent atrial fibrillation in humans. Circulation. 2000; 101(10): 145-551. [ Links ]
7. Fisher JD, Spinelli MA, Mookherjee D, Krumerman AK, Palma EC. Atrial fibrillation: reaching the mainstream. PACE 2006; 29: 523-537. [ Links ]
8. Oral H, Chugh A, Good E, Sankaran S, Reich SS, Igic P y cols. A tailored approach to catheter ablation of paroxysmal atrial fibrillation. Circulation 2006; 113: 1824-1831. [ Links ]
9. Pappone C, Santinelli V, Manguso F, Vicedomini G, Gugliotta F, Augello G y cols. Pulmonary Vein Denervation Enhances Long-Term Benefit After Circumferential Ablation for Paroxysmal Atrial Fibrillation. Circulation, Jan 2004; 109: 327 - 334. [ Links ]
10. Oral H, Pappone C, Chugh A, Good E, Bogun F, Pelosi F y cols. Circunferential pulmonary vein ablation for chronic atrial fibrillation. N Engl J Med 2006: 3354: 934-941. [ Links ]
11. Wood M, Mahoney C, Kay N, Ellenbogen K. Clinical outcomes after ablation and pacing therapy for atrial fibrillation. Circulation 2000; 101: 1138- 1144).. [ Links ]
12. Borro GL, Luzi M, Sagone A. Atrial fibrillation: the remodelling phenomenon. Eur Heart J 2003; 5: Suppl. H: H1-H7. [ Links ]