Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Costarricense de Cardiología
versión impresa ISSN 1409-4142
Rev. costarric. cardiol vol.9 no.1 San José ene. 2007
Ultrafiltración como alternativa terapéutica en la insuficiencia cardiaca congestiva
Dr. Jorge A. Brenes S.
Servicio de Emergencias, Hospital Calderón Guardia, San José, Costa Rica
Dirección: Del Antiguo Higuerón de San Pedro, 100 mts Sur y 75 mts Este, Apts. El Retiro #1, San Pedro, Montes de Oca.
Teléfono: (506) 225-5849, Fax (506) 253-2342; e-mail: jorgebrenes80@hotmail.com
Abreviaturas: ICC: insuficiencia cardiaca congestiva; SNS: sistema nervioso simpatico; AMP: adenosín monofosfato cíclico; ADH: hormona antidiurética arginina-vasopresina; RAA: reninna angiotensina aldosterona; NYHA: New York Heart Association; UF: Ultrafiltración.
Resumen
La Insuficiencia Cardiaca Congestiva es un síndrome complejo que representa un problema de salud pública. En los casos con excesiva retención de líquidos, los intentos por mantener un estado euvolémico sostenido son en ocasiones insuficientes y su manejo tradicional con diuréticos, tanto de manera aguda como crónica, no ha demostrado incrementar la supervivencia de estos pacientes a largo plazo y de manera paradójica, agrava el círculo vicioso neurohormonal, que es el sustrato fisiopatológico principal de esta entidad.
En este contexto, la ultrafiltración surge como alternativa terapéutica capaz de remover cantidades significativas de fluido en este tipo de pacientes, mejorando su capacidad funcional y perfil de peso de manera sostenida, al atenuar la estimulación del eje renina-angiotensina-aldosterona y sistema nervioso simpático. Su tolerancia y perfil de seguridad son adecuados. Futuros estudios analizarán la relación costo/beneficio de esta terapia y su aplicación a mayor escala.
Palabras clave: insuficiencia cardiaca, eje renina-angiotensina-aldosterona, sistema nervioso simpático, diuréticos, ultrafiltración.
Abstract
Congestive Heart Failure is a complex syndrome that represents a public health problem. In cases with excessive volume fluid overload,attempts to maintain a sustained euvolemic state are sometimes insufficient and its traditional management with diuretics, both acutely and chronically, has failed to demonstrate increased survival on the long term, and paradoxically, it aggravates the vicious neurohormonal cycle, which is the main pathophysiological feature of this entity.
In this context, ultrafiltration comes as a therapeutic alternative, capable of removing significant amounts of fluid in these patients, improving their functional capacity and weight profile in a sustained way, attenuating the stimulation of the renin-angiotensin-aldosterone axis and sympathetic nervous system. Its tolerance and security profile are adecuate. Future studies will address the cost/benefit relationship and its possible application on a larger scale.
Key words: heart failure, renin-angiotensin-aldosterone axis, sympathetic nervous system, diuretics, ultrafiltration.
Introducción
La Insuficiencia Cardiaca Congestiva (ICC) es un síndrome con una expresión clínica variable y una fisiopatología compleja, no dilucidada por completo1. Representa un problema de salud pública tanto en países desarrollados como en vías de desarrollo; en los Estados Unidos, se presentan anualmente un millón de hospitalizaciones por este padecimiento. Hoy en día, es el problema de salud más costoso en este país2, y primera causa de ingreso hospitalario en pacientes mayores de 65 años. Los resultados obtenidos en el manejo de estos pacientes con sobrecarga de fluidos son en definitiva subóptimos; las altas tasas de readmisión revelan el fracaso de las hospitalizaciones para lograr un estado euvolémico sostenido3. De hecho, 42% de los pacientes aun presenta síntomas congestivos al egreso, 50% pierde solamente 5 libras de peso o menos durante el internamiento, y de manera paradójica, un 20% de estos gana peso al final de su estancia hospitalaria4. La base de datos ADHERE3 demuestra que la mayor parte de los costos asociados al tratamiento de esta población se atribuyen a las repetidas hospitalizaciones y son preocupantes las consecuencias de este fenómeno de "puerta giratoria" en términos de morbimortalidad5.
Fisiopatología del estado edematoso de la insuficiencia cardiaca
La fisiopatología de la retención de agua y sodio en la ICC involucra una estimulación inapropiada y sostenida de los mecanismos compensatorios que defienden los compartimentos líquidos corporales, particularmente el espacio intravascular6. Se ha propuesto la hipótesis del subllenado arterial7 para unificar varios conceptos; las alteraciones en el gasto cardíaco provocan disminución del flujo sistémico, lo cual es interpretado inicialmente como un déficit de volumen; los barorreceptores, ubicados a nivel de ventrículo izquierdo, seno carotídeo y arco aórtico, envían señales aferentes al sistema nervioso central, que disminuye el tono inhibitorio vagal y glosofaríngeo, activándose consecuentemente el sistema nervioso simpático (SNS), lo que provoca un incremento de las resistencias vasculares periféricas, incluso a nivel renal. Aparentemente, la norepinefrina es el agente inicial en esta cascada de eventos8, y en los pacientes que presentan ICC, alcanza niveles suprafisiológicos sumamente deletéreos; se ha documentado claramente que los niveles circulantes de esa hormona se asocian de manera inversamente proporcional con la probabilidad de supervivencia9. La norepinefrina presenta cardiotoxicidad directa, mediada por sobrecarga intracelular de calcio dependiente de AMP cíclico en los miocitos7. Posee actividad central, estimulando receptores a nivel de los núcleos supraóptico y paraventricular, que conducen a la liberación de arginina-vasopresina (ADH), hormona que por medio de los canales de acuaporina 2 en el túbulo colector, permite la absorción de agua libre por gradiente osmótico. Periféricamente, los receptores adrenérgicos a nivel renal producen liberación de renina, lo que conduce a un incremento en los niveles de angiotensina II y aldosterona. La angiotensina II, además de incrementar las resistencias vasculares periféricas, tiene numerosas acciones biológicas, que incluyen la facilitación de la liberación presináptica de norepinefrina, contribuye a la hipertrofia y remodelación de los cardiomiocitos, y potencia la capacidad de reabsorción de agua y sodio a nivel del túbulo contorneado proximal. En los pacientes con ICC manifiesta, los niveles de aldosterona se incrementan hasta 20 veces en comparación con controles sanos. Esta hormona causa fibrosis miocárdica intersticial y fibrosis reactiva perivascular, capaces de alterar tanto la función sistólica como diastólica y de propiciar un sustrato arritmogénico10.
Por otro lado, en la insuficiencia cardiaca se detectan niveles elevados de los péptidos natriuréticos atrial y cerebral, hormonas con efectos natriurético y vasodilatador y que contrarrestan inhiben las acciones del SNS y del eje renina-angiotensina-aldosterona (RAA). No obstante, en este sindrome se documenta resistencia a la acción de estos péptidos, que interfiere en su acción de modulación7.
En síntesis, existe en la ICC una activación neurohumoral progresiva, cuya intensidad es paralela al grado de severidad de la disfunción miocárdica6, pero que está presente inclusive desde las etapas asintomática o levemente sintomática1, lo que conduce a un acelerado proceso de catabolismo, degeneración y remodelación, terminando en un estado de caquexia cardiaca11. Lo anterior motiva en la actualidad a algunos autores a considerar la ICC como una endocrinopatía global2.
Diuréticos: ventajas y desventajas de su utilización en el manejo de la ICC con retención de fluidos
La sobrecarga de fluido y la congestión pulmonar son las consecuencias fisiopatológicas más frecuentes que motivan las hospitalizaciones por ICC descompensada5. Las elevadas presiones de llenado asociadas conducen a una serie de alteraciones, tanto a corto como a largo plazo, que incluyen la posibilidad de isquemia subendocárdica, necrosis y/o apoptosis de cardiomiocitos debido al aumento del estrés de pared, además de alteraciones valvulares y miocárdicas debido al fenómeno de remodelación12. Los diuréticos han sido utilizados para contrarrestar la hipervolemia, gracias a su demostrada capacidad para incrementar el gasto urinario, por lo que han sido el pilar del manejo de esta patología por más de 200 años. La revolución terapéutica que se inició en la década de 1980 con la introducción de los inhibidores de enzima convertidora de angiotensina y posteriormente los antagonistas de receptores de angiotensina II, hizo pensar en la posibilidad clínica de abandonar los diuréticos. Sin embargo, se observó que la mayor parte de los pacientes a quienes se les suspendió el tratamiento con diuréticos, manteniéndolos solamente con las otras terapias mencionadas rápidamente desarrollaron sintomatología congestiva13.
Por lo tanto, en la actualidad, dichos medicamentos siguen teniendo un rol protagónico en el manejo de la ICC, y recientemente los diuréticos de asa han sido recomendados en las guias prácticas de la Sociedad Americana de Insuficiencia Cardiaca como terapia de primera línea para descompensaciones agudas14. En este contexto, su uso debe ser agresivo pero conlleva un alto riesgo de deterioro de la función renal, asociado a un incremento en la estancia hospitalaria y más preocupante aun, mayor morbimortalidad a largo plazo5. De hecho, la disfunción renal es una característica muy frecuente en este tipo de pacientes, el llamado "síndrome cardiorrenal"; hasta 30% de los pacientes internados por ICC descompensada presentan historia de insuficiencia renal y 20% de ellos manejan niveles de creatinina por encima de 2mg/dl3.
Se ha demostrado que un 25-30% de los pacientes portadores de ICC desarrollan resistencia a los diuréticos4 y su respuesta natriurética se reduce a un tercio o un cuarto de lo esperable normalmente. Este subgrupo de pacientes resistentes son los que presentan un riesgo relativo mucho más alto de deterioro ulterior de su función renal durante los episodios de descompensación15. La acción de los diuréticos de asa depende de la superación de un umbral de su concentración a nivel tubular; en la mayoría de los individuos, dicha concentración se alcanza solamente por un corto periodo de tiempo (natriuresis aguda) y en los pacientes con ICC y otras condiciones edematosas ocurren cambios adaptativos y progresivos a nivel tubular que incrementan aun más dicho umbal13.
La persistente activación del eje RAA y del SNS que se aprecia en los pacientes con ICC se relaciona en parte al uso de diuréticos1, los cuales estimulan dichos sistemas por varias vías: al disminuir la cantidad de sodio que llega a la mácula densa, se produce aumento en la liberación de renina, lo cual provoca en consecuencia un incremento en los niveles de angiotensina II y aldosterona, independientemente de los cambios en el volumen intravascular13, lo que contribuye al proceso de remodelación y progresión de la disfunción ventricular10. Adicionalmente, los diuréticos de asa estimulan la secreción de prostaciclinas a nivel renal, las cuales también favorecen la liberación de renina. Desde luego, estos medicamentos son capaces de provocar contracción del volumen intravascular, que es el estímulo clásico para la activación del eje RAA y del SNS, mecanismo que se ha demostrado incluso en individuos asintomáticos tratados con diuréticos11. Debido a la disminución en las presiones de llenado, se inhibe la secreción de los péptidos natriuréticos. En pacientes con clase funcional NYHA avanzada (III-IV), estos cambios en el compartimento intravascular son capaces de propiciar un cambio agudo de los parámetros hemodinámicos, con paradójico deterioro de la condición clínica del individuo, poco después de iniciar la terapia intravenosa con diuréticos16. Las complicaciones más frecuentes en individuos sensibles a los diuréticos de asa son la hipokalemia, hiponatremia e hipotensión arterial, pero en los pacientes resistentes, las dosis altas provocan ototoxicidad, usualmente reversible, pero ha habido casos con secuelas permanentes13. Debido a un aumento en su excreción renal, también se asocian deficiencia de tiamina (vitamina B1), incluso a dosis orales bajas de furosemida (40mg), lo cual es capaz de empeorar la contractilidad miocárdica11.
Finalmente, debe recordarse que el único tipo de diurético que ha demostrado prolongar la sobrevida en pacientes con ICC es el de los ahorradores de potasio (estudios RALES17, EPHESUS18), en cambio, la utilización de los diuréticos de asa no se traduce en un beneficio en términos de mortalidad a largo lazo.
Mecanismos de acción de la ultrafiltración en pacientes con ICC
La ultrafiltración (UF) es una técnica que se ha aplicado desde hace más de 20 años en el manejo de pacientes hipervolémicos refractarios. Anteriormente presentaba una serie de limitaciones técnicas, entre ellas: alta tasa de flujo, grandes volúmenes extracorpóreos y necesidad de accesos centrales y monitoreo invasivo. La tecnología ha superado dichos obstáculos19 y en la actualidad, es posible realizar ultrafiltración con pequeñas máquinas de un tamaño semejante a una bomba de infusión (Fig. 1), que se operan con facilidad y son flexibles con respecto a los sitios de acceso venoso y tipos de catéter. Se trata de un circuito extracorpóreo pequeño, en el cual la sangre es extraída del paciente procedente de un acceso venoso (central o periférico) y pasa a través de un filtro especial de polisulfona, que aloja solamente una pequeña cantidad de sangre en un momento dado (33cc), a una tasa de flujo ajustable (de 10 a 40 ml/min), con un rango predeterminado de velocidad de extracción (10 a 500 ml/hora como máximo). Este filtro utiliza una diferencia de presiones para selectivamente empujar los contenidos sanguíneos a través de sus poros, un mecanismo denominado transporte convectivo, pues solamente emplea gradientes de presión y selectividad de acuerdo al tamaño de la partícula, permitiendo el paso de moléculas con un peso menor a 65.000 daltons. De esta forma, células, proteínas y otras moléculas de gran tamaño no se filtran, mientras que los electrolitos sí lo hacen y se equilibran a ambos lados del filtro. El ultrafiltrado resultante, constituido por agua, electrolitos y moléculas pequeñas es isoosmolar, por lo que no se produce difusión simple. Este se recolecta en un recipiente para ser descartado, y la sangre retorna al paciente por medio de un segundo acceso venoso (Fig. 2).
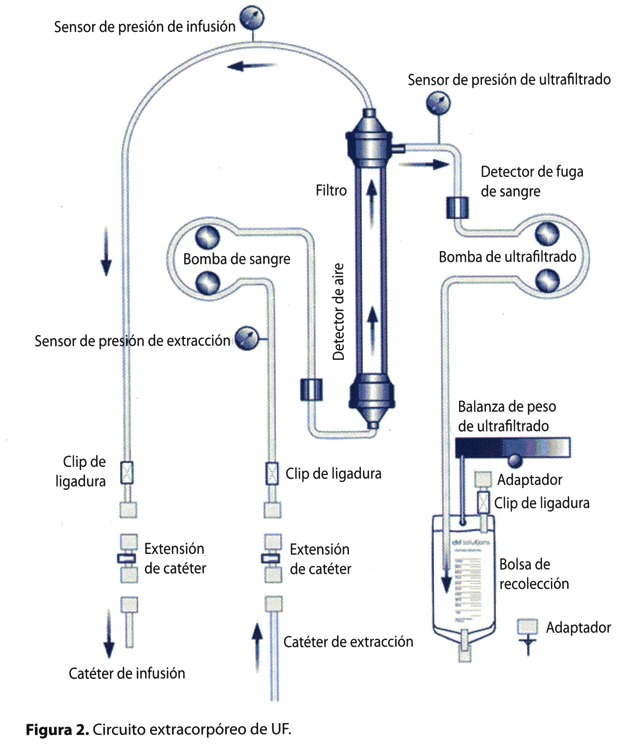
Todo el proceso ocurre bajo numerosos controles de seguridad; el circuito presenta sensores internos de presión que detectan oclusiones, desconexiones y fugas de aire. La máquina revisa continuamente la velocidad de filtración y la tasa de remoción es modificable, pero tiene un límite de 500 ml/hora, lo cual es muy importante dado que en el pasado, tasas de eliminación de fluido superiores a 0.25 ml/kg/min se asociaron a inestabilidad hemodinámica debido a una discrepancia entre el ritmo de extracción de fluido y el reingreso de líquido a partir del espacio intersticial20.
Justificación para el uso de ultrafiltración en ICC
Los efectos de la UF han sido valorados tanto en pacientes con ICC compensada como agudamente descompensada. Agostoni y colaboradores21,22 realizaron, a mediados de los años 90, estudios clínicos en pacientes portadores de ICC moderada en condición estable. Se evidenció que incluso estables clínicamente, presentaron evidencia radiológica subclínica de congestión, a pesar de intervenciones farmacológicas aparentemente apropiadas. Demostraron que esta modalidad terapéutica es capaz de disminuir la presión atrial derecha y de llenado ventricular derecha y de provocar una significativa reducción de la presión venosa pulmonar. Estos cambios hemodinámicos incrementan el flujo linfático pulmonar y provocan descompresión de las vías aéreas de bajo calibre e incrementan la distensibilidad pulmonar, lo cual se tradujo en una inequívoca mejoría en la capacidad de ejercicio, lo que sugirió la disponibilidad de una mayor cantidad de parénquima descongestionado para realizar el intercambio gaseoso. En esta población de pacientes, la tolerancia al ejercicio está determinada no solo por el gasto cardíaco, sino también por la capacidad de difusión a través de la barrera hematoaérea. Por primera vez, se demostró que la furosemida, en forma comparativa, no era capaz de provocar los mismos beneficios 21 a pesar de remover cantidades semejantes de fluido. Los cambios favorables persistían por períodos prolongados de hasta 6 meses en los pacientes sometidos a UF y esto se correlacionó con una marcada disminución de la actividad del eje neurohumoral.
Debido al alivio en la congestión de diversos órganos, se produce un aclaramiento más eficiente de norepinefrina, tanto a nivel renal como pulmonar2. Además, dado que la UF no modifica el contenido tubular de sodio, no se estimula la mácula densa, a diferencia de los diuréticos de asa, que activan el eje RAA por la vía independiente de volumen13.
Se ha demostrado que los niveles de norepinefrina y renina plasmática están inversamente relacionados con el gasto urinario8 y es de esperarse que un decremento en la actividad neurohumoral se asocie a un aumento en la diuresis. Marenzi y colaboradores23 observaron que los beneficios más significativos de la UF se evidenciaban en aquellos pacientes con ICC avanzada y en los años siguientes, se retomó el interés original en la UF para ser aplicada en el manejo de pacientes agudamente descompensados.
El estudio SAFE24 fue un acercamiento inicial en este sentido y demostró en una población pequeña de 21 pacientes con sobrecarga de volumen, que era posible remover, en la mayor parte de estos individuos, más de 1 litro de fluido en menos de 8 horas, en forma segura, sin necesidad de diuréticos o drogas vasoactivas. En el estudio EUPHORIA, Costanzo y colaboradores4 valoraron una población de 20 pacientes con evidencia clínica de sobrecarga de volumen y resistencia al tratamiento convencional con diuréticos. Se inició ultrafiltración temprana al ingresar al hospital, que se mantuvo hasta observar resolución de la sintomatología clínica. Se lograron remover en promedio más de 8 litros de fluido, sin alteraciones significativas en los parámetros hemodinámicos, función renal, electrolitos o hemoglobina. El 80% de ellos fue egresado en 4 días o menos y al darles seguimiento al mes y a los 3 meses, persistió la mejoría en el peso, capacidad funcional y niveles de péptido natriurético cerebral, con solamente un 5% de reingreso hospitalario en ese periodo.
Estos hallazgos fueron llevados más allá por Bart y colaboradores en el estudio RAPID-CHF6, la primera propuesta de un estudio multicéntrico aleatorizado que tuvo como objetivo demostrar la eficacia y seguridad de la ultrafiltración como terapia adyuvante de la ICC. Se incluyeron 40 pacientes con ICC descompensada y evidencia clínica de sobrecarga de volumen y de forma aleatoria, 20 de ellos recibieron terapia tradicional con diuréticos y los otros 20 fueron sometidos a un único curso de ultrafiltración de 8 horas, seguido de diuréticos de asa a discreción del médico tratante. La remoción de volumen fue estadísticamente superior en el grupo de UF al cabo de las primeras 24 horas, sin efectos adversos en los parámetros hemodinámicos y de electrolitos. Sin embargo, el pequeño tamaño del estudio limita la capacidad de extender conclusiones definitivas acerca del impacto clínico de la UF en comparación al manejo tradicional.
Surge de esta forma la investigación UNLOAD19, el primer estudio prospectivo, multicéntrico, randomizado y de gran escala que compara directamente los resultados de la UF versus diuréticos como terapias aisladas. Se llevó a cabo en 28 centros médicos de los Estados Unidos con experiencia en UF. Se enrolaron 200 pacientes portadores de ICC descompensada y evidencia de hipervolemia y de forma aleatoria, 100 de ellos recibieron manejo tradicional con diuréticos y los otros 100 fueron sometidos a UF, por un lapso de 48 horas. Es de resaltar la homogeneidad en las características de base de ambos grupos. Luego del período de observación, tanto la pérdida de peso como la extracción neta de fluido fue estadísticamente superior en la rama de UF. La mejoría en términos del síntoma disnea, fue semejante en los dos grupos, pero al cabo de 90 días, los pacientes sometidos a UF presentaron menos rehospitalizaciones (18% vs 32%), menor número de días de estancia (en caso de presentarse una sola hospitalización, 1,4 vs 3,8 días en promedio) y menor número de visitas médicas no programadas (21% vs 44%). El estudio tuvo particular interés en evaluar el perfil de seguridad de la UF, el cual fue ratificado al demostrar menor requerimiento de drogas vasoactivas coadyuvantes (3,1% vs 12%) y menor riesgo de hipokalemia (1% vs 12%); la frecuencia reportada de eventos hipotensivos fue muy similar en ambos grupos (4% en UF vs 3% con diuréticos). La UF es un procedimiento que también entraña riesgos y eventos adversos que en este estudio se resumen en el cuadro 1.
Direcciones futuras
Dado que uno de los objetivos principales de la base de datos ADHERE3 es explorar si estrategias terapéuticas más tempranas y/o efectivas pueden mejorar los resultados en el manejo de los pacientes con ICC, se prevee que la UF aportará cada vez más información, conforme el procedimiento vaya adquiriendo mayor aceptación y difusión.
Dado de que la presión arterial es un parámetro hemodinámico global19, será necesario analizar los efectos de la ultrafiltración sobre otras variables como volumen intravascular, tasa de llenado plasmático (plasma refill rate) y desempeño cardíaco objetivo (cardiac performance).
Desde hace muchos años se ha planteado como hipótesis que parte de los efectos beneficiosos de la UF se deben a la remoción directa de compuestos biológicamente activos, sean estos hormonas, citoquinas o incluso oligopéptidos. Será de utilidad valorar la composición del ultrafiltrado con respecto a dichos compuestos. A pesar de la cuantiosa evidencia acerca de los beneficios de la ultrafiltración, deberá establecerse mediante futuros estudios la relación costo/beneficio, con el objetivo de considerar su implementación a mayor escala dentro del sistema de salud.
Podría incluso tener un mayor alcance y trascienda la aplicación en ICC a su empleo en otras condiciones edematosas con puntos fisiopatológicos comunes, tales como el síndrome nefrótico y las hepatopatías crónicas con ascitis25.
En la actualidad, el fracaso relativo en el manejo de muchos pacientes con ICC se debe tanto al uso ineficiente de terapias existentes, asi como a la imposibilidad de controlar algunos de los mecanismos fisiopatológicos de este síndrome. Las repetidas hospitalizaciones para efectuar intervenciones agresivas con diuréticos e inotrópicos ofrecen resultados subóptimos en cuanto a calidad de vida y capacidad funcional. Los nuevos conceptos acerca de la fisiopatología de este padecimiento nos obligan a reconocerlo como una compleja endocrinopatía y no meramente como una serie de disfunciones mecánicas y hemodinámicas. Por ende, es evidente que la dirección futura de las estrategias terapéuticas debe ir dirigida a antagonizar sistemas biológicamente activos ya reconocidos, que jueguen un papel principal en la progresión de la enfermedad, es decir, interrumpir el círculo vicioso neurohumoral y hemodinámico.
Conclusiones
La ultrafiltración ha emergido de una relativa oscuridad para prometer un papel importante en el tratamiento de la ICC ya que permite disminuir de forma notable la activación neurohormonal de manera sostenida, incluso por varios meses, lo cual se traduce en estabilidad desde el punto de vista clínico. Es una alternativa que se ha demostrado es capaz de eliminar mayor cantidad de fluido al ser comparada con diuréticos, sin estimulación del eje RAA y SNS, con buena tolerancia y escasa incidencia de efectos indeseables. La efectividad y seguridad del procedimiento han sido demostrados y futuros estudios deberán aclarar otros puntos importantes, principalmente acerca de mecanismos de acción y la relación costo/beneficio.
Agradecimientos
El autor desea externar su agradecimiento a Dianne Hauge y Scott Campbell de CHF Solutions por su aporte de las figuras y al Dr. Brad Bart y Dra. Meghan Walsh del Centro Médico Hennepin County (HCMC, Minnesota, EEUU) por su apoyo incondicional para la realización de esta evisión.
Referencias
1. Francis G, Benedict C, Johnstone DE, Kirlin PC, Nicklas J, Liang CS, et al. Comparison of neuroendocrine activation in patients with left ventricular dysfunction with and without Congestive Heart Failure: a substudy of the Studies of Left Ventricular Dysfunction (SOLVD). Circulation 82 (5): 1724- 29, 1990. [ Links ]
2. Sharma A, Hermann D, Mehta,R. Clinical Benefit and Approach of Ultrafiltration in Acute Heart Failure. Cardiology 96: 144-54, 2001. [ Links ]
3. Adams K, Fonarow G, Emerman C, LeJemtel T, Costanzo MR, Abraham W, et al. Characteristics and outcomes of patients hospitalized for Heart Failure in the United States: rationale, design, and preliminary observations from the first 100.000 cases in the Acute Decompensated Heart Failure National Registry (ADHERE). Am Heart J 149(2): 209-16, 2005 [ Links ]
4. Costanzo MR, Saltzberg M, O`Sullivan J, Sobotka, P. Early Ultrafiltration in Patients with Decompensated Heart Failure and Diuretic Resistance (EUPHORIA). J Am Coll Cardiol 46(11): 2047-51, 2005. [ Links ]
5. Elkayam U, Hatamizadeh P, Janmohamed M. The Challenge of Correcting Volume Overload in Hospitalized Patients with Decompensated Heart Failure. J Am Coll Cardiol 49(6): 684-86, 2007. [ Links ]
6. Bart B, Boyle A, Bank A, Anand I, Olivari MT, Kraemer M, et al. Ultrafiltration Versus Usual Care for Hospitalized Patients with Heart Failure (RAPID). J Am Coll Cardiol 46 (11): 2043-46, 2005. [ Links ]
7. Cadnapaphornchai M, Gurevich A, Weinberger H, Schrier R. Pathophysiology of Sodium and Water retention in Heart Failure. Cardiology 96: 122-31, 2001. [ Links ]
8. Guazzi M, Agostoni P, Perego B, Lauri G, Salvioni A, Giraldi F, et al. Apparent paradox of neurohormonal axis inhibition after body fluid volume depletion in patients with Chronic Congestive Heart Failure and water retention. Br Heart J 72: 534-39, 1994. [ Links ]
9. Cohn J, Levine T, Olivari MT, Garberg V, Lura D, Francis GS, et al. Plasma norepinephrine as a guide to prognosis in patients with chronic congestive heart failure. N Engl J Med 311: 819-23, 1984. [ Links ]
10. Domanski M, Norman J, Pitt B, Haigney M, Hanlon S, Peyster E. Diuretic use, Progressive Heart Failure and Death in Patients in the Studies of Left Ventricular Dysfunction (SOLVD). J Am Coll Cardiol 42(4): 705-08, 2003 [ Links ]
11. Weber, K. Furosemide in the Long Term Management of Heart Failure: the Good, the Bad and the Uncertain. J Am Coll Cardiol 44(6): 1308-10, 2004. [ Links ]
12. Gheorghiade M, Zannad F, Sopko G, Klein L, Piña I, Konstam M, et al. Acute Heart Failure Syndromes: current state and framework for future research. Circulation 112: 3958-68, 2005. [ Links ]
13.Ellison, D. Diuretic Therapy and Resistance in Congestive Heart Failure. Cardiology 96: 132-43, 2001. [ Links ]
14. Heart Failure Society of America. Executive Summary: HFSA 2006. Comprehensive Heart Failure Practice Guidelines. J Card Fail 12:10-38, 2006. [ Links ]
15. Butler J, Forman D, Abraham W, Gottlieb S, Loh E, Massie B, et al. Relationship between Heart Failure treatment and development of worsening renal function among hospitalized patients. Am Heart J 147 (2): 331-38, 2004. [ Links ]
16. Francis G, Siegel R, Goldsmith S, Olivari MT, Levine B, Cohn J. Acute Vasoconstrictor Response to Intravenous Furosemide in Patients with Chronic Congestive Heart Failure. Ann Intern Med 103(1): 1-6, 1985. [ Links ]
17. Pitt B, Zannad F, Remme W, Cody R, Castaigne A, Pérez A, et al. The Effect of Spironolactone in Morbidity and Mortality in Patients with Severe Heart Failure. NEJM 341(10): 709-17, 1999. [ Links ]
18.Pitt B, Williams G, Remme W, Martínez F, López-Sendon, Zannad F, et al. The EPHESUS Trial: Eplerenone in Patients with Heart Failure Due to Systolic Dysfunction Complicating Acute Myocardial Infarction. Cardiovascular Drugs and Therapy 15(1): 79-87, 2001. [ Links ]
19. Costanzo M, Guglin M, Saltzberg M, Jessup M, Bart B, Teerlink J, et al. Ultrafiltration Versus Intravenous Diuretics for Patients Hospitalized for Acute Decompensated Heart Failure. J Am Coll Cardiol 49(6): 675-83, 2007. [ Links ]
20. Ronco C, Bellomo R, Ricci Z. Hemodynamic Response to Fluid Withdrawal in Overhydrated Patients treated with Intermittent Ultrafiltration and Slow Continous Ultrafiltration: role of Blood Volume Monitoring. Cardiology 96: 196-201, 2001. [ Links ]
21 .Agostoni P, Marenzi G, Lauri G, Perego G, Schianni M, Sganzerla P. Sustained Improvement of Functional Capacity after removal of Body Fluid with Isolated Ultrafiltration in Chronic Cardiac Insufficiency: failure of Furosemide to provide the same result. Am J Med 96: 191-99, 1994. [ Links ]
22. Agostoni P, Marenzi G, Pepi M, Doria E, Salvionni A, Perego G, et al. Isolated Ultrafiltration in Moderate Congestive Heart Failure. J Am Coll Cardiol 21(2): 424-31, 1993. [ Links ]
23. Marenzi G, Grazi S, Giraldi F, Lauri G, Perego G, Guazzi M, et al. Interrelation of Humoral Factors, Hemodynamics and Fluid and Salt Metabolism in Congestive Heart Failure: effects of Extracorporeal Ultrafiltration. Am J Med 94: 49-56, 1993. [ Links ]
24. Jaski B, Ha J, Denys BG, Lamba S, Trupp RJ, Abraham WT, et al. Peripherally inserted veno-venous Ultrafiltration for rapid treatment of volume overloaded patients (SAFE). J Card Fail 9: 227-31, 2003. [ Links ]
25. Davenport, A. Ultrafiltration in Diuretic-Resistant Volume Overload in Nephrotic Syndrome and Patients with Ascites due to Chronic Liver Disease. Cardiology 96: 190-95, 2001. [ Links ]
















