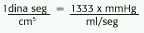Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Cardiología
Print version ISSN 1409-4142
Rev. costarric. cardiol vol.6 n.2 San José May. 2004
REVISION
Hidrodinamia de la circulación vascular periférica normal y patológica.
Dr.Carlos Ciancaglini
El estudio del flujo sanguíneo (hidrodinámica aplicada o hemodinámica) es imprescindible para comprender las distintas patologías cardiovasculares y los hallazgos de los métodos de diagnóstico; en este sentido, los principios físicos que rigen la circulación periférica no son necesariamente aplicables al estudio del funcionamiento cardíaco aislado. Se debe destacar también que muchos de estos fenómenos significan la aplicación de descripciones hechas en laboratorios de Física (algunas siglos atrás) con líquidos y en condiciones ideales, muy diferentes de aquellas que rigen en el aparato circulatorio; es por esto que la hidrodinámica es un área relativamente nueva,de evolución permanente (1-8).
Las variables más utilizadas son presión, flujo, velocidad y resistencia.
Presión: es el producto de una fuerza aplicada sobre una superficie. Se mide en:dinas/cm2 (la DINA es fuerza que acelera un cuerpo de una masa de 1g a 1cm/s2 ),cm H2O o mmHg, donde: 1cm H 2 O =0,738mmHg o 1mmHg =1,355 cm H2O;1cm H 2 O =980 din/cm 2 ;1mmHg =1329 din/cm2 .
Flujo: es el volumen de sangre bombeado en una unidad de tiempo. Se mide en ml/s o L/min; a su vez la velocidad con que éste se desplaza (como se verá, flujo y velocidad no son sinónimos), o sea la distancia recorrida en la unidad de tiempo, se mide en cm/s o m/s.
Resistencia: es la dificultad para que fluya la sangre (es decir, ocurra flujo sanguíneo)en un vaso y, debido a que no puede medirse directamente, se debe calcular a partir de los valores de diferencia de presión entre dos puntos determinados y la cantidad de flujo (la base teórica se explicará después); una unidad de resistencia periférica (P.R.U., en inglés) ocurre cuando existe una diferencia de presión de 1mmHg para que haya un flujo de 1ml/s;otra forma de cuantificar la resistencia en el sistema C.G.S. es en dinas por seg/cm5;
La sangre, elemento de análisis por ultrasonido (U.S.):
La fuente principal de reflexión de los ultrasonidos (U.S.)son los glóbulos rojos (G.R.); los leucocitos, mucho más grandes que los primeros, son muy escasos para actuar como estructuras de reflexión eficaces desde el punto de vista clínico (1:1000/mm3);también las plaquetas, si bien numerosas, no poseen un volumen capaz de actuar como reflector a la longitud de onda de los transductores utilizados (&=1/F;c=1560m/s,o sea 0,15mm a 10MHz o 0,22mm a 7MHz).
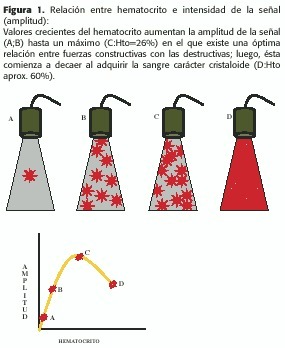
Cada eritrocito actúa como un elemento de reflexión individual puntiforme; cuando están acumulados en el torrente sanguíneo su interacción es compleja,dependiendo de su densidad y distribución; cuando el hematocrito es menor al 10%, los G.R. actúan como reflectores individuales distribuidos al azar en la luz del vaso, siendo la energía acústica reflejada una función lineal con su concentración;por encima de este valor, la sangre asume una característica "cristaloide ", con una marcada interacción entre las partículas, con fuerzas constructivas y destructivas que interactúan entre sí;las fuerzas constructivas predominan hasta un hematocrito de alrededor del 25%; por encima comienzan a predominar las fuerzas destructivas y la energía acústica reflejada cae, de modo que, cerca del 60%, los G.R.están tan juntos que la sangre actúa como un líquido cristaloide y muy poca energía U.S.es reflejada (Figura 1).
En cuanto a la distribución a lo largo de la luz, los G.R.no están uniformemente distribuidos, tendiendo a ser más escasos cerca de la pared vascular, siendo por lo tanto mayor su velocidad y menor el tiempo de tránsito que el del plasma (la velocidad varía a lo largo de la luz, desde 0 en la zona inmediata vecina a la pared hasta alrededor de 1m/s en el centro). La presencia de turbulencia aumenta el poder de reflexión U.S.; los remolinos ("eddies") crean fuerza centrífuga que separa el plasma de los elementos formes de acuerdo a su densidad, alterando la uniformidad de la distribución de éstos, aumentando su poder de reflexión; esto explica por qué en el flujo turbulento se 1dina seg =1333 x mmHg cm 5 ml/seg producen señales más fuertes que en el laminar.
También la energía reflejada varía con la frecuencia del U.S. usada, aumentando con la cuarta potencia de la misma; esto debe ser balanceado por la desventaja simultánea de la disminución en el poder de penetración.
Perfiles de flujoEl flujo (Q) es función del área (A)y de la velocidad (v)en el tiempo (t).
(1)FLUJO (Q)=A x v (t)
_
v =velocidad promedio (la velocidad varía a través del ciclo cardíaco y de la luz vascular debido a la fricción viscosa entre la sangre y la pared arterial,como se dijo).
El perfil de flujo está determinado fundamentalmente por tres factores:
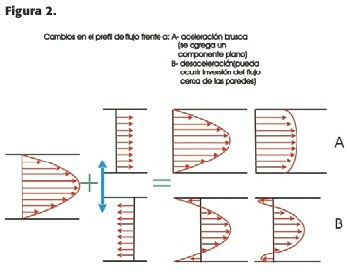
1) Aceleración: Ésta agrega un componente plano al perfil de flujo (Figura 2-A). Ésta es la causa principal del perfil plano de flujo en las arterias periféricas.
En ciertos lechos de órganos nobles que necesitan flujo constante durante todo el ciclo cardíaco, de baja resistencia (impedancia) periférica (como por ej.carótidas internas, vertebrales, riñón) con flujo diastólico prominente, existe muy poca aceleración,de modo que el perfil se torna parabólico.
En la fase de desaceleración en la sístole tardía se resta un componente plano al perfil de flujo, lo que puede ocasionar reversión del mismo cerca de las paredes vasculares, de velocidad cercana a 0 (Figura 2-B).
Esto ocasiona que pueda haber turbulencias en la diástole tardía porque desaparece el componente estabilizador de la aceleración; por otra parte, también durante la diástole, la reducción de la velocidad disminuye el Re, por lo que en esta fase del ciclo cardíaco puede aparecer una relaminización del flujo; estos efectos contrapuestos, aparentemente paradójicos, demuestran la complejidad de la circulación "in vivo "y del estudio y aplicación de leyes estáticas a una situación de flujo pulsátil como ocurre en el ser humano.
2) Factores Geométricos:
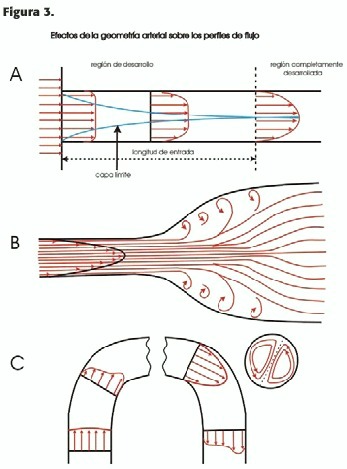
a) un flujo convergente aplana el perfil;esto ocurre, por ejemplo, en el nacimiento de la carótida primitiva izquierda; luego, gradualmente se transforma en perfil parabólico, como se explicará más adelante (Figura 3-A).
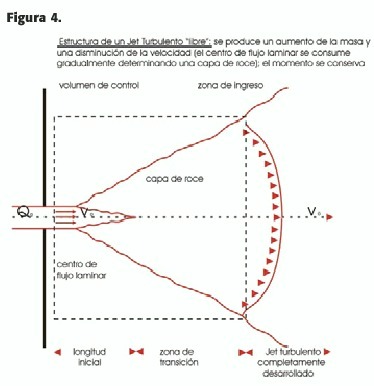
b) Un flujo divergente (por ej.en el seno carotídeo) agudiza el perfil (Figura 3-B);esto puede ser considerado un tipo de jet libre si está eyectado en una cámara con un área varias veces mayor que el orificio; debido a la diferencia de velocidad entre el "core "del jet y las capas adyacentes de flujo quieto, se crea una fuerza de roce ("shear force "), donde las fuerzas inerciales dominan las de fricción viscosa, originándose una capa de roce caótica que gradualmente consume el jet central de velocidad uniforme (Figura 4), exhibiendo una forma cónica; si las divergencias son acentuadas existe separación de la pared del vaso con formación de remolinos ("eddies ")que se detectan en el Doppler color por una inversión del color. Debido a que la velocidad (energía cinética)es muy alta en el jet comparada con el flujo de la cámara de ingreso, por la ley de conservación de la energía (más adelante se explicará esto por medio de la ecuación de Bernoulli)la energía potencial (presión) es baja, creándose un gradiente que impulsa el ingreso de sangre desde afuera hacia adentro del jet, de modo que éste se enriquece, representando la suma del flujo del jet entrante y la penetración de flujo estanco de la cámara de ingreso. El aumento de la masa del jet y la disminución de su velocidad se balancean en forma tal que el momento (flujo radial que entra y sale) se conserva, como se verá más adelante.
c) En un asa o rulo arterial ocurre una desviación del perfil de la línea media, dependiendo del perfil de entrada:si el flujo es laminar y el perfil de ingreso parabólico (Figura 3-C2), la inercia desplaza las velocidades mayores desde el centro axial hacia la pared externa;sin embargo, se destaca un flujo secundario separado en dos círculos paralelos pero de sentido opuesto, uno horario y el otro antihorario. Si el perfil de ingreso por el contrario es plano (Figura 3-C1), toda la capa tiene la misma inercia; las fuerzas centrífugas crean presiones elevadas en la pared externa, en lugar de desplazar las velocidades hacia fuera; por ley de conservación de energía las velocidades más pronunciadas están en el radio interno del arco. En la aorta, que posee una doble curvatura, esto ocurre en la primera de ellas, proximal; una vez que se crearon las turbulencias fisiológicas en esta zona, en la curvatura distal, el perfil se desplaza hacia fuera, encontrándose las mayores velocidades cerca de la pared externa.
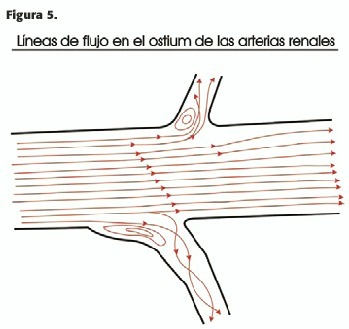
d) En las ramificaciones, sean éstas por bifurcación o colaterales, el área de cada una de las ramas hijas es menor que la arteria originaria; sin embargo,en el primer caso (bifurcación) la suma de las secciones de las ramas hijas es mayor que la de la principal; debido a que el flujo debe ser constante, debe existir una caída de la velocidad proporcional en cada una de las ramificaciones; en el caso de que éstas sean dos ramas hijas iguales (ej.arterias iliacas naciendo de la aorta)el flujo axial impacta contra el divisorio de flujo, creándose remolinos en la zona interna de ambas ramas hijas; el flujo es laminar y organizado en la porción externa de las mismas. En el caso de una ramificación lateral en ángulo más o menos recto (ej.arterias renales), la caída descripta de las velocidades reduce el Re, estabilizando el flujo; sin embargo puede ocurrir flujo bifurcado, con zonas de flujo rotatorio,predisponiendo al depósito de placas ateromatosas,las que,por ejemplo, ocurren frecuentemente en los ostium renales y vertebrales (Figura 5).
3) Viscosidad: El aumento de la viscosidad sanguínea estabiliza el patrón laminar de flujo y ocasiona un perfil parabólico más precozmente y más marcado.
Diagnóstico del tipo de perfil con el doppler:
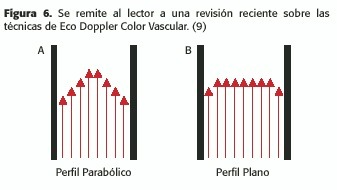
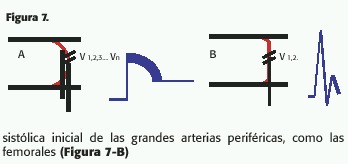
En el caso del perfil parabólico (Figura 6-A), la onda de Doppler medirá una pendiente de varias velocidades progresivamente decrecientes hacia la periferia,aunque el volumen de muestra haya sido colocado correctamente y sea lo más pequeño posible; como consecuencia, la rampa de ascenso o descenso de la onda Doppler está ensanchada, como ocurre normalmente durante la diástole en la carótida interna o las vertebrales (Figura 7-A).
En el flujo plano (Figura 6-B), existe la misma velocidad en gran parte de la sección del vaso; es decir que las velocidades sensadas son similares; la onda de Doppler pulsado es de ascenso limpio y angosto; esto ocurre normalmente en la fase sistólica inicial de las grandes arterias periféricas, como las femorales (Figura 7-B)
Flujo, velocidad y aceleración:
Con las técnicas de Doppler U.S. (ultrasonográfico) medimos velocidad y no flujo: ambos términos no son iguales; esta diferencia es muy importante dado que en todo el sistema arterial periférico flujo y velocidad difieren, con la excepción de la circulación intracraneal, donde, dada la uniformidad en el diámetro de las arterias en esta localización, existe entre ambos una correlación estrecha y, por lo tanto, flujo y velocidad podrían considerarse sinónimos.
Cuando la velocidad no permanece uniforme en el tiempo, se produce un cambio de la misma, algo similar a lo que ocurre al manejar un auto en una ciudad: aceleraciones y frenadas; es decir que la sangre, por efecto del bombeo cardíaco sufre aceleraciones y desaceleraciones; esta aceleración se mide por los cambios de velocidad en la unidad de tiempo:m/s o cm/s en la unidad de tiempo (s),o sea:m/s/s o cm/s/s (m o cm/seg2).
Si las velocidades máximas de un vaso sanguíneo son integradas, la integral es el área bajo la curva de velocidad en el tiempo 0 a t:d = 
Así como con la integral de velocidad conocemos la distancia atravesada en un tiempo dado, integrando la tasa de volumen (tasa volumétrica) obtendremos el volumen sanguíneo (V) (cantidad de sangre bombeada) que atravesó la luz (sección) de una arteria durante este tiempo (entre 0 y t): (2)V(t) = 
sería entonces:
(3)V =A .v .t
La tasa volumétrica de flujo (Qt)es.
(4)Qt =V (t)/t ;pero V =A .v .t o sea que Qt =A .v .t /t,
finalmente:
(5)Q =A .v
Es decir que la tasa de flujo (Q) es igual al área por la velocidad.
Cuando la velocidad varía a través de la sección del vaso, o sea que el perfil no es plano, la luz arterial puede ser dividida en áreas concéntricas pequeñas,de tal manera que la velocidad es constante en cada una de ellas (A1,A2....An);el flujo sanguíneo que atraviesa cada área produce cilindros de diferente volumen (An .v .t)debido a que v varía entre las distintas áreas; el volumen total que atravesó la sección en un período de tiempo (t) es igual a la suma de los volúmenes que atravesaron cada una de las áreas. Esto se define como flujo laminar.
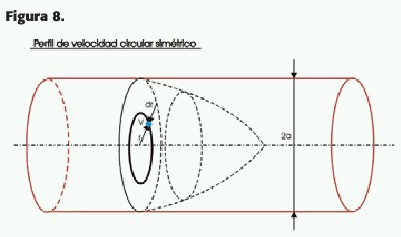
La tasa volumétrica (Q,t) puede ser calculada a partir del perfil de flujo; en el caso de que el vaso y el perfil de flujo sean circularmente simétricos, se puede asumir que el perfil de velocidad tiene el perfil de la forma v (r), donde r es una distancia determinada desde el eje o centro del vaso (R) con una velocidad máxima dada (v0)(Figura 8). El perfil de velocidad puede ser calculado con la fórmula:
o también:(7)v(r)=v0 [1 –(r /R)n ], donde v0 es la velocidad en el centro del vaso, v(r) es la velocidad en un punto cualquiera de la luz (r) y R es el radio del mismo;n es una constante para
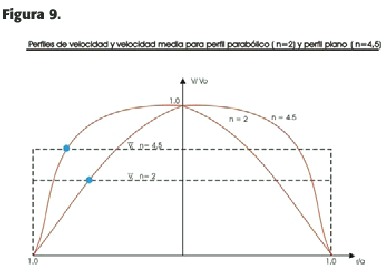
cada tipo de perfil,de modo que si n=2 el mismo es parabólico, y si n >2 el perfil es aplanado (Figura 9).
La velocidad media ( )en la arteria es:
v
Para el perfil parabólico (n =2):_=1/2 v0,o sea que en este tipo de perfil la velocidad media es la mitad de la velocidad máxima en la arteria;en caso de perfil plano donde, por ej.,n = 5,n /n+2,es 5 /5+2: /v =v0 .0,71.
Viscosidad sanguínea y perfiles de flujo:
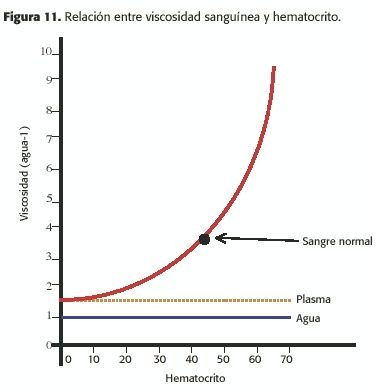
La viscosidad de la sangre normal (u) es de aproximadamente 3,5 x 10-2 P o de 3,5 x 10-3 Pa-s (Pascal/seg) [1poise(P) = 1dina/s/cm2 equivale a 10 pascales-seg (Pa-s)];esto está directamente relacionado con el hematocrito (Figura 11).
Cuanto mayor la viscosidad de un fluido,más se suaviza el movimiento del mismo. A bajas velocidades éste fluye a lo largo de líneas regulares; este patrón de flujo se llama laminar .
La fricción viscosa produce una resistencia al flujo; para mantener un flujo estable a través de un vaso se produce una caída de presión a lo largo del mismo:(9)
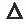 P /R.
P /R.  P =P1 –P2
P =P1 –P2
(caída de presión a lo largo del sistema).O sea que (10)R= P1-P2 /Q es decir que la resistencia al flujo (R)es directamente proporcional a la diferencia de presión e inversamente proporcional a la tasa volumétrica de flujo(Q).

Sabemos que Q = V/t V: volumen ; t: tiempo y V = A.L / t Cmo Q = A . v (A. Área y velocidad) , luego v = Q/A = Q/ñ. r2 Reemplazando R en (10) por (11):
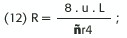
Por lo tanto una disminución del radio del vaso a la mitad precisa de un aumento de (2)4 (es decir ¡16 veces!)de la presión para mantener el flujo constante; si tenemos 3 vasos de 1,2 y 3mm de diámetro, a igual gradiente de presión que permita que por el primero pase 1ml/s, por el segundo pasarán 16ml/s,y por el tercero 81ml/s (a igualdad de presión de perfusión duplicar o triplicar el diámetro aumenta el flujo respectivamente ¡16 y 81 veces!);imaginemos la importancia que los cambios de la autorregulación en las pequeñas arterias tienen sobre el flujo sanguíneo.
Por otro lado, frente a tubos de igual diámetro interno el componente que determina la resistencia es la viscosidad. Sin embargo, esto es válido para tubos rígidos, inelásticos, sin ramificaciones ni circulación colateral, con flujo estable no pulsátil, de tipo Newtoniano, es decir, con viscosidad lineal (de tipo cristaloide);esto es sólo parcialmente aplicable al flujo pulsátil de nuestro sistema circulatorio arterial, que posee flujo pulsátil, elasticidad, numerosas anastomosis, autorregulación (vasodilatación y vasoconstricción)y capacidad de colateralización; esto será tratado a continuación.
En el cerebro, la resistencia vascular se ajusta por las arteriolas y vénulas, de tal modo que existe flujo cerebral constante con gradientes de presión de perfusión ("P1-P2") de entre 50 y 150 o más mmHg;cuando la autorregulación cerebral se agota, se aplica la ecuación (12), ocurriendo marcado aumento de la resistencia y caída secundaria de flujo si existe estenosis o espasmo de las arterias intracraneales.
Relación de la ley de Poiseuille con el flujo sanguíneo "in vivo ":
Debido a que esta ley física fue estudiada en condiciones de laboratorio en tubos rígidos, ¿cómo varían en un sistema circulatorio de flujo pulsátil,con arterias elásticas, ramificadas y de diámetro decreciente?
La Ley de Poiseuille asume:
1) Viscosidad constante,o sea relación lineal entre fricción viscosa y gradiente de velocidad (líquido newtoniano);
2) flujo laminar;
3) capa o lámina externa adyacente a la pared (interfase líquido-pared)con velocidad 0 (fenómeno de no deslizamiento o "no slippage");
4) flujo estable;
5) tubos con paredes paralelas de sección circular; 6) tubos rígidos,inelásticos.
Veamos uno a uno los puntos previos:
1) La sangre actúa como flujo newtoniano en la mayoría de las circunstancias examinadas por el Doppler, excepto en vasos muy pequeños (menores de 1mm de diámetro y con muy baja velocidad, así como con hematocritos menores a 10% o mayores al 60%); esto último puede ser importante en anemias severas o en E.P.O.C. o cardiopatías congénitas con policitemia marcada.
2) Escapan sólo ciertas zonas del sistema arterial, como la aorta ascendente, que pueden sufrir turbulencias transitorias al final de la sístole.
3) Existe velocidad 0 en la capa más externa.
4) Por supuesto, el flujo es pulsátil, con variación de los perfiles de velocidad, siendo frecuentemente no parabólicos; la aceleración se agrega al componente estable descripto por la Ley de Poiseuille.
5) Las venas y la arterias pulmonares son ovoides; sí son circulares las arterias sistémicas;al reducirse el diámetro arterial a medida que se acercan a la periferia (lo contrario ocurre con las venas hacia el corazón) las paredes no son paralelas, pero esto no representa un problema clínico.
6) Los vasos sanguíneos son distensibles (ver más adelante efecto Windkessel), cambiando el diámetro en función de la presión transmural, ocurriendo errores de por lo menos el 10%.
En resumen, las tres primeras suposiciones se cumplen en el sistema circulatorio humano; las últimas tres no. En general, la ley de Poiseuille sobreestima el flujo medio para un gradiente de presión, viscosidad sanguínea y diámetro vascular dados, especialmente en los pequeños vasos; sin embargo, los conceptos son cualitativamente correctos, sirviendo para la comprensión de las bases de la hidrodinámica y su estudio por técnicas como el Doppler.
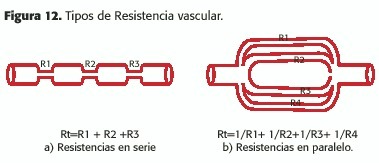
Los vasos sanguíneos progresivamente van reduciendo su diámetro, el determinante más importante de la resistencia; en menor medida lo es la longitud.Sin embargo, otro elemento a tener en cuenta es la disposición del sistema arterial; en efecto, las arteriolas se disponen no en serie,donde la resistencia es igual a la suma de las resistencias consecutivas (Rt =R1 +R2 .....+Rn) (Figura 12a), sino que lo hacen en paralelo; esta disposición permite que la resistencia sea igual a la suma de las conductancias (la inversa de la resistencia:C =1/R,o sea
que Rt =1/R1 +1/R2+1/Rn)(Figura 12b); sencillamente, esto permite que, al mismo tiempo que se da un gran área de intercambio a nivel capilar, y,aunque la mayor resistencia del sistema arterial se encuentre a nivel arteriolar (prácticamente la mitad), la misma sea muy inferior a la que hubiera sido de haber estado estos vasos en serie, de acuerdo a la ley de Poiseuille (aunque ésta no tiene en cuenta el hecho de que en vasos de menos de 1mm de diámetro adquiere un peso significativo en la distribución de la energía la resistencia viscosa).
Flujo turbulento:
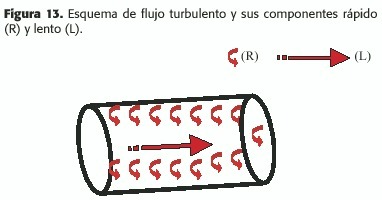
A medida que la velocidad aumenta,el flujo laminar sufre oscilaciones crecientes, tornándose progresivamente irregular, hasta transformarse en flujo turbulento, situación en la que las velocidades en cada punto de la luz cambian rápidamente, aunque la tasa volumétrica de flujo a lo largo de la sección del vaso tiene variaciones estables en el tiempo. El movimiento de los glóbulos rojos tiene dos componentes de velocidad: a) uno de variación lenta,a lo largo del eje del vaso (L),y otro b)de variación rápida,aleatorio (R)(Figura 13).
Debido a estos componentes transversales aleatorios rápidos (R), el gasto de energía (E) en forma de calor y de energía cinética es mucho mayor que en el flujo laminar, donde el único elemento responsable de pérdida de E.en condiciones fisiológicas es la fricción viscosa,como ya se vio;por lo tanto, la resistencia al flujo aumenta en la progresiva transformación de éste de laminar en turbulento.
El número de Reynolds se usa para caracterizar el patrón de flujo:

Las situaciones fisiológicas:

En la zona prelesional (d:0,6cm);v:50cm/s;Re =857.
En la zona de máxima reducción del diámetro (estenosis): d:0,18cm;v:185cm/s:Re =951.
En el punto postestenótico inmediato,cuando aún no hubo una recuperación de la energía potencial y sí ocurre flujo a alta velocidad en luz de diámetro nuevamente normal o casi, en Re es de:d:0,6cm;v:180cm/s;Re =3171; esto explica la presencia de flujo laminar frecuentemente en el punto de máxima estrechez y la máxima turbulencia en el segmento postestenótico cercano; ambos patrones son fácilmente detectados por la morfología de onda de Doppler pulsado, en especial a nivel de la ventana acústica espectral.
Una forma levemente diferente de definir el número de Reynolds es expresarlo por medio de la tasa de flujo volumétrica (Q);sabemos por (5)que v =Q/A y reemplazando en (13):
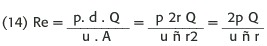
Esto explica por qué en una estenosis,cuando el flujo es constante, la reducción del área produce flujo turbulento; también por qué ocurren turbulencias sin estenosis en situaciones clínicas de aumento del flujo sanguíneo.
Si bien los conceptos de flujo laminar y turbulento fueron estudiados en condiciones de flujo estable y con fluidos newtonianos, se pueden trasladar ciertas condiciones al flujo pulsátil del sistema circulatorio. La gran diferencia es la presencia de aceleración y desaceleración. La primera tiene un efecto estabilizador del flujo, con aplanamiento del perfil y restitución de las láminas o capas del flujo laminar perdidas durante la fase de desaceleración del ciclo previo (al perderse la aceleración durante la diástole sólo quedan la fuerzas inerciales, desapareciendo las viscosas); las primeras están como numerador en la fórmula de Reynolds, es decir se favorece la turbulencia.
En condiciones de flujo pulsátil este número puede ser reemplazado por el Número de Womersley que incorpora a la ecuación anterior un componente (w)que es la frecuencia angular de la frecuencia cardíaca (f):w =2 ñ f, con lo que incluye los efectos del tiempo sobre el Re (requerido para el desarrollo de la turbulencia en este sistema pulsátil):
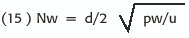
Flujo laminar y "Shear Stress "(tensión de roce):
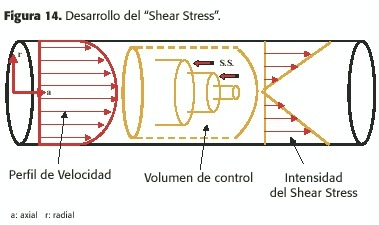
Como ya se dijo, en condiciones de flujo estable, la sangre fluye en capas concéntricas de igual velocidad, con una caída de presión a expensas de la viscosidad (fricción viscosa)que se opone a dicho movimiento;la capa más externa, debido a la elevada fricción que la adhiere a la interfase líquido-sólido que ocurre entre la sangre y la pared arterial permanece inmóvil (fenómeno de no deslizamiento o "no slippage "); cada una de las capas tiene un volumen progresivamente creciente desde el centro hacia la periferia,es decir que su superficie externa en contacto con capas cada vez más periféricas, es mayor, siendo por lo tanto cada vez mayor la resistencia viscosa, a igual presión ("empuje") aplicada a cada una de ellas;esta fuerza opuesta a la circulación de la sangre (llamada "shear stress") produce un retardo sucesivo desde el centro hacia la periferia del vaso; esto puede ser considerado también como la transferencia del "momento" (o fuerza tangencial al eje de circulación) entre las distintas capas de fluido concéntricas hacia la pared arterial; este shear stress está directamente relacionado con la viscosidad de la sangre y con el gradiente de velocidad entre las capas, e inversamente a la distancia entre éstas,es decir cuanto más vecinas,mayor la fricción viscosa (fig.14).
Esto se representa por la fórmula:
(16)S.S.= - u &V / & r u:viscosidad; &v:diferencia de velocidad;
&r:distancia entre dos capas.
El signo negativo a la izquierda del término derecho indica que el shear stress (S.S.)se opone a la dirección del flujo.
Al inicio del vaso el flujo es plano pues todas las capas, como se dijo, reciben igual presión, pero a medida que la sangre fluye, el roce entre las capas vecinas, más acentuado desde el centro hacia la periferia, ocasiona que las capas centrales avancen más rápido;obviamente, existe una zona de transición entre el flujo plano de inicio y el perfil parabólico que se va formando, fenómeno llamado desarrollo de la capa límite o "boundary layer development"; después de un trayecto variable (largo de penetración –L.P.-o "entrance length ") el perfil se estabiliza y se torna establemente parabólico; dicho trayecto de penetración está relacionado con el número de Reynolds: (Figura 3-A)(ver más adelante).
(17)L.P.= 0,03 .d . Re.= 2r . 2r .v .p /u =0,03 .4 .r2 .v .p /u =r2 .v .p /u;
como la densidad (p)y la viscosidad (u)son constantes, la longitud de penetración está directamente relacionada con la velocidad y el tamaño del vaso.
Esto explica por qué en pocas zonas del organismo se obtiene un perfil parabólico estable; una excepción son los vasos abdominales, de baja velocidad y flujo (bajo Re), longitud y diámetro adecuados. En una arteria iliaca de 0,8cm de diámetro y velocidad de 1m/s, el Re sería de 2300 y la distancia en la que se obtendría perfil de flujo parabólico estable: 55cm.
Esta zona de desarrollo del perfil es lo que mide el Doppler.
Como se dijo, el perfil del flujo turbulento tiende a ser plano por la interacción de las capas vecinas, con tranferencia radial más uniforme de las capas de alta velocidad cerca del centro del vaso; el flujo se vuelve completamente desarrollado antes que en el flujo laminar, y, a pesar de que la naturaleza caótica y azarosa del mismo impresiona como imposible de predecir, esta longitud de penetración se puede calcular con una derivación de (17):(18)L.P.(para flujo turbulento) = 0,693 .d .Re 1/4
El organismo tiene mecanismos endoteliales de regulación del S.S.relacionado con el flujo; en efecto, existen a nivel endotelial sensores de velocidad sanguínea que, actuando por estímulos neurohumorales (a través de las uniones mioendoteliales) y autocrinos (óxido nítrico y/o prostaciclina –PGI2), ajustan la luz arterial por regulación vasomotora (vasoconstricción y vasodilatación)(autorregulación)de forma que mantienen niveles estables de velocidad sanguínea [por(5)] y, en consecuencia, de S.S.(10).
Transmisión de ondas de presión y flujo:
Dado el bombeo periódico cardíaco, la presión y el flujo arteriales son pulsátiles; la elasticidad de la pared arterial se combina con la inercia sanguínea de modo que ambos (presión y flujo) viajan como las ondas en la superficie de un lago, con una velocidad de onda de 5 a 10m/s, o sea, muchas veces mayor a la de la sangre, lo cual produce demoras en la transmisión de los pulsos periféricos; las ramificaciones arteriales causan reflexiones que cambian la forma de aquellos; esta es la razón de la diferente morfología entre los pulsos de la aorta y las femorales, por ejemplo.
La presencia de pulsaciones introduce cuatro variables de interés desde el punto de vista de los estudios Doppler de la circulación periférica. Primero, ocurren las fuerzas inerciales asociadas con la aceleración y desaceleración de la sangre (ver más adelante, ecuación de Bernoulli modificada para el flujo pulsátil). Al producirse la movilización de la columna sanguínea, se necesita una fuerza o presión para vencer las fuerzas inerciales asociadas con la aceleración más la requerida para vencer la fricción viscosa que se opone al movimiento de la misma; las pérdidas de energía (presión) por fricción viscosa son significativas en las fases de aceleración y desaceleración del ciclo cardíaco, es decir al inicio y final de la sístole (pues durante la máxima velocidad la aceleración es nula), en orificios pequeños (menores de 0,1cm2) y estenosis largas (mayores de 4cm).
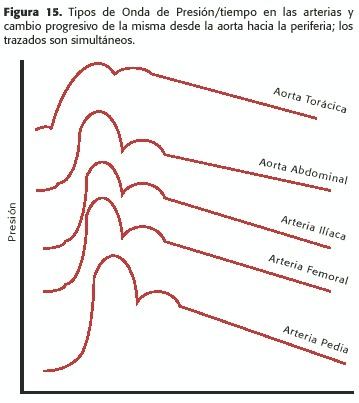
Segundo, producen cambios en el tamaño y forma de las ondas de presión y flujo a medida que viajan por el sistema circulatorio. Si la aorta no tuviera flujo pulsátil, la presión caería muy poco, y la amplitud del pulso también disminuiría; debido a las pulsaciones, existe una reflexión de las ondas en la periferia; la discontinuidad en la impedancia (resistencia en flujo pulsátil) como la que ocurre en las ramificaciones arteriales produce reflexiones de la onda de pulso; sin embargo, la zona que más contribuye a éstas es la de las arterias menores a 1mm (arteriolas), por lo que el estudio con Doppler de la onda de pulso (índices de pulsatilidad por ej.)es reflejo de los cambios en la impedancia periférica secundarios a vasodilatación o vasoconstricción; cuando dicha onda de reflexión se suma a la de pulso, ésta aumenta; el efecto es más notable en los chicos (existe una demora por la elasticidad arterial que se reduce con la edad, es decir que en los gerontes ambas ondas de pulso anterógrado y de reflexión se antagonizan parcialmente):una presión de pulso (diferencial)en la aorta ascendente de 50mmHg se transforma en una de 65mmHg en la aorta distal, y es aún mayor en la femoral (Figura 15); también cambia la forma de la onda hacia la periferia, con ascenso sistólico más empinado y un pico positivo tardío más acentuado; existe una demora de alrededor de 50ms a través de toda la aorta y de alrededor de 100ms hasta la femoral. Los efectos de la reflexión (determinados por la elasticidad o compliance arterial y la inercia de la sangre) son opuestos sobre las ondas de flujo y velocidad con respecto a la de presión; mientras ésta aumenta hacia la periferia por aumento de la presión de pulso, las dos primeras se atenúan, disminuyendo la amplitud; sin embargo, el flujo diastólico aumenta en las arterias más distales; en éstas predominan los efectos de la conductancia periférica (C =1/ R), mientras que en las proximales, como la aorta ascendente, se notan los efectos contráctiles del corazón, con una onda de pulso marcada y descenso a 0 durante la diástole, como ocurre en el ventrículo izquierdo. En las arterias del abdomen se produce flujo diastólico importante por el efecto de bomba secundaria (ver más adelante); en las ramas distales a la aorta se producen inversiones de flujo dadas por la diferencia de presión impuestas por el retardo en la transmisión de la onda de presión descripta precedentemente.Tercero, debido a la naturaleza elástica de los vasos sanguíneos, se producen cambios latido a latido en el diámetro de los mismos a medida que las ondas los atraviesan, en función de la presión transmural; esto debe ser tenido en cuenta en los análisis cuantitativos de flujo efectuados con Doppler, donde el diámetro del vaso es esencial.
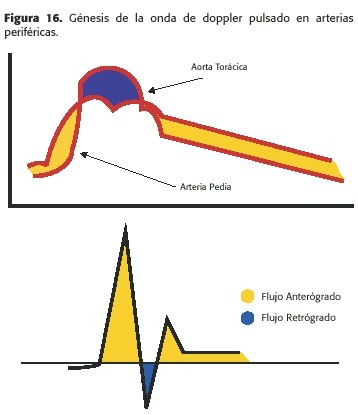
Cuarto, y de mayor importancia, alteran el perfil de velocidad en varios puntos de este sistema, tanto en sentido espacial como temporal, dependiendo del vaso en consideración y del momento del ciclo cardíaco; en el final de la diástole, por la desaceleración y la adherencia por fricción viscosa cerca de las paredes arteriales ocurren fenómenos de reversión de flujo; éstos, junto a la diferencia de presión que existe entre dos puntos del circuito arterial por el retardo antedicho (Figura 2b y Figura 16), explican el flujo reverso marcado que ocurre normalmente en arterias como las femorales.
En el caso de una estenosis significativa, existe vasodilatación por isquemia distal, lo que baja la impedancia periférica; el flujo pulsátil se altera al pasar por la zona estrechada (ésta actúa como un filtro para las vibraciones de alta frecuencia del pulso de presión); tanto la resistencia que significa la estenosis, como la conductancia distal aumentada amortiguan más allá de la misma la amplitud del pulso; la presencia de ondas atenuadas y flujo diastólico acentuado pueden deberse tanto a una disminución de la impedancia periférica como a una estenosis/oclusión proximal o a ambas.
Las grandes arterias centrales tienen paredes predominantemente elásticas, lo cual les otorga una compliance importante, con almacenamiento de energía potencial, la que se convierte en cinética en la diástole, alimentando las arterias más distales (como las del abdomen) manteniendo un flujo continuo por amortiguación del efecto pulsátil del corazón; esto se conoce como "efecto Windkessel ") o de bomba secundaria (ver más adelante).
Interrelación entre presión, velocidad y resistencia:
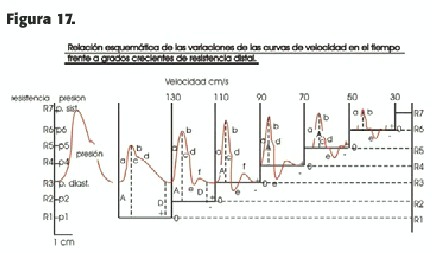
Cuando existe un flujo en un sistema cerrado, éste ocurre con una velocidad determinada, de modo que, si el área vascular permanece uniforme, es función lineal de esta variable; dicho flujo se efectúa contra una resistencia al mismo, que en la circulación periférica normal depende de la impedancia (determinada por la autorregulación del flujo, es decir por la vasoconstricción o la vasodilatación) y en condiciones patológicas por la presencia de estenosis; el cambio en el flujo depende entonces de cambios en la resistencia normal o patológica y se refleja en cambios en la velocidad sanguínea en el tiempo, es decir en la onda de velocidad que medimos con el Doppler; a la inversa, la evaluación de ésta permite descifrar las condiciones del sistema circulatorio normal y detectar y cuantificar la presencia de cambios patológicos; este análisis permite, mediante la comparación con patrones considerados normales para un lecho vascular determinado, conocer cambios por autorregulación o secundarios a patología significativa distante, proximal o distal, a la zona de análisis. Frente a una curva de velocidad -tiempo determinada, con flujo permanente durante todo el ciclo cardíaco, los cambios en la resistencia periférica modifican el perfil de la misma, graficados en la onda de Doppler pulsado; imaginemos distintas situaciones con aumentos progresivos de la resistencia al flujo.(Figura 17)(11)
Si la resistencia (impedancia) al mismo fuera casi nula, no habría prácticamente modificaciones:la velocidad sistólica (S) sería elevada, pero mayor, comparativamte, sería la velocidad diastólica (D),(ej.1);esto ocurre en la circulación normal de los órganos nobles como el cerebro, es decir es el trazado típico, por ej., de una carótida interna normal.
Ante un leve incremento de la resistencia, se reduce S, pero más lo hace D; esto ocurre, por ejemplo en una carótida primitiva, 70% de cuyo flujo alimenta el cerebro (ej.2).
Si aumentamos algo más la resistencia,ocurre una disminución mayor de S, pero D es muy baja (ej.3); esto ocurre en una arteria como la subclavia o la axilar.
Un mayor aumento de la resistencia deprime aún más S, pero D es nulo; incluso puede existir normalmente flujo reverso (ej.4); esta es la situación normal de una arteria que irriga mucha masa muscular en reposo, como la arteria femoral (los miembros inferiores tienen mayor masa muscular que los superiores).
Ante un gran aumento de la resistencia al flujo, la onda cambia de tal forma que S es aún más pequeña y, por supuesto, D ausente (ej.5); esto ocurre en zonas preoclusivas, como la carótida primitiva, en oclusiones o lesiones críticas (generalmente mayores al 90%) de carótida interna homolateral; es dramática la asimetría en la morfología de ambas carótidas primitivas cuando se compara el lado enfermo con el sano, siendo un elemento importante de diagnóstico de severidad de la lesión. Una resistencia total al flujo, como ocurre en la zona inmediatamente preoclusiva de una carótida interna ocluída, (ej.6), muestra una onda de Doppler embrionaria, bifásica, que no guarda ninguna relación con lo normal (comparar con el ej. 1); en la zona ocluida el flujo no existe (situación 7).
Función fisiológica de las grandes arterias:
El sistema arterial posee dos funciones interrelacionadas: la función de conducción (de la que depende el aporte adecuado a las necesidades metabólicas de los tejidos periféricos) y una función de amortiguación (la que permite que este aporte sea continuo y no pulsátil, a partir de la transformación de la eyección sistólica ventricular intermitente).
Función de conducción:
Para satisfacer los requerimientos metabólicos de los tejidos periféricos debe existir un flujo arteriolocapilar continuo y estable; para lograr este flujo estable, debe aplicarse a la columna sanguínea arterial una presión estable, con la finalidad de superar las pérdidas de energía, fundamentalmente a partir de la resistencia viscosa (fricción) y la viscosidad, de acuerdo a lo descripto por la ecuación de Haagen-Poiseuille:esta función conductora de las arterias depende de una presión (media) y de un flujo sanguíneos estables; la relación entre ambos establece la resistencia vascular, como ya se explicó. La presión arterial media (definida como la relación entre el área de la curva de presión dividida por el tiempo transcurrido) depende del gasto cardíaco y de la resistencia vascular periférica; la eficiencia de esta función de conducción depende del diámetro de los vasos y de la estabilidad de la presión arterial, con un muy discreto descenso (gradiente) de la media entre las cúspides aórticas y las arterias periféricas; para compensar el aumento de la sistólica distal se produce un decremento correspondiente de la diastólica; ello permite un flujo centrífugo adecuado.
Función de amortiguación:
Por esta función las arterias amortiguan el efecto intermitente de bombeo, transformando las oscilaciones de la presión secundarias a la eyección cardíaca intermitente; las grandes arterias acomodan este volumen eyectado, almacenando parte de él para liberarlo durante la diástole, permitiendo una perfusión tisular continua; esta función consiste en una transformación de la energía cinética en potencial (ver más adelante) y se denomina "bomba secundaria " o "efecto Windkessel ".
Durante la sístole el ascenso de la curva de presión hasta llegar al pico depende de la capacidad de eyección ("performance ") del ventrículo izquierdo y de la distensibilidad arterial, en especial de la aorta ascendente; la presión arterial sistólica será mayor si la pared arterial está endurecida; después del cierre de las sigmoideas aórticas la presión arterial gradualmente cae a medida que la sangre se escurre hacia la periferia; la presión arterial diastólica mínima es determinada por la duración de la diástole y la tasa de descenso de la presión; esta última está determinada por la tasa de egreso ("outflow ")o drenaje (es decir la resistencia periférica) y por las propiedades viscoelásticas de las arterias; para un determinado nivel de resistencia periférica la caída en la presión diastólica será mayor si la rigidez de la pared arterial está aumentada. También las propiedades viscoelásticas de las arterias determinan la rapidez de propagación de la onda de pulso (velocidad de onda de pulso) y del tiempo de reflección de la misma en forma anterógrada en la periferia y en forma retrógrada, antagonizando la nueva onda recién emitida; por lo tanto, el endurecimiento arterial produce un aumento en la velocidad de propagación de la onda de pulso y, por lo tanto, de un retorno más precoz de la misma; la sumatoria de ambas ondas (la que regresa y la recién formada que se dirige en forma anterógrada) aumenta aún más la presión diferencial de pulso y la presión sistólica, disminuyendo las velocidades diastólicas; esto tiene implicancias en los cambios de las ondas de Doppler de los estudios vasculares secundarios a la edad y a procesos patológicos como la hipertensión o la aterosclerosis.
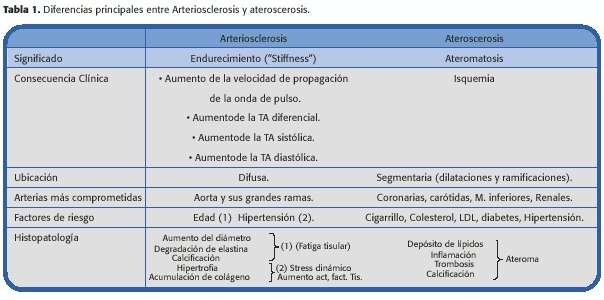
Al respecto existe una confusión entre los términos arteriosclerosis (endurecimiento arterial) con aterosclerosis (ateromatosis), el proceso de lesiones arteriales segmentarias producido por placas tromboestenóticas (Tabla I).
Sin embargo, ambas patologías pueden estar interrelacionadas y ocurrir en un mismo individuo,aunque no necesariamente; la patología aterosclerótica altera secundariamente las propiedades viscoelásticas de las grandes arterias, y, por lo tanto, la rigidez de las mismas (arteriosclerosis).
Existen datos epidemiológicos provenientes de estudios poblacionales con muchos miles de pacientes que sugieren un rol importante del endurecimiento arterial en el pronóstico de los pacientes hipertensos, así como en la cardiopatía isquémica.
Determinantes del endurecimiento arterial:
La composición, así como la distribución estructural de las arterias, determinan la distensibilidad de las mismas, principalmente esto es válido para las células musculares lisas, el colágeno y las proteínas elásticas; también de las interacciones entre estos componentes de la pared (células y matriz extracelular), que son mediadas por proteínas de adhesión (fibronectina -productora de nuevo colágeno en la pared-y laminina, y sus receptores, las integrinas); la estimulación de estos promueve la adhesión y migración celulares, y un cambio en el fenotipo de las células musculares lisas, de un estado contráctil a otro sintético. O sea que las proteínas de adhesión y sus receptores son fundamentales para controlar el tono arterial y regular la elasticidad/dureza arterial;estos procesos tienen importantes efectos en las arterias, a través de fractura, ruptura, formación de aneurismas y el desarrollo de aterosclerosis (ateromatosis).
Los dos factores más comunes que producen endurecimiento de las arterias son la edad (envejecimiento) y la hipertensión, los que pueden ser modulados por factores genéticos y ambientales.
a) Edad:
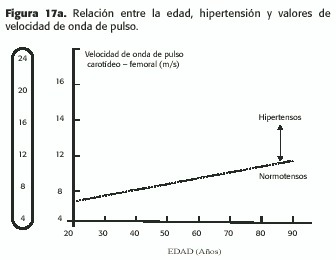
La misma produce a nivel de las grandes arterias aumento del diámetro y del grosor parietal arterial,de la fragmentación de la elastina, de la calcificación y del contenido de colágeno, procesos más evidentes a nivel de las arterias centrales (aorta torácica y carótidas) que en las más periféricas (femorales o humerales). El endurecimiento arterial secundario a la edad es acompañado por un ascenso de la presión sistólica de 25 a 35mmHg entre la tercera y la octava década en sujetos sanos. Aunque la edad y la hipertensión deterioran la elasticidad arterial, el mecanismo no es el mismo: el aumento del diámetro arterial y la degradación de los componentes elásticos son los principales responsables de los cambios durante el envejecimiento (determinantes de la fatiga tisular); en la hipertensión se destacan la hipertrofia y la acumulación de colágeno, secundarios al stress mecánico y a la estimulación aumentada de factores tróficos humorales. A pesar de estas diferencias, los cambios estructurales secundarios a la edad son acelerados en presencia de hipertensión (Figura 17a) y pueden ser evaluados a nivel aórtico o carotídeo (medición del espesor íntima media, de la velocidad de la onda de pulso,etc.).
En el pasado, el endurecimiento arterial y el ascenso sistólico de la presión arterial eran considerados procesos "normales "del envejecimiento, pero los estudios epidemiológicos demostraron que los hipertensos más ancianos con endurecimiento arterial e hipertensión sistólica y de pulso (diferencial) aumentadas padecen de mayor morbimortalidad cardiovascular, y que el descenso terapéutico de estas cifras reduce los eventos, especialmente a nivel cerebrovascular y coronario.
Por lo tanto, si bien los cambios deletéreos en la elasticidad arterial y en la presión sistólica y diferencial son comunes, deben ser considerados factores mayores de riesgo para eventos cardiovasculares.
b) Hipertensión arterial:
Además de las alteraciones citadas en la pared arterial de los hipertensos, cambios hormonales locales en la misma determinan desviaciones en la curva presión/elasticidad, modificando el crecimiento celular y la síntesis de matriz extracelular; la misma hipertensión per se es un determinante fundamental de cambios en la distensibilidad arterial: la misma está más alterada en las arterias centrales como la aorta que en las más periféricas, como las humerales, a pesar de grados similares de hipertrofia; por otra parte, la misma es similar en sujetos hipertensos que en normotensos para iguales cifras de presión arterial, a pesar del mayor grado de hipertrofia de las arterias de los primeros; la causa de esto es oscura, pero es evidente que los cambios en la pared arterial por sí solos no son responsables de las alteraciones de la elasticidad, y es posible que cambios genéticos determinen alteraciones en la matriz extracelular arterial en la hipertensión.
En resumen, en aquellos hipertensos en quienes se desarrollan alteraciones en la elasticidad de las grandes arterias, la hipertensión se verá agravada, a través de un aumento de la hipertensión sistólica y diferencial o de pulso, y los mismos deben ser identificados.
Además de los estudios epidemiológicos que demostraron el riesgo aumentado de la hipertensión arterial para eventos cardiovasculares, el papel de la hipertensión sistólica, diastólica y de pulso han sido discriminados. La hipertensión arterial diastólica está más fuertemente asociada a riego cardiovascular en los hipertensos jóvenes menores de 45 años, mientras que la sistólica lo está después de esta edad; la relación entre ambos componentes, la presión diferencial o de pulso, así como la presión arterial sistólica estuvieron relacionadas casi exclusivamente con cambios cardíacos, por ejemplo con el grado de hipertrofia miocárdica y con el riesgo de mortalidad por cardiopatía isquémica en las mujeres mayores de 55 años; la presión arterial media y la diastólica están asociadas al riego cardiovascular total, comprometiendo el cerebro, el corazón y los riñones. Además, un dato interesante que muestran la mayoría de los estudios epidemiológicos sobre hipertensión arterial es que, si bien la curva de riesgo cardiovascular y las cifras de P.A. tienen una relación linear (cuanto mayor la P.A. mayor el riesgo), esto es cierto para cifras de P.A.diastólica mayores a 85 o 90mmHg, y la relación linear no sería real para valores inferiores; aquí comenzaría a observarse una curva en "J"o en "U", es decir, que por debajo de estos valores de P.A. diastólica el riesgo,paradójicamente, sería mayor; esto sería válido tanto para hipertensos tratados como aquellos no tratados; esto es especialmente cierto para los hipertensos portadores de cardiopatía isquémica, con un aumento de la mortalidad para valores de P.A. menores a 85mmHg; por el contrario, la relación entre la P.A.sistólica y la mortalidad cardíaca sí es linear, aún para valores muy bajos de la misma; esto sugiere que un descenso marcado de la P.A.diastólica pero no de la sistólica puede ser peligroso, especialmente en pacientes portadores de isquemia miocárdica.
En un estudio epidemiológico de más de 2000 pacientes con enfermedad cardiovascular, una elevada P.A.diferencial o de pulso (>de 63mmHg) pretratamiento (elasticidad arterial disminuida), se asoció con un riesgo de eventos tres veces mayor durante el tratamiento antihipertensivo, y sólo en este grupo de P.A.diferencial aumentada se observó la relación en "J "entre P.A.diastólica e infarto de miocardio, sugiriendo que en este tipo de pacientes con endurecimiento arterial el descenso terapéutico de la resistencia periférica puede causar un excesivo descenso de la P.A.diastólica, con reducción secundaria de la perfusión coronaria.
En resumen, el endurecimiento arterial (especialmente el aórtico) favorece la isquemia miocárdica, a través de un doble mecanismo: por un lado reduce la P.A.diastólica (y,como se dijo, la perfusión cardíaca) pero también aumenta la P.A. sistólica, la tensión parietal y el consumo de O2 miocárdico. La medición de la elasticidad de las grandes arterias es un dato pronóstico muy importante (algo similar a lo que ocurre con la presencia de hipertrofia miocárdica en el ECG o el ecocardiograma), aunque es mucho más difícil de evaluar, especialmente en grandes estudios epidemiológicos.
Principios de conservación:
Las leyes de conservación de la masa (m), la energía (E) y el momento (M) explican el funcionamiento del aparato circulatorio.
Conservación de masa (m):
Es el principio más fundamental de estas tres leyes de conservación. Dentro de un fluido incompresible en movimiento, podemos definir un volumen de estudio de cualquier forma y tamaño (generalmente estos se corresponden con los del sistema); esto se llama volumen de control; debido a esta ley, la cantidad de fluido que entra al volumen de control es igual al que sale.Masa =volumen x p (densidad).Si m 1 =m 2 , y el volumen de flujo es Q:
(19) Q1 .p1 =Q2 .p2 ;p es constante,o sea que Q1 =Q2 pero por (5)Q =A .v, donde v es la velocidad y A el área de sección de modo que:
(20)Q1 =A1 .v1 =Q 2 =A2 .v 2 (Figura 10).
Esta ley de conservación de masa se conoce como la ley de la continuidad y es de gran utilidad en el cálculo de flujo y de severidad de estenosis valvulares cardíacas, aplicada junto al principio de conservación de la energía.
Conservación de la energía (e):
La explicación práctica de este principio puede semejarse a lo que ocurre con una bola de billar que es colocada en la parte más alta de una pendiente; en este momento, tiene una energía potencial proporcional a la altura de la misma (esta forma de energía potencial depende de la gravedad); si se la suelta, comenzará a moverse, transformando la misma en energía cinética [cuyo valor es igual al cuadrado de la velocidad (v)], dependiendo del punto de declive en que se encuentre la cantidad de una u otra forma de energía, pero la suma total de ambas es la misma siempre.
La E. Potencial gravitatoria se describe por: p.g.h (donde p es la densidad, g la aceleración por la gravedad y h la altura). Otro ejemplo es lo que ocurre al inflar un globo:el aire se acumula a cada vez a mayor presión, inmóvil, distendiendo las paredes del mismo (ésta es la energía potencial dependiente fundamentalmente de la presión acumulada); al soltar el cuello de ingreso, el globo se desinfla, transformándose la mayor parte de la energía potencial en cinética, pero aquí notamos otro hecho: el cuello se calienta con la salida rápida del aire hasta, a veces, quemarnos los dedos que lo sostienen; una parte de la energía también se transformó en calor; obviamente, en todo el ciclo la suma de las energías es la misma. La energía cinética es descripta por la ecuación:1/2pv2 (o de aceleración convectiva), dado que es la E consumida para "empujar "la sangre en una región de alta o baja velocidad, lo que puede ocurrir en casos de flujo estable o pulsátil.
Para el ejemplo de la bola de billar, donde la pérdida de E por roce es despreciable, podemos describir el fenómeno entre las energías potencial (P) y cinética, así:
P1+1/2pv1 =P2 +1/2pv2
En el caso del globo, la pérdida de energía por roce, que se transforma en calor (o resistencia viscosa, Rv) es significativa;entonces, deberíamos describir el fenómeno:
P1 +1/2pv1 = P2 + 1/2pv2 + Rv.
El movimiento de los fluidos Newtonianos también puede describirse en estos términos, que se conocen como la Ecuación de Bernoulli :
(21) E =P +pgh +1/2pv2 +Rv
Comprende un componente de energía potencial o de presión, uno de energía gravitatoria, otro de energía cinética y otro de resistencia viscosa.
En el caso del sistema cardiovascular pulsátil, se agrega un componente dado por la pérdida de energía que se produce con la aceleración de una masa de sangre (energía inercial): para acelerar un fluido se necesita una fuerza que depende de su masa (m) y de la aceleración (a), es decir F =m .a; como a =dv/dt (derivada de la velocidad con respecto al tiempo),luego:F =m .dv
dt
La velocidad media es la distancia recorrida por la sangre en un tiempo t; con el Doppler podemos calcular dicha distancia con la integral de la onda de velocidad. Esto se representa por:
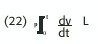 (L es la distancia a recorrer)
(L es la distancia a recorrer)
esto implica que la magnitud de la caída de presión por la E. Inercial depende del gradiente de velocidad (dv)y de la longitud de la lesión (L).
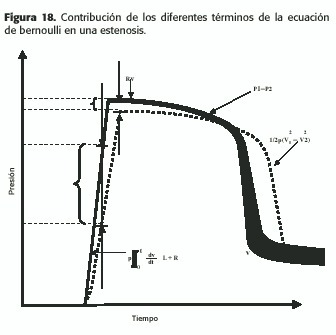
Este último término se denomina energía inercial y es función de la aceleración local, la cual es significativa al inicio y al final de la sístole, es decir, en los períodos de aceleración y desaceleración; si este término se ignora, la presión calculada a partir de la ecuación de Bernoulli ocurre con una demora con respecto a la realidad, causando errores en las mediciones, especialmente al inicio de la sístole, pero sin impacto clínico. (Figura18)En el caso de una estenosis se pierde energía como consecuencia de la resistencia viscosa (en proporción inversa a la cuarta potencia del radio), fundamentalmente como calor; también en caso de un flujo pulsátil se pierde energía adicional para forzar el movimiento de la sangre con mayor velocidad a través de la estenosis.
La Ecuación de Bernoulli es sumamente compleja para ser usada clínicamente; como varios de sus términos carecen de importancia en la mayoría de las situaciones clínicas (como el de la energía inercial), se idearon formas simplificadas de la misma, utilizadas para el cálculo de estenosis valvulares; en la mayoría de las estenosis valvulares cardíacas el término de resistencia viscosa puede ser ignorado; y, si medimos dos puntos vecinos, de tal forma que la diferencia de gravedad entre ellos sea prácticamente nula, g también puede ser desechado; como p/2 es casi igual a 4, queda entonces el término de energía cinética (4 v12 -v22 ); como V1 es despreciable respecto a V2, también puede descartarse,quedando la ecuación simplificada tan conocida:P1 –P2 =4v22.
Esta ecuación simplificada no es aplicable en los casos en que los otros términos sí tienen importancia clínica, es decir aquellas en las que la inercia y la resistencia viscosa significan una parte importante de la energía del sistema.
Estudios de laboratorio (12) mostraron que en orificios menores a 3,5mm de diámetro (o menos de 0,1cm2), en lesiones largas (mayores a 4cm) o cuando existen caídas de presión de menos de 70mmHg, la resistencia viscosa es significativa y las caídas reales de presión exceden las calculadas según la ecuación simplificada; en estos casos, la ecuación de Haagen-Poisseuille puede ser más correctamente utilizada para cálculos de caída de presión; tampoco es aplicable en casos de estenosis en serie (en "tandem").
Esto explica la inaplicabilidad de la ecuación simplificada de Bernoulli en los estudios de la vasculatura periférica, incluso la coronaria.
Sin embargo, en términos sencillos, esta ecuación completa (y compleja) describe las distintas formas en las que la energía se va transformando a medida que la sangre circula; es válida tanto para sistemas de flujo estable como inestable (pulsátil), y así es como debe ser interpretada; más adelante veremos ejemplos en los que la misma se aplica a situaciones diarias tan dispares como la arteriosclerosis o el porqué vuelan los aviones.
"Gold standard" para la medición de presiones: relación del doppler pulsado/cateterismo:
La comparación de las mediciones de presiones entre la técnica de Doppler y la efectuada por medio de catéteres debe ser cuidadosamente diferenciada, pues ambas miden cosas diferentes en el espacio y en el tiempo.
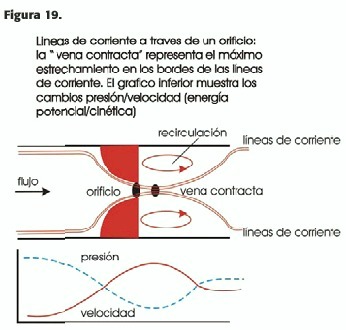
En el espacio: (Figura 19) se llaman líneas de corriente ("streamlines") a aquellas líneas de flujo que unen puntos siempre paralelos a la dirección del mismo (tangentes); se llama "vena contracta" a una contracción de los bordes de estas líneas a medida que se acercan al orificio estenótico; a medida que el flujo pasa por el mismo, éstas lo "estrujan" en una zona inmediatamente distal a aquel, fenómeno llamado "efecto de la vena contracta"; por el fenómeno descripto previamente, se produce una separación del flujo y una zona de recirculación del mismo; la zona de máxima velocidad entonces está justo por delante y no en la misma estenosis, en ese "sendero estrecho" marcado por las líneas de corriente; ésta es la zona de máxima transferencia de energía (potencial a cinética), por lo que es donde ocurre la mayor caída de presión; distalmente, se produce una desaceleración (zona de "recuperación de la energía potencial " o de presión);esta recuperación depende del número de Reynolds (Re)(como ya se explicó)y de la forma del orificio. Con Re bajos o altos esta recuperación no es tan significativa (debido, respectivamente, a la energía de resistencia o fricción viscosa y a la turbulencia o energía inercial) como lo es a Re moderados, que es una situación muy común en la clínica. Cuando la recuperación potencial o de presión es significativa las técnicas de catéter subestiman el gradiente (el mismo debe ser colocado justo en la zona de vena contracta, lo que es prácticamente imposible). También esta recuperación potencial depende de la forma del orificio: si éste es de bordes afilados producirá turbulencias a velocidades más bajas (con gran efecto de recuperación potencial) que si los mismos son suaves.
En cuanto al tiempo, ambas técnicas nunca miden la misma variable, aún cuando se comparen los gradientes medios de presión o el pico instantáneo de presión con Doppler y el gradiente pico a pico con catéteres.
Conservación del momento (m):
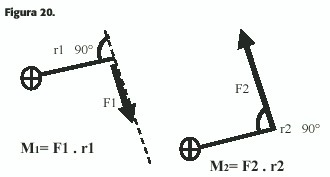
Se llama momento (M) de una fuerza respecto a un punto al producto de la fuerza (F) por la distancia (r) que separa el punto de la recta de aplicación de aquella. El momento es una magnitud vectorial cuya dirección y sentido están definidas según lo que ocurre con la llave que se usa para aflojar las tuercas de la rueda del auto o del sacacorchos que gira en el sentido de la fuerza (Figura 20).
Como ocurre con las otras dos leyes de la conservación, la tasa de momento que fluye dentro y fuera del volumen de control debe ser la misma. Esto se rige por la ecuación:
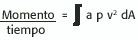
Este principio está siendo motivo de estudio para su aplicación en el cálculo de las regurgitaciones valvulares.
Conclusiones
Estas leyes de conservación son aplicadas exitosamente para el estudio y medición de muchos problemas cardíacos y vasculares; su potencial es ilimitado, y deberían ser el punto de inicio de cualquier técnica a desarrollar. De acuerdo a lo definido por Blevins:"Estas ecuaciones de conservación no están atadas a una geometría o sistema específicos; son herramientas generales cuya utilidad está limitada sólo por la inteligencia con la que son aplicadas "(3).
Concepto de estenosis crítica:
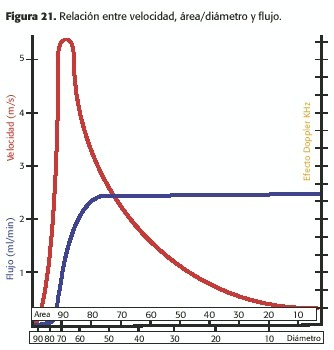
Sabemos que flujo es igual a área por velocidad, y que cambios es esta última compensan reducciones en aquella para mantener al primero estable (Figura 21).
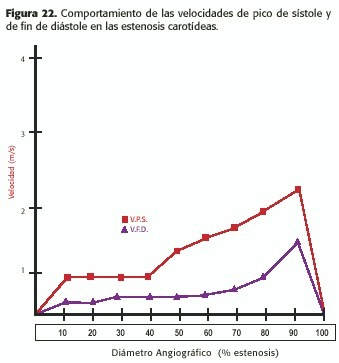
Este incremento de la velocidad se correlaciona con el cuadrado inverso del tamaño de la luz, comenzando a ocurrir cuando ésta se reduce en al menos un 30%; a nivel carotídeo los cambios detectables en la onda de Doppler pulsado comienzan con estenosis de al menos un 50% (Figura 22).
El aumento de la velocidad implica una reducción de la energía potencial, como ya se dijo al hablar de conservación de la energía, que se transforma en cinética, y al mismo tiempo aumenta Re, haciendo aparecer turbulencias; éstas producen pérdida adicional de la energía potencial como calor (en el flujo turbulento las pérdidas de energía son mucho mayores que en el laminar); todas estas resistencias aumentan con la cuarta potencia del radio que va disminuyendo, siendo en consecuencia ambos efectos sumados función sobre todo de cambios en la luz. Un dato derivado de la observación clínica es que existe un grado de estenosis más allá del cual pequeñas reducciones adicionales de la misma ocasionan caídas del flujo, (significando un agotamiento del mecanismo compensador de aumento de la velocidad); en efecto, el fluido se esparce como un spray fino, con gran caída de la presión; es decir, pasado este punto, se observa una caída simultánea de la velocidad y del flujo; esta condición del flujo se alcanza con una reducción del diámetro luminal de alrededor del 95%(suboclusión) en la carótida interna; la reducción de la velocidad hace que estos pacientes reciban el diagnóstico de oclusión cuando, en realidad, ésta todavía no ocurrió;en el aspecto práctico, la importancia es obvia en cuanto a la indicación o no de cirugía de endarterectomía carotídea y al uso del "power angio " (que no mide velocidades sino la presencia o no de flujo y es especialmente útil en caso de velocidades de flujo muy bajas). También, en casos de vasodilatación marcada, la diferencia de presión se acentúa por disminución de la impedancia distal (P1 –P2 se acentúa porque baja P2), por lo que el punto crítico se alcanza antes; este mecanismo explica la aparición de dolor de miembros inferiores al caminar cuando hay obstrucciones arteriales significativas (claudicación intermitente)y del aumento de la sensibilidad de los métodos no invasivos de diagnóstico en estos pacientes tras el ejercicio:el incremento del flujo aumenta el gradiente de presión, implicando un aumento de la resistencia con respecto a la basal, exagerando las estenosis moderadas, que se ubican cerca de la significación hemodinámica; otra situación en la que se aplica este concepto, explica el porqué del fracaso de los vasodilatadores clásicos (ej. anticálcicos) en los pacientes con obstrucciones de miembros inferiores, quienes ya están máximamente vasodilatados por la isquemia; en ellos estas drogas producen deterioro clínico por efecto de robo hacia los lechos sanos no vasodilatados.
Algunas situaciones clínicas:
Aterosclerosis y aerodinamia:
Recordando la ecuación de Bernoulli, hemos descripto sus distintos términos y, dado su diferente peso relativo, visto la posibilidad de ignorar algunos de ellos, como la gravedad, o la resistencia viscosa; quedan entonces, los términos de energía potencial (P, presión) y de energía cinética (V, velocidad); en resumen,vimos que,como la E.es constante,E1=E2,y como E1=P1 x V1 y E2=P2 x V2,luego P1 x V1 =P2 x V2.
Si nos fijamos en el perfil del ala de un avión, éste no es igual en la parte superior que en la inferior; la mayor curvatura de la primera determina que el aire se desplace a mayor velocidad, con respecto a la segunda;como contrapartida, la presión ascendente en la zona inferior es mucho mayor que la descendente en la superior;esta diferencia de E.potencial (ascendente>>descendente) ocasiona que el avión vuele.
Las lesiones ateroscleróticas se ubican con llamativa frecuencia en zonas predecibles en la mayoría de los pacientes: el bulbo de la carótida interna, el ostium de las arterias vertebrales o de las renales, etc. Indudablemente, existen razones hemodinámicas (hidrodinámicas) que explican esta realidad: si en una zona determinada ocurre una dilatación, como en el bulbo carotídeo, o el nacimiento de una rama, ambas situaciones comportan regiones anatómicas de baja velocidad o de vórtices; dado que el flujo es el mismo [recordar que Flujo(Q)=A x V ] si la primera aumenta, disminuye V, al contrario de lo que ocurre en las estenosis. Al reducirse V, debe compensarse esta caída de la energía cinética por un aumento proporcional de la potencial (P), lo que "empuja "las lipoproteínas dentro de la pared arterial; el organismo trata de solucionar esta "anormalidad fisiológica" disminuyendo la luz aumentada a expensas de engrosar la pared: los proteoglicanos producen el engrosamiento excéntrico o concéntrico en las zonas en donde más adelante se desarrollarán las distintas lesiones evolutivas de la arteriosclerosis (13).
Shear stress y trombosis:
La presencia y cuantía de la trombosis, un evento casi nunca ausente en los síndromes isquémicos agudos (14), depende de factores sistémicos y locales; entre éstos, se destacan los sustratos para trombosis en la pared arterial y factores reológicos del flujo sanguíneo.
Los trombos plaquetarios se depositan a lo largo del sitio de desgarro de la pared arterial; la magnitud de los mismos está modulada por las características de la lesión, como la profundidad, el área, el tipo de superficie y la configuración de la herida, el tipo de colágeno, la presencia de material de caseum lipídico, la presencia de tromboplastina, la producción de prostaciclina y el contenido de trombina de la lesión. Los tipos IV y V de colágeno son no trombogénicos y se encuentran en la íntima; los tipos I y III, así como el colágeno glicosilado de los diabéticos, son altamente trombogénicos y se encuentran en la media arterial y en la placa arteriosclerótica; otro factor trombogénico, la tromboplastina tisular, se encuentra en la adventicia y en menor medida, en la media y en la capa fibrosa de la placa. Como consecuencia, una lesión superficial o leve (injuria tipo II o despulimiento endotelial) o una delgada y corta, aunque profunda, probablemente conduzca a un trombo mural sin obstrucción; por el contrario, una lesión profunda (tipo III, por debajo de la membrana elástica interna o dentro de la placa fisurada), con una superficie grande o de trayecto en espiral iniciará en instantes el depósito de plaquetas, con rápido crecimiento del trombo, vasoconstricción y oclusión en minutos.
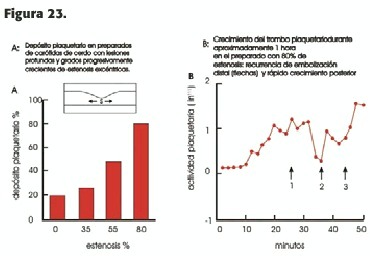
Respecta a los factores dependientes del flujo, el depósito plaquetario es directamente proporcional al shear stress (SS), que, como ya vimos, a su vez depende de la diferencia de velocidad entre las capas de sangre arterial; está en relación directa con el flujo y la velocidad e inversa con el cubo del radio luminal; por lo tanto, las arterias pequeñas (como las coronarias), con velocidad de flujo elevada, están en riesgo mayor de trombosis que las grandes, como la aorta. Los trombos plaquetarios aumentan en proporción directa con la severidad de la estenosis (Figura 23); a su vez, la mayor concentración de plaquetas ocurre en la zona de menor luz de la estenosis.
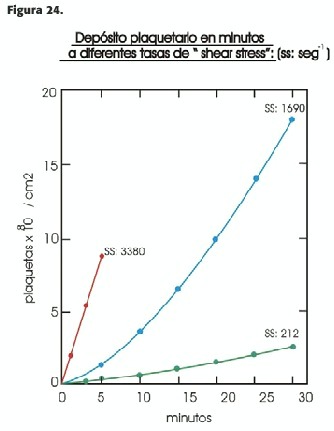
En presencia de S.S.elevado los glóbulos rojos desplazan a las plaquetas hacia la periferia (donde se depositan en la zona lesionada) al mismo tiempo que aumenta la presencia de ADP, que a su vez favorece el depósito y la agregación plaquetaria (15). En presencia de una lesión profunda y extensa, el depósito plaquetario continúa aumentando en forma proporcional con el S.S.(16) (Figura 24); la presencia de una lesión arterial aguda se asocia con vasoconstricción, existiendo una relación directa entre la misma y la cuantía del trombo plaquetario (17), lo cual incrementa la velocidad sanguínea y, en consecuencia el S.S., creándose un círculo vicioso; esta vasoconstricción es significativamente reducida o abolida por drogas como la nitroglicerina, la inhibición de los receptores del tromboxano y de la serotonina y la aspirina.
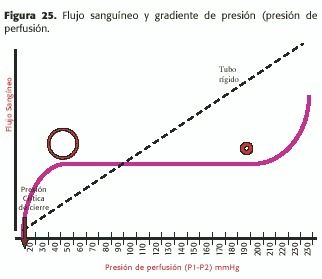
El sistema circulatorio es dinámico:presenta la posibilidad de adaptarse a circunstancias extremas, manteniendo el flujo estable con grandes diferencias de presión de perfusión (o sea P1 –P2) como lo muestra la figura 25 .El mismo explica distintas situaciones clínicas comunes.
Por ejemplo, en los casos de isquemia crónica de miembros inferiores, la vasodilatación es tan marcada (P2 =0), que el flujo en las pantorrillas es normal en reposo en la mayoría de los pacientes; recién cuando la presión de perfusión es tan baja como 50mmHg comienza a deteriorarse, apareciendo el dolor de reposo cuando la presión sistólica en el tobillo es de 30mmHg o menor; en este punto aparecen los trastornos tróficos pues la presión de perfusión no logra mantener el flujo cuando es menor de 20mmHg; a partir de estas cifras de gradiente de presión, los vasos están funcionalmente cerrados (presión crítica de cierre).
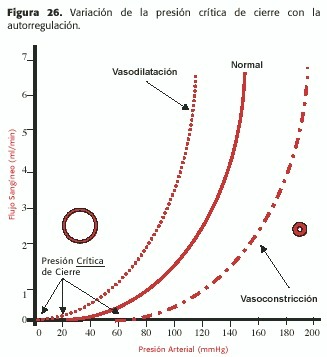
También la circulación cerebral mantiene un flujo estable por medio de una vasodilatación intensa (autorregulación cerebral) en situaciones de TA muy baja (70mmHg o aún menos); también, en casos de estenosis severa de la carótida interna, el flujo se mantiene gracias a la autorregulación cerebral; esto explica que los síntomas de isquemia cerebral secundarios a la misma generalmente no se deben a hipoflujo hemodinámico sino a ateroembolia (Figura 23-B). En los casos de obstrucciones carotídeas muy significativas de larga data, la autorregulación está muy deprimida por vasodilatación extrema crónica; si el paciente es un hipertenso severo, al efectuar la endarterectomía, la brusca normalización del flujo cerebral impacta sobre un lecho no acostumbrado, que actúa como la línea recta rayada (es decir sin autorregulación); un ascenso no controlado de la T.A. tiene como consecuencia un aumento paralelo del flujo cerebral: este es el mecanismo del síndrome de hiperperfusión, generalmente con consecuencias dramáticas, varios días después de una endarterectomía exitosa.
En el otro extremo de la curva, la autorregulación permite mantener estable el flujo cerebral frente a ascensos marcados de la T.A.de hasta 200mmHg o más de presión de perfusión (P1 –P2).
La presión crítica de cierre varía con el tono simpático vasomotor, es decir con la autorregulación (Figura 26).
Resumen
Se desarrollan los principales conceptos básicos de la física (hemodinámica o hidrodinámica aplicada al movimiento pulsátil de la sangre) que rigen el funcionamiento del aparato circulatorio en condiciones normales y patológicas; esto es de fundamental importancia para comprender muchos de los hallazgos diagnósticos y las implicancias terapéuticas: localización preferencial de las placas arterioscleróticas, efectos de la autorregulación a nivel de los diferentes lechos arteriales (cerebral, miembros inferiores, etc.), definición e importancia clínica del "shear stress ",etc. Es necesario destacar, como se dijo al principio, que estos principios fueron descriptos siglos atrás en condiciones de laboratorio muy diferentes a las que ocurren en el hombre, con su circulación de bombeo pulsátil, paredes elásticas, ramificaciones y reducción progresiva del diámetro arterial, por lo que la aplicación y estudio de los mismos está en permanente cambio. Sin embargo, constituyen la base ineludible a partir de la cual se debe iniciar cualquier nuevo intento investigativo.
Finalmente, también se debe reconocer la naturaleza compleja de esta materia; se intentó explicar en términos sencillos lo que muchas veces no lo es, sobre todo para quien no está familiarizado con el lenguaje de la física, así como abundar con ejemplos que sirvan a ese propósito; es el mayor deseo del autor haberlo conseguido.
Summary
Basic concepts that explain the pumping motion of blood within the peripheral circulatory system, both in normal and pathologic conditions, are briefly explained in this article. This knowledge is essential to understand diagnostic findings and aim therapeutic decisions: preferential location of atherosclerotic plaques, effect of vessel auto regulation at different arterial beds (cerebral, lower limbs), clinical relevance of shear stress, etc. It should be remembered that these principles and theories were described some centuries ago,in environmental Laboratory conditions, that are very different from those found in the human body, dictated by the pumping action of the heart, and the special characteristics of the arteries: elastic walls, branching and progressive tapering throughout the periphery; this determines a field of permanent evolution and research.
It must be emphasized, at the same time, their importance as a basic background and the complex nature of these physic laws; plenty of clinical examples are shown in an attempt to overcome these difficulties and make them more comprehensible.
Referencias
1. Burton AC, Physiology and biophysics of the circulation, 2nd. Ed.Chicago Year Book Medical Publishers,1972. [ Links ]
2.Mc Donald DA., Blood flow in arteries. London. Edward Arnold, 1974. [ Links ]
3.Blevins RD, Applied fluid dynamics handbook. New York. Van Nostrand Reinhold,1984. [ Links ]
4.Yoganathan AP et al. Review of hydrodynamic principles for the cardiologist: Applications to the study of blood flow and jets by imaging techniques.J Am Coll Cardiol;12:1344-1353,1988. [ Links ]
5.Nichols WWW, O Rourke MF (Eds.). Mc Donald s blood flow in arteries, 3rd. Ed. Philadelphia. Lea & Febiger, 1990. [ Links ]
6.Noordergraaf A.Circulatory system dynamics. New York. Academic press.1978. [ Links ]
7. Strandness DE, Sumner DS. Hemodynamics for surgeons. New York. Grune & Stratton,1975. [ Links ]
8.Hatle L, Angelsen B. Doppler Ultrasound in cardiology, 2nd. Ed, Philadelphia. Lea & Febiger,1985. [ Links ]
9.Ciancaglini C., Evaluación de los estudios vasculares con ultrasonidos.IMC Informa, 1996; 22:336-344. [ Links ]
10.Smiesko V, Jhonson PC. News Physiol Sci 1993;8:34-38. [ Links ]
11.Franceschi C. Diagnóstico vascular por ultrasonografía Doppler. Masson. 1980. [ Links ]
12. Holen J., Aaslid R. et al, Determination of effective orifice area in mitral stenosis from noninvasive Doppler data and mitral flow rate. Acta Med Scand 1977;201:83-88. [ Links ]
13. Stary HC et al, A Definition of the Human Arteries and of Its Atherosclerosis-Prone Regions. Circulation. 1992, 85,1:391-405. [ Links ]
14.Fuster V., et al. Insights into the pathogenesis of acute ischemic syndromes. Circulation 1988;77:1213-1220. [ Links ]
15. Badimon L.et al. Influence of arterial damage and wall shear rate on platelet deposition .Ex vivo study in a swine model. Arteriosclerosis 1986;6:312-320.
16.Chesebro J.et al. Pathogenesis of Thrombosis in Unstable Angina. Am J Cardiol 1991;68:2B-10B. [ Links ]
17.Lam JYT et al. Is vasospasm related to arterial deposition? Relationship in a porcine preparation of arterial injury in vivo. Circulation 1987;75:243-248. [ Links ]