Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Costarricense de Cardiología
versión impresa ISSN 1409-4142
Rev. costarric. cardiol vol.6 no.2 San José may. 2004
REVISION
Un acercamiento a la cinética del oxígeno.(Parte II)
Dres.*Edgar Méndez J.**Fernando S.Zeledón S.***José F.Zamora L.****Asdrúbal Cortés V.
Medición del consumo de oxígeno
A partir del principio de Fick,que establece que el oxígeno consumido en el metabolismo celular sistémico es exactamente igual al captado en los capilares pulmonares; se puede determinar el VO2 de tres formas:
1) Espirometría volumétrica de reinhalación en circuito cerrado.
Durante la aplicación de este método se pone al individuo a respirar dentro y fuera de un espirómetro de baja resistencia equipado con un absorbedor de CO2 ,y a medida que se absorbe el oxígeno puede determinarse la pérdida del volumen en el sistema cerrado. El consumo de oxígeno se determina durante 5-10 min y se calcula como un promedio, además se realiza una conversión de la temperatura y presión ambiental a valores estandar, lo cual es muy importante.
Es importante a la hora de realizar este método que no exista escape del sistema, ya que esto alteraría enormemente la muestra.
2) Análisis de gases espirados mixtos en circuito abierto.
Lo que se hace es medir la concentración de oxígeno en el gas inspirado y espirado, multiplicándolo por el volumen minuto. Con la descripción del método se puede evidenciar varios problemas a la hora de calcular el consumo de oxígeno. Por ejemplo, la variación de la concentración del oxígeno inspirado de 40 a 40,5% supone un gran error en el cálculo del VO2 .
También, la cantidad de CO2 espirado quizá no sea igual a la de O2 inhalado, sin embargo, lo anterior se ignora suponiendo que el cociente respiratorio (VCO2 /VO2) es igual a 1 o se calcula dicho cociente en el contexto clínico del enfermo.
3) Cálculo de la diferencia del contenido arteriovenoso de oxígeno multiplicado por el gasto cardíaco.
El gasto cardíaco se determina mediante termodilución, además de una determinación exacta del contenido de oxígeno en sangre arterial y sangre venosa mixta, medida por un catéter en la arteria pulmonar. El VO2 calculado de esta forma puede variar hasta un 15%, por lo cual se dice que los cambios en el consumo de oxígeno deben variar más de la cifra citada para que sean significativos.
VO2 =indice cardíaco *({Hb *1.39 * SaO2 * 10} + {0,003 * PaO2}) – ({Hb * 1,39 *SvO2 * 10} + {0,003 * PvO2})
Siempre es importante correlacionar los valores del consumo de oxígeno con la clínica del enfermo. Por ejemplo, si un paciente sedado, normotérmico, en reposo presenta un VO2 el 65% mayor al esperado,lo más probable es que exista una fuga en el sistema o un error en el cáculo.
Una vez calculado el VO2, este se puede utilizar para valorar si el paciente se encuentra en un estado de hipermetabolismo o hipometabolismo,calcular el gasto calórico del metabolismo o determinar y regular la relación entre el DO2 y el VO2.
¿Qué hacer cuando el VO2 se encuentra alterado?
Un acercamiento al análisis de un VO2 podría ser el siguiente:
En primer lugar, se presta atención a la volemia, es decir, se valoran la PVC y la la presión de enclavamiento capilar pulmonar (PECP). Si se evidencia un hipovolemia, posiblemente ésta sea la que está reduciendo el DO2 y por ende el VO2. Ahora, si el individuo se encuentra normovolémico, el siguiente parámetro por investigar es el gasto cardíaco. Ante un GC bajo lo que hay que analizar son las causas de éste y tratar de aumentarlo ya sea con inotrópicos o volumen; pero si el GC es normal o alto, el siguiente paso es medir el VO2. Si el consumo de oxígeno es bajo hay que emprender los métodos para para aumentar el DO2 y además tratar de disminuir las necesidades celulares de este gas.
Por otro lado, si el VO2 es normal o alto (dentro de este contexto normal o alto significa que existe un buen DO2 y que por lo tanto la célula presenta aún un suministro de oxígeno que le permite realizar procesos metabólicos, aunque quizás la célula se encuentre en un estado de hipoxia). Por consiguiente, el paso a seguir es medir el lactato sérico, pensando que los niveles de lactato elevados indican que el VO2 es inferior a la tasa metabólica, por lo cual hay que disminuir ésta o aumentar el VO2 (es decir, disminuir las necesidades de oxígeno y por lo tanto, lograr que el oxígeno suministrado sea suficiente para llevar a cabo los procesos metabólicos, lo que en terminología parece paradójico, pero que en clínica se conoce como VO2 alto).
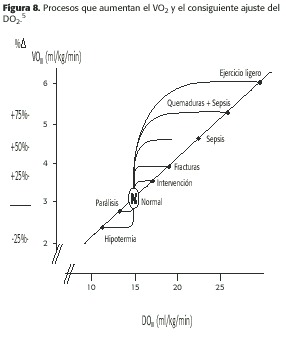
Ahora bien, si el DO2 es lo suficientemente bajo para provocar que el VO2 varíe con respecto a el transporte de oxígeno, se presenta el fenómeno llamado "dependencia patológica de oxígeno "y se ha visto que en términos generales corresponde a un DO2 de 9 ml/kg/min. (ver Fig. 4)
A un DO2 mayor de 9 ml/kg/min el VO2 se independiza y permanece constante en virtud de que el oxígeno está disponible en exceso para los requerimientos tisulares.
Cuando los procesos de autorregulación no pueden por sí mismos mantener una relación DO2 /VO2 mayor a 3:1,es necesario que el clínico inicie medidas para optimizar el aporte de oxígeno celular, como por ejemplo, la transfusión de glóbulos rojos, mejorar el gasto cardíaco con inotrópicas, aumentar la oxigenación pulmonar o mejorar las RVP, como se ha citado anteriormente.
Por ejemplo, los enfermos graves muchas veces presentan un síndrome séptico, alcalosis respiratoria a raíz del ventilador o se corrigen acidosis metabólicas de forma agresiva. En cualquiera de los casos, se produce una hipofosfatemia (aumento de las demandas y transporte intracelular del ión fosfato); ésta a su vez interfiere con el transporte de oxígeno si no se repone precozmente, ya que interfiere en las tres factores más importantes de la ecuación para calcular el DO2. A saber, deteriora el gasto cardíaco al perjudicar la contractilidad de la miocito, en un grado extremo puede producir hemólisis y disminuir el nivel de hemoglobina y además la depleción de fosfato se asocia con la disminución del 2,3 DPG lo que desvía la curva de disociación de la Hb hacia la izquierda y por lo tanto la entrega de oxígeno a los tejidos se va a deteriorar.
La infusión de volumen se ha usado rutinariamente (e indiscriminadamente) para mejorar el transporte de oxígeno. Sin embargo,esta estrategia puede tener sus consecuencias negativas al administrar un exceso de volumen a pacientes con un aumento de permeabilidad vascular o a enfermos que presentan una función miocárdica deteriorada en los cuales dicho aumento de la precarga no mejoraría el gasto cardíaco sino más bien tendería a deteriorarlo.(38)
Con respecto a los inotrópicos, en general se ha visto que pueden aumentar el DO2, sin embargo, cuando se utilizan a grandes dosis pueden exacerbar el VO2 (aumentar la necesidad de oxígeno) al actuar en la cadena respiratoria.
La ventilación mecánica ha demostrado aumentar el DO2 al provocar un cortocircuito sanguíneo atraves del diafragma. Además, la ventilación positiva intermitente también puede mejorar el gasto cardíaco al disminuir la carga ventricular izquierda. No obstante, la ventilación mecánica también puede deteriorar el DO2 al disminuir el gasto cardíaco como consecuencia del menor retorno venoso cuando se utiliza PEEP o cuando el paciente se encuentra en un shock hipovolémico. (38)
Por otro lado, también se puede disminuir el consumo de oxígeno enfriando al paciente previa sedación o parálisis, ya que las tiritonas que desencadena la hipotermia pueden por sí solas incrementan el VO2 .Otra medidas útiles para disminuir la demanda de oxígeno tisular son evitar la fiebre, infecciones, uso excesivo de agonistas beta,el exceso de actividad física (fisioterapia), evitar el dolor y la ansiedad en el paciente, entre otros. Claro está todo lo anterior dentro del contexto clinico en que se desenvuelva el enfermo.
Hay que resaltar que el flujo sanguíneo y el consumo de oxígeno son diferentes para cada órgano, de esta manera, por ejemplo, en condiciones homeostáticas, el corazón tiene un flujo de 300 ml/min y el VO2 es de 34 ml/min., mientras que el riñón presenta un flujo de 1380 ml/min.y un VO2 de 19 ml/ min. Lo anterior significa que en un aumento en la demanda de O2 el corazón requerirá un aumento en el flujo, es decir, presentará una dependencia del aporte, mientras que el riñón incrementará su extracción sin requerir cambios en el flujo (aporte independencia). (25)
La respuesta de un órgano a la disminución en la llegada de oxígeno depende de la capacidad de dicho órgano para aumentar su índice de extracción de oxígeno y de mecanismos de vasorregulación sistémicos.
Con la hipoxia se redistribuye el GC al cerebro y corazón, que son órganos de elevada extracción de oxígeno y que no demuestran los efectos de la hipoxia hasta que enfrentan disminuciones extraordinariamente grandes en la llegada de oxígeno. No obstante, otros órganos como los intestinos y el riñón son indicadores más sensibles de la hipoxia. (26,38)
Por esta razón, ningún índice aislado de oxigenación hística muestra el panorama completo de la adecuación de la respiración celular, y lo que más bien se intenta es integrar la información procedente de múltiples herramientas diagnósticas, como por ejemplo, gases arteriales y venosos mixtos,SvO2, oximetría de pulso, gasto cardíaco, cociente de extracción de oxígeno, la tonometría gástrica y las mediciones de lactato en sangre, entre otros.(27)
Durante la hipoxia aumenta la concentración de iones hidrógeno celulares conforme el ATP generado por vías anaerobias es hidrolizado. Estos hidrogeniones reaccionan con el bicarbonato y forman agua más CO2. Por lo tanto, pareciera lógico cuantificar este CO2 para valorar el grado de hipoxia. No obstante, el CO2 debe ser medido en órganos que sean vulnerables a la disminución de la oxigenación hística antes que ésta se manifieste sistémicamente, tales como el tracto gastrointestinal y los riñones.
Lo anterior se debe, en parte, al proceso de redistribución del flujo sanguíneo en situaciones de hipoperfusión tisular, que deriva la corriente sanguínea al corazón y sistema nervioso central y deja desprotegidos otros órganos, como los mencionados anteriormente; y además, también al fenómeno de microcirculación contracorriente que se da en estos órganos.
Es decir, existe una difusión de oxígeno desde las arteriolas a las venillas vecinas que provoca que las células situadas en el extremo superior de la vellosidad intestinal presenten una presión parcial de oxígeno menor que las células que están en la base.
Luego, a partir de lo anterior se calcula el pH intragástrico (pHi) con la ecuación de Henderson-Hasselbalch:
pHi = 6,1 + log HCO3/0,03* PCO2 por tonometría.
Varios estudios han arrojado resultados promisorios con este método, que pareciera alterarse antes que otros parámetros de oxigenación hística y que como se mencionó anteriormente, se ha denominado tonometría gástrica.(28,29,30,31) Sin embargo, como muchas otras variables medidas en la oxigenación hística tiene sus factores en contra;como por ejemplo, el estado ácido-base del paciente (alcalosis respiratoria en pacientes ventilados), la concentración de bicarbonato de la mucosa gástrica no es igual al de tomas arteriales, sobre todo cuando el paciente se encuentra en un estado de acidosis tisular que ha consumido el bicarbonato de la mucosa o el uso de antiácidos indiscriminadamente,que son frecuentes en casi todo enfermo hospitalizado.
Los síndromes clínicos de shock se caracterizan todos ellos por una oxigenación insuficiente de los tejidos. Por ejemplo, en una insuficiencia cardíaca y en un shock cardiogénico, ambos presentan una PVC aumentada, un índice cardíaco disminuido y las resistencias vasculares periféricas aumentadas.embargo, el consumo de oxígeno es normal en la insuficiencia cardíaca, mientras que se encuentra muy disminuido en el shock cardiogénico. Sin la medición del VO2 con los parámetros antes expuestos, prácticamente sería imposible diferenciar entre un estado de bajo gasto y un shock cardiogénico.
El cociente de extracción de oxígeno (O2 ER) es la relación entre el consumo y el transporte de oxígeno multiplicada por 100. Así pues, en el contexto de un DO2 alterado, un O2 ER superior de 50 %indica que existe un riesgo elevado de que se deteriore la oxigenación hística. En este caso, las medidas para aumentar el transporte de oxígeno tienen un carácter protector, y son una fuerte indicación para transfusión sanguínea en pacientes p.ej. con anemia normovolémica.(32)
Conforme el DO2 disminuye y la "sed "de oxígeno celular aumenta, se inicia un círculo vicioso con la liberación de una serie de citoquinas y metabolitos activadores de neutrófilos e intermediarios que desencadenan la expresión de moléculas de adhesión en la superficie celular, la liberación de enzimas proteolíticas y formación de radicales libres con la subsecuente respuesta inflamatoria sistémica; en la que los órganos encargados de llevar a cabo la homeostasis se verán involucrados en un fallo orgánico múltiple. (33)
El oxígeno: "lo bueno, lo malo y lo feo".
Ya es conocido que el oxígeno es indispensable para la vida; además se ha analizado el por qué es importante mantener una oxigenación hística adecuada, sobre todo en enfermedades críticas.
No obstante, es este mismo gas indispensable para la supervivencia el que puede llevar a la muerte a los pacientes graves.
¿Cómo sucede esta paradoja? Un agente oxidante es aquel que sustrae electrones de otros átomos y moléculas con facilidad, y precisamente el oxígeno es un agente oxidante (aunque débil). Además toda la reacción es de tipo Redox, ya que el otro compuesto que recibe los electrones se reduce. Un radical libre es, desde el punto de vista químico,cualquier molécula que contenga un electrón no apareado único.
Conforme se administra oxígeno y este reacciona con diferentes compuestos orgánicos "robando lectrones "e hidrogeniones, u se va transformando en una serie de metabolitos, que son mucho más reactivos que el propio oxígeno. (34)
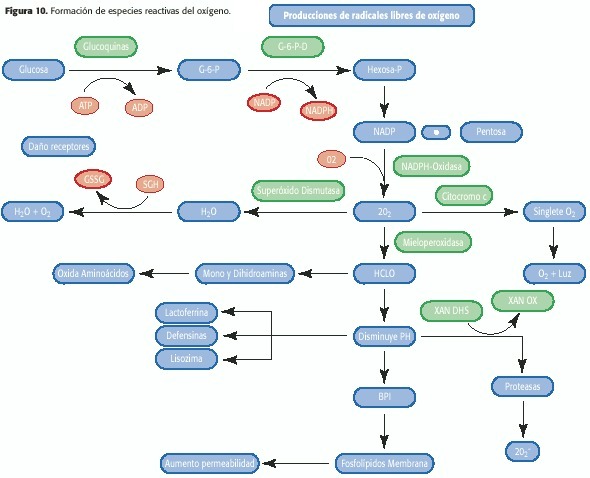
Lo anterior, es el caso del radical superóxido (O2-), que no es sino el oxígeno más un electrón más en uno de sus orbitales.
Ahora, si este metabolito reacciona con 2 hidrogeniones y un electrón, se forma el peróxido de hidrógeno (H2O2), el cual no cumple con la definición de radical libre, ya que no tiene un electrón desapareado.
Sin embargo, el peróxido de hidrógeno es una potente citototoxina; traspasa las membranas y tiene la capacidad de formar dos radicales más potentes: uno se forma al hierro donarle un electrón convirtiéndolo en el radical hidroxilo (OH-), que no traspasa las membranas.(31,32)
El otro se forma especialmente en los neutrófilos, mediante la enzima mieloperoxidasa, cuya función es realizar la cloración del peróxido de hidrógeno formando el ácido hipocloroso. (2HOCl)
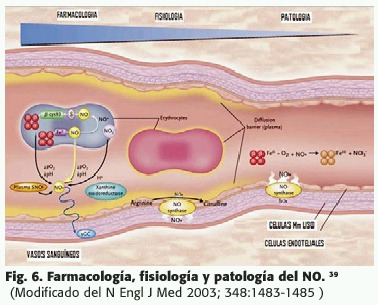
Pero siguiendo con la vía metabólica, si el radical hidroxilo se le agrega otro electrón y 2 protones, se forma nada menos que dos moléculas de agua, como parte de la cadena respiratoria. (Fig. 6 y 10 )
Los radicales libres pueden extraer electrones (y los protones) de otros compuestos, y así éstos dejan de ser radicales libres, pero los compuestos de los cuales se les ha extraído el electrón ahora son nuevos radicales, así sucesivamente. Esta es la cara del proceso conocido como peroxidación lipídica, que no es otra cosa,que la reacción de radicales libres con los ácidos grasos insaturados de las membranas celulares, lo cual altera su arquitectura y funcionabilidad, desencadenando la apoptosis y en última instancia la necrosis celular.
Estos metabolitos reactivos del oxígeno se han visto involucrados en una serie de procesos fisiopatológicos como por ejemplo, la aterogénesis, la carcinogénesis, la apoptosis, etc., y fisiológicos como el envejecimiento. (23)
Por lo tanto, parece lógico mantener un pool adecuado de antioxidantes en los enfermos graves, aunque los estudios al respecto han revelado resultados desalentadores, cuyas justificaciones se escapan de esta revisión.(36)
Dentro de los agentes antioxidantes tanto enzimáticos como no enzimáticos cabe citar las vitaminas E,C,N-acetilcisteína, glutatión,selenio y la metilprednisolona a altas dosis (30 mg/Kg) entre otros.
Por lo tanto, el oxígeno se comporta como una molécula "buena ", ya que nos permite vivir y mejorar el estado de enfermos graves, cuando se utiliza de manera prudente, permitiéndole que se lleven a cabo los procesos metabólicos celulares.
Además, es "malo", ya que cuando el balance se inclina a la producción de radicales libres y se vence a los agentes antioxidantes, se crea una condición de estrés oxidativo, muchas veces causa o consecuencia de un sin número de patologías potencialmente fatales.
Por otro lado, el metabolismo oxidativo muchas veces impone una situación difícil para el clínico ("feo"), en la cual en algunas se saldrá victorioso pero en otras muchas se perderá.
Conclusión
El conocimiento de los aspectos moleculares de la cinética del oxígeno es de gran importancia en el quehacer médico; ya que como en otras ocasiones, es sobre estas bases fisiológicas y fisiopatológicas que se podrían enfrentar diversas situaciones clínicas e incorporar los nuevos avances en este inmenso campo de una forma apropiada.
Además, no se discute en esta revisión si hay que llevar a pacientes en situaciones adversas a un aporte de oxígeno supraóptimo como se ha expuesto por Shoemaker y col. En el pasado, ya que actualmente esto se encuentra en tela de duda, por diversos estudios que han arrojado resultados contradictorios. (37)
Tampoco la misión es recomendar utilizar un arsenal de medios invasivos y no invasivos de monitoreo metabólico y cardiopulmonar, ya que cada uno de éstos tendrían sus pro y contra, además del aspecto costo/beneficio.
Pero lo que sí se intenta resaltar es la siguiente idea:"Tanto una célula carente de oxígeno como una hiperóxica son células destinadas a morir ".
Referencias
1. Guyton AC, Hall JE.Textbook of Medical Physiology. 9th ed. Philadelphia,W. B.Saunders,1996. [ Links ]
2.Ganong WF.Review of Medical Physiology.19th ed.California, Appleton and Lange,1999. [ Links ]
3.Dickerson, R.E.e I.Geis: Hemoglobin:Structure, Function, Evolution and Pathology. Benjamin/Cummings, Menlo Park, California,1983. [ Links ]
4.Mathews, C.K.,van Holde, K.E., Ahern K.G. Biochemistry.3rd ed.Addison Wesley, California, 2002. [ Links ]
5.Bartlett RH.Critical Care Physiology.Masson-Little,Brown,1996. [ Links ]
6.Dantzker DR, Foresman B, and Gutierrez G: Oxygen supply and utilization relationships:A reevaluation. Am Rev Respir Dis 143:675-679,1991. [ Links ]
7.Schneeweiss B, Druml W, Graninger W, et al. Assessment of oxygen-consumption by use of reverse Fick principle and indirect calorimetry in critically ill patients.Clin Nutr 1989;8:89-9 [ Links ]
8.De Robertis EMF, Biología Celular y Molecular.12 ª ed.,4 ª reimp.Buenos Aires:El Ateneo,1998 [ Links ]
9.Cooper GM.The Cell:A Molecular Approach.2nd ed.Boston, Sinauer Associates, 2002. [ Links ]
10. Bartlett RH, Dechert RE. Oxygen Kinetics:pitfalls in clinical research.J Crit Care 1990;5:77-80 [ Links ]
11.Grisham MB and McCord JM:Chemistry and cytotoxicity of reactive oxygen metabolites.In Taylor AE,Matalon S,and Ward P,.:Physiology of oxygen radicals. Bethesda, MD, American Physiological Society,1986, pp 1-18. [ Links ]
12.Bartlett RH.Critical Care.In:Greenfield L,ed.Surgery:scientific principles and practice. Philadelphia: Lippincott,1992:195-222. [ Links ]
13.Di Mauro S, Schon EA. Mitochondrial Respiratory Chain Disease.N Engl J Med 2003; 348:2656-2668. [ Links ]
14. Harold FM: The vital force: A study of bioenergetics. New York, Freeman, 1986,pp 28-56 [ Links ]
15.Saraste M: Oxidative phosphorylation at the fin de siecle.Science 283:1488-1493. [ Links ]
16.Gutiérrez G:Cellular energy metabolism during hypoxia.Crit Care Med 1991;19:619. [ Links ]
17.Ludwing B, Bender E, et al. Cytochrome c Oxidase and the Regulation of Oxidative Phosphorylation.Chembiochem 2001;2:392-403. [ Links ]
18. Berne R.M.and Levy M.N.:Principles of Physiology. 4th ed.Mosby .1998 [ Links ]
19.Matheis G, Sherman MP, Bucberg GD, et al: Role of L-arginine-nitric oxide pathway in myocardial reoxygenation injury.Am J Physiol 1992;262:H616-H620 [ Links ]
20. Moncada S, Erusalimsky JD. Does nitric oxide modulate mitochondrial energy generation and apoptosis?.Nature 2002;3:214-220. [ Links ]
21. Gianetti J, Del Sarto P, et al.: Supplemental nitric oxide and its effect on myocardial injury and function in patients undergoing cardiac surgery with extracorporeal circulation. J Thoracic Cardiovasc.Surg 2004;127:44-50 [ Links ]
22. Palmer, L.A., Gaston, B.and Johns, R.A. Normoxic stabilization of hipoxia inducible factor 1 expression and activity: redox dependent effect of nitrogen oxide. Mol Pharmacol. 58,1197-1203 [ Links ]
23.Narula J, Dixit VM, Miller LW. Apoptosis in cardiovascular disease. Cardiology Clin 2001;19:95-150 [ Links ]
24. Bontemps F, Van den Berghe G, and Hers HG: Pathways of adenine nucleotide catabolism in erythrocytes. J Clin Invest 77:824-830,1986. [ Links ]
25.Van Lanschot J.J.B., Feentra B.W.A., Vermij C.G. and Bruining H.A.:"Outcome prediction in critically ill patients by means of oxygen consumption index and simplified acute physiology score ".Crit Care Med 1988,14:4-49. [ Links ]
26.Marik PE.Gastric intrmucosal Ph.A better predictor of multiorgan dysfunction syndrome and death than oxygen derived variables in patients with sepsis. Chest 1993,104:225-22 [ Links ]
27.Gutierrez G and Browm SD: Gastric tonometry: A new monitoring modality in the intensive care unit. J Intensiv Care Med 1995,10:34-44. [ Links ]
28. Doglio GR, Pusajo JF, Egurrola MA, et al: Gastric mucosal Ph as a pronostic index of mortality in critically ill patients.Crit Care Med 19:1037-1040,1991 [ Links ]
29.Gys T, Hubens A, Neels H, et al: Prognostic value of gastric intramural Ph in surgical intensive care patiens. Crit Care Med 16:1222-1224,1988 [ Links ]
30. Maynard N.Bihari D, Beale R, et al: Assesment of splacnic oxygenation by gastric tonometry in patients with acute circulatory failure. JAMA 270:1203- 1210,1993 [ Links ]
31. Mythen MG and Webb AR: Prospective, randomized study in patients undergoing elective cardiac surgery. Arch Surg 130:423-429,1995 [ Links ]
32.Levy P, Chavez RP, Crystal GJ, et al.Oxygen extraction ratio:a valid indicator of transfusion need in limited coronary vascular reserve? J Trauma1992; 32:769-774. [ Links ]
33. Shoemaker WC, Appel PL, Krom HB. Role of oxygen debt in the development of organ failure,sepsis,and death in high-risk surgical patients. Chest 1992;102:208-215 [ Links ]
34. Grace PA. Ischemia reperfusion injury. Br J Surg 1994;81:637-647 [ Links ]
35.Liochev SI, Fridovich I. The role of O2 in the production of HO. in vitro and in vivo. Free Radic Biol Med 1994, 16:29-33. [ Links ]
36.Halliwell B. Free radical,antioxidants, and human disease: curiosity, cause, or consequence. Lancet 1994; 344:721-724. [ Links ]
37.Michelle AH, Andrew CT, et al. Elevation of Sistemic Oxygen Delivery in the treatment of Critically III Patients. N Engl J Med 1994;330:1717-1722. [ Links ]
38.Leach RM, Treacher DF. The relationship Between Oxygen delivery and consumption.Disease a Month 1994; 40:301-368. [ Links ]
39. Schechter AN, Gladwin MT. Hemoglobin and the Paracrine and Endocrine Functions of Nitric Oxide. N Engl J Med 2003; 348:1483-1485. [ Links ]
*Asistente en Cirugía Cardiovascular, Hospital México, C.C.S.S., San José, Costa Rica.**Residente en Circulación Extracorpórea, Hospital México, C.C.S.S., San José, Costa Rica.***Médico General.****Asistente en Cardiología y Ci Extracorpórea, Hospital México, C.C.S.S., San José, Costa Rica.