Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Costarricense de Cardiología
versão impressa ISSN 1409-4142
Rev. costarric. cardiol vol.4 no.2 San José Ago. 2002
Introducción
La cirugía cardiovascular con circulación extracorpórea es un procedimiento complejo, pero cuando además, el paciente es testigo de Jehová, se convierte en un desafío, ya que al no aceptar transfusiones de sangre ni de sus derivados, surgen limitaciones para el manejo de cualquier complicación.
Este caso corresponde a una paciente Testigo de Jehová con insuficiencia aórtica y doble lesión mitral, que al inicio de la circulación extracorpórea se produce una entrada masiva de aire por la aorta por lo que es inmediatamente sometido a circulación cerebral retrógrada asociada a hipotermia profunda.
Caso Clínico
G.A.C., Femenina de 17 años, cajera, limonense, Testigo de Jehová, con el único antecedente importante de fiebre reumática a los 4 años de edad, referida en Noviembre de 1.999 del Hospital Nacional de Niños. Se le realizó ecocardiograma transesofágico en Enero del 2.000 el cual reportó doble lesión Mitral, ambas moderadas con predominio de la insuficiencia; doble lesión Aórtica con insuficiencia severa y estenosis leve. Sobrecarga moderada sobre ventrículo izquierdo. Fracción de eyección de 58%, patrón de contractilidad global hiperdinámico. Se hospitaliza en Marzo del 2.000, y se lleva a sala de operaciones para reemplazo valvular mitroaórtico; al inicio de la circulación extracorpórea se produce embolismo aéreo masivo, en ese momento se procede a realizar circulación cerebral retrógrada a través de la vena. Cava superior durante 15 minutos, y al mismo tiempo se baja la temperatura a 20°C, logrando evacuar el aire embolizado; luego se exploran válvulas aórtica y mitral confirmándose su deterioro, por lo que se realiza el doble cambio valvular utilizando válvulas mecánicas mitral N° 25 y Aórica N° 19. Tiempo de pinzamiento de la Aorta 1 hora y 40 minutos, tiempo de derivación cardiopulmonar 1 hora 55 minutos.
La paciente evoluciona bien y es extubada a lo horas en el postoperatorio inmediato; cursando neurológicamente integra, hemodinámicamente estable sin uso de inotrópicos, con balance de líquidos negativo, manejada con expansores plasmáticos.
Se le da salida de la UTI en el postoperatorio número 2 con Warfarina 5 mg y digoxina 0,25 mg al día. Continúa recuperación en sala general; hemoglobina de 9 gr/dl por lo que se le agrega ácido fólico y sulfato ferroso oral. Evolucionando satisfactoriamente y se egresa en el postoperatorio número nueve.
Actualmente controlada en consulta externa permaneciendo en buenas condiciones generales con válvulas mecánicas clínicamente normofuncionantes.
Técnica
Cuando ocurre embolismo aéreo por gas bombeada a la circulación sistémica, la acción inmediata es detener la bomba. El paciente debe colocarse en la posición de Trendelemburg, la cánula aórtica es removida o se realiza una incisión en la aorta ascendente. Si se confirma la presencia de aire en la aorta ascendente, la perfusión cerebral retrógrada a través de la vena Cava superior está indicada (1). Esta se realiza luego de que )a línea arterial es purgada y se retira la cánula de su inserción en la aorta, se hace una incisión en la vena cava superior (VCS) justo por encima de un clamp vascular colocado a través de toda la VCS, y se introduce la cánula (Fig.1). Se inicia la perfusión retrógrada con hipotermia a 20°C y con un flujo de 1 a 2 litros / minuto, se realiza durante 1 a 3 minutos o hasta que no salga más espuma de la aorta (5). El anestesiólogo comprime temporalmente las carótidas durante la fase tardia de la perfusión retrógrada para purgar el aire desde el sistema vertebral. El diagnóstico también puede ser confirmado por el anestesiólogo mediante un examen de fondo de ojo evidenciando la presencia de aire en las arterias retinales.
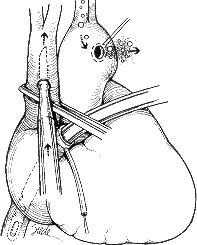
La hipotermia entre 20 y 22°C es utilizada cuando se reinicia la derivación cardiopulmonar para ofrecer protección cerebral, disminuyendo los requerimientos metabólicos y estimulando la solubilidad del gas en la sangre, lo cual disminuye el tamaño de las burbujas (7). Se mantiene una fracción inspirada de oxígeno al 100% durante 6 horas después de terminada la cirugía. El edema cerebral que sigue al embolismo aéreo se maneja mediante la administración inmediata de esteroides, dexametasona 10 a 20 mg IV o metilprednisolona 4 gramos IV. (6)
Se administra manitol 25 gramos IV y luego se continúa a 1 gramo/Kg/día, o infusión de glicerol a 1,2 gramos/Kg/dia durante 48 horas.
La elevación de la presión sanguínea, después de reiniciado la derivación cardiopulmonar, es muy importante para continuar
evacuando el aire del circuito cerebral; esto se lleva a cabo durante un periodo de hiperperfusión de 6.000 a 6.500 cc/ minuto y la administración de vasopresores. La aplicación temporal de un clamp a la aorta descendente inmediatamente por debajo de la arteria subciavía durante dos o tres minutos, con cuidadosos monitoreo de la arteria radial, es otro método para evacuar el aire del circuito cerebral. La neutralización de la heparina con protamina se debe retardar hasta el último momento posible.
Discusión
El riesgo de introducción de aire dentro de la circulación sistémica durante la derivación cardiopulmonar es conocido desde el mismo inicio del procedimiento. Recientemente, se ha detectado la presencia de aire mediante el uso del ecocardiograma transesofágico de las cavidades cardíacas, especialmente durante las cirugías en las cuales una o más cámaras cardíacas han sido abiertas, tales como las cirugías valvulares. Aunque es imposible conocer el volumen de aire, dentro de la circulación sistémica o cerebral que realmente causará lesión, al parecer es mayor que las cantidades presentes en la mayoría de las cirugías. En los pacientes sometidos a cirugía valvular se ha detectado, por ultrasonido doppler, más embolismo que en aquellos sometido a cirugía de bypass coronario y la mayoría de estos embolismos son de naturaleza aérea.
El incremento de la temperatura en la derivación cardiopulmonar producen hipoperfusión y daño cerebral. Adicionalmente, el embolismo aéreo provocado en animales de manera experimental a altas temperaturas cerebrales producen extensas lesiones necróticas en el cerebro. Por el contrario, bajas temperaturas son relativamente protectoras contra necrosis de la célula neural y aún parece ser uno de los mecanismos principales de neuroprotección durante la derivación cardiopulmonar. Como mecanismo de neuroprotección, la perfusión de la derivación cardiopulmonar debe realizarse usando una hipotermia superficial (32°C- 34°C), con hematocrito por encima de 15% y al final de la anestesia con hematocrito del 25 %. El flujo debe ser mantenido en 2,2 litros/metro2. La presión medía de perfusión debe mantenerse por encima de 50 y hasta preferiblemente 60 mm Hg usando vasopresores. La mayoría de los cirujanos piensan que las temperaturas bajas son muy útiles para cirugía valvular, especialmente en pacientes con hipertrofia ventricular. Es importante no permitir temperaturas sanguíneas que excedan los 37°C, además del uso, en sala de operaciones, de técnicas de monitoreo de perfusión cerebral, especialmente en pacientes de alto riesgo.
El embolismo aéreo es la tercera causa de morbilidad y mortalidad secundaria a derivación cardiopulmonar. El daño cerebral es esencialmente fácil de describir, pero solo recientemente se han estudiados los efectos neurológicos adversos subclínico. El daño subclínico es común después del derivación cardiopulmonar, pero usualmente es reversible. Actualmente los estudio más sensibles para detectar pequeñas áreas de daño cerebral después de derivación cardiopulmonar son la resonancia magnética nuclear y la tomografía con emisión de positrones.
En el pasado la causa más común de embolismo aéreo era un descuido del nivel de sangre en el oxigenador (8). Ocasionalmente la vasodilatación por medicamentos durante el curso de la perfusión puede dar como resultado una drástica disminución del nivel de sangre del oxigenador permitiendo la entrada de aire a la bomba. Un inesperado reinicio de los latidos cardíacos puede resultar en la eyección de aire antes que el cirujano tome medidas específicas. Un cambio en la dirección (reversa) de la perfusión o de la línea de ventilación permitirá la entrada de aire. El aire puede entrar al lado izquierdo desde el corazón derecho abierto por un foramen ovale permeable, lo cual ocurre en un 20 % de la población. Una ruptura en las líneas o en el puerto del oxigenador puede dar como resultado la entrada de aire (4). El uso concomitante del balón de contrapulsación aórtica y el arresto circulatorio puede permitir la entrada de aire a los vasos del arco aórtico si no se detiene el balón antes de abrir el corazón, la aorta ascendente o el arco.
Una inadvertida rotación continuada de la cabeza de la bomba puede vaciar el reservorio y permitir la embolización sistémica de aire después del bypass cardiopulmonar y antes de la decanulación de la aorta ascendente.
El aire retenido en la aurícula izquierda, las trabéculas miocárdicas y las venas pulmonares son, probablemente, la causa más común de embolización (1). El aire desde una simple infusión IV puede hacer su entrada a la circulación sistémica en pacientes con enfermedad cardíaca congénita y algún grado de corto circuito de izquierda a derecha. El aire puede entrar al circuito cerebral por una purga inadecuada dentro de la oclusión con clamp parcial usado sobre la aorta para la anastomosis proximal de coronarías. Se ha observado entrada de aire a través de la aorta desde arterias coronarias abiertas no ocluidas durante anastomosis distal, cuando se coloca el Vent sobre la aorta. Se ha reportado embolismo aéreo masivo secundario a filtración en la línea arterial. Una malfunción del oxigenador puede generar microembolismo gaseosos.
En los pacientes sometidos a cirugía de corazón abierto el riesgo de embolismo aéreo proviene de 3 fuentes: El cirujano y la técnica quirúrgica, el perfusionista y la bomba y el anestesiólogo y la técnica anestésico (1). Para prevenir los accidentes de embolismo aéreo debe haber una estrecha comunicación entre estos tres especialistas; la vigilancia constante, el conocimiento de las causas identificadas y el uso de mecanismos de seguridad son necesarias, además la constante atención del nivel de sangre en el oxigenador. Debe usarse un sistema de alarma audible con un principio fotoeléctrico o ultrasónico para el nivel de sangre en el oxigenador. La línea arterial debe tener un adecuado filtro. Una revisión sistemática de la integridad y dirección de todas las líneas de perfusión debe realizarse antes de la derivación y reportarse al cirujano. Las líneas de ventilación y aspiración deben probarse antes de la derivación para corroborar la correcta dirección de las líneas de perfusión. El oxigenador debe estar fijado de manera segura y hay que evitar el tráfico a su alrededor. Una adecuada ventilación del oxigenador, para evitar la presurización, se encuentra en casi todos los sistemas. La compresión sobre la carótida previa a la reanudación de los latidos cardíacos está indicada en ciertos pacientes (1). La bomba debe detenerse e inspeccionarse ante cualquier ruido anormal, ya que algunas veces ese ruido es el primer indicativo de aire proveniente de la bomba. La ecocardiografía bidimensional transesofágica, es muy útil para detectar aire dentro de las cavidades cardíacas antes del uso del desfibrilador y así prevenir que el aire sea eyectado a la circulación sistémica.
Conclusión
La perfusión cerebral retrógada a través de la VCS es una técnica relativamente nueva usada para la protección del cerebro durante operaciones del arco aórtico. Experimentalmente se ha medido el flujo sanguíneo del tejido cerebral, el consumo de oxígeno y la liberación de dióxido de carbono durante la perfusión cerebral retrógada en normotermia (37°C) y en hipotermia (20°C) con un flujo de perfusión de 300 ml /minuto a través de la vena cava superior y estos valores fueron comparados con los obtenidos en la derivación cardiopulmonar con un flujo de 1200 ml/min. En la perfusión cerebral retrógrada acerca del 20 % de lo perfundido por la VCS retornó a través de la aorta y el resto drenó hacía la vena cava inferior (9). La resistencia vascular cerebral durante la perfusión cerebral retrógrada es más baja que durante la derivación cardiopulmonar; la perfusión cerebral retrógrada provee la mitad del flujo sanguíneo cerebral de la derivación cardiopulmonar, además también provee una tercera parte del oxígeno, elimina el 20% del dióxido de carbono y reduce el daño isquémico durante la interrupción del flujo cerebral sanguíneo; usando condiciones de hipotermia profunda (20°C), posee más efecto cerebro-protector, que cuando se usa perfusión pulsátil o arresto circulatorio.
Es una técnica simple que provee protección cerebral, sin embargo, su óptimo manejo y limitaciones no están claros.
Referencias
1. Milis Noel. MD, Morris Joseph. CCR Air Embolism Associated with Cardiopulmonary Bypass. Complications in Cardiothoracic Surgery. 6:60-87. [ Links ]
2. Taylor MSc, Borger. MD, Weisel. MD, Cerebral Microemboli During Cardiopulnary Bypass: Increased Emboli During Perfusionist interventions. Ann Thorac Surg. 68: 89-93. 1999 [ Links ]
3. Longley, Chai, Miller, Mault, ieggers. lntermittent Perfusion Protects the Brain During Deep Hypotermic Circulatory Arrest. Ann Thorac Surg 68 :4-13. 1999. [ Links ]
4. Kuruusz M, Shaffer C W, Christman E W. Runaway pump head: New cause of pas embolism during cardiopulmonary bypass. J Thorac cardiovasc Surg.77: 792-795. 1979 [ Links ]
5. Mc Groon DC:Techniques of open hearth surgery for congenital hearth disease. Curr. Probi. Surg, 11: 3-42. 1986. [ Links ]
6. Bruce DA, Gennarel TA, Langfitt TW: Resucitation fom coma due to head injury. Crit Care Med .6:254-269. 1978 [ Links ]
7. BW Lytie, PM Mc Carthy, K M Mesney, RW Stewart and D M Cosprove. Systemic hypothermia and circulatory arrest combined with arterial perfusion of the superior vena cava. Effective intraoperative cerebral protection. The Journal of Thoraacic and cardiovascular surgery. Vol.1 09 .738-743. 1995
8. NL Milis, J L Ochsner. Massive air embolism during cardiopulmonary bypass . Causes, prevention and management. The Journal of Thoracic and cardiovascular Surgery, Vol.80, 708-717.1980 [ Links ]
9. Averi, Hotta, MHHiroura, M Murose. Retrograde cerebral perfusion through a superior vein caval cannula protects the brain. The Ann thorac Surg 53: 47-53. 1991 [ Links ]
*Cirujano cardiovascular. Hospital México (H.M.)
**Cirujano general, residente cirugía cardiovascular H.M.
***Jefe de servicio Cirugía cardiovascular H.M.
****Jefe de sección de Cirugía H.M., C.C.S.S., San José, Costa Rica.