Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Cardiología
Print version ISSN 1409-4142
Rev. costarric. cardiol vol.2 n.3 San José Dec. 2000
REVISIÓN
Introducción
Cada año aproximadamente 800.000 personas en los Estados Unidos presentan un infarto agudo del miocardio de las cuales 213.000 fallecen (1). La mayoría de estas muertes ocurren en la primera hora del infarto, y antes de que el paciente se presente al servicio de emergencias (2). Una vez que el paciente recibe atención médica la mortalidad intrahospitalaria es de un 10%. Otro porcentaje igual muere en el primer año después del infarto.
En las últimas tres décadas se ha observado una marcada disminución de la mortalidad en pacientes con enfermedad coronaria. Posiblemente se deba a una mejor educación, a la modificación de los factores de riesgo coronario y mejoras en el manejo de los Síndromes Coronarios Agudos donde la trombolísis y la angioplastía han contribuido significativamente.
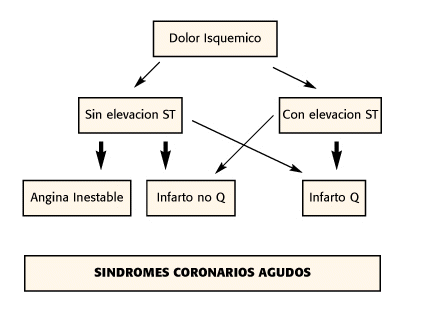
Fisiopatología: El infarto del miocardio se define como la necrosis del tejido cardíaco debido a una isquemia prolongada que lleva al reemplazo del miocardio por una cicatriz de tejido fibrótico. Generalmente ocurre por una oclusión trombótica súbita de una arteria coronaria. Esta se produce sobre una placa aterosclerótica que se vuelve inestable por un proceso de ulceración, fisura y ruptura(3,4,5) La vulnerabilidad de la placa y la trombogenicidad son factores que han adquirido más importancia que el tamaño de la placa o la severidad de la estenosis (6,7).Revisiones extensas o meta-análisis de la literatura(8) han mostrado: El 68% de los infartos ocurren en lesiones con estenosis menores del 50%; 18% con lesiones entre 50 a 70%, solamente el 14% de los infartos con lesiones mayores del 70%. Las manifestaciones clínicas que se presentan en el infarto agudo del miocardio dependerán de la vulnerabilidad de la placa y del tamaño del trombo. Es así, que trombos que ocluyen completamente la luz arterial y con una pobre circulación colateral provocarán un infarto del miocardio con onda Q. Cuando el trombo no ocluye completamente la luz arterial se presentará como angina inestable o infarto no Q(9).

El conocimiento más profundo de la fisiopatología de la enfermedad coronaria ha llevado a un cambio en la nomenclatura de las consecuencias de la enfermedad coronaria. Se denominan como Síndrome Coronario Agudo a la Angina Inestable, el Infarto no Q, y el Infarto Q.
Antman EM,Braunwald E,Acute Myocardial Infarction.In Braunwald EB,Editor.Heart Disease: A texbook of Cardiovascular Medicine,1996,Philadelphia,PA: WB Saundres.
Diagnóstico:
El criterio de la Organización Mundial de la Salud para el diagnóstico del infarto del miocardio se basa en la presencia de por lo menos dos de los tres criterios diagnósticos:
- Historia de dolor torácico con características de isquemia miocárdica.
- Cambios evolutivos electrocardiográficos en trazos seriados.
- Elevación y caída de marcadores de daño miocárdico en el suero.
Presentación Clínica:
La historia clínica continúa siendo el elemento más importante en la evaluación inicial.
Síntomas Típicos: Se presentan en 70 a 80% de los pacientes con IAM. La manifestación más frecuente es el dolor torácico. Es una opresión retroesternal con irradiación al hombro y brazo izquierdo. Pudiéndose irradiar a cuello, mandíbula, hombro y brazo derecho y al abdómen. Síntomas que se asocian comúnmente son sudoración, palidez, náusea, vómito, debilidad, síncope y sensación de muerte inminente. Pródromos de horas o días se presentan en aproximadamente un 50% de los pacientes.
Síntomas Atípicos: los más frecuentes cuando no hay dolor torácico son disnea y dolor abdominal. También se presentan manifestaciones de insuficiencia cardíaca reciente o deterioro de una insuficiencia crónica con o sin edema agudo pulmonar. Otra presentación son arritmias, síncope o accidente vascular cerebral embólico. Aproximadamente del 25 a 35% son infartos silenciosos, especialmente en pacientes diabé-ticos,mayores de 70 años y en pacientes recientemente operados cuando aún están bajo efectos de sedación.
En el Registro Nacional del Infarto del Miocardio de los E.U.A. un 33% de los pacientes con IAM no presentaron dolor torácico, por lo general eran mayores, mujeres y diabéticos. Tardaban mayor tiempo en solicitar ayuda médica y por lo tanto en recibir tratamiento apropiado. Su mortalidad intrahospitalaria era del 23.3% en comparación con los pacientes que referían dolor, la cual era de 9.3%(10).
Síntomas atípicos en el IAM.
| Síntomas | 65-74 años | 75-84 años | > 85 años |
| Dolor torácico | 78% | 60% | 38% |
| Disnea | 41% | 44% | 43% |
| Sudoración | 34% | 23% | 14% |
| Síncope | 3% | 18% | 18% |
| Confusión | 3% | 8% | 7% |
Reeder GS, Gersh BJ Acute Myocardial Infarction. Steins Internal Medicine 1994:169-89(11).
Exámen Físico: Rara vez es diagnóstico por sí mismo. Puede ser de un exámen prácticamente normal hasta un exámen severamente alterado. Killip y Kimbal(12) demostraron que con el exámen físico se puede establecer el pronóstico inmediato del paciente:
| Killip | Características Clínicas | Porcentaje de pacientes | Mortalidad |
| 1 | Sin insuficiencia cardíaca | 40-50% | 6% |
| 2 | Galope, estertores basales | 30-40% | 17% |
| 3 | Edema agudo pulmón | 10-15% | 38% |
| 4 | Shock Cardiogénico | 5 -10% | 81% |
| 1) Disección aórtica. | 6) Costocondritis. |
| 2) Pericarditis. | 7) Esofagitis. |
| 3) Miocarditis. | 8) Ulcera Péptica. |
| 4) Embolismo Pulmonar Agudo. | 9) Pancreatitis. |
| 5) Neuralgia Intercostal. | 10) Colelitiasis. |
Electrocardiograma: Continúa siendo por sí solo en la valoración inicial el exámen más útil para el diagnóstico del IAM(13). Sin embargo hay varios factores que limitan la interpretación del electrocardiograma para el diagnóstico y localización del infarto:
Condiciones que pueden simular el patrón electrocardiográfico de un IAM, el denominado pseudoinfarto (14):
Patrón Electrocardiográfico del IAM:
- El patrón clásico de lesión transmural con elevación del segmento ST, con cambios en la onda T y el desarrollo posterior de ondas Q se presenta en aproximadamente el 50% de los pacientes (15-16).
- Bloqueo de rama reciente.
- Depresión del segmento ST o inversión de la onda T.
- Cambios no específicos.
- Elevación ST en V3R-V6R en el infarto del ventrículo derecho.
Isquemia a Distancia: Es una condición que se presenta en electrocardiogramas de pacientes que tienen ondas Q recientes, con elevación del segmento ST diagnósticas de IM en evolución y depresión del segmento ST en otro territorio. Estos cambios adicionales pueden ser provocados por isquemia en otro sitio del infarto o por un fenómeno eléctrico recíproco. Este fenómeno llamado isquemia a distancia es un factor de mal pronóstico ya que lleva a un riesgo más elevado de complicaciones futuras (17).
La mayoría de los pacientes que desarrollan ondas Q durante un IAM las continuarán presentando en los electrocardiogramas. Hay un pequeño grupo de pacientes en que estas desaparecen del trazo electrocardiógrafico (18).
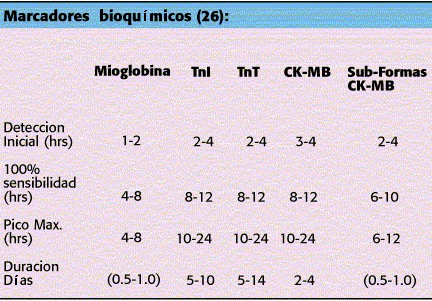
Marcadores Bioquímicos de daño Miocárdico.
Cuando se necrozan las células del tejido miocárdico pierden la integridad de la membrana celular y las macromoléculas intracelulares difunden hacia la micro- circulación y a los linfáticos. Eventualmente estas macro moléculas se detectan en la circulación periférica y constituyen los marcadores bioquímicos que nos permiten el diagnóstico y cuantificación del IAM. Nuevos marcadores de daño miocárdico como las sub- formas de la CK-MB, las Troponinas I y T, la mioglobina han adquirido gran popularidad (19).
Elevaciones seriadas de la Creatin-fosfokinasa y de la fracción MB han sido utilizadas para el diagnóstico del Infarto durante muchos años.
La CK-MB existe en una sola forma en el tejido miocárdico pero en diferentes sub-formas en el plasma. Una es CK-MB1 (Plasma) y CK-MB2(tisular). En las primeras 6 horas de la evolución de un infarto, un nivel absoluto de CK-MB2 > 1.0 U/lt y una relación de CK-MB2 a CK-MB1 > 1.5 es más sensible y específica para el diagnóstico de IAM que la CK-MB. (20,21).
El complejo de las Troponinas consiste de tres sub- unidades: Troponina T, Troponina I y Troponina C. Ambas troponinas TnT y TnI están presentes en el músculo esquelético y cardíaco, sin embargo por tener diferentes genes y secuencia de aminoácidos producen anticuerpos diferentes que permiten ser detectados independientemente. Varios estudios han demostrado su utilidad en el diagnóstico y pronóstico de los Síndromes Coronarios Agudos. Dado que la troponina I es muy sensible para la detección temprana de lesión miocárdica se utiliza para evaluar pacientes con el Síndrome de Dolor Torácico Agudo(22,23,24). Los pacientes que no presentan elevación del segmento ST durante el período de dolor y teniendo dos muestras de TnI negativas (por lo menos 6 hrs después del inicio del dolor) tienen un riesgo muy leve de IM o muerte (0.3%) y pueden ser externados del servicio de observación. La elevación de las Troponinas cardíacas en los Síndromes Coronarios Agudos ha llevado al Dr Braunwald ha modificar la clasificación de angina propuesta por él en 1989. Publicada recientemente en Circulation en Julio de este año (25) propone dividir a la angina en reposo con menos de 48 hrs de evolución Clase 3B en un grupoTnT positiva y otro TnT negativo. El riesgo de infarto o muerte en el primer grupo es entre 15-20% comparado con el segundo que es de menos del 2%.
Las mioglobinas se elevan muy tempranamente en el IAM pero no son específicas para músculo cardíaco y se pueden encontrar elevadas cuando hay daño en el músculo esquelético.
Valoración inicial del Tamaño del Infarto.
Actualmente la Ecocardiografía es la técnica más frecuentemente utilizada en los hospitales para valorar el tamaño del infarto. Puede mostrar la extensión y localización de las anormalidades de la contracción segmentaria, la función ventricular y la presencia de trombos, así mismo puede identificar complicaciones mecánicas del IAM. No puede distinguir las alteraciones segmentarias de la motilidad parietal agudas de las antiguas.
El uso de perfusión por medio de isótopos ayuda a valorar la respuesta a la reperfusión y la isquemia residual. Cuando la viabilidad del tejido es la duda, los estudios con Thallium con imágenes tempranas y tardías es una excelente opción.
Tratamiento:
Evaluación Inicial. La evaluación y tratamiento inicial se deberán realizar lo más rápidamente posible. Idealmente el tiempo transcurrido entre la llegada del paciente al servicio de emergencias y la aplicación del tratamiento deberá ser menos de 30 minutos.
Una historia y exámen físico breves, electrocardiograma y la toma de marcadores bioquímicos deberá realizarse de inmediato. El riesgo de muerte súbita es mayor en esta etapa inicial. Los objetivos del tratamiento son: la limitación del tamaño del infarto con medidas de reperfusión, detección temprana y tratamiento de arritmias complejas, prevención de insuficiencia cardíaca y de isquemia recurrente. Otras medidas estarán orientadas al confort del paciente, reducir complicaciones y facilitar una recuperación y rehabilitación adecuada.
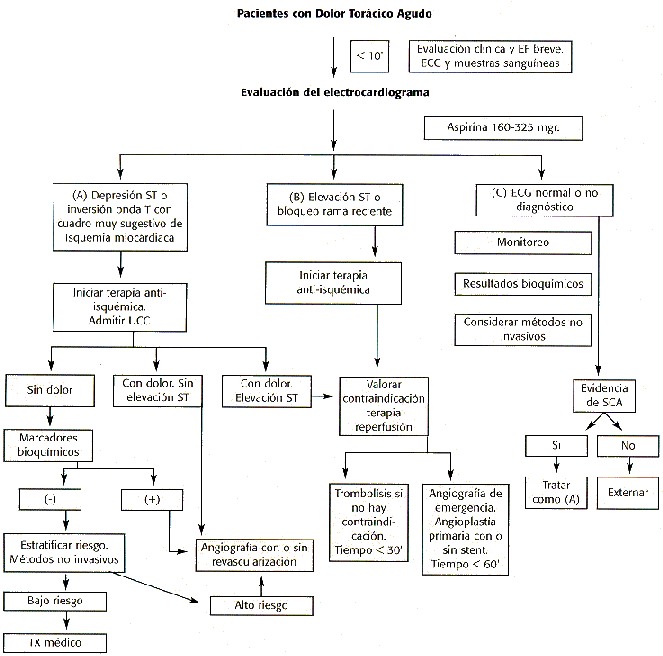
Medidas Generales de Rutina:
Oxígeno: Se ha establecido como práctica universal la aplicación de oxígeno por cánula nasal en todos los pacientes con sospecha de presentar un Síndrome Coronario Agudo.
Estudios experimentales muestran que la administración de oxígeno puede limitar el daño isquémico(27) y hay evidencia que el oxígeno disminuye la elevación del segmento ST en el IAM (28). Se administra de 2-4 lts por minuto, especialmente en pacientes con congestión pulmonar y con saturaciones menores del 90%. En infartos no complicados puede administrarse solamente en las primeras horas de evolución.
Aspirina (29): Forma parte integral del tratamiento del Síndrome Coronario Agudo. Actúa bloqueando rápidamente la formación de Tromboxano A2 en las plaquetas por la inhibición de la ciclo-oxigenasa. Las plaquetas pierden la capacidad de generar nueva ciclo-oxigenasa durando esta inhibición enzimática toda la vida de la plaqueta, aproximadamente 10 días.
En el estudio ISIS-2 (30) se demostró que disminuye la mortalidad en el IAM en 23% por sí sola y en combinación con la Streptokinasa la disminución fué aún mayor 42%. Las dosis pequeñas de aspirina 80 mgr toman varios días en mostrar su efecto antiplaquetario, es por esta razón que se utilizan dosis de 160 a 325 mgr y para facilitar su absorción se disuelve en la boca. Se usa inmediatamente y se continúa indefinidamente si no hay contraindicaciones. No se ha mostrado ningún beneficio cuando se asocia aspirina a dosis bajas de warfarina en pacientes con IAM(31).
Analgesia (32): El Sulfato de Morfina ha sido tradicionalmente el agente más usado en el manejo del IAM. Se administra en bolos IV en dosis de 2-5 mgr cada 5 a 30 minutos dos a tres dosis. Algunos pacientes podrían requerir dosis hasta de 25 a 30 mgr para lograr alivio del dolor. Se deben tomar precauciones en pacientes con EPOC severo. En el caso esporádico que se presente depresión respiratoria se administrará Naloxano a dosis de 0.4 mgr IV cada 3 minutos a un máximo de 3 dosis.
Medidas específicas:
La reperfusión de la arteria infartada con trombolísis o angioplastía primaria es la estrategia más importante en el manejo del IAM. El beneficio de la reperfusión es dependiente del tiempo, entre más rápido se restaure el flujo sanguíneo a la zona isquémica mayor beneficio en términos de sobrevida y pronóstico(33,34,35).
Trombolísis: Los agentes fibrinolíticos actúan como activadores directos o indirectos del plasminógeno, lo que resulta en un cambio de la pro-enzima a su forma activa plasmina la cual cataliza la degradación de fibrina o fibrinógeno y la disolución del coágulo. Los agentes fibrinolíticos pueden ser denominados como activadores específicos de la fibrina y activadores no específicos. Los activadores no específicos como la Streprokinasa, Urokinasa o Anistreptase convierten el plasminógeno circulante y el unido al coágulo en plasmina, resultando no solo en lísis de la fibrina en el coágulo sino también en fibrinogenolísis sistémica, fibrinogenemia y elevación de los productos de degradación del fibrinógeno circulantes(36). Los activadores específicos por el contrario producen lisis de fibrina en la superficie del coágulo preservando el fibrinógeno circulante. En este grupo se encuentra el activador tisular del plasminógeno.
Indicaciones:
1) Infarto del miocardio en evolución con elevación del segmento ST mayor de 0.1mV en dos o más derivaciones contiguas, menos de 12 horas de evolución y en pacientes menores de 75 años.
2) Síntomas sugestivos de IAM en presencia de bloqueo de rama reciente.
Contraindicaciones:
Absolutas:
1) Antecedente de AVC hemorrágico en cualquier época de la vida, otro tipo de AVC en término de un año.
2) Neoplasia intracraneal.
3) Sangrado interno activo(no incluye menstruación).
4) Sospecha de disección aórtica.
Relativas:
1) Hipertensión severa >180/110.
2) Uso de anticoagulantes en dosis terapéuticas (INR entre 2 y 3) y trastornos de la coagulación.
3) Historia de AVC no cubierto en contraindicaciones absolutas.
4) Trauma reciente ( 2 a 4 semanas) incluye trauma de cráneo, resucitación cardiopulmonar traumática o prolongada y cirugía mayor (< 3 semanas).
5) Punción vascular previa en sitios no compresibles.
6) Sangrado interno reciente(2 a 4 semanas).
7) Reacción alérgica a aplicación de Streptokinasa/Anistreptase previa.
8) Embarazo.
9) Ulcera Péptica activa.
10) Historia de Hipertensión crónica severa.
Beneficios de la Trombolísis:
El Grupo Italiano para el estudio de la Streptokinasa en el Infarto del Miocardio(34) fue el primer estudio que demostró una reducción de la mortalidad en los pacientes tratados con Streptokinasa. Análisis posteriores de 5 estudios grandes GISSI(34), ISAM(37), ISSIS 2(30), AIMS(38), ASSET(39),obtuvieron una disminución de la mortalidad del 27% entre 28.000 pacientes tratados en las primeras seis horas del IAM.
A pesar del enorme beneficio de la trombolisis sólo 33% de los pacientes se consideran candidatos elegibles para este tratamiento. En el estudio TIMI-2B(40) la mortalidad intra-hospitalaria de los pacientes que recibiron t-PA fue del 2.5 % comparado con un 10 a 25% en los pacientes que fueron excluídos de la trombolísis por diferentes razones.

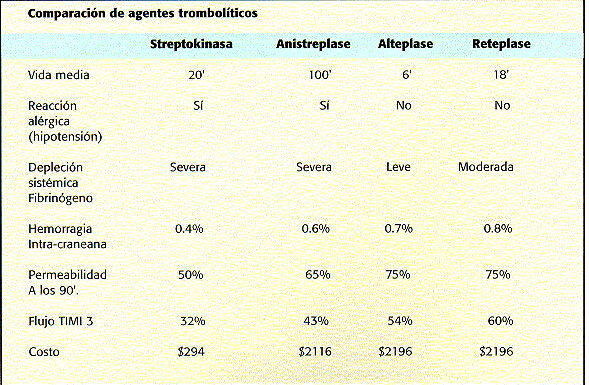
Independientemente del agente utilizado el mayor beneficio de la terapia trombolítica se obtendrá agilizando el tiempo que transcurre entre el inicio de los síntomas y la aplicación de la terapia; entre más rápido se aplique mejores resultados se obtendrán. (112).
Se han sugerido algunas alternativas para escoger el agente trombolítico. El estudio Gusto-1 (48), Gusto III (49) sugieren que el Régimen acelerado de Alteplase y Reteplase con heparina intravenosa son aparentemente las terapias más eficientes para obtener reperfusión coronaria temprana, pero ambas son mucho más caras y tienen un riesgo un poco mayor de hemorragia intracraneana. Se prefiere su uso en pacientes con infartos anteriores extensos, en menores de 75 años, que se presenten temprano a recibir atención médica y que no tengan factores que predispongan a un accidente vascular cerebral.
Efectos Adversos:
La terapia trombolítica está asociada con un riesgo pequeño pero definitivo de hemorragia intracraneana que ocurre predominantemente en el primer día de terapia (41).
Las variables clínicas que muestran un mayor riesgo de hemorragia intracraneana son (42):
1) Edad mayor de 65 años.
2) Bajo peso corporal.
3) Hipertensión diastólica > 110 mmHg.
4) Sexo femenino.
5) Uso de t-PA.
El riesgo aumenta conforme aumenta el número de factores predisponentes; en promedio general la incidencia es de 0.75%. Sin ningún factor el riesgo es de 0.26%, con un factor es de 0.96%, con dos factores 1.32% y es de 2.17% con la presencia de tres factores predisponentes (43).
Existe un riesgo temprano de muerte en las primeras 24 hrs de tratamiento de aproximadamente 5 muertes por cada 1000 pacientes tratados (50). Este riesgo prácticamente se anula al observar la sobrevida después del segundo día de tratamiento. Este aumento en la mortalidad temprana se observa principalmente en pacientes mayores de 75 años y en aquellos tratados después de 12 hrs del inicio de los síntomas.
Utilización de la trombolísis en grupos problema
Pacientes mayores de 75 años.
Los lineamientos del Colegio Americano del Corazón y de la Asociación Americana (44) proponen el uso de trombolísis en pacientes con elevación del ST mayores de 75 años como clase II a (el peso de la evidencia/opinión está en favor de la necesidad/eficiencia del procedimiento o tratamiento).
En este sub-grupo de pacientes el riesgo de muerte por infarto es elavado con o sin tratamiento.
En un meta-Análisis de la literatura entre 1982 y 1992 (45) en pacientes mayores de 75 años la terapia trombolítica redujo la mortalidad en 10 pacientes salvados por cada 1000 pacientes tratados mayores de 75 años.
En un estudio muy reciente de este año el Dr Thiemann (46) observó que en pacientes mayores de 76 años tratados con trombolíticos el beneficio que se obtenía era poco y la mortalidad mucho más elevada que en grupos de menor edad, las más afectadas eran las mujeres. En un editorial de la misma revista (47) el Dr Braunwald concluye: algunos pacientes mayores de 75 años definitivamente se benefician de la terapia trombolítica, pero muchos se enfrentan a un mayor riesgo de hemorragia intracraneana y a otras complicaciones incapacitantes o fatales. Los médicos debemos reconocer que la edad per-se no es la que provoca la evolución positiva o negativa de la terapia trombolítica, sino que es un marcador de patología y de enfermedades co-mórbidas asociadas que pueden influenciar el resultado del tratamiento.
Presentación tardía.
Tiempo transcurrido mayor de 12 horas de evolución.
Corresponde en los lineamientos a clase II b (La necesidad/eficiencia del procedimiento o tratamiento está menos establecida por la evidencia/opinión). Generalmente se obtiene poco beneficio con la terrapia trombolítica en pacientes con más de 12 hrs de evolución.
Se debe considerar el tratamiento para aquellos pacientes con dolor persistente y con elevación del ST que no tengan contraindicaciones absolutas para la trombolísis. Otras medidas de reperfusión se deben considerar.
Presión Arterial Mayor de 180/110.
Clase II b. El riesgo de hemorragia intracraneana es mauor cuando el paciente presenta hipertensión severa. Se sugiere controlar la presión arterial inicialmente con nitratos, beta bloqueadores, etc para normalizarla. Estas maniobras ayudan pero no reducen el riesgo. Más recomendado sería el uso de angioplastía primaria como método de reperfusión.
Angioplastía Coronaria Primaria.
La Angioplastía coronaria desarrollada por Andreas Gruentzig y aplicada por primera vez en 1977 abrió el camino de la cardiología intervencionista y su uso en el IAM (51). La restauración rápida y completa del flujo arterial y el tratamiento definitivo de la lesión a través de la angioplastía primaria la ha colocado como una excelente alternativa a la trombolísis.
El término Angioplatía Coronaria Primaria se aplica a la realización de la angioplastía en el IAM sin el uso previo de agentes trombolíticos.
La mayoría, pero no todos los estudios clínicos randomizados sugieren que los pacientes tratados extiosamente con angioplastía primaria tienen una menor incidencia de isquemia recurrente, reinfarto y muerte que los pacientes tratados con agentes trombolíticos (52,53,54). Los investigadores del estudio Gusto IIb (55) compararon el uso de un Régimen acelerado de t-PA con angioplastía primaria y demostraron una tendencia favorable a la angioplastía pero no fue estadísticamente significativa. El estudio MITI (56) con 3.145 pacientes estudiados no reportó ningún beneficio en la mortalidad cuando compararon angioplastía primaria con la terapia trombolítica.
Debido a los análisis de 10 estudios randomizados realizados por el Dr Weaver (57) comparando éstas dos modalidades de tratamiento es que la mayoría de los cardiólogos en los EU consideran actualmente a la angioplastía promaria como la terapia más efectiva para la reperfusión coronaria en el manejo del IAM.
La indicación más clara, Clase I (aquella condición en las cuales hay evidencia y/o acuerdo general que un procedimiento o tratamiento es beneficioso, necesario y efectivo) para la angioplastía primaria es:
1) Como alternativa a la terapia trombolítica en pacientes con IAM con elevación del ST o con bloqueo de rama izquierda reciente. A quienes se les pueda realizar la angioplastía de la arteria infartada dentro de las 12 hrs del inicio del los síntomas o mayor de éste lapso si los síntomas isquémicos persisten. Tiene que ser realizada en un tiempo prudente, por personas experimentadas en el procedimiento y en un laboratorio con personal entrenado.
2) Pacientes que se encuentran dentro de las 36 hrs de haber desarrollado una elevación del ST/onda Q que presentan Shock Cardiógenico, son mayores de 75 años y la revascularización puede realizarse dentro de las 18 hrs del inicio del Shock.
Angioplastía de Rescate:
Se refiere el término al uso de la angioplastía luego del fracaso de la trombolísis.
En general la angioplastía no está indicada en aquellos pacientes con reperfusión exitosa por trombolísis a menos que haya evidencia de isquemia recurrente. Estas recomendaciones son tomadas del Estudio Coperativo Europeo, Trombolísis y Angioplastía en el infarto del Miocardio (TAMI) (58) y dek TIMI -II (59).
El estudio RESCUE (60) comparó angioplastía de rescate contra la terapia coservadora en pacientes en los cuales fracasó la tromboleisis con IAM anterior. Se realizó la angioplastía exitosamente en 92% pero no se obtuvo una diferencia en la mortalidad, fracción de eyección o insuficiencia cardíaca a los 30 días de análisis. Cuando se consideró la combinación de muerte y de insuficiencia cardíaca, si se observó una mayor ventaja de la angioplastía de rescate.
Se ha sugerido que la angioplastía de rescate es más exitosa en la arteria descendente anterior que en la coronaria derecha. Estudios multicéntricos (61) han encontrado mayores complicaciones, especialmente Fibrilación Ventricular, Bloqueos y reoclusión en la angioplastía de rescate en la oclusión de la arteria coronaria derecha.
Uso de Stents en la Angioplastía Primaria.
La angioplastía primaria es un método muy valioso de reperfusión que resulta en una menor mortalidad, menos recurrencia de infarto y de accidente vascular cerebral comparado con la trombolísis. Sin embargo la isquemia recurrente se presenta en el 15% de los pacientes exitosamente tratados y un 40-50% de reestenosis en los primeros 6 meses. La colocación del Stent coronario ya no está contraindicada en lesiones que presenten trombos y disminuye notablemente las limitaciones de la angioplastía.
Varios estudios entre ellos el estudio de Amsterdam (62), PAMI stent pilot trial (63) FRESCO (64) Y Stentim-2 (65), han demostrado una menor incidencia de isquemia recurrente y un menor grado de reestenosis o de reoclusión en la arteria infartada con el uso de los Stent coronarios.
Comparación entre la Trombolísis y la Angioplastía Coronaria Primaria.
Terapia Trombolítica.
-Ventajas:
1) Disponible universalmente, no hay necesidad de laboratorio de cateterismo.
2) Inicio del tratamiento rápido.
3) Puede ser administrado por personal de enfermería entrenado.
4) Trata el problema agudo, disolución del coágulo.
5) Disminuye la mortalidad significativamente.
-Desventajas:
1) Se utiliza solamente en 30 35% de los pacientes con IAM.
2) Uso limitado en estados de inestabilidad.
3) Leve incremento de la posibilidad de hemorragia intra-craneana.
4) Permeabilidad coronaria temprana 55-85%.
5) Flujo TIMI 3 sólo en el 50%.
6) No modiffica la estenosis residual.
7) Valoración de la permeabilidad de la arteria requiere estudios adicionales.
Angioplastía Coronaria Primaria.
-Ventajas:
1) Excelente grado de reperfusión 80-90%. Flujo TIMI 3 en más del 90%.
2) Pocas contraindicaciones.
3) Trata la estenosis y la oclusión.
4) Grado de reperfusión valorado rápidamente.
5) Facilita el diagnóstico: permite valorar la extensión y severidad de la enfermedad coronaria.
6) Efectiva en situaciones de inestabilidad hemodinámica.
7) Facilita acceso para la colocación de Balón de Contrapulsación intra-aórtico.
8) Baja mortalidad.
Desventajas:
1) Requiere de acceso al laboratorio de cateterismo las 24 hrs.
2) Requiere personal especializado (mas de 75 casos de angioplastía por año) y de un centro con gran número de procedimientos (200-300 por año).
3) Procedimiento caro (inicialmente).
4) Puede prolongar el inicio del tratamiento inaceptablemente.
5) Reestenosis alta. Disminuye con la colocación de Stent.
El futuro de la reperfusión
A) Nuevos Trombolíticos. Una nueva mutación de t-PA, TNK-tPA (TENECTEPLASE), ha mostrado buenas expectativas. Ha sido aprobada por la FDA en julio de éste año. Su vida media prolongada ha permitido su uso en bolo en 5 a 10 segundos. Los estudios TIMI-10 B (66) y ASSENT 2 (67) han encontrado que a los 90' se obtuvo un flujo TIMI 3 semejante a t-PA.
LANOTEPLASE: es un nuevo activador sintético del plasminógeno, más potente que Alteplase, vida media más prolongada y se administra en bolo. En el estudio TIME-II (68) fue equivalente a Alteplase en reducir la mortalidad a 30 días pero con una incidencia mayor de hemorragia intracraneana.
Staphylokinasa Recombinante (STAR) es un agente fibrinolítico de origen bacteriano. Recanaliza eficiente y rápidamente las arterias coronarias y es más específico de fibrina que el r-tPA (69). También ha demostrado ser útil en oclusión arterial periférica (70).
B) Asociación de Inhibidores de las glicoproteínas IIb/IIIa con trombolíticos.
El trombo que obstruye la arteria infartada en pacientes con elevación del ST consiste de múltiples elementos que incluye plaquetas, trombina y una red de fibrina, pero su uso aumenta la actividad de la trombina y de las plaquetas. En respuesta a la estimulación de la trombina las plaquetas expresan receptores GP IIb/IIIa en su superficie con la cual por medio del fibrinógeno presenta una mayor superficie para la formación de complejos de protrombina y la generación adicional de trombina (71,72). Otra consecuencia de la activación plaquetaria que facilita la formación del trombo es la liberación de un inhibidor de la activación del plasminógeno 1 (PAI-1) y de sustancias vasoconstrictoras. De tal manera que el trombo rico en plaquetas es más resistente a la trombolísis y por la activación plaquetaria facilita la reoclusión.
Para poder vencer esta resistencia a la trombolísis y conociendo la estructura del trombo, la fibrina, la trombina y las plaqueta es que la terapia del IAM está dirigida hacia la inhibición de estos componentes (73).
-Fibrina: Activadores PLasminógeno o fibrinolíticos, t-PA, r-PA, SK, TNK-tPA.
-Trombina: terapia anti-trombina, Heparina no Fraccionada, Heparina de bajo perso molecular.
-Plaquetas: Terapia antiplaquetaria. Aspirina, Inhibidores GP IIb/IIIa.
En base a estos conocimientos es que se pensó en asociar potentes agentes antiplaquetarios con agentes trombolíticos para ver si era factible reducir el riesgo de reoclusión.
En el estudio TIMI 14 (74) los investigadores combinarion dosis parciales del agente trombolítico Alteplase con el Inhibidor de la GP IIb/IIIa Abciximab con dosis bajas o muy bajas de Heparina. Obtuvieron flujo TIMI 3 a los 60 y 90 minutos muy similares a los logrados con angioplastía, con una incidencia de sangrado serio o hemorragia intra-craneana muy baja semejante a la observada con los regímenes trombolíticos estándar. Cuando se asoció Streptokinasa a Abciximab la incidencia de sangrado fué prohibitivo.
La normalización de la elevación del segmento ST en el ECG se ha utilizado como un indicador no invasivo de la permeabilidad de la arterria infartada en la trombolísis (75). Los pacientes que tienen recuperación completa del segmento ST tienen un 94% de probabilidad de tener la arteria infartada permeable y un riesgo muy bajo de muerte a corto plazo (76). Los investigadores del estudio TIMI 14 (77) compararon la reducción del segmento ST en los pacientes tratados con sólo t-PA o con la combinación de la dosis reducida de t-PA más Abciximab. Los pacientes tratados sólo con t-PA la resolución fue de 37% vrs 59% con la combinación de medicamentos. La asociación de estos medicamentos mejora la reperfusión miocárdica (micro-vascular) y el flujo epicárdico.
Ohman y colaboradores del estudio IMPACT-AMI (78) utilizaron el inhibidor de la GP IIb/IIIa de acción rápida Eptifibatide que combiado con Alteplase mostró a los 90 minutos flujo TIMI 3 del 66% comparado con el grupo con sólo Alteplase de 39%.
En el editorial de la revista Circulation (79) el Dr Kenedy analiza la combinación farmacológica en la reperfusión y menciona que ésta con algunas modificaciones proablemente será equivalente o superior a la terapia de reperfusión mecánica. Cuando este punto esté debidamente aclarado la angioplastía primaria posiblemente se utilizará en aquellos pacientes en los que la terapia farmacológica haya fracasado o en aquellos que presenten contraindicaciones absolutas para su uso.
C) Combinación de Adenosina y Trombolíticos en el IAM.
La Adenosina ha sido estudiada extensamente como un agente cardioprotector. Se han demostrado que restaura las reservas de fosfato de las células endoteliales y miocárdicas, inhibe la formación de radicales libres, inhibe la actividad de los neutrófilos y su acumulación, mejora la función microvascular. En modelos animales reduce el tamaño del infarto, mejora la función ventricular y el flujo coronario. El estudio AMISTAD (80) demostró que el uso de Adenosina asociado a la trombolísis redujo el tamaño del infarto en un 67% pero solamente en pacientes con infartos anteriores. A pesar de la reducción del tamaño del infarto en el grupo con Adenosina, la evolución intra-hospitalaria en ambos grupos fue similar. Los autores recomiendan estudios de mayor volúmen para poder evaluar mejor la utilidad de este medicamento.
D) Combinación de Trombolísis y Angioplastía de Rescate PLanificada.
La literatura reciente en el manejo del IAM ha hecho énfasis en la necesidad de seleccionar un método específico de reperfusión, ya sea la terapia fibrinolítica o la terapia de reperfusión mecánica. Una alternativa sería la combinación de estos dos métodos de reperfusión. Estudios anteriores utilizando esta asociación mostró gran número de efectos adversos por lo que fue desechada por muchos años (81).
Lo atractivo de esta combinación de estrategias es el de superar el modesto grado de reperfusión que se obtiene con la trombolísis, usando la angioplastía de rescate planificada, con lo cual se mejora la reperfusión y también disminuye el tiempo de espera para recibir el tratamiento adecuado.
El Dr Allan Ross y el grupo de investigadores del estudio PACT (82) utilizaron dosis bajas de trombolíticos de acción corta rt-PA (Activase) junto con la angioplastía de rescate planificada y concluyeron: el estudio ha demostrado que a pesar de usar dosis bajas de rt-PA se obtuvo flujo TIMI 2-3 en 61% de los pacientes y TIMI 3 en 33% versus 15% en placebo. Cuando se requiere la angioplastía de rescate no hay disminución en el éxito del procedimiento y no aumentan las compliacaciones. La trombolísis usada en este estudio y la angioplastía son totalmente compatibles. Este tipo de combinación permitirá tratar a los pacientes inicialmente con la trombolísis y luego trasladarlos a un centro con facilidades de cateterismo y angioplastía coronaria (83).
Combinación de Inhibidores de la GP IIb/IIIa y Angioplastía Coronaria Primaria.
Con el uso de estos inhibidores en pacientes sometidos a una angioplastía coronaria de rutina se ha demostrado una disminución de los eventos isquémicos (84).
El uso de Abciximab en el tratamiento del IAM elegible para angioplastía coronaria promaria fue evaluada en el estudio GRAPE (85). El medicamento se aplicó en el servicio de emergencias a pacientes en espera de la angioplastía. Solamente el 20% de los pacientes presentaron flujo TIMI 3 a los 45 minutos de iniciado el tratamiento. Dado el número bajo de pacientes serán necesarios estudios más grandes para definir el papel de este medicamento en la angioplatía primaria.
El estudio RAPPORT (86) utilizó Abciximab en 483 pacientes con IAM a los cuales se les iba a realizar angioplastía primaria. Se demostró una reducción del 36% en la mortalidad, una disminución de reinfarto y en la necesidad de revascularización en los pacientes que recibieron el tratamiento.
Cirugía Coronaria de Emergencia.
Rara vez el uso de la cirugía de revascularización de emergencia está indicada en el IAM. Se reserva usualmente para aquellos pacientes con enfermedad coronaria múltiple con isquemia persistente, en el shock cardiogénico después del fracaso de la trombolísis o de la angioplastía coronaria y en las complicaiones mecánicas del IAM (87,88,89).
Terapia farmacológica:
A) Terapia antiplaquetaria y antitrombótica.
Aspirina (ya mencionada en medidas generales). Ticlodipina y Clopidogrel (131). Son agentes antiplaquetarios que inhiben la agregación plaquetaria por una modificación irreversible en los sitios de unión de las plaquetas. No han sido estudiados en la fase aguda del IM. Muy útiles asociados a la aspirina en el manejo del Stent intra-coronario (132).
Heparina. Es un compuesto antitrombina que reduce la deposición de plaquetas y fibrina.
Se utiliza la Heparina no fraccionada en al IAM con elevación del segmento ST en pacientes que no tengan contraindicaciones para la anticoagulación y que no sean candidatos para la trombolísis (90,91). Las dosis a usar varían de 7.500 UI subcutánea cada 12 horas hasta dosis completas reducidas hoy en día a 60 IU/Kg en bolo y una infusión de 12 U/Kg/hr para mantener un TPT de 1.5 a 2 veces el normal.
Los pacientes que reciben trombolísis con Alteplase (t-PA) se utiliza heparina no fraccionada concomitantemente a dosis como anteriormente descrita con un máximo de bolo de 4000 Uds y 1000 Uds/hr por un período de 48 hrs. Generalmente se puede descontinuar en pacientes de bajo riesgo. Se puede administrar subcutánea en pacientes con riesgo de embolia sistémica.
En los pacientes tratados con Streptokinasa no hay beneficio aparente con el uso inmediato de heparina IV. La única ecepción es en aquellos pacientes con infartos anteriores extensos, en la fibrilación auricular, trombosis previa o trombo mural. Se recomienda esperar 6 horas antes del uso de la heparina, controlar el TPT que este menos de 2 veces el control (aproximado 70 seg). Se inicia la infusión con 1000 u/hr durante aproximadamente 48 hrs y de acuerdo a la condición clínica se cambia a heparina subcutánea, Warfarina o Aspirina.
Las Heparinas de Bajo Peso Molecular son fragmentos de la heparina estándar producida por polimerización química o enzimática quue resuta en la producción de heparinas con un peso molecular entre 4.000 a 6.500. Varios estudios clínicos han demostrado su utilidad en el manejo de los Síndromes Coronarios Agudos especialmente en la Angina Inestable y el IM no Q (92).
Ventajas clínicas de las Heparinas de bajo peso molecular.
1) Respuesta más predeciblea una dosis fija.
2) Una vida media prolongada y una disminución del sangrado con efectos antibrombóticos equivalentes.
3) Mayor seguridad y eficacia en el tratamiento de la trombosis venosa.
4) No requiere de controles de anticoagulación.
5) Mas fácil de aplicar.
Hay varias heparinas de bajo peso molecular en estudio.
Actualmente contamos con: Ardeparin, Dalteparina (Fragmin), Enoxaparina (Clexane), Nadroparina (Fraxiparina).
En el estudio HART II (93) el Dr Ross comparó el uso de Heparina de bajo peso molecular Enoxaparina, t-PA y Aspirina contra Heparina no fraccionada, t-PA y Aspirina en pacientes con IAM con elevación del segmento ST. Los autores demostraron que la Enoxaparina puede sustituir a la heparina no fraccionada asociada a t-PA y Aspirina. Más estudios y mayor número de pacientes deben ser analizados antes de usar rutinariamente las Heparinas de bajo peso molecular en el IAM.
La Hirudina es un inhibidor directo de la trombina que puede tener algunas ventajas sobre la Heparina (94). Los investigadores del estudio Gusto IIb encontraron que la mortalidad y la incidencia de IM en el manejo del Síndrome Coronario Agudo fue de 8.9% en el grupo con Hirudina vrs 9.8% en el grupo con Heparina. El estudio TIMI 9b (95) indicó que la Heparina y la Hirudina eran igualmente efectivas en prevenir la muerte y el reinfarto. Cuando se usa con terapia trombolítica puede tener cierta ventaja sobre la Heparina (96).
B) Nitroglicerina:
Tradicionalmente los nitratos se han usado en los SCA desde 1970. Actúan produciendo una vasodilatación coronaria, arterial periférica y venodilatación con lo cual reduce la pre y post carga, aumenta la perfusión a las zonas isquémicas, disminuye el tamaño del infarto y mejora la función ventricular (97,98).
Indicaciones:
1) En las primeras 24 a 48 hrs en todos los pacientes con IAM y con Insuficiencia Cardíaca, Infarto Anterior extenso, Isquemia persistente o Hipertensión.
2) Uso continuo en pacientes con angina recurrente o congestión pulmonar.
3) Uso con precaución en pacientes con bradicardia severa, hipotensión, taquicardia o infarto del ventrículo derecho. Puede provocar tolerancia su uso prolongado (99,100).
4) Dosis inicial de 5 micro gramos/min con incrementos iguales hasta una disminución del dolor o de Presión Arterial Sistólica en un 10% en pacientes normotensos y un 30% en hipertensos.
C) Agentes Bloqueadores Beta Adrenérgicos.
La administración temprana de estos agentes en el IAM reduce el riesgo de muerte súbita y de reinfarto.
Su mecanismo de acción es por una disminución en el consumo de oxígeno del miocardio, por una disminución de la frecuencia cardíaca, de la presión arterial sistémica y de la contractilidad miocárdica (101,102,103,104).
Bloquean el efecto adverso de la activación simpática y tienen propiedades antiarrítmicas muy útiles. Los resultados de estudios clínicos documentan una impresionante disminución en la mortalidad temprana y tardía. En la revisión de 28 estudios con agentes boqueadores beta adrenérgicos (105), la reducción promedio de la mortalidad fue de 28% en una semana, boteniendo el mayor beneficio en las primeras 24 hrs.
Se documento una disminución de 18% de reinfarto y de un 15% en pparo cardiorespiratorio.
Contraindicaciones:
1) Bradicardia severa (FC < 50 lpm).
2) Bloqueo AV de 2do o 3er grado.
3) Edema Pulmonar.
4) Shock Cariogénico.
5) Asma.
6) EPOC severo.
Dosis:
Metroprolol: se administra a 5 mrg IV cada 2-5 minutos por 3 dosis. Si no hay efectos adversos después de 15 minutos de la administración de la última dosis se inicia 25-50 mgr por vía oral cada 6 hrs por dos días y luego 50-100 mgr bid.
Atenol: 5-10 mgr IV seguido de dosis por vía oral.
Propanolol: 0.5mgr IV con incrementos cada 5 minutos hasta efecto buscado o dosis máxima de 0.1 mgr/Kg.
Esmolol (106): Es una beta bloqueador de acción extremadamente corta, muy útil en pacientes que presenten contraindicaciones relativas en los cuales se desea una disminución de la frecuencia cardíaca. Dosis de inicio de 50 Microgr/Kg/min.
D) Inhibidores de la Enzima Convertidora de Angiotensina.
Los inhibidores de la ECA están claramente ubicados en el manejo del IAM. Estudios clínicos han establecido con gran claridad el beneficio de estas drogas (107). Estos han sido divididos en dos grupos: estudios no selectivos aquellos en los cuales se les administró la droga a todos los pacientes con IAM y los estudios selectivos en los que la droga fue administrada a sólo pacientes de alto riesgo.
Estos últimos incluyen a SAVE (108), TRACE (109), AIRE (110), AIREX (111). Se documentó una reducción de la mortalidad de 40 a 70 vidas salvadas por cada 1.000 pacientes tratados. Los inhibidores se deben iniciar idealmente en las primeras 24 hrs en tdos los pacientes con IAM, después de la terapia trombolítica y de que la presión arterial se encuentre estable. Los pacientes de alto riesgo que más se benefician son aquellos con infartos previos, insuficiencia cardíaca, infartos anteriores y pacientes taquicárdicos. Los pacientes de bajo riesgo que no presenten complicaciones y que no tienen evidencia de disfunción ventricular sintomática o asintomática se deben valorar a las 4-6 semanas y si no hay complicaciones se puede suspender el tratamiento con los inhibidores.
Su uso no esta indicado si la PA sistólica es < de 100 mmHg, si hay insuficiencia renal severa o si existe historia de estenosis de la arteria renal o alergia severa a los inhibidores de la ECA.
Se debe utilizar dosis bajas inicialmente de Enalapril, Captopril, Lisinopril o Ramipril y aumentar progresivamente hasta lograr el efecto deseado.
E) Bloqueadores de los canales del Calcio.
Su uso rutinario en el IAM no está indicado. Se puede utilizar para tratar angina post infarto en pacientes que no pueden utilizar beta bloqueadores y también en aquellos pacientes con Fibrilación Auricular para el control de la frecuencia cardíaca.
F) Magnesio.
Su utilización en el manejo del IAM permanece controversial. Los lineamientos del Colegio Americano y de la Asociación Americana del Corazón no recomiendan su uso rutinario.
En modelos de reperfusión animal se demostró un efecto protector del magnesio sobre el miocardio. El estudio LIMIT-2 (113) demostró una disminución de la mortalidad en pacientes tratados con magnesio del 24% y un 25% menos de incidencia de insuficiencia cardíaca. El estudio más grande realizado hhasta la fecha ISIS-4 (114) con 58.050 pacientes randomizó un grupo con magnesio y otro con placebo. No se observó ningún beneficio en el grupo tratado con magnesio. En otro estudio pequeño de 194 pacientes no considerados candidatos para terapia trombolítica (115), la mortalidad intra-hospitalaria fue de 4% en pacientes tratados con magnesio vrs 17% en el grupo no tratado. En el análisis de sub-grupos, los pacientes mayores de 70 años la disminución de la mortalidad fué aún mayor, 9% en los tratados vrs 23% en los no tratados. El estudio MAGIC (Magnesium in Coronary Artery Disease) se está realizando y hasta que no se presente el análisis final no tendremos una posición actual más clara con el uso de Magnesio. La recomendación actual es de usarlo en pacientes que presentan déficit de magnesio con episodios de Taquicardia Ventricular Torsades de Pointes y probablemente en pacientes de alto riesgo en quienes no se puede aplicar la terapia trombolítica.
La dosis óptima no se ha establecido. Por lo general se aplica 2 gr IV en 5-151 minutos seguido de una infusión de 18 grs en 24 hrs.
G) Glucosa Insulina y Potasio.
Propuesto su uso originalmente por el Dr Sodi-Pallares en 1969 (116). El estudio del Grupo Estudios Cardiológicos Latinoamérica (117) reportó el uso de GIP en 407 pacientes demotrando una disminución significativa en muerte, insuficiencia cardíaca y fibrilación ventricular en el grupo tratado. Otro estudio DIGAMI (118) reportó una reducción del 30% en la mortalidad a un año en pacientes diabéticos con IAM que recibieron un régimen estricto de Glucosa e Insulina por 24 hrs seguido de inyecciones subcutáneas de insulina durante 3 meses.
H) Estatinas.
Estas drogas que son altamente efectivas en la prevención primaria y secundaria de la enfermedad coronaria se han empezado a utilizar en la fase aguda del infarto del miocardio. Se ha demostrado que mejoran la vasodilatación endotelio-dependiente posiblemente mejorando la producción de óxido nitroso y estabilizando las lesiones vasculares ateroscleróticas, posiblemente al reducir el estímulo inflamatorio.
La Pravastatina en combinación con la terapia trombolítica redujo la morbilidad y mortalidad en pacientes con IAM (119).
En la reunión del Colegio Americano del Corazón en Febrero de este año el grupo de la Clínica Mayo (120) en un estudio con estatinas en el momento de la presentación del infarto mostraron que se obtiene una menor mortalidad intra-hospitalaria, menores niveles pico de CPK y un menor uso de Lidocaína para tratar arritmias ventriculares.
Otro estudio presentado por la Cleveland Clinic (121) en la misma época mostraron también una mehor evolución de los pacientes tratados con estarinas. Con ésta información preliminar queda abierto el camino para el desarrollo de nuevos y definitivos estudios para la utilización de las estatinas en los Síndromes Coronarios Agudos.
I) Warfarina.
El uso de la anticoagulación oral después del IAM ha sido muy controversial. En la actualidad se utiliza en pacientes con Fibrilación Auricular y en pacientes que presenten trombos en el VI. Las dudas persisten en pacientes con infartos extensos y con zonas aquinéticas grandes, para prevenir la posibilidad de accidentes vasculares embólicos. En los lineamientos anteriores se recomendaba la anticoagulación por un período de 3 meses. Actualmente queda a criterio del médico tratante el uso de este medicamento en estas circunstancias.
Medidas Complementarias en la Unidad Coronaria.
Dieta: Nada vía oral o solamente líquidos claros en las primeras 12 hrs. Continuar luego con la dieta recomendada por la Sociedad Americana del Corazón, la de Fase II, la cual es baja en grasa saturada (menos del 7% de las calorías) y en colesterol (menos de 200 mrg). Preferiblemente alimentos ricos en potasio, magnesio, fibra y baja en sodio.
Reposo: Las primeras 12 hrs en cama en pacientes hemodinámicamente estables y sin dolor. Pueden utilizar facilidades al lado de la cama para sus necesidades fisiológicas. Reducir al mínimo las visitas. El progreso de la actividad debe individualizarse para que ésta continué lenta y progresivamente hasta ser externado.
Ansiolíticos: No es necesario su uso rutinario, solamente en aquellos pacientes con marcada ansiedad o que los utilizaban de previo. El soporte psicológico de parte del personal y de la familia es muy importante.
Evitar: Las maniobras de Valsalva. Se deben utilizar alimentos altos en fibra o medicamentos que faciliten las evacuaciones intestinales.
Complicaciones Intra-hospitalarias.
1) Arritmias auriculares y ventriculares.
2) Bradiarritmias y transtornos de la coducción.
3) Dolor isquémico persistente o recurrente.
4) Extensión del infarto (reinfarto).
5) Expansión del infarto (aneurisma).
6) Shock Cardiógenico.
7) Insuficiencia cardíaca derecha o izquierda.
8) Dsifunción o ruptura músculo papilar.
9) Ruptura Septum o Pared libre del IV.
10) Infarto del ventrículo Derecho.
11) Pericarditis.
12) Trombosis venosa. Embolia Pulmonar.
13) Transtornos Psicológicos.
Manejo posterior del paciente con IAM
Estratificación de Riesgo Coronario
Estimación muy razonable en relación a la morbilidad y mortalidad futura se puede establecer en base a parámetros clínicos y de laboratorio. El pronóstico va en relación a varios factores de los cuáles el más importante sigue siendo el tamaño del infarto (122).
Estos factores de pronóstico se pueden dividir en:
A) Mecánicos
B) Isquémicos
C) Electrofisiológicos
D) Generales

En base a la presencia o no de factores de riesgo los pacientes pueden ser evaluados antes de ser externados con el siguiente esquema:
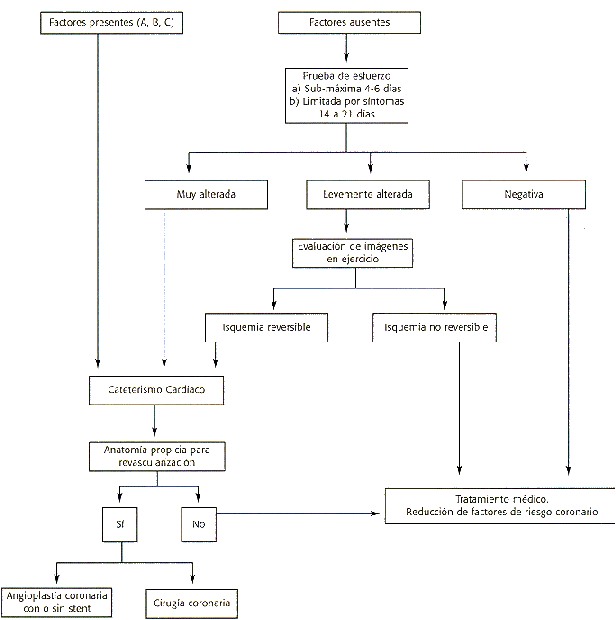
El manejo a corto plazo del paciente post IAM dependerá fundamentalmente de su condición clínica, de la anatomía coronaria y de la función del VI. Resultados obtenidos después de la trombolísis muestran diferentes grados de enfermedad coronaria residual(123). Por ésta razón muchos cardiólogos hoy en día realizan la angiografía coronaria después del uso exitoso de la trombolísis a pesar de que ésta conducta no es recomendada por el Colegio Americano de Corazón. No hay evidencia clara de que el conocimiento de la anatomía coronaria mejore el pronóstico de los pacientes que no tienen isquemia demostrable. Por el contrario el estudio DANAMI (124) sí mostró clara evidencia de que en pacientes post-trombolísis con isquemia inducible, el tratamiento invasivo, angioplastía o cirugía, resultó en una disminución de reinfarto, angina estable o inestable, comparado con el grupo tratado conservadoramente.
Tratamiento y modificación del riesgo coronario.
Prevención secundaria.
- Aspirina.
- Beta bloqueadores.
- Colesterol: Reducir LDL < 100 mgr/dl. El estudio 4S (125) demostró una disminución del 30 % en la mortalidad total y 42 % en enfermedad coronaria en los pacientes tratados con Simvastatina. Resultados semejantes en el estudio CARE (126).
- Dieta : Estadio II dieta de la Sociedad Americana del Corazón.
- Dieta Mediterránea (dieta Lyon) (127,128).
- Ejercicio, disminución de peso, rehabilitación y manejo adecuado de Stress.
- Fumar: programas especiales para dejar de fumar.
- Genética: diferentes genes se han detectado como causantes de enfermedad coronaria de gran interés para el futuro(133).
- Hipertensión: controles estrictos para mantener normo-tensión.
- Inhibidores ECA.
Nuevos Factores de Riesgo Coronario en Estudio:(129,130)
*Hiperhomocisteinemia.
*Stress oxidativo.
*Lp(a).
*Reservas de hierro.
*Factores de inflamación:
-Proteína C reactiva.
*Sustancias pro coagulantes:
-Fibrinógeno
-Factor VII
-Inhibidores de Activador del Plasminógeno 1 (PAI 1)
*Agentes Infecciosos:
-Clamydia Pneumoniae.
La enfermedad cardiovascular continúa siendo la causa más frecuente de muerte en todo el mundo, esto a pesar de los avances extraordinarios que se han obtenido en el diagnóstico y tratamiento del IAM. Debemos continuar con el propósito no sólo de buscar mejores medicamentos y de equipo técnico sino en educar a pacientes y familiares sobre ésta enfermedad. Solamente con la prevención y modificación de los factores de riesgo coronario lograremos continuar disminuyendo la mortalidad de los Síndromes Coronarios Agudos.
Referencias
1) American Heart Association Heart and Stroke facts 1966. Statistical Supplement Dallas AHA: 1996;1-23. [ Links ]
2) Herlitz J,Blohn M,Hartford M.Delay time in suspected Acute Myocardial Infarction and the importance of its modification. Clin Cardiol 1989; 12: 370-374. [ Links ]
3) Farb A, Burke AP, Tang A L , et al. Coronary plaque erosion without rupture into a lipid core: A frequent cause of coronary thombosis in sudden coronary death. Circulation 1996;93:1354-1363. [ Links ]
4) Dalager-Pederson S, Pederson E, Ringgaard S et al. Coronary Artery Disease : Plaque vulnerability, Disruption and thrombosis. From Fuster V.The Vulnerable Atherosclerotic Plaque, 1999; chapter 1: 1-23. [ Links ]
5) Toschi V, Gallo R,Lettino M et al. Tissue Factor modulates the thrombogenicity of Human Atherosclerotic Plaque. Circulation 1997;95: 594-599. [ Links ]
6) Falk E, Shah PK,Fuster V. Coronary Plaque disruption. Circulation 1995;92: 657-71. [ Links ]
7) Fuster V,Badimon JJ,Chesebro JH. The Pathogenesis of coronary artery disease and the Acute Coronary Syndromes. N Engl J Med 1992; 326:242-50. [ Links ]
8) Fuster V. The Vulnerable Atherosclerotic Plaque. American Heart Association Monograph series. Futura Publishing Company Inc 1999. [ Links ]
9) Muller JE, Abela GS,Nesto RW, Tofler GH. Triggers, acute risk factors, and vulnerable plaques: The Lexicon of a new frontier J Am Coll Cardiol 1994;23:809-813. [ Links ]
10) Canto J,Shlipak M,Rogers W et al. Prevalence, clinical characteristics, and mortality among patients with Myocardial Infarction presenting without chest pain. JAMA 2000,283: 3223-3229. [ Links ]
11) Reeder GS,Gersh BJ Acute Myocardial Infarction. Steins Internal Medicine. 1994:169-89. [ Links ]
12) Killip T,Kimball J. Treatment of Myocardial Infarction in a Coronary care unit. Am J Cardiol 1967;20:457-464. [ Links ]
13) Antman E, Braunwald E. Acute Myocardial Infarction In : Braunwald Heart Disease 5 th ed 1997:1184-1288. [ Links ]
14)Taussing AS, et al : Misleading ECG: Patterns of Infarction. J Cardivasc Med 1983;9:1147 [ Links ]
15) Golberg R, Gore J, Alpert J et al Incidence and case fatality rates of Acute Myocardial Infarction. Am Heart J 1988; 115:761-767. [ Links ]
16) Gibleer W,Lewis L,Erb R et al. Early detection of Acute Myocardial Infarction in patients presenting with chest pain and nondiagnostic ECG: serial CK- MB sampling in the ER. Ann Emerg Med 1990;19:1359-1366. [ Links ]
17) Reeder G. Gersh B. Curr Prob Cardiol. Modern Management of Acute Myocardial Infarction. 1996; 21:597-600. [ Links ]
18) Coll S, Betriu A, De Flores T, et al. Significance of Q-wave regression after transmural Acute Myocardial Infarction. Am J Cardiol 1988;61:739. [ Links ]
19) Newby LK,Gibler WB, Ohman WM, et al. Biochemical markers in suspected Acute MyocardialInfarction. ClinChem. 1995; 41:1263. [ Links ]
20)Poleo PR, Meyer D, Wathen C et al. Use of a rapid assay of sub forms of Creatine kinase MB to diagnose or rule out Acute Myocardial Infarction. N Engl J Med. 1994;331:561-6. [ Links ]
21)Yee T, Goldman L. Evaluation of the patient with Acute Chest Pain. N Engl J Med 2000;342:1187-1195. [ Links ]
22) Hamm CW, Goldmann BU, Heeschen C et al. Emergency room triage of patientes with Acute Chest Pain by means of rapid testing for cardiac troponin T or troponin I. N Engl J Med. 1997;337:1648-53. [ Links ]
23) Luscher MS, Thygesen K,Ravkilde J. Applicability of cardiac troponin T and I for early risk stratification in unstable coronary artery disease. Circulation 1997;96: 2578-85. [ Links ]
24) Hamm CW, Heeschen D,Goldmann BU et al. Cardiac troponin T levels for risk stratification in Acute Myocardial Ischemia. Abstr. J Am Coll Cardiol.1998;31:185 A. [ Links ]
25) Hanam CH, Braunwald E. A Classification of Unstable Angina Reviseted. Circulation 2000;102:118-122. [ Links ]
26) Adams J,Abendschein D,Jaffe A, Biochemical markers of Myocardial injury. Circulation ,1993;88:750-763. [ Links ]
27) Maroko PR, Radvany P,Braunwald E, Hale SL.Reduction of infarct size by oxigen inhalation following acute coronary occlusion. Circulation,1975;52:360-368. [ Links ]
28) Madias JE, Hood WB . Reduction of precordial S T segment elevation in patients with anterior myocardial infarction by oxygen breathing. Circulation, 1976; 53 (Suppl) I-198-200. [ Links ]
29) Hennekens C H. Update on Aspirin in the treatment and prevention of cardiovascular disease. Am Heart J 1999;137:S9-13. [ Links ]
30) ISIS-2 ( Second International Study of Infarct Survival) Collaborative Group.Randomised trial of intravenous Streptokinase,oral aspirin, both, or neither among 17187 cases of suspecteded acute myocardial infarction:ISIS-2. LANCET. 1988;2:349-360. [ Links ]
31) Randomized double blind trial of fixed Low-dose Warfarin with Aspirin after Myocardial Infarction. Coumadin Aspirin Reinfarction Study ( CARS ) Investigators. Lancet 1997;350: 389-6. [ Links ]
32) Herlitz J. Analgesia in Myocardial Infarction. Drugs 1989;37:939-944. [ Links ]
33) Martin G V, Kennedy J W. Choice of Thrombolytic agent. In: Julian DG,Braunwald E,eds. Management of Acute Myocardial Infarction. London, England: WB Saunders Co Ltd; 1994: 71-105. [ Links ]
34) Grupo Italiano per lo Studio della Streptochinasi nell Infarto Miocardico (GISSI). Effectiveness of intravenous thrombolytic treatment in Acute Myocardial Infarction. Lancet. 1986; 1:397-402. [ Links ]
35) Maurii F, Gasparani M,Barbonaglia L et al. Prognostic significance of the extent of Myocardial injury in Acute Myocardial Infarction treated by Streptokinase ( the GISSI trial). Am J Cardiol 1989; 63:1291-1295. [ Links ]
36) Collen D,Bouameaux H, De Cock F et al. Analysis of coagulation and fibrinolisis during intravenous infusion of Recombinant Human Tissue - Type Plasminogen Activator in patients with Acute Myocardial Infarction. Circulation. 1986;73:511-517. [ Links ]
37) ISAM Study Group. A prospective trial of intravenous Streptokinase in Acute Myocardial Infarction. N Engl J Med .1986; 314:1465-1471. [ Links ]
38) AIMS Trial Study Group. Effect of intravenous APSAC on mortality after Acute Myocardial Infarction.Preliminary report of a placebo - controlled clinical trial.Lancet. 1988;1: 545-549. [ Links ]
39) Wilcox RG,Olsson CG,Skene AM et al. For the ASSET Study Group. Trial of Tissue Plasminogen activator for mortality reduction in Acute Myocardial Infarction. Anglo -Scandinavian study of early thrombolysis (ASSET ).Lancet 1988; 2: 525-530. [ Links ]
40) Cragg DR, Friedman HZ,Bonema JD et al. Outcome of patients with Acute Myocardial Infarction who are inelegible for thrombolytic therapy. Ann Int Med. 1991;115: 173-177. [ Links ]
41) Simoons ML, Maggioni AP, Knatterud G et al. Individual risk assessment for intracranial haemorrhage during thrombolytic therapy. Lancet. 1993;342: 1523-1528. [ Links ]
42) De Jaegere PP, Arnold AA, Balk A H, Simoons ML. Intracraneal Hemorrage in association with thrombolytic therapy : incidence and clinical predictive factors. J Am Coll Cardiol. 1992;19:289-294. [ Links ]
43) Gore,J. M. Granger,CB,Simoons, M.L.,et al: Stroke after thrombolysis:Mortality and functional outcomes in the GUSTO-1 Trial. Circulation. 1995;92: 2811. [ Links ]
44) Ryan T J, Antman E M, Brooks N H , Califf R M, Hillis L D ,Hiratzka L F, Rapaport E, Riegel B, Russell R O, Smith E E, Weaver W D. ACC/AHA Guidelines for the management of patients with Acute Myocardial Infarction. [ Links ]
45) Fibrinolytic therapy trialists ( FTT) Collaborative Group. Indications for fibrinolytic therapy in suspected Acute Myocardial Infarction: collaborative overview of early mortality and major morbidity results from all randomized trials of more than 1000 patients. Lancet. 1994; 343:311-322. [ Links ]
46) Thiemann DR, Coresh J, Schulman S P et al. Lack of benefit for intravenous thrombolysis in patients with Myocardial Infarction who are older than 75 years. Circulation. 2000;101: 2239 -2246. [ Links ]
47) Ayanian J, Braunwald E. Thrombolytic therapy for Patients with Myocardial Infarction who are older than 75 years. Do the Riks Out weigh the Benefits. Circulation. 2000; 101: 2224-2226. [ Links ]
48) The GUSTO Investigators. An International randomized trial comparing four thrombolytic strategies for Acute Muocardial Infarction. N Engl J Med 1993;329: 673-682. [ Links ]
49) A comparison of Reteplase with Alteplase for Acute Myocardial Infarction. The Global Use of Strategies to Open Occluded Coronary Arteries ( GUSTO III ) Investigators. N Engl J Med. 1997; 337: 1118-1123.
50) Kleiman N, White H, Ohman E et al: Mortality within 24 hrs of thrombolysis for Myocardial Infarction. Circulation. 1994; 90:2658. [ Links ]
51) Gruentsig A R, Senning A, Siegenthaler W E. Nonoperative dilatation of coronary artery stenosis: Percutaneous transluminal coronary angioplasty. N Engl J Med. 1979;301:61-68. [ Links ]
52) O'neill W, Timmis G C, Bourdillon PD et al. A prospective randomized clinical trial of intracoronary Streptokinase versus coronary angioplasty for Acute Myocardial Infarction. N Engl J Med. 1979;301: 61-68. [ Links ]
53) Grines C L, Browne K F, Marco J et al. A comparison of inmediate angioplasty with thrombolytic therapy for Acute Myocardial Infarction. The Primary Angioplasty in Myocardial Infarction Study Group. N Engl J Med 1993; 328: 673-9. [ Links ]
54) Lieu TA, Gurley R J, Lundstrom R J, Parmley WW. Primary angioplasty and thrombolysis for Acute Myocardial Infarction . J Am Coll Cardiol 1996;27: 737-50. [ Links ]
55) A clinical trial comparing primary coronary angioplasty with tissue plasminogen activator for Acute Myocardial Infarction. The Global use of Strategies to Open Occluded Coronary Arteries in Acute Coronary Syndromes ( GUSTO II b).N Engl J Med.1997;336:1621-8.
56) Every NR, Parsons LS, Hlatky M et al. A comparison of thrombolytic therapy with primary coronary angioplasty for Acute Myocardial Infarction. Myocardial Infarction Triage and Intervention Investigators. N Engl J Med. 1996;315:1253-60. [ Links ]
57) Weaver W D, Simes R,Betriu A, et al Coomparison of primary coronary angioplasty and intravenous thrombolytic therapy for Acute Myocardial Infarction: a quantitative review. JAMA. 1997; 278:2093-8. [ Links ]
58) Harrington RA, Calif R M . The role of angioplasty after failed thrombolysis for Acute Myocardial Infarction.
Coron Artery Dis. 1994;5:392-8.
59) McKendall GR, Forman S, Sopko G, Braunwald E, Williams DO. Value of rescue percutaneous transluminal coronary angioplasty following unsuccessful thrombolytic therapy in patients with Acute Myocardial Infarction. Thrombolisis in Myocardial Infarction Investigators. Am J Cardiol . 1995;76: 1108-11. [ Links ]
60) Ellis Sg, da Silva ER, Heyndrickx G et al: Randomized Evaluation of Salvage angioplasty with combined utilization of end points. (RESCUE) study.Circulation 1994;90:2280-2284. [ Links ]
61) Abbottsmith C W, Topol EJ, George BS, Stack RS, et al: Fate of patients with Acute Myocardial Infarction with patency of the infarct-related vessel achieved with successful thrombolysis versus rescue angioplasty. J Am Coll Cardiol. 1990:16:770-778. [ Links ]
62) Suryapranata H, Van't Hof A W, Hoorntje JC,de Boer M J, Zijlstra F. Randomized comparison of coronary stenting with ballon angioplasty in selected patients with Acute Myocardial Infarction. Circulation. 1998;97: 2502-5. [ Links ]
63) Stone GW, Brodie BR, Griffin JJ, et al. Prospective, multicenter study of the safety and feasibility of primary stenting in Acute Myocardial Infarction: in hospital and 30 day results of the PAMI Stent Pilot Trial. Primary Angioplasty in Myocardial Infarction Stent Pilot Trial Investigators. J Am Coll Cardiol. 1998; 31:23-30. [ Links ]
64) Antoniucci D, Santoro GM, Bolognese L,Valenti R, Trapani M, Fazzini PF. A clinical trial comparing primary stenting of the infarct- related artery with optimal primary angioplasty for Acute Myocardial Infarction: Results from the Florence Randomized Elective Stenting in Acute Coronary Occlusions ( FRESCO) trial. J Am Coll Cardiol. 1998;31:1234-9. [ Links ]
65) Maillard L, Hamon M, Khalife K et al: A comparison of Sys tematic Stenting and conventional Ballon Angioplasty during Primary Percutaneous Transluminal Coronary Angioplasty for Acute Myocardial Infarction. J Am Coll Cardiol. 2000;35:1729-1736. [ Links ]
66) Cannon CP, Gibson CM, McCabe CH, Adgey AA, Schweiger MJ, Sequeira RF, et al. TNK-Tisuee plasminogen activator compared with front- loaded Alteplase in Acute Myocardial Infarction: results of the TIMI 10 B trial. Thrombolisis in Myocadial Infarction TIMI 10 B Investigators. Circulation. 1998;98: 2805-14. [ Links ]
67) ASSENT - 2 Investigators. Single bolus Tenecteplase compared with front loaded Alteplase in Acute Myocardial Infarction: The ASSENT - 2 double blind randomized trial.Lancet 1999;354: 716-22. [ Links ]
68) Den Heijer P, Vermeer F, Ambrosioni E ,et al Evaluation of a weight adjusted single-bolus plasminogen activator in patients with Myocardial Infarction. A double blind randomized,angiographic trial of Lanoteplase versus Alteplase. Circulation.1998;98:2117-25. [ Links ]
69) Collen D,van de Werf F: Coronary thrombolysis with Recombinant Staphylokinase in patients with evolving Myocardial Infarction. Circulation.1993; 87:1850-53. [ Links ]
70) Vanderschuren S, Stock L, Wilms G ,et al, Thrombolytic therapy of peripheral arterial oclussion with recombinant Staphylokinase. Clirculation. 1995; 92:2050-7. [ Links ]
71) Fitzgerald DJ, Catella F, Roy L. Marked platelet activation in vivo after intravenous Streptokinase in patients with Acute Myocardial Infarction. Circulation.1988;77:142-150. [ Links ]
72) Merlini PA,Baver KA,Oltrona L, et al. Thrombin generation and activity during thrombolysis and concomitant heparin therapy in patients with Acute Myocardial Infarction. J Alm Coll Cardiol. 1995; 25:203-209. [ Links ]
73) Cannon Ch. Overcoming thrombolytic resistance. Rationale and initial clinical experience combining thrombolytic therapy and Glycoprotein II b/IIIa receptor inhibition for Acute Myocardial Infarction. J Am Coll Cardiol. 1999;34:1395-1402. [ Links ]
74) Antman E M, Guigliano R P, Gibson CM, McCabe CH, et al: Abciximab facilitates the rate and extent of thrombolysis: results of the thrombolysis in Myocardial Infarction ( TIMI) 14 trial. Circulation. 1999;99: 2720-2732. [ Links ]
75) Clemmensen P, Ohmann E , Sevilla D, et al : Changes in standar electrocardiographic ST segment elevation predictive of successful reperfusion in Acute Myocardial Infarction. Am J Cardiol.1990;66: 1407-1411. [ Links ]
76) Schroder R, Dissman R, Bruggeman T et al: Extent of early ST segment elevation resolution: a simple but strong predictor of outcome in patients with Acute Myocardial Infarctin. J Am Coll Cardiol. 1994;24:384-391 [ Links ]
77) DeLemos J, Antman E, Gibson CM,McCabe CH, et al: Abciximab improves both Epicardial Flow and Myocardial Reperfusion in ST elevation Myocardial Infarction. Obervations from the TIMI 14 Trial. Circulation. 2000;101:239-245. [ Links ]
78) Ohman E M, Kleiman NS, Gacioch G et al: for the IMPACT-AMI Investigators. Combined accelerated tissue-plasminogen activator and platelet glycoprotein IIb/IIIa integrin receptor blockade with Integrilin in Acute Myocardial Infarction: results of a randomized, placebo- controlled,dose - ranging trial. Circulation. 1997;95:846-854. [ Links ]
79) Kennedy JW, Stadius ML. Combined thrombolytic and platelet glycoprotein IIb/IIIa inhibitor therapy for Acute Myocardial Infarction. Will pharmacological therapy ever equal Primary Angioplasty. Circulation.1999;99: 2714-2716. [ Links ]
80) Mahaffey K, Puma J, Barbagelata A, et al: Adenosine as an adjunt to thrombolytic therapy for Acute Myocardial Infarction. Results of a multicenter, randomized,placebo, controlled trial: The Acute Myocardial Infarction Study of Adenosine (AMISTAD) trial. J Am Coll Cardiol. 1999;34:1711-1720. [ Links ]
81) Simoons ML, Betriu A , Col J et al : for the European Cooperative Study Group for recombinant tissue-type Plasminogen Activator (rt PA). Thrombolisis with tissue plasminogen activator in Acute Myocardial Infarction: no additional benefit from inmediate percutaneous coronary angioplasty. Lancet . 1988;1:197-205. [ Links ]
82) Ross A, Coyne K, Reiner J, Greenhouse S , et al: A randomized trial comparing primary angioplasty with a strategy of Short-Acting thrombolysis and immediate Planned Rescue Angioplasty in Acute Myocardial Infarction. The PACT trial.J Am Coll Cardiol. 1999;34:1954-1962. [ Links ]
83) Keekey E, Weaver W. Combinaton therapy for Acute Myocardial Infarction. J Am Coll Cardiol. 1999;34: 1963-1965. [ Links ]
84) The CAPTURE Investigators. Randomized placebo controlled trial of Abciximab before, during and after coronary intervention in refractary unstable angina : the Capture Study. Lancet.1997;349:1428-35. [ Links ]
85) Van den Merkhof L, Zilstra F, Olsson H, Grip L, et al : Abciximab in the treatment of Acute Myocardial Infarction Elegible for Primary Percutaneous Transluminal Coronary Angioplasty. Results of the Glycoprotein Receptor Antagonist Patency Evaluation (GRAPE) Pilot Study. J Am Coll Cardiol. 1999;33:1528-32. [ Links ]
86) Brenner S J, Barr LA, Burchenal JE , et al Randomized , placebo- controlled trial of platelet Glycoprotein IIb/IIIa blockade with primary angioplasty for Acute Myocardial Infarction. Circulation. 1998;98: 734-741. [ Links ]
87) Gersh B J, Chesebro JH, Braunwald E, et al: Coronary artery by pass graft surgery after thrombolytic therapy in the Thrombolysis in Myocardial Infarction Trial, Phase II ( TIMI II) . J Am Coll Cardiol. 1995;25:395-402. [ Links ]
88) Braxton JH, Hammond GL, Letson GV,et al : Optimal timing of coronary artery by pass graft surgery after acute myocardial infarction. Circulation. 1995:92:1166-1168. [ Links ]
89) Hochman J Shold we emergently revascularize occluded coronary arteries for Cardiogenic Shock (SHOCK) trial.An international randomized trial of emergency PTCA/ Coronary Bypass graft. J.Am Coll Cardiol 1999;34:1-8. [ Links ]
90) Chesebro JH, Badimon JJ, Ortiz AF, Meyer B J, Fuster V. Conjuntive antithrombotic therapy for thrombolysis in myocardial infarction. Am J Cardiol .1993;72:666-746. [ Links ]
91) Cairns JA, Hirsh J, Lewis HD, et al Antithrombotic agents in coronary artery disease. Chest. 1995;108(Suppl):3805. [ Links ]
92) Kaul S, Shah P. Low Molecular Weight Heparin in Acute Coronary Syndrome: Evidence for superior or Equivalent Efficacy compared with Unfractioned Heparin . J Am Cloll Cardiol 2000;35: 1669-1712. [ Links ]
93) Ross A. A randomized comparison of Low- Molecular Weight Heparin and Unfractioned Heparin (UFH) adjuntive to t-PA thrombolisis and Aspirin (HART-II ). Late Breaking Clinicals Trials Sessions at ACCIS and ACC 2000. J Am Coll Cardiol.2000;36:318-319. [ Links ]
94) A comparison of recombinant Hirudin with Heparin for the treatment of Acute Coronary Syndromes. The Global Use of Strateggies to Open Occluded Coronary Arteries (GUSTO) II b Investigators. N Engl J Med. 1996;335:775-82.
95) Antman E M. Hirudin in Acute Myocardial Infarction. Thrombolisis and thrombin Inhibition in Myocardial Infarction (TIMI ) 9b trial. Circulation. 1996;94:911-21. [ Links ]
96) Cannon CP, Braunwald E. Hirudin: initial results in Acute Myocardial Infarction, unstable angina and angioplasty. J Am Coll Cardiol. 1995;25:30S-7s. [ Links ]
97) Yusuf S, Collins R, MacMahon et al. Effect of intravenous nitrates on mortality in Acute Myocardial Infarction: an overview of the randomized trials. Lancet.1988;1:1088-92. [ Links ]
98) Jugdutt BI, Warnica JW. Intravenous nitroglycerin therapy to limit Myocardial Infarct size, expansion and complications: Effect of timing, dosage, and infarct location. Circulation. 1988; 78:906-19. [ Links ]
99) Come PC, Pitt B Nitroglycerin-induced severe hypotension and bradycardia in patients with acute myocardial infarction. Circulation.1976;54: 624-628. [ Links ]
100) Kinch JW, Ryan TJ. Right ventricular infarction. N Engl J Med.1994;330: 1211-1217. [ Links ]
101) B-Blocker Heart Attack Study Group. The B -Blocker Heart Attack Trial. JAMA 1981;246:2073-4. [ Links ]
102) The Norwegian Multicenter Study Group. Timolol induced reduction in mortality and reinfarction in patients surviving acute myocardial infarction. N Engl J Med. 1981;304:801-7. [ Links ]
103) B-Bloker Heart Attack Trial Research Group. A randomized trial of propanolol in patientes with acute myocardial infarction. Mortality Results. JAMA 1982;247:1707-14. [ Links ]
104) The MIAMI trial Research Group. Metoprolol in Acute myocardial infarction (MIAMI) a randomized placebo- controlled international trial. Eur Heart J.1985:6:199-211. [ Links ]
105) Lau J, Antman EM, Jimenez-Silva, et al. Cumulative meta- analysis of therapeutic trials for Myocardial Infarction. N Engl J Med. 1992;327:248-54. [ Links ]
106) Kirshenbaum JM, Kloner RF, McGowan N. Use of an ultra short-acting beta bloquer (esmolol) in patients with acute myocardial ischemia and relative contraindications to beta - blockade therapy. J Am Coll Cardiol.1988;12:773. [ Links ]
107) Indications for ACE inhibitors in the early treatment of acute myocardial infarction: systematic overview of individual data from 100000 patients in randomized trials. ACE Inhibitor Myocardial Infarction Collaborative Group. Circulation.1998;97:2202-12. [ Links ]
108) Pfeller MA, Braunwald E, Moye LA , et al : for the SAVE Investigators. Effect of Captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction.Results of the Survival and Ventricular Enlargement Trial (SAVE) N Engl J Med . 1992:327:669-77. [ Links ]
109) The TRACE Study Group. The Trandolapril Cardiac Evaluation (TRACE) study. Rationale, characteristics of the screened population. Am J Cardiol.1994;73:44c-55c. [ Links ]
110) The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators. Effect of Ramiprimil on mortality and morbidity of acute myocardial infarction with clinical evidence of heart failure. Lancet.1993;342:821-8. [ Links ]
111) Hall AS, Murray GD, Ball SG.Follow up study of patients randomly allocated Ramipril or placebo for heart failure after acute myocardial infarction: AIRE Estension (AIREX) Study. Acute Infarction Ramipril Efficacy. Lancet.1997;349:1493-7. [ Links ]
112) Cannon CH,Gibson M, Lambrew C. Longer thrombolisis Door-to Needle times are associated with increased mortality in Acute Myocardial Infarction: An Analisis of 85589 patients in the National Registry of Myocardial Infarction. Presented at the 49th Annual Scientific Session, Anaheim California. J Am Coll Cardiol.2000;35:376A. [ Links ]
113) Woods KL,Fletcher S,Rofle C,et al. Intravenous magnesium sulphate in suspected acute myocaardial infarction: Results of the Second Leicester Intravenous Magnesium Intervention Trial (LIMIT-2). Lancet 1922;339:1553-8. [ Links ]
114) ISIS-4 Collaborative Group ISIS-4. A randomized factorial trial assessing early oral captopril,oral mononitrato and intravenous magnesium sulphate in 58050 patients with suspected acute myocardial infarction. Lancet. 1995;345:669-85. [ Links ]
115) Schechter M, Hod H, Chouraqui P, Kaplinsky E, et al Magnesium Therapy in Acute Myocardial Infarction When patients are not candidates for thrombolityc therapy. Am J Cardiol. 1995; 75:321-3. [ Links ]
116) Sodi- Pallares D,Testelli MR, Fischleder BL.Effects of an intravenous infusion of a Potassium-Glucose-Insulin solution on the electrocardiographic signs of myocardial infarction. Am J Cardiol. 1962;9:166-181. [ Links ]
117) Diaz R, Paolasso EA, Piegas LS,et al. Metabolic Modulation of Acute Myocardial Infarction: the ECLA
(Estudios Cardiológicos Latinoamerica) Collaborative Group. Circulation. 1998; 98: 2227-2234.
118) Malmberg K,Ryden L,Efendic S,et al Randomized trial of Insulin-Glucose infusion followed by subcutaneous insulin treatment in diabetic patients with Acute Myocadial Infarction ( DIGAMI ) Study. Effects on mortality at 1 year. J Am Coll Cardiol.1995;26:57. [ Links ]
119) Kayikcioglu M, Turkoglu C, Kultursay H,Evrengul H, Can L. the short term results of combined use of Pravastatin with thrombolytic therapy in acute myocardial infarction. Circulation. 1999; 100(Suppl I): II-303. [ Links ]
120) Bybee K, Wrigh S, Williams B. Is use of a Statin Agent at the time of presentation for Acute Myocardial Infarction Associated with a favorable out come. J Am Coll Cardiol. 2000;35 (Suppl A):314A. [ Links ]
121) Arnow H, Roe M, Lover M et al Early and Striking Mortality Reduction after Acute Coronary Syndromes Following Lipid Lowering Therapy. J Am Coll Cardiol. 2000; 35 (Suppl A ): 411 A. [ Links ]
122) Antman E, Braunwald E Acute Myocardial Infarction. In Braunwald E ed Heart Disease : A texbook of Cardiovascular Medicine. 5 th Ed.WB. Saunders Co, 1977:1258 -1266. [ Links ]
123) Topol EJ, Holmes DR, Rogers WJ. Coronary angigraphy after thrombolityc therapy for acute myocardial infarction. Ann Inter Med 1991;114:877-85. [ Links ]
124) Madsen JK, Grande P, Saunamaki K et al.Danish Multicenter randomized study of invasive versus conservative treatment in patients with inducible ischemia after thrombolysis in acute myocardial infarction (DANAMI). Danish trial in Acute Myocardial Infarction. Circulation.1997;96:748-55. [ Links ]
125) Scandinavian Simvastatin Survival Study Group. Randomized trial of Cholesterol lowering in 4444 patients with coronary heart disease: The Scandinavian Simvastatin Survival Study (4S). Lancet 1994;344:1383-9. [ Links ]
126) Sacks FM, Pfeller MA, Moye LA, Rouleau JL, et al: The effect of Pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels.Cholesterol and Recurrent Events (CARE). Trial Investigators. N Engl J Med .1996;335:1001-9. [ Links ]
127) Lorgeril M, Salen P,Martin J L, Monjaud I, et al: Mediterranean diet, traditional risk factors, and the rate of cardiovascular complications after myocardial infarction: final report of the Lyon Diet Heart Study. Circulation.1999;99:779-785. [ Links ]
128) Leaf A . Dietary Prevention of Coronary Heart Disease. The Lyon Heart Study.Circulation. 1999;99:733-735. [ Links ]
129) Liebson P, Amsterdam E. Prevention of Coronary Heart Disease. Part I. Primary Prevention. DM.1999;45:497-572. [ Links ]
130) Liiebson P, Amsterdam El, Prevention of Coronary Heart Disease. Part II.Secondary Prevention. DM 2000;46:1-124. [ Links ]
131) Sharis PJ, Cannon CP,Loscalzo J. The antiplatelet effects of Ticlopidine and Clopidogrel. Ann Int Med 1998:129:394-405. [ Links ]
132) Bertrand M,Rupprecht H, Urban P,Gershlick A, et al Double-Blind Study of the Safety of Clopidogrel with and without a Loading dose in combination with Aspirin compared with Ticlopidine in combination with Aspirin after Coronary Stenting The Clopidogrel Aspirin Stent International Cooperative Study (CLASSICS). Circulation 2000;102:624-629. [ Links ]
133) O'Brien T,Simari D. Gene therapy for Aterosclerotic CardiovasculaR Disease: A time for Optimism and Caution. Mayo Clin Proc 2000;75:831-834. [ Links ]
*Cardiología y Medicina Crítica
Clínica Burstin y Hospital Cima-San José.
Apdo. 445-100
San José, Costa Rica.














