Introducción
Se ha denominado como Historia Social de los Virus al área de la salud que se encarga de estudiar y describir la influencia de los virus y las infecciones virales con relación a la historia de la Humanidad (McMichael 2004). Los problemas epidemiológicos se inician con los cambios de comportamiento del Homo sapiens en el Neolítico cerca de 12.000 años atrás, cuando el ser humano desarrolla comunidades alrededor de los cultivos alimentarios, generalmente cereales. El mayor contacto entre los miembros de la población, como el incremento en número favoreció que los virus se propagaran rápidamente, esta situación ayuda a que algunas de estas enfermedades virales se hicieran endémicas (Clark 2010, Barret & Armelagos 2013)
Hubo paralelamente un incremento de las virosis de animales y plantas, debido a que, al ser manipulados por el ser humano, las poblaciones aumentaron y se incrementó el hacinamiento, con lo que se favoreció el contagio. Como el ser humano se hace dependiente de la agricultura y la ganadería, las enfermedades como los tospovirus de múltiples plantas y la peste bovina han tenido efectos devastadores. Entonces se registran algunas enfermedades que atacan al humano pudiendo terminar con la muerte (Villareal 2005).La viruela y el sarampión se consideran entre los virus de más larga data asociados a los grupos humanos (Villareal 2005). Estos virus posiblemente evolucionaron a partir de virus que infectan a otros animales y aparecen por primera vez en Europa y Norte de África. Aparecen por primera en humanos hace 11 000 años en comunidades agrícolas de la India (Villareal 2005). Algunos consideran que los virus exclusivamente humanos evolucionan a partir de los Poxiviridae que afectan a los roedores (Hughes et al 2010).
Entre los Flaviviridae se tiene conocimiento que los virus Dengue se hayan asociados al ser humano desde hace mucho tiempo. Los recuentos históricos indican que hay evidencias de infecciones por este tipo de virus desde el año 992 a.C. en Asia. Luego se informa en el siglo XVII donde se puede observar una amplia distribución de la enfermedad (Chen & Vasilakis 2011).
Estos acontecimientos indican que la familia Flaviviridae se haya asociada al ser humano desde hace mucho tiempo, y el género Flavivirus presenta una larga historia de asociación con los humanos. Los patrones de dispersión como de infección dependen en mucho de la distribución y presencia de los insectos vectores en este caso mosquitos de los géneros Aedes y Culex (Vlachakis et al. 2013). No obstante, estos patrones de asociación cambian dependiendo de la evidencia analizada por lo que no hay un consenso claro y definitivo acerca de cómo se da la asociación con los grupos de artrópodos vectores (Cook & Holmes 2006).
El Virus del Nilo Occidental (VNO (WNV); Flavivirus; Flaviviridae) es el agente etiológico de la enfermedad viral más extendida en el mundo, la cual es mediada por artrópodos y además es la enfermedad neuroinvasiva con el mayor brote de la enfermedad nunca antes informado(Bosch et al. 2007). Brotes transmitidos por mosquitos son influenciados por factores intrínsecos, como, por ejemplo, la especie vector del virus, competencia genética, longevidad de los vectores y el anfitrión, rasgos de la historia natural del vector y extrínsecos como por ejemplo, la temperatura, la precipitación, el uso humano de la tierra, entre otros que afectan a la actividad de virus y biología de los mosquitos (Hardy et al. 1983).
El concepto de capacidad vectorial integra estos factores para hacer frente a las interacciones del virus con la especie anfitrión de los artrópodos, que conduce a una comprensión más clara de su relación vinculante, la forma en que afectan la transmisión de enfermedades y cómo afectan a la salud humana (Macdonald 1961).
Factores relacionados con la ecología de los hospederos vertebrados como la competencia entre hospederos, la dinámica poblacional y el estado inmunitario de los individuos también afectan la dinámica de la transmisión.
La complejidad de estas interacciones se agrava aún más por el hecho de que el virus también puede afectar tanto a huéspedes vertebrados e invertebrados en formas que alteran significativamente los patrones de transmisión del virus (Ciota & Kramer 2013).
La importancia de estos acontecimientos relativos a los arbovirus y su transmisión es por lo que la OMS (WHO) ha declarado en el 7 abril de este año, el Día Mundial de la Salud, la necesidad de estudiar y prevenir las enfermedades mediadas por artrópodos, empezando con la campaña "Pequeño bocado, gran amenaza" campaña que tiene como objetivo educar acerca de las enfermedades transmitidas por vectores (http://vaccinenewsdaily.com/world_health_organization/330449-whofocuses-on-vector-borne-diseasesfor-world-health-day-2014/).
En este trabajo se pretende revisar y actualizar la información acerca de las tendencias evolutivas en el uso de los grupos de artrópodos vectores, como los caracteres que son de importancia en la clasificación de los géneros Aedes y Culex con especial referencia a las especies que son vectores del virus WNV.
Materiales y métodos
Para el desarrollo de este trabajo se han utilizado datos tomados de una amplia revisión bibliográfica utilizando las bases de datos de texto completo referentes al área de Salud (http://sibdi.ucr.ac.cr/dbsalud.jsp), Interdisciplinarias (http://sibdi.ucr.ac.cr/dbinterdisci.jsp) y Ciencias Básicas (http://sibdi.ucr.ac.cr/dbciencibasi.jsp) suscritas al Sistema de Bibliotecas, Documentación e Información (SIBDI) de la Vicerrectoría de Investigación de la Universidad de Costa Rica. Además se han utilizado documentación pertinente obtenida en la red en los sitios de consulta del Instituto Nacional de Biodiversidad (INBio), material preparado por Guillermo Chaverri y publicado en línea bajo el título Clave Fotográfica para larvas de zancudo (Diptera: Culicidae) presentes en Centroamérica y Panamá (http://www.inbio.ac.cr/papers/culicidae_larvas/index.html), como también la Sinopsis de los géneros de zancudos (Diptera: Culicidae) presentes en Centroamérica y Panamá (http://www.inbio.ac.cr/papers/sinopsis/index.html). La sinopsis de los datos se presenta organizada desde el punto de vista de la importancia de la taxonomía y la sistemática en los estudios de virus y vectores, para entrar en los aportes de la moderna filogenia y su estructura de estudio e importancia, la ecología de las especies y su importancia en Costa Rica.
Resultados
Se analiza y se da una breve sinopsis de los conceptos fundamentales necesarios para comprender los mecanismos evolutivos que pueden conducir al desarrollo de relaciones entre organismos sean antagónicas o simbióticas. En donde hay una competencia evolutiva que involucra un constante intercambio de costo beneficio, en donde ante una reacción al medio hay una respuesta de los organismos asociados al primer organismo que reacciona ante el medio como un intento de adaptación.
Estas respuestas son constantes y se manifiestan de manera que no haya una pérdida por parte de las especies que interactúan. Desde este punto de vista lo primero que debemos abordar es el concepto de vector epidemiológico, que se refiere a las asociaciones evolutivas que permiten que un organismo sirva de transporte a otro utilizando o adaptándose a su ciclo de vida.
Biología de los vectores
Unas décadas atrás al hablar de un vector biológico lo primero en que se podía pensar era en las especies que sirven de reservorio intermediario en el ciclo de vida de los parásitos y patógenos. Hoy cuando buscamos la definición esta nos lleva a un abanico de posibilidades donde debemos establecer que se trata de un agente habitualmente orgánico que se utiliza como medio de transmisión de un organismo a otro.
En la actualidad los vectores biológicos se estudian por ser causas de enfermedades, pero también como mediadores de posibles curas. En estos términos hallamos una serie de conceptos que de forma genérica quedan englobados dentro de esta definición, como son los vectores genéticos en los cuales que son aquellos capaces de llevar información genética de un organismo a otro, como es el caso de los plásmidos (Solar Dongil 1991, Wang et al. 2009). Dentro de estos debemos considerar los llamados vectores virales, la conjugación bacteriana, la transfección y la transducción (Schleif 1993).
Por estas razones cuando se habla de los organismos que sirven como mecanismos de dispersión de otros organismos, estamos haciendo referencia a un nuevo concepto que es el de vector epidemiológico, donde se acerca la perspectiva de un organismo biológico que presenta características que facilitan el ciclo de vida y transmisión de patógenos a otros organismos, o tan solo facilitan la transmisión (Vargas Herrera 2003), los aspectos epidemiológicos de estos organismos facilitadores los convierte en lo que se ha denominado vectores epidemiológicos donde se toman en cuenta factores de la biología de las especies vectores que pueden influir en la transmisión y en consecuencia en la epidemiología de los patógenos transmitidos (Martin et al. 2008).
De esta forma, el concepto de vector epidemiológico es cualquier agente (animal incluido el ser humano, vegetal, hongo o microrganismo) que puede llevar y transmitir un patógeno infeccioso hacia otro organismo vivo (Roberts et al. 2008).Esta definición es muy laxa ya que cualquier transporte de un patógeno lo convierte en un vector epidemiológico.
No obstante, es más frecuente aceptar esta definición cuando se considera que hay una asociación que compromete reacciones metabólicas y fisiológicas de la especie hospedera y la especie del organismo patógeno.
Por ejemplo, en el caso de la fiebre amarilla es necesario que el virus sea transmitido por mosquitos de los géneros Aedes y Haemagogus(Abarca et al. 2001).
Cuando se habla de estos tipos de transmisión se establece habitualmente dos categorizaciones de los vectores epidemiológicos, el vector en que la transmisión es mecánica y por lo tanto la transmisión no requiere multiplicación o desarrollo del microorganismo dentro del artrópodo como en el caso de la fiebre tifoidea/mosca doméstica. La otra categoría es la que se ha llamado vector de transmisión biológica o fisiológica en la que se requiere multiplicación (dengue/mosquitos Aedes) o desarrollo cíclico antes de que el artrópodo sea capaz de transmitir la infección (paludismo/mosquitos Anopheles). En estos casos es necesario un periodo de incubación extrínseco en el artrópodo vector.
Descubrir los patrones y modos de transmisión de los diferentes patógenos ha resultado en un camino largo y complicado. Como sucedió con el ciclo de vida y transmisión de Yersinia pestis, el agente etiológico de la peste, de esta infección se tiene noticia desde el siglo sexto, no obstante no es hasta 1894 que Alexandre Yersin logra aislar e identificar al agente etiológico de la enfermedad, y establece que esta bacteria también se encuentra en las ratas (Fresquet Febrer 2003). Estos hallazgos abren las puertas para poder hacer estudios de transmisión, que llevarían a determinar el ciclo de vida y las especies vectores de este patógeno.
La historia de las asociaciones biológicas que comprometen la salud ha sido largas y de muchas horas de trabajo. El caso del virus del Nilo Occidental es uno más de los ciclos complejos que utilizan más de una especie de vector, lo que dificulta su estudio. Por otra parte los ciclos de vida complejos de los mosquitos hacen aún más compleja la determinación de las especies involucradas en la transmisión donde incluso los sistemas de hibridación entre especies con potencial vectorial cambian la efectividad de la misma, además de la distribución de las mismas que define donde se puede hallar el problema de salud pública.
Vectores epidemiológicos biológicos del virus del nilo
Desde el momento en que se descubre por primera vez el Virus del Nilo Occidental en New York en 1999, se ha empezado una serie de estudios para determinar sus vectores reales y potenciales de este patógeno del que no hay tratamiento ni vacunas según la página oficial del CDC (CDC http://www.cdc.gov/westnile/). La necesidad de establecer medidas de control ha conducido a tener que determinar cuáles especies de mosquitos tienen potencia para la transmisión de este virus, muchos de estos ensayos se han llevado a cabo en condiciones de laboratorio (Turell et al. 2005).
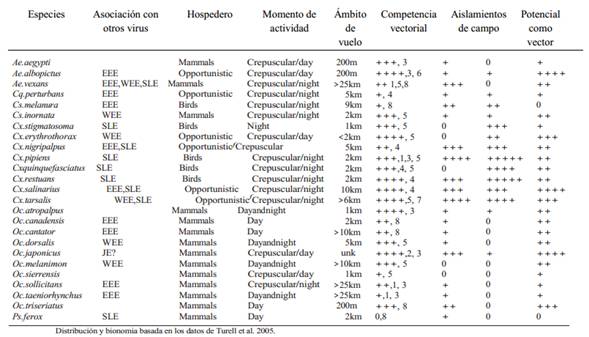
Turell y colaboradores (2005) hacen una revisión en la que no se incluyen ni Aedes albopictus ni Culex pipiens y Culex quinquefasciatus debido a que son especies comprobadas como vectores, pero en pruebas de laboratorio y estudios de competencia vectorial logran determinar la vectorialidad de una serie de especies y la probabilidad de que muchas otras tengan el potencia del ser vectores de este virus (Cuadro 1).
Cuadro1. Potencial de especies seleccionadas de mosquitos de América del Norte que pueden transmitir el WNV según los datos de la bionomía, competencia vectorial, aislamiento viral e interacción con otros arbovirus (Tomado de Turell et al. 2005).
a
Asociaciones con otros virus con un ciclo de transmisión similar. EEE, Vir us de la Encefalitis Equina del Este; JE;V i r u s d e l a E n c e f a l i t i s J a p o n e s a ;SLE;Vir u s de la Ence f a lit is de St.Louis;WEE;V i r u s d e l a E n c e f a l i t i s E q u i n a d e l O e s t e .S e g ú n l o s d a t o s d e T u r e l l e t a l . 2 0 0 5 .
b
Eficiencia con la cual la especie es capaz de transmitir el WNV e n co nd ic io ne s d e la b o r ato r io .0,incompetente;+,ineficiente;++++,v e c t o r e x t r e m e d a m e n t e eficiente. Según datos de Turell et al. 2005.
c
Número relativo de WNV-positivosdetectados.0,ninguno; +,pocos;++++,muchos.
d
Potentialde la especiepar a actuar co mo un vecto r enzoóticooc o m o u n v e c t o r d e m a n t e n i m i e n t o b a s a d o e n a i s l a m i e n t o s d e v i r u s a p a r t i r d e r e c o l e c t a s d e c a m p o a c e r c a d e l a c o m p e t e n c i a v e c t o r i a l , c o m p o r t a m i e n t o d e a l i m e n t a c i ó n ,y otras variables0, poco o no riesgoso; +++++, especie que puede jugar un rol mayor en la transmisión.
e
Potencial de la especie para actuar como un vector epizoótico o como un Puente vectorial a partir de datos de aislamientos de virus tomados de muestras de campo, competencia vectorial y comportamiento alimentario y otros. 0, poco o sin riesgo; +++++, especie que puede jugar un mayor rol en la transmisión.
f
Se alimenta primariamente en hospederos aves en la primavera y al principio del verano en zonas templadas y facultativamente en aves y mamíferos en el verano tardío y el otoño en zonas templadas.
Estas especies pertenecen a diferentes grupos dentro de la filogenia de los Culicidae, con lo que se puede asumir que la vectorialidad con respecto a estos virus ha evolucionado en esta familia más de una vez, con lo que se puede concluir que se trata de un carácter con valor neutro o positivo para las especies de mosquitos y evidentemente hay una selección positiva para el virus con mayor capacidad de dispersión a través de sus vectores. Esto indica también que se trata de un carácter convergente lo que le da un alto valor adaptativo, mientras que no es un carácter derivado de un ancestro y en consecuencia no es un carácter de valor filogenético (Méndez Iglesias 1999).
En este caso, como en muchos otros la filogenia es de utilidad para poder determinar que se trata de características de importancia en la ecología evolutiva del grupo pero no tanto en la determinación de grupos naturales dentro de los Culicidae que son definidos gracias a los estudios de filogenia (Harbach & Kitching 1998, Harbach et al. 2009). La filogenia de los Flavivirus muestra que la asociación de los diferentes grupos de artrópodos vectores presentan cierta relación con la evolución de los grupos de virus dentro de la filogenia, pero la misma no es totalmente clara debido a que diferentes evidencias indican diferentes topologías de los grupos de Flavivirus de esta forma la filogenia obtenida con las secuencias del gen NS5 muestra al grupo de especies de virus que no tienen vector conocido como el grupo más basal y las especies de virus asociadas a vectores garrapatas se muestran en una posición secuencial con respecto a los primeros en la filogenia general de los Flavivirus lo que es coincidente con la posición de este grupo de artrópodos en la filogenia de los artrópodos con respecto a los demás grupos de artrópodos vectores de los Flavivirus. Otro grupo de especies de virus que no utilizan vectores porque se han perdido en forma secundaria se halla como grupo hermano de uno de los grupos de especies asociados a vectores mosquitos (Cook & Holmes 2006).
Por otra parte, los resultados de la filogenia de los Flavivirus utilizando las secuencias del gen NS3 muestran un resultado que si bien es concordante con los parentescos establecidos dentro de los grupos de especies de Flavivirus como el grupo que no presenta vectores en forma primaria se halla como grupo hermano del grupo de especies dentro de Flavivirus que presentan asociación con vectores garrapatas, pero la posición de este grupo es terminal y no basal como se obtuvo con el NS5, lo que cambia radicalmente la interpretación evolutiva, ya que el grupo basal es el grupo de especies de Flavivirus que no presentan vectores por haberlos perdido de forma secundaria (Cook & Holmes 2006). Una filogenia con el genoma completo de los Flavivirusindica que de nuevo lo más probable es que el grupo de especies que utilizan garrapatas como vectores es el grupo más derivado (Cook & Holmes 2006, Vlachakis et al. 2013).
Otros factores biológicos que influyen en la vectorialidad
Como lo demuestran los amplios estudios de competencia vectorial efectuados en múltiples especies la capacidad de infección y de transmisión de las diferentes especies de mosquitos es variable (Cuadro 1), donde las especies del género Culexcomo C. quinquefasciatus y C. nigripalpus resultan especies moderadamente eficientes en la transmisión viral, mientras que especies como Coquillettidia perturbans son ineficientes en la transmisión en pruebas de laboratorio, pero al mismo tiempo se demuestra que numerosas especies son capaces de actuar como vectores de este virus (Sardelis et al. 2001).
Algunas especies de las que no se habla comúnmente como vectores, presentan capacidades de transmisión muy elevadas, como es el caso de Culex restuans que presenta un porcentaje de transmisión en laboratorio de un 100%, mientras que las especies que se consideran ineficientes como Coquillettidia perturbans presentan un 24% de transmisión. Por otra parte, especies que han sido claramente asociadas a estos procesos de transmisión como es C. quinquefasciatus presenta un porcentaje de transmisión de un 94%.
Otras especies como C. nigripalpuspresenta niveles de transmisión considerables en pruebas de laboratorio (87%) pero no se han hallado infecciones naturales en esta especie (Sardelis et al. 2001). Estos resultados indican que esta especie es un potencial buen vector, pero factores particulares de su biología, evitan que actúe como tal.
Otro factor biológico propio de cada especie que puede afectar la transmisión viral por parte de los vectores mosquitos es su capacidad de dispersión, lo que se asocia con su capacidad o ámbito de vuelo el cual cambia con las diferentes especies como los momentos de su pico de actividad (Cuadro 1). Esto se ve afectado también por las zonas en que habitan las especies de mosquitos. De esta forma una especie que es un buen vector de varios virus como es Aedes aegypti es de comportamiento diurno y crepuscular, lo que hace que esta especie esté activa en las horas de mayor actividad de la población humana, con lo que pone a su disposición una gran cantidad de recurso, además se halla adaptada a cumplir su ciclo de vida en zonas urbanas en sistemas de aguas variables y estancadas en recipientes de bajo contenido de volumen, lo que facilita que esta especie entre en contacto con los humanos. Sin embargo, su ámbito de vuelo es de tan solo 200m pero por la alta densidad de población que hay en donde se desarrollan sus poblaciones, este ámbito no afecta mucho su capacidad vectorial. Pero se evidencia que es una especie con fuerte capacidad enzoótica pero, pero un bajo potencial como vector puente o epizoótico o como potencial promotor de una epidemia generalizada.
En otros casos como la especie Aedes vexans muestra un ámbito de vuelo superior a los 25km pero su ritmo de actividad es crepuscular y nocturno, lo que baja la disponibilidad de población humana que puede ser infectada, por otra parte es una especie de aguas encharcadas, pero no hay una disponibilidad alta de este hábitat cerca de las zonas domiciliares, por lo que esto baja la disponibilidad de población que puede ser afectada por la transmisión viral. Por otra parte, esta especie si presenta un mayor potencial epizoótico, con respecto a la anterior (Cuadro 1).
Otras especies como Aedes albopictuspresenta características biológicas muy similares a las de A. aegypti pero su capacidad de epizoótica es mucho mayor que cualquiera de las especies tratadas antes. Una de las diferencias importantes es que tanto A. aegypti como A. vexans mantienen como hospederos solo a mamíferos, mientras que A. albopictus es un oportunista con lo que aumenta la posibilidad de transmisión en diferentes grupos de hospederos, lo que explica su mayor potencial epizoótico.
Además de estos factores, otro que afecta la transmisibilidad es la hibridación entre especies, lo que altera el potencial de transmisión de estas. Recientemente se ha evaluado el potencial de transmisión de los híbridos de obtenidos entre varias
especies de mosquitos con comprobada acción vectorial. Ciota y colaboradores (2013) han estudiado al complejo de mosquitos Culex pipiens L. que presentan una distribución mundial y son los vectores principales de agentes patógenos de importancia para la salud pública. En los EE.UU., Cx. pipiensbioformes, Cx. pipiensf.pipiens y Cx. pipiensf.molestus constituyen junto con Cx. quinquefasciatus, el principal grupo de especies vectores del Virus del Nilo Occidental (WNV).Estas especies de mosquitos viven en nichos ecológicos diferentes, pero que muestran traslape y se hibridan con facilidad en las zonas donde coexisten. Aunque las especies y las diferencias específicas de la población en la competencia vectorial de mosquitos Culex para la transmisión del WNV han sido identificadas, el grado en que la hibridación dentro de este complejo altera el potencial de transmisión del WNV no ha sido bien caracterizado. La competencia vectorial para las transmisión del WNV en colonias de laboratorio de Cx. p. f. pipiens, Cx. p. f. molestus, y Cx. quinquefasciatus fueron evaluadas y se comparó con las poblaciones híbridas creadas a partir de apareamiento recíproco de estas líneas. Los resultados obtenidos por este equipo de investigadores demuestran que la hibridación tiene un efecto significativo sobre la infección por WNV, la difusión, y, en particular, la transmisión de los mosquitos del complejo Culex pipiensL. Específicamente, se midió una mayor transmisión de WNV en todas las poblaciones híbridas relativas a una o ambas de las sepas de los padres (Fig. 1). Estos hallazgos demuestran que los cambios ambientales o antropogénicos que resultan en fluctuaciones en la distribución y extensión de las poblaciones híbridas de mosquitos Culex podrían tener un impacto significativo en los patrones de transmisión del WNV en la naturaleza (Ciota et al. 2013)
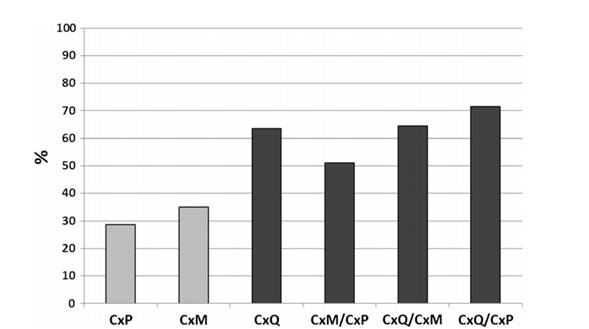
Figura 1. Porcentaje de mosquitos del género Culex expuestos al WNV que son transmisores en el día 13/14 de post alimentación. Cx.p f pipiens (CxP), Cx.p f molestus (CxM), Cx. quinquefasciatus (CxQ), las líneas hibridas de la progenie fueron probadas. El sombreado diferente indica que se registran diferencias estadísticamente significativas (χ2-cuadrado p<0,05)(tomado de Ciota et al. 2013).
El que estos híbridos tengan la capacidad de aumentar la transmisión los hace de importancia en salud pública por lo que su localización en sistemas abiertos es de importancia radical. De esta manera el híbrido de Culex pipiens/quinquefasciatus ha sido informado en la región Oeste de Texas (Silberbush et al. 2014). Las investigaciones en ecología molecular llevan a la necesidad de vincular las observaciones de campo con los datos moleculares para poder establecer si están presentes estos híbridos. En este sentido se han desarrollado estudios básicos de la ecología de estas especies que son de utilidad en la caracterización ecológica de las especies, lo que ayuda a encontrar los caracteres de los híbridos. Los estudios dirigidos a encontrar caracterizaciones ecológicas del nicho de las especies son de utilidad en la determinación de la ecología de las especies y sus híbridos (Calderón Arguedas & Troyo 2007).
Distribución vectorial.
La actual disponibilidad de herramientas moleculares facilita el avance del conocimiento de la genética de las especies vectores de importancia médica, en especial las del grupo de los Nematocera(mosquitos), así como sus hábitos de alimentación, y la prevalencia de la infección.
La distribución de las especies y la densidad de población sugieren que Culex pipiens L. y Culex restuans Theobald pueden ser responsables de hasta el 80% de las infecciones por virus del Nilo Occidental en humanos en el noreste de EE.UU (Kilpatrick et al. 2005). Las poblaciones de Cx restuans alcanzan un pico en la primavera y principios del verano (Geery & Holub 1989, Ebel et al. 2005, Savage et al. 2007), a diferencia de las poblaciones de Cx. pipiens que muestran un incremento más tarde, por lo que la primera especie puede ser el vector fundamental de virus del Nilo Occidental a principios de la temporada de transmisión (Andreadis et al. 2001). Cx. restuans ocurre desde California a Carolina del Norte, desde el sur de Canadá a Honduras; poblaciones adaptadas localmente pueden ser diferentes en rasgos epidemiológicamente significativas (Fonseca et al. 2009).
El complejo Cx. pipiens incluye a las especies Cx. pipiens, Cx. quinquefasciatus Say, Cx. Australicus Dobrotworsky y Drummond, y Cx.globocoxitus Dobrotworsky. Estas especies de mosquitos presentan una distribución mundial (Fig. 2), y se hallan estrechamente relacionadas evolutivamente, y además son de difícil separación morfológica (Collins& Paskewitz 1996). Se reconocen dos subespecies de Cx pipiens, Cx pipiens pipiens y Cx pipiens pallens. La primera se distribuye en el Viejo Mundo desde el Norte de Europa hasta las tierras altas de África del Sur (Harbach et al. 1985), y Cx. p. pallens que se extiende desde los Urales a través de la región templada de Asia (Fonseca et al. 2009). Por otra parte, Cx. pipienspresenta dos bioformas: molestus y pipiens, las cuales difieren en varias características biológicas como la autogenia, estenogamia, capacidad de diapausa, y la preferencia alimentaria (Fonseca et al 2004, Farajollahi, et al. 2011).
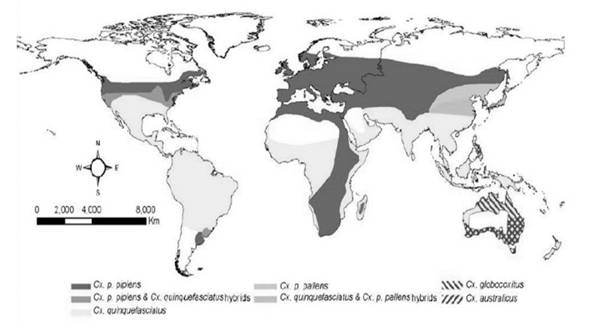
Figura 2. Distribución global del complejo de especies Cx. pipiens. Rango geográfico de distribución de Cx. p. pipiens inlcuyendo las formas pipiens y molestus. Cx australicus y Cx. globocoxitus se hallan restringidos a Australia (tomada de Coita & Kramer 2013)
La especie críptica de Culex pipiens, Cx quinquefasciatus difiere de Cx. pipiens en que se distribuye en las regiones tropicales y subtropicales en latitudes al sur de los 36 ° de latitud (Kramer et al. 2007, Andreadis 2012), pero, al igual que Cx. pipiens, es predominantemente ornitófíla, prefiriendo alimentarse de aves, aunque ambos también se alimentan de seres humanos (Ciota & Kramer 2013).Los híbridos de Cx. pipiens y Cx. quinquefasciatus se encuentran en una zona donde los dos se superponen se extiende desde aproximadamente 30 ° N y 40 ° N de latitud norte en Norte América (Sanogo et al. 2008, Kothera et al. 2009, Huang et al. 2011).Los estudios poblacionales de las formas híbridas del complejo de mosquitos Cx. pipiens, donde se incluyen a Cx. pipiens f. pipiens, Cx. pipiens f. molestus, y Cx. quinquefasciatusmuestran que la hibridación tiene un efecto significativo sobre la infección, difusión y sobre todo en la transmisión del Virus del Nilo Occidental (Ciota & Kramer 2013).
Los datos muestran que la presencia de Cx. quinquefasciatus incrementa en los mosquitos híbridos la susceptibilidad a la infección; y el porcentaje de poblaciones híbridas infectadas transmiten en los días 13/14 incrementan significativamente la tasa de transmisión más que en otras poblaciones parentales (Ciota et al. 2013). En consecuencia, factores extrínsecos tales como el uso del suelo y las actividades de urbanización, particularmente, es probable que incrementen el potencial de hibridación entre distintas bioformas (Kent et al. 2007, Brown et al. 2008, Kilpatrick 2011), lo que puede tener un impacto en la actividad del WNV.
Se puede hallar una amplia discusión acerca del complejo de especies Culex pipiens en los trabajos de Farajollahi y colaboradores (2011) y en Harbach (2012).
Por otra parte, en EEUU el principal vector es Culex tarsalis Coquillet (Ciota & Kramer 2013). Cx. tarsalisse adapta mejor a los escenarios agrícolas (Reisen & Reeves 1990) y es responsable de la expansión occidental de VNO (Golberg et al. 2010), en donde la actividad humana estaba altamente relacionada con la actividad de Cx. tarsalis en las regiones rurales que la separan los paisajes urbanos (Bolling et al. 2009, Bowden et al. 2011).
En la especie Cx. tarsalis no se conoce hibridación, pero se han determinado agrupamientos genéticos espaciales o regionales (Venkatesan et al. 2007, Venkatesan & Rasgon 2010), lo que probablemente contribuye a la variabilidad en la capacidad vectorial de las poblaciones de esta especie.En Costa Rica los principales vectores de este virus son Aedes albopictus y Culex quinquefasciatus. Como puede verse en el cuadro 1 esta especie no es específica de un grupo particular de hospederos, sino que es un oportunista que presenta condiciones particulares para hacer un puente entre especímenes de diferentes especies de vertebrados por lo que su potencial epizoótico es mucho mayor que el de Cx quinquefasciatus. De las especies enlistadas en el cuadro 1, los datos oficiales indican que casi ninguna especie con potencial de vector para el WNO se localiza en Costa Rica, pero las dos que hay presentan un enorme potencial vectorial demostrado.
Latitud, clima y la presencia de vectores de wnv.
La riqueza de especies es una de los aspectos de más importancia en el estudio de la biodiversidad. En este sentido la riqueza de especies de patógenos del ser humano y laprevalencia varían ampliamente a lo largo y ancho del mundo. Sin embargo, es escaso el conocimiento acerca de si los patrones globales que se observan en otros taxa también predicen la diversidad de este heterogéneo grupo de organismos (McNeill 1976, Crosby 1986).
Un estudio reciente evalúa (a) la importancia relativa de la temperatura, la precipitación, la diversidad de hábitats, y la densidad de población en las distribuciones globales de los patógenos humanos y (b) las predicciones en base a la hipótesis de especies-área utilizadas en la biogeografía de islas para las distribuciones de las especies de patógenos humanos (Cashdan 2014).
La metodología seguida es fue bastante simple pero requiere de grandes de bases de datos y programas informáticos robustos para el análisis de los datos, en forma resumida la autora hizo lo siguiente: 1) los datos históricos fueron utilizados para minimizar la influencia de las diferencias en el acceso a la atención sanitaria moderna sobre la prevalencia de los patógenos, b) la base de datos incluyó datos codificados sobre los patógenos, variables ambientales y culturales, para una muestra de 186 culturas no industriales en todo el mundo, dentro de las que se incluyeron 37 en islas, 3) se combinaron los niveles de prevalencia de 10 agentes patógenos en un índice de prevalencia de patógenos, y se aplicó una regresión de mínimos cuadrados ordinarios (MCO), la cual se utilizó para para modelar los determinantes ambientales del índice de prevalencia y el número de agentes patógenos (Cashdan 2014).
Cashdan (2014) obtiene resultados muy interesantes. Los patógenos medidos a través de su número e índice de prevalencia mostraron el gradiente latitudinal esperado, pero estos predictores variaron con la latitud. Los agentes patógenos se incrementaron con la temperatura en las zonas ubicadas en latitudes altas (zonas templadas), mientras que la precipitación media anual fue un predictor más importante en las zonas ubicadas en latitudes bajas (regiones tropicales). Otros factores ambientales asociados con mayor presencia de patógenos incluyen los extremos estacionales, ya sean secos, climas sin heladas, y la densidad de población humana fuera de los trópicos. En las islas se comprobó que se cumplen los modelos predictivos de la relación especie-área para todos los casos, pero en especial en las islas más pequeñas, además la relación no estaba mediada por la diversidad de hábitats. A pesar de que las distribuciones geográficas de los grupos de vida libre y los grupos parásitos presentan típicamente diferentes determinantes ecológicos, los datos muestran que las variables que influyen en la distribución de los organismos de vida libre también influyen en los patrones de distribución global de los patógenos humanos.
La comprensión de la causa de estas distribuciones es importante, ya que la variación geográfica en los patógenos humanos tiene una influencia importante en las disparidades globales en el bienestar humano.
Lo más importante de los resultados del estudio de Cashdan (2014) para efectos de este trabajo es la determinación de variables que incrementan los riesgos de vectorialidad de virus como el dengue en las zonas tropicales. Las razones son simples, muchos de los predictores para las condiciones de las formas de vida libre actúan de igual forma para los parásitos. La temperatura juega un papel importante en la dinámica de las poblaciones de patógenos pero solo en las regiones externas a los trópicos.
En las regiones tropicales la precipitación es un factor determinante de las poblaciones de patógenos y se asocia con los patógenos que utilizan vectores, en especial mosquitos, lo que indica que este es un factor que debe tomarse en cuenta en los estudios de prevalencia del Dengue, el Chikungunya y el WNV. Otras condiciones como sequedad extrema se asocian a otro tipo de enfermedades como la leishmaniasis. Además, los patógenos tuvieron mayor prevalencia en zonas con alta densidad de población. Por otra parte, son más abundantes en las tierras continentales que en las islas y en mayor proporción en las islas grandes que en las pequeñas.
Existe un gradiente latitudinal en la riqueza de especies que se puede observar en un amplio ámbito de taxa de vida libre, las causas de estos patrones siguen sin ser totalmente claras y se mantiene entre los temas de debate ecológico (Rosenzweig 1995, Williget al. 2003) y su relevancia para los taxones parasitaria sigue siendo poco clara. Algunos de estos factores se han discutido en la literatura y Cashdan (2014) analiza entre los principales a la temperatura la cual a menudo es utilizado como un indicador de la disponibilidad de energética, las heladas, y la precipitación.
Cashdan (2014) encuentra que los niveles de prevalencia de algunos patógenos se incrementaron con la temperatura en 7 de los 10 grupos de patógenos analizados, incluyendo los patógenos transmitidos por mosquitos, los cuales son muy sensibles a la temperatura (Patz et al. 1996). Sin embargo, a pesar de esto se sabe que en condiciones de altas temperaturas hay un decline de las especies de vectores (Mordecai et al. 2013). No obstante, hubo registros de una mayor diversidad de patógenos cuando la temperatura se incrementó.
Por otra parte, los sitios con un clima libre de heladas durante todo el año presentan una mayor abundancia de patógenos debido a la media anual de temperatura, esto favorece que los patógenos pasen las estaciones más frías (Cashdan 2014).
La precipitación es una variable más compleja con respecto al índice de prevalencia de patógenos, debido a que la precipitación anual media y el grado de sequedad del medio en condiciones extremas de estacionalidad presentan efectos diferentes sobre los patógenos. La media de precipitación anual tuvo una relación curvilínea tanto con el índice de prevalencia como con el número de patógenos analizados, alcanzando sus valores máximos en el ámbito de los valores intermedios y un marcado decremento en las zonas de alta precipitación. La asociación entre los agentes patógenos y la precipitación anual media fue especialmente fuerte en los trópicos, afectando sobre todo a los patógenos transmitidos por mosquitos. Es posible que el declive en las zonas húmedas se deba a que las lluvias fuertes lavan las poblaciones de larvas e inundan los sitios de reproducción (Cashdan 2014). No obstante, debe considerarse el efecto de este factor sobre las poblaciones de adultos ya que las lluvias fuertes afectan el desempeño del vuelo, lo que puede impedir alcanzar los sitios mejores de oviposición, lo que produciría una fragmentación de las oviposiciones. Por otra parte, en las zonas tropicales el incremento de la humedad y las temperaturas habituales de estas regiones, favorecen la proliferación de hongos, entre los cuales puede haber algunos que ataquen las poblaciones de mosquitos en diferentes estadios de desarrollo.
Por otra parte, las áreas con escasa o ninguna precipitación durante la estación seca medida con la precipitación más baja en el mes más seco, también muestra incrementos en las poblaciones de los patógenos. La condición de alta sequedad estacional afecta a un grupo diferente de agentes patógenos al que fue afectado por la temperatura y la precipitación. El mayor efecto lo tuvo el tifus, que es transmitido por pulgas y piojos y se agrava entre mayor sea el hacinamiento y un saneamiento deficiente, por la escases de agua, la cual también propicia que los roedores se acerquen a los asentamientos humanos en busca de agua (Cashdan 2014).Un análisis de los anillos de los árboles en México
centro en el periodo preindustrial demostró que una sequía importante se produjo durante el primer año de los 22 grandes brotes de tifus (Acuna Soto et al. 2007) que se estudiaron en el trabajo de Cashdan (2014). Un patrón similar se halló en Brasil con respecto a la agregación de la población humana y la presencia de los Psychodidae, Phlebotominaeresponsables de la transmisión de Leshmania y se asocia con cambios temporales en la leshmaniasis en estas regiones de Brasil (Thompson et al. 2002).
Guernier y colaboradores (2004) hallaron que el ámbito de precipitación es el mejor predictor de la riqueza de especies en el análisis de seis categorías de los patógenos asociados a los humanos. Por su parte Cashdan (2014) encuentra la misma relación al medir el ámbito de precipitación, que se determina mediante el cálculo de la diferencia entre la mayor precipitación en el mes más húmedo, menos la mínima precipitación del mes más seco.
Cashdan (2014) encuentra que existe una relación que asocia un número significativamente mayor de especies de patógenos y se asocia también a los valores del índice de prevalencia. Sin embargo, el ámbito no funciona como un predictor significativo cuando se incluyen otras variables climáticas en el modelo, mientras que la resequedad de temporada, que es uno de los tantos componentes considerados en el modelo siguió siendo significativa. En estos datos, el aspecto más influyente del ámbito de precipitación sobre las distribuciones de patógenos parece ser la resequedad estacional (Cashdan 2014).
La importancia relativa de la temperatura y la disponibilidad de agua como predictores de la riqueza de especies varían con la latitud. La temperatura es más importante en las latitudes en las que se ubican las zonas templadas y frías del planeta(latitudes altas) y la disponibilidad de agua es más importante en las latitudes donde se ubican los trópicos (latitudes bajas), donde la energía es abundante (Hawkins et al. 2003, Whittaker et al. 2007).
Los patrones hallados también se encontraron en los datos de los patógenos. En zonas de latitudes altas, la temperatura media anual resulta ser el predictor más fuerte de clima número de patógenos y el índice de prevalencia, mientras que en las zonas tropicales la precipitación media anual es la variable climática clave.
La densidad de población también fue un predictor mucho más fuerte en las zonas de alta latitud; una razón plausible para este hallazgo es que hay más animales hospederos alternativos en las zonas tropicales, por lo que los agentes patógenos zoonóticos pueden permanecer endémicos, incluso cuando las poblaciones humanas tengan bajas densidades (Cashdan 2014).
Por otra parte algunos factores ambientales son dependientes del clima, en este sentido las variables como la precipitación y la temperatura se ven influidos por fenómenos como
El Niño o La Niña, lo que puede hacer que haya momentos de mayor incidencia que otros. Se ha demostrado que con el cambio climático la fauna de las regiones tropicales será de la más afectada (Deutsch et al. 2008) ya que al haber calentamiento se facilita la colonización de especies foráneas y la competencia y el nuevo clima desfavorecen las capacidades de subsistencia de las especies nativas.
Estos cambios afectan los sistemas agroalimentarios, comprometiendo la seguridad alimentaria, pero también afectan los sistemas de salud pública con lo que los patógenos que utilizan artrópodos como vectores pueden verse afectados.
Taxonomía de los vectores de wnv
Los vectores artrópodos de este virus son muchos (Cuadro 2) y varían las especies según la región del mundo donde se estudie la epidemiología del problema. De esta forma para
América del Norte Turell y colaboradores (2005) enlistan cerca de 25 especies de mosquitos repartidas en seis géneros, siendo el género Culex el que presenta mayor número de especies vectoras con un 32% de las especies. Mientras que para Europa Hubálek y Halouzka (1999) enlistan 45 especies de mosquitos y ocho de garrapatas para una revisión general. De esta forma Hubálek y Halouzka (1999) informan de siete géneros de mosquitos, pero pocos compartidos con los enlistados por Turell y colaboradores (2005) (Cuadro 1)
Cuadro 2. Aislamientos del WNV a partir de mosquitos (tomado de Hubalek & Halouzka 1999)
| Especies de mosquitos | Números | Localidad |
| Cullexantenatus | 6 | Egipto |
| descens | 8 | Madagascar |
| ethiopicus | 1 | Etiopía |
| guirti | 1 | Costa de Marfil |
| modestus | 3 | Francia, Rusia |
| neavei | 4 | Senegal, Sudáfrica |
| nigripes | 1 | República Centroafricana |
| perexiguus | 1 | Israel |
| perfuscus | 3 | República Centroafricana, Senegal |
| pipiens (a) | 7 | Sudáfrica, Egipto, Israel, Rumania, República Checa, Bulgaria (b) |
| poicilipes | 29 | Senegal |
| pruina | 1 | República Centroafricana |
| quinquefasciatus (a) | 7 | India, Pakistán, Madagascar |
| scottii | 1 | Madagascar |
| theileri (a) | 4 | Sudáfrica |
| tritaeniorhynchus (a) | 3 | Pakistán, India, Madagascar |
| univittatus (a) | 51 | Egipto, Israel, Sudáfrica, Madagascar |
| vishnui (a) | 6 | India, Pakistán |
| weschei | 1 | República Centroafricana |
| sp. | 3 | Egipto, Algeria, Repùblica Centroafricana |
| Coquillettidia metallica | 1 | Uganda |
| microannulata | 1 | Sudáfrica |
| richiardii | 5 | Sur de Rusia, Bulgaria (b) |
| Mansonia uniformis | 1 | Etiopía |
| Aedes aegypti (a) | 1 | Madagascar |
| africanus | 1 | República Centroafricana |
| albocephalus | 35 | Madagascar |
| albothorax | 1 | Kenia |
| cantans | 7 | Eslovaquia, Ucrania, Bulgaria (b) |
| caspius (a) | 1 | Ucrania |
| circumluteolus | 2 | Sudáfrica, Madagascar |
| excrucians | 1 | Ucrania |
| juppi+caballus | 1 | Sudáfrica |
| madagascarensis | 1 | Madagascar |
| vexans | 3 | Senegal, Rusia |
| Anopheles brunnipes | 1 | Madagascar |
| coustani | 1 | Israel |
| maculipalpis | 1 | Madagascar |
| maculipennis | 3 | Portugal, Ucrania |
| subpictus | 1 | India |
| sp. | 1 | Madagascar |
| Mymomia hispida | 8 | Senegal |
| lacustris | 4 | Senegal |
| splendens | 6 | Senegal |
| Sp. | 2 | Senegal |
| Aedeomyia africana | 1 | Senegal |
(a) Transmisión experimental del virus también demostrada
(b) Detectado en mosquitos a través de inmunofluorescencia
Los géneros hallado en América del Norte son Aedes, Coquillettidia, Culiseta, Culex, Ochlerotatus y Psorophora, mientras que en otras latitudes mayormente del Viejo Mundo se informan los géneros Aedes, Aedeomyia, Anopheles, Coquillettidia, Culex, Mansonia, y Mimomyia, se puede observar que hay solo tres géneros en común que son Aedes, Culex y Coquillettidia donde las especies ubicadas en los dos primeros son los principales vectores.
Es interesante que el género Anopheles cuenta con cinco especies que son vectores del WNV en el Viejo Mundo (Asia, África y Europa) incluyendo a A, maculipennis en Portugal y Ucrania.
Por otra parte la constante evolución de la clasificación de la familia Culicidae obliga a una constante revisión de material. Por ejemplo el género Ochlerotatus fue elevado a esta categoría, pero era un subgénero de Aedes (Chaverri 2004), situación que se repite con otros grupos de especies. Estos cambios en la clasificación son indispensables si se quiere la misma refleje la realidad evolutiva de los grupos y que se llegue a tener una clasificación filogenética (Retana-Salazar 2007), pero se convierte en una herramienta delicada e incómoda para aquellos que no son taxónomos del grupo.
En este apartado la atención se centra en la necesidad de conocer que hay en el área de América Central acerca de los mosquitos vectores del WNV, para analizar el potencial epidemiológico de la fauna de culícidos de la región.
Dentro de esto es importante analizar los géneros que hay en Costa Rica particularmente con potencial de transmisión de esta enfermedad.
Los géneros de mosquitos recolectados en América Central son bastantes (Cuadro 3) y muchos de ellos con especies que han sido demostradas como vectores en otras regiones del mundo.
Cuadro 3. Géneros de Culicidae hallados en la Región de América Central y Panamá. La vectorialidad se considera a la especies que se ha comprobado tienen capacidad de transmisión (Tomado de Chaverri 2004, modificado por el autor).
| Géneros presentes en Centroamérica y Panamá | |||
| Género | Vectorialidad | Género | Vectorialidad |
| Aedeomyia | + | Mansonia | + |
| Aedes | + | Ochlerotatus* | + |
| Anopheles | + | Onirion** | |
| Chagasia | Orthopodomyia | ||
| Coquillettidia | + | Psorophora | + |
| Culex | + | Runchomyia | |
| Culiseta | + | Sabethes | |
| Deinocerites | Shannoniana | ||
| Haemagogus | + | Toxorhynchites | + |
| Isostomyia | Trichoprosopon | ||
| Johnbelkinia | Uranotaenia | + | |
| Limatus | + | Wyeomyia | + |
| TOTAL | 8 | TOTAL | 6 |
*El género Ochlerotatus fue segregado de Aedes y solo es posible diferenciarlo de este último por las estructuras genitales de machos y hembras (Chaverri 2004).
Aunque este género si contiene especies con potencial vectorial no se incluye en la clave debido a que escapa a los intereses de este trabajo los estudios taxonómicos complejos. Estos temas se abordarán en otras publicaciones en el futuro.
**El género Onirion se halla en Costa Rica pero fue segregado de Wyeomyia y solo
es posible separarlos si se cuenta con machos, ya que las hembras son indiferenciables entre ambos géneros (Chaverri 2004), además no se ha informado de especies de este género con importancia vectorial por lo que no se incluye en este trabajo.
Los vectores reales del WNV en Costa Rica son solo Aedes albopictus, A. aegyptiy Culex quinquefasciatus, estas especies aparecen informadas por Turell y colaboradores (2005), aunque A. albopictusy A. aegyptino aparecen en el listado de Hubalek y Halouzka(1999), posiblemente debido a que estos autores se hallan más interesados en las especies problema en el Viejo Mundo. La distribución natural de Cx. pipiens no abarca a Costa Rica (Fig. 2), especie considerada hermana y críptica de Cx. quinquefasciatus, pero que hoy se hallan totalmente aceptadas como especies separadas por su biología. Un detalle que es de importancia es que en los estudios de Europa se incluyen una buena cantidad de especies del género Anopheles (Hubalek & Halouzka 1999) como posibles vectores del WNV pero en los estudios de América del Norte no hay especies de este género consideradas (Turell et al. 2005). Los estudios efectuados en Colombia acerca de los mosquitos asociados a la transmisión viral indica que los mismos géneros son de importancia en este país (ParraHenao & Suárez 2012).
Los estudios en mosquitos en Costa Rica no han contado con el interés necesario, ni con especialistas que se dediquen a su estudio sistemático, por lo que las colecciones de referencia se hallan ubicadas en departamentos de enseñanza y no en museos donde hay curación profesional que mantenga la clasificación actualizada. El INBio hizo un intento por sostener esta línea de investigación, pero hace unos años dejó de apoyar los estudios en mosquitos, posiblemente porque no son rentables. Esto produce largos periodos de estancamiento en el estudio de la fauna de culícidos del país, por esto muchos informes se hallan en publicaciones de extranjeros. Por ejemplo, Culex quinquefasciatus está informado para Costa Rica desde la década de los años 70 a partir de muestras recolectadas desde 1964, es decir 50 años atrás (Heinemann &Belkin 1977). Estos mismos autores indican la presencia de Cx. coronator, Cx. declaratory Cx. nigripalpusen Costa Rica, especies que se ha considerado de interés en salud en las investigaciones llevadas a cabo en Colombia (Parra-Henao & Suárez 2012). Algunas especies como Aedes aegypti, Culex quinquefasciatus, Culex interrogator, Culex nigripalpus, Culex corniger, Culex tarsalis, Limatus durhamii y Toxorhynchites theobaldi han sido halladas en regiones de alta incidencia de otros arbovirus como el Dengue (Calderón-Arguedas et al. 2009).
Estos autores señalan que en algunas regiones de Costa Rica donde solo se informa de la presencia de Ae. aegypti como vector del dengue, hay otras especies en la zona que no han sido consideradas como posibles vectoresa pesar de que se han informado en la literatura mundial (Calderón Arguedas et al. 2009). Esto es una muestra del panorama en salud pública de nuestro país en lo referente a los vectores de este tipo de enfermedades. Por lo que es necesario que se estimule en Costa Rica la investigación en estas áreas.
En vista de que de esta investigación se deduce que es necesario ordenar y actualizar las colecciones de mosquitos de Costa Rica, que es necesario empezar proyectos de investigación que nos pongan en el mapa de la investigación en salud en el área en temas de interés como son los Arbovirus. Como resultado de esta investigación se ha determinado que hay al menos 10 géneros en Costa Rica en los cuales algunas especies pueden ser vectores epidemiológicos del WNV. Por esta razón y como un aporte a la salud pública de presenta aquí una clave adaptada de las claves de Luis G. Chaverri para la identificación de los principales géneros de mosquitos del país. En este caso en la clave se incluyen solo aquellos géneros que han sido informados con especies vectoras del WNV.
Clave para los adultos de los géneros de mosquitos con importancia potencial en la transmisión del WNV (adaptada de las claves de Luis G. Chaverri)
1a) Palpos maxilares tan largos como la probóscide (Fig. 3, 4), escutelo redondeado con setas uniformemente distribuidas (Fig 4B); setas y escamas del pospronoto ausentes (Fig. 4C) ___________________________ Anopheles
1b) Palpos maxilares más cortos que la probóscide (Fig. 5) _________________ 2
2a) Probóscide fuertemente curvada ventralmente (Fig. 6) ____ Toxorhynchites
2b)Probóscide recta o ligeramente curvada dorsalmente (Fig. 5) ________________ 3
3a) Borde superior del merón en línea o ligeramente arriba del borde superior de la coxa de las patas traseras (Fig. 7A) ____ 4
3b) Borde superior del merón distintivamente arriba del borde superior de la coxa de las patas traseras (Fig.
7B)_________________________ 6
4a) Postpronoto sin un grupo central de setas (Fig. 8A) ___________Haemagogus
4b) Postpronoto con un grupo central de setas (Fig. 8B) ____________________ 5
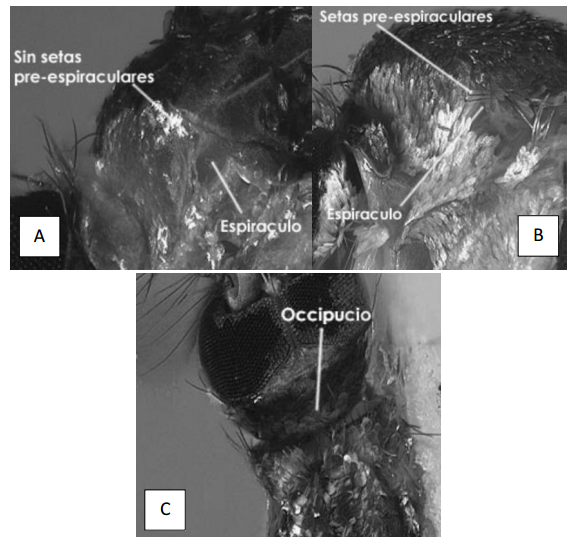
5a) Setas preespiraculares ausentes (Fig.8B, 9A); patas traseras con la uña tarsal simple, occipucio sin una línea de escamas negras erectas (Fig 9C) _ Limatus
5b) Setas preespiraculares presentes (Fig. 9B); patas traseras con la uña tarsal doble, seta prealar presente (Fig. 10); escudo sin escamas de color metálico____ Wyeomyia
6a) Celda R2 más corta o igual que la longitud de la vena R2+3 (Fig. 11A); vena A1 terminando antes de la unión de las venas CuA1 y CuA2 (Fig. 11A); tórax con líneas de escamas iridiscentes (Fig. 11B) _______________________ Uranotaenia
6b) Celda R2 más larga que la longitud de la vena R2+3 (Fig. 11C); vena A1 terminando después de la unión de las venas CuA1 y CuA2 (Fig. 11C); tórax sin líneas de escamas iridiscentes ________ 7
7a) Antenómeros cortos y ligeramente redondeados (Fig. 12A); fémures de las patas medias con un mechón de escamas en el ápice (Fig. 12B), tarsómero IV de las patas I-II más largo que ancho___________________ Aedeomyia
7b) Antenómeros largos (Fig. 13A); fémures de las patas II sin un mechón de escamas en el ápice (Fig. 13B) _______ 8
8a) Setas presentes en la base de la superficie ventral de la vena subcostal del ala I (Fig. 14A) ______________ Culiseta
8b) Setas ausentes en la base de la superficie ventral de la vena subcostal
del ala I (Fig. 14B) ____________________ 9
9a) Escamas anchas sobre las venas R2 y R3 (Fig. 15A) ____________________ 10
9b) Escamas largas y angostas sobre las venas R2 y R3 (Fig. 15B) ___________ 11
10a) Fémures con bandas pre-apicales de escamas blancas (Fig. 16A)
______________________ Coquillettidia
10b) Fémures con escamas negras y blancas mezcladas pero sin bandas pre-apicales de escamas blancas (Fig. 16B) _________________________ Mansonia
11a) Setas postespiraculares ausentes (Fig. 17A, B), tarsos III con ungus muy pequeños e inconspicuous, pulvilli presente _____________________ Culex
11b) Setas postespiraculares presentes (Fig. 17C) ______________________ 12
12a) Setas preespiraculares presentes (Fig. 18) ____________________ Psorophora
12b) Setas pre-espiraculares ausentes (Fig. 18) _________________________ Aedes
Factores psicológicos que afectan la epidemiología de la transmisión
Habitualmente cuando se habla de factores que afectan la transmisión de un agente etiológico patogénico, la atención se centra en los elementos físico del individuo que pueden favorecer o entorpecer la probabilidad de que un individuo se infecte con una determinada enfermedad., siendo habitual que la lista presente desde factores tecnológicos e industriales, hasta factores económicos (Suárez Larreinaga & Berdasquera Corcho 2000).
No obstante, una serie de factores socio-psicológicos pueden afectar la transmisión parasitaria, lo que ha generado toda una nueva área de estudio de la epidemiología, donde se analizan los factores de la personalidad que pueden afectar la transmisión de patógenos (Thornhill et al. 2010). Una consideración importante es que cuando la amenaza de la enfermedad es más relevante, las personas expresan actitudes más xenófobas e inclinaciones conductuales menos extravertidas (Thornhill et al. 2010).
Estos datos indican que es fundamental la actitud para que favorezca o no el contagio. En la actualidad se sabe que incluso el clima y la latitud cambian las tendencias emocionales de los individuos (Erren et al. 2011).Por otra parte, los factores psicosociales alteran las condiciones fisiológicas del organismo donde el estrés puede alterar dramáticamente las reacciones endocrinas y del sistema inmune (Gómez- Ortiz 2000, Solano & Velázquez 2012). En la actualidad hay evidencias claras de que problemas exógenos que causan estrés al individuo pueden alterar factores fisiológicos de la salud integral física y no solo mental (Sheldon et al. 2009). Estos factores orgánicos mediados por estrés psicológico hacen de estos individuos organismos con debilidades en salud que los hacen más susceptibles.
Sin embargo, es necesario estimar otros aspectos psicológicos de los individuos que pueden afectar los comportamientos habituales haciendo al individuo un hospedero de mayor susceptibilidad. Estos factores pueden ser endógenos o mediados por condiciones ambientales que se presentan desde su desarrollo.
En las últimas décadas del siglo XX se ha discutido ampliamente la interacción entre ambiente y cultura, desarrollándose desde las ciencias sociales, en especial la Antropología una serie de vertientes de estudio que con diferencias de matices han estudiado el efecto del medio sobre el desarrollo cultural de las sociedades, de esta forma mientras algunos han argumentado que la cultura es un producto de la adaptación al medio, lo cual es un enfoque muy Darwiniano, otros han concluido que esto no es una apreciación del todo real, al final se ha concluido que las barreras levantadas entre la Antropología y la Biología carecen de sentido, al cambiar la percepción del objeto de estudio hacia la percepción e interpretación del individuo de su entorno, entonces la distinción entre relaciones ecológicas y sociales se ha convertido en innecesaria (Milton 1997).
En este caso los diferentes comportamientos grupales e individuales de los individuos en una sociedad pueden estar en gran mediad influidos por el ambiente en que se ha desarrollado un grupo social y esto debe tener una repercusión directa en los sistemas de salud de esa sociedad.
En la actualidad en los grupos de primates no humanos se estudia el desarrollo del comportamiento de manutención de la salud, de manera que hay ingesta de algunas plantas que no tienen buen sabor, ni tampoco contienen altos niveles energéticos, pero si presentan compuestos activos útiles en el control de infecciones parasitarias y de otros microorganismos (Huffman 2003).
No obstante, los comportamientos, como el uso de plantas por parte de los primates no humanos con fines de consumo alimentario o médico cambia según la región en que habite el grupo de animales (Kamilar &Marshack 2012).
De esta forma, se ha demostrado que la taxonomía es una característica de cada sociedad, donde los pueblos crean cada uno su forma de clasificación, lo cual se ha evidenciado desde las primeras décadas del siglo XX y lo informa incluso Mayr (1969) en su libro Systematic Zoology y Diamond (1997), luego de esto hay una serie de trabajos particulares sobre la taxonomía de diferentes etnias en lo que se ha dado en llamar en los últimos tiempos folktaxonomy.
Incluso se estudia desde un punto de vista antropológico y psicológico el incremento del uso de nombres de diferentes animales con la edad en niños, determinando cuales grupos de animales son más importantes en cada grupo étnico analizado (Pizarro 2011).
Es evidente que hay numerosas pruebas de que hay una interacción constante entre los factores ambientales y el desarrollo de la cultura, así en la creación de la taxonomía se registran primero las especies más abundantes y comunes, como las de mayor utilidad, para continuar luego con la diferenciación de las especies raras y las de menor uso, tal como sucedió con las especies de Europa inicialmente, es la razón por la que Linneo describe las especies de plantas que más se utilizaban en la cocina y medicina de la época. Los europeos nunca inventarían una palabra para describir la danta (Tapirusbairdii) porque no existe en su medio, mientras que las etnias americanas nunca inventarían una palabra para describir al Alce (Alces alces, la especie europea). En otras palabras estamos condicionados por el medio para observar los caracteres que nos son útiles en ese entorno y que son de interés para nuestra cultura, y por eso le damos nombre a todo lo que encontramos.
El aprendizaje por descubrimiento es una de las estrategias educativas que se promocionan hoy (Jiménez Pierre et al. 2007) y es el método que se utiliza cuando aprendemos desde la observación directa en la naturaleza desde esto se ha desarrollado entre otras la técnica del ABP (Aprendizaje Basado en Problemas) donde se utiliza como medio de enseñanza en algunas universidades (Servicio de Innovación Educativa 2008). En este sentido la percepción del medio y lo que enseñamos desde las campañas son una forma de llevar información a la gente, pero al mismo tiempo funcionan como medio de alienación y al mismo tiempo de sensibilización y desensibilización acerca del problema.
La desensibilización es un mecanismo para solucionar las fobias irracionales ampliamente utilizado por los psicólogos. No obstante, es un proceso que vivimos constantemente, si viajamos a Paris la Tour Eiffel se convierte en una atracción, al igual que la Gioconda en el Louvre, pero después de un mes de pasar todos los día frente a la Tour Eiffel si vivimos en Paris, o si somos gurdas en Louvre de ver la Mona Lisa esto se convierte en parte del paisaje general y no lo tomamos en cuenta, es decir nos desensibilizamos por la habituación al estímulo constante (Wolpe 1958).
En que se relaciona todo esto con los arbovirus, pues es sencillo es más fácil controlar mediante campañas educativas estos problemas de salud en zonas como Europa o América del Norte debido a que no hay una exposición tan constante a los vectores y las enfermedades que causan, por lo que las campañas alertando acerca de los riesgos (no siempre tan dramáticos como aparecen en estas campañas) son más efectivas debido a una menor desensibilización del medio. Veamos un caso, en Costa Rica ha habido una campaña prolongada contra el Dengue (el principal arbovirus en este país) que ha señalado los problemas de esta enfermedad y hasta la posibilidad de letalidad de la misma. No obstante, el temor a la enfermedad no es perceptible en la población y se habla del Dengue al igual que de un resfrío común. La razón para que esto suceda es sencilla, hay una exposición constante por parte de la población al peligro real del contagio, esto hace un efecto similar al de la terapia de desensibilización cuando se hace la exposición “in vivo” al motivo de miedo.
En el caso del Dengue el miedo es inducido con la campaña que se implementa, de esta manera en una forma inversa a la que se utiliza en la desensibilización sistémica, aquí se pretende mediante la campaña, despertar miedo hacia el Dengue, creando ansiedad cuando alguien ve un mosquito similar al Aedes aegypti, que es el vector más común en Costa Rica. Entonces se logra que la población huya y trate de controlar los criaderos de mosquitos para estar tranquilos, ahora bien como el mosquito que actúa como principal vector del Dengue está informado para Costa Rica desde mucho tiempo antes que el Dengue en el país, hay una costumbre en las zonas rurales a convivir en presencia de este mosquito, con lo que la campaña logra que la población en general distinga muy bien la especie (en adultos) pero no necesariamente se logra que hay ansiedad (temor) al estar frente a ella.
Esto es porque hay una desensibilización ante la presencia de mosquitos.
Cuando se encuesta a los extranjeros que llegan de visita al país, vienen con una fuerte instrucción acerca de lo que es el Dengue, sus síntomas y sus alcances, incluso la posibilidad de que sea letal. Esto ayuda a que generen una enrome ansiedad cuando se les dice que hay mosquitos transmisores del virus cerca o que la zona en la que se hallan de paseo es de alta incidencia de Dengue, por estas razones duermen con mosquiteros, ventiladores encendidos y con altas cantidades de repelentes en su piel, algunos incluso adquieren brazaletes especiales para repeler los mosquitos. Mientras que la población local no utiliza ninguno de esos medios y hasta encuentra graciosos el miedo extremo que se genera en algunos visitantes. En los extranjeros además hay un factor más, la mayor parte de ellos vienen en una vista corta por lo que no se desea enfermarse para perder el tiempo de un viaje de placer, y por otro lado nadie desea enfermar lejos de los sistemas de salud que conoce y de la gente en la que confía.
Ahora bien la población local muy probablemente ha visto casos de Dengue entre los pobladores, además han visto que en la mayor parte de los casos no es letal y se comporta tan solo como una gripe fuerte. El manejo “in vivo” de estos datos hace que la población local se desensibilice cuando la campaña le indica riesgos relativos que se dan en una pequeña fracción de la población.
Además de otras razones como la falta de presupuesto, la interrupción de las campañas, la mala planificación de las mismas, la ausencia de estudios locales acerca de la transmisión, razones todas de importancia en el éxito o fracaso de las campañas de prevención de la infección, también deben tomarse en cuenta los factores individuales y grupales que afectan la transmisión de los parásitos en las poblaciones humanas. Aunque se ha demostrado que con las enfermedades transmitidas por vectores las actitudes particulares de los individuos o grupos de individuos poco influyen en el contagio, si se sabe que el modelo de parasitismo y estrés las diferencias entre países en los rasgos de personalidad (la sexualidad sin restricciones, extraversión, apertura a experiencias) y en los valores sociales (individualismo, colectivismo, la igualdad de género, la democratización) son de importancia específicamente en la prevalencia de parasitosis no zoonóticas (Thornhill et al. 2010).
Ahora bien, si factores de este tipo pueden afectar la transmisión de enfermedades, es un hecho que los hábitos están en gran medida definidos por las condiciones ambientales donde se desarrolla la población. Hay estudios que indican que tanto la latitud como el clima afectan el estado emocional de los individuos (Erren et al. 2011), esto tiene directa relación con los hábitos y el tipo de ropa que se utiliza, en zonas bajas de altas temperaturas es habitual que los pobladores usen ropas con menos área de cobertura lo que facilita que los mosquitos puedan picar a los hospederos. El clima favorece estados sociales de agregación diferentes también y actividades distintas con lo que se puede afectar la tasa de picaduras y de transmisión.
Los factores psicosociales son fundamentales en los comportamientos que pueden influir en que haya mayor posibilidad de ser picado por los mosquitos y esto facilite la transmisión de la enfermedad. De esta manera los requerimientos ecológicos de las especies de mosquitos en relación con las condiciones ambientales que alteran el comportamiento humano, que responde a su ecología, son parte del conjunto de determinantes que pueden ayudar a que sea favorecida la transmisión o no. Las experiencias con otras enfermedades mediadas por vectores deben ayudarnos a planificar mejores campañas regionales, donde no solo se tome en cuenta el nivel educativo y económico de los núcleos sociales, sino sus condiciones ambientales y como estas pueden afectar desde un punto de vista psicosocial la transmisión de estas enfermedades zoonóticas.
Agradecimientos
Al Dr. Jorge Vargas Carmiol por la iniciativa y organización del Primer Congreso sobre el Virus del Nilo Occidental en Costa Rica, a la Asociación Costarricense de Salud Pública (ACOSAP) por el apoyo en la realización de esta actividad, a la Universidad de Costa Rica por haber contribuido en la realización de esta actividad, al Dr. César CerdasQuesada por la revisión del manuscrito original y por sus aportes para mejorarlo. También se agradece al señor Jader Martínez por su colaboración con el manejo de las imágenes.
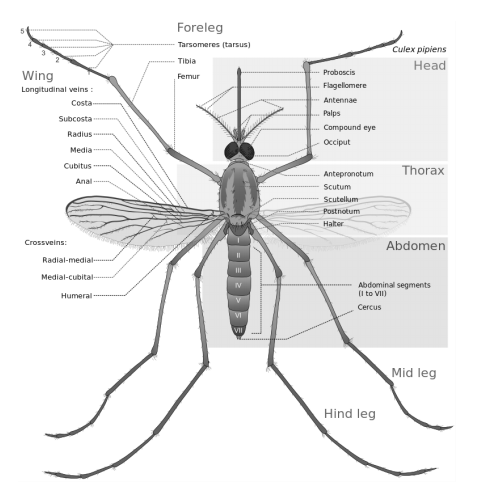
Figura 3. Diagrama general de la morfología externa de un Culicidae (Culex sp) (tomado de http://upload.wikimedia.org/wikipedia/commons/8/82/Culex_pipiens_diagram_en.svg).
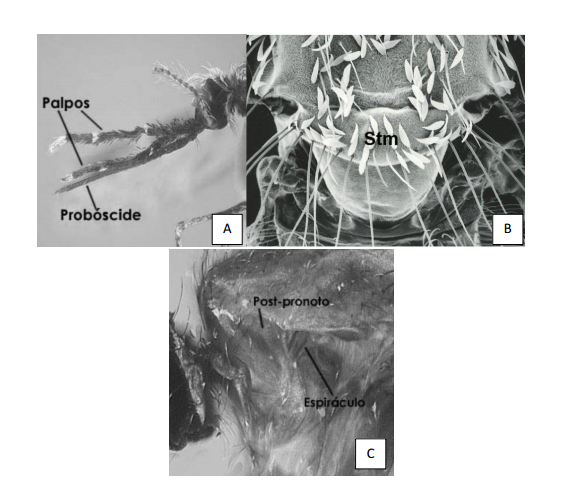
Figura4. Anopheles sp. A. Palpos maxilares y probóscide de similar longitud (Tomado de Chaverri 2004). B. Escutelo de Anopheles sp. (Tomado de Harbach 2013). C. Postpronoto y espiráculo de Anopheles sp.(Tomado de Chaverri 2004).

Figura 5. Aedessp. Palpos maxilares y probóscide mucho más desarrollada que los palpos (Tomado de Chaverri 2004)
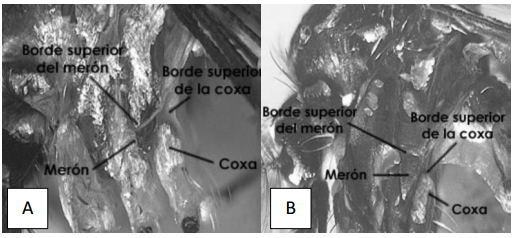
Figura 7. A. Wyeomyia sp. Borde superior del merón ligeramente por encima del borde superior de la coxa de la pata III. B. Aedes sp Borde superior del merón muy por encima arriba del borde superior de la coxa de la pata III. (Tomado de Chaverri 2004).
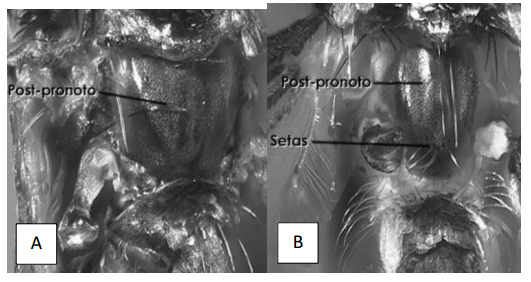
Figura 8. A. Haemagogus sp. Postpronoto mostrando ausencia de un grupo central de setas. B. Limatus sp mostrando la presencia de un grupo central de setas. (Tomado de Chaverri 2004).
preespiraculares. B. Wyeomyia sp. Vista lateral del tórax mostrando la presencia de setas preespiraculares. C. Limatus sp. Vista dorsal de la cabeza mostrando el occipucio sin escamas erectas. (Tomado de Chaverri 2004).

Figura 10. Wyeomyia sp. Vista lateral del tórax mostrando la presencia de setas prealares.(Tomado de Chaverri 2004).
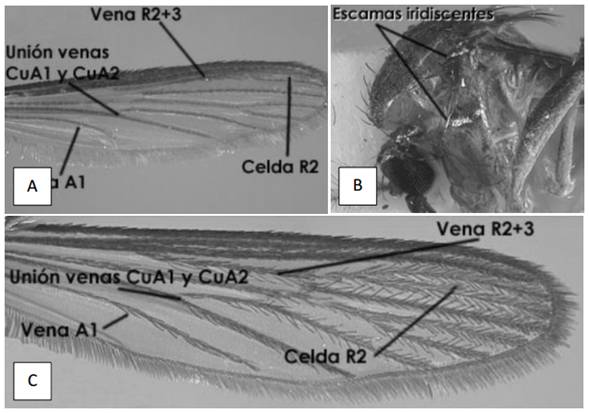
Figura 11. Uranotaenia sp. A.Ala I mostrando la celda R2 más corta que la vena R2+3 y la vena A1 terminando antes de la unión de las venas CuA1 y CuA2. , B.
Vista lateralmostrando las escamas iridiscentes en el tórax.Culex sp C. Ala I mostrando la celda R2 más larga que la vena R2+3 y la vena A1 terminando después de la unión de las venas CuA1 y CuA2.(Tomado de Chaverri 2004).

Figura 12. Aedeomyia squamipennis. A. Cabeza mostrando la antena con antenómeros cortos. B. Fémur de la pata II mostrando el mechón apical de escamas.(Tomado de Chaverri 2004).

Figura 13. A. Aedes sp. Cabeza mostrando la antena con los antenómeros largos. B. Culex sp. Fémur de la pata II mostrando ausencia del mechón apical de escamas.(Tomado de Chaverri 2004).
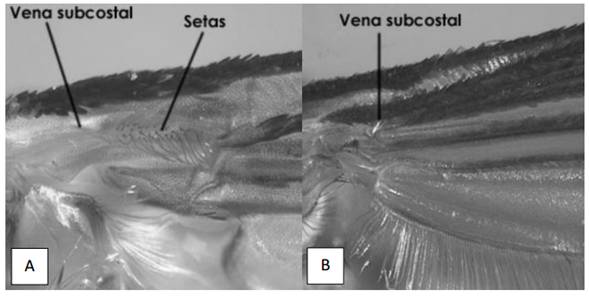
Figura 14. A. Culiseta particeps. Vista ventral de la base del ala I mostrando las setas en la vena subcostal. B. Culex sp. Vista ventral de la base del ala I mostrando ausencia de setas en la vena subcostal.(Tomado de Chaverri 2004).
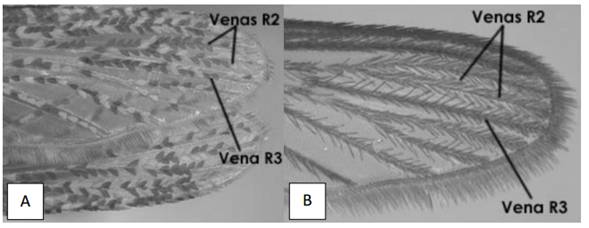
Figura 15. A. Mansonia sp. Ala I de mostrando las escamas anchas en las venas R2 y R3. B. Culex sp. Ala I mostrando las escamas largas y angostas en las venas R2 y R3. (Tomado de Chaverri 2004).

Figura 16. A. Coquillettidia sp.Patas mostrando las bandas preapicales de escamas blancas en los fémures. B. Mansonia sp. Pata II mostrando escamas negras y blancas entremezcladas y sin un patrón de banda preapical. (Tomado de Chaverri 2004).
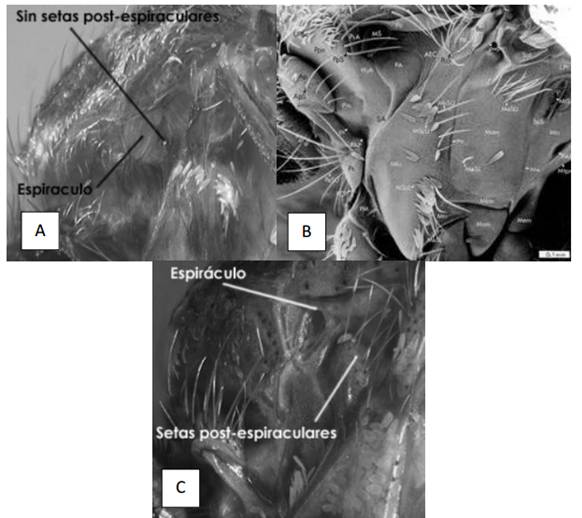
Figura 17. A. Culex sp. Vista lateral mostrando ausencia de setas postespiraculares. (Tomado de Chaverri 2004). B. Culex opisthopus. Vista lateral de la región espiracular (Tomado de http://mosquito-taxonomic-inventory.info/adultsmetathoracic-spiracle-8). C. Aedes sp. Vista lateral mostrando la presencia de setas postespiraculares. (Tomado de Chaverri 2004).

Figura 18. A. Psorophora sp. Vista lateral mostrando la presencia de setas preespiraculares. B. Aedes sp. Vista lateral mostrando la ausencia de setas preespiraculares. (Tomado de Chaverri 2004).