Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Salud Pública
Print version ISSN 1409-1429
Rev. costarric. salud pública vol.22 n.2 San José Jul./Dec. 2013
Original
Porque convivir con el Dengue: control integrado del vector
Coexisting with Dengue: Integrated Vector Control
Edilber Almanza Vasquez1*, Esteban Puello Mendoza2*, Edilber Almanza Meza3*
Resumen
Objetivo: Demostrar que el dengue permanecerá por siempre en la población humana y plantear alternativas de cómo controlar el vector, y por tanto, la enfermedad.
Métodos: Através del análisis cualitativo de un sistema de ecuaciones diferenciales ordinarias que incluye el control biológico en la etapa larval, la dinámica de los vectores y la dinámica de la enfermedad hasta un segundo contagio.
Resultados: Manteniendo un manejo adecuado en la relación del vector con personas infectadas con algún serotipo, se puede generar equilibrio estable, evitando que cada brote de la enfermedad sea más virulento. La única forma de prevenir el denguees el control del contacto de los vectores con las personas.
Conclusión: Si no se mantiene un control adecuado en todas las etapas de desarrollo de los vectores del dengue, nunca se controlará la enfermedad y aparecerá periódicamente, aunque desaparezcan los vectores o la enfermedad por algún tiempo.
Palabras claves: Dengue, Larva, Aedes, Virus del Dengue, Control de Mosquitos (fuente: DeCS, BIREME)
Abstract
Objective: To demonstrate dengue will remain endlessly in humanity and pose alternatives for controlling the vector, thus the disease.
Methods: Through qualitative analysis of a system of ordinary differential equations including biological control in the larval stage, vectors behave and diseases’ behavior in a second.
Results: Maintaining an appropriatemanagement of vector nexus with serotype-infected-person, can generate stable equilibrium, avoiding that each outbreak becomes more virulent. The only way to reduce dengue-infection is to prevent the vectors from contacting with people.
Conclusion: If an adequate control at all stages of growth of dengue vectors is not maintained, it will never be possible to control the disease and it will appear regularly, even if vectors or disease disappear for short periods of time.
Keywords: Dengue, larva,Aedes, Dengue Virus, Mosquito Control (source: MeSH, NLM)
En los países de América salvo Chile (protegidos por los andes) y Canadá (protegido por las montañas rocosas), el dengue se presenta como una gran preocupación para los gobiernos y sus habitantes; no solo por los efectos biológicos limitantes de la sintomatología, sino porque las personas que lo padecen deben suspender sus labores diarias no asistiendo a las empresas donde laboran, asistir a los hospitales para recibir los cuidados especiales, efectuar gastos en el proceso de recuperación. Los efectos en la economía de los países son inmensos. Los esclavos en América provenientes de África asociaban esta enfermedad con los espíritus malos de “dinga o dyenga”, homónimo de ki denga pepo. La OMS (Organización Mundial de la Salud) considera al dengue, como la segunda infección re-emergente entre las enfermedades tropicales, como una de las principales enfermedades virales transmitidas al hombre por vectores y la incluyó como una enfermedad con alta prioridad en la investigación (1).
El dengue es la quinta en la lista de las enfermedades tropicales desatendidas en las Américas en términos de años de vida ajustados por discapacidad (AVAD). Dado su crecimiento exponencial se ha convertido en un problema de salud pública, se estima que más de 100 millones de personas padecen dengue y miles de casos de dengue severo se pueden presentar cada año, especialmente en los países tropicales donde se favorecen el desarrollo y la proliferación del vector (2). Dado que la transmisión de la enfermedad utiliza un ciclo mosquito-hombremosquito, la presencia o ausencia de la enfermedad depende de la coexistencia de: a) los vectores, b) el virus y c) la población susceptible. En tal sentido, la única forma de prevenir el dengue es a través del control de los vectores, debido a que no existen vacunas ni drogas que lo prevengan o lo curen.
El dengue es una enfermedad infecciosa, viral y aguda que afecta al hombre, causa la mayor morbilidad y mortalidad en países de regiones tropicales y subtropicales de todo el mundo, principalmente en zonas urbanas y semiurbanas, producida por cualquiera de los cuatro serotipos del virus del dengue DEN-1, DEN-2, DEN-3 y DEN4 (3). La clasificación se hace con base a criterios clínicos, biológicos, inmunológicos, moleculares y de acuerdo a la secuencia de ácido nucleico cada serotipo puede ser clasificado en dos o más genotipos. Pertenece a la familia flaviviridae, constituido por una cadena simple de alrededor de 11 kilo-bases (kb) de ARN de polaridad positiva. Su genoma codifica tres proteínas estructurales la proteína C, que compone la cápside que rodea y protege al ácido nucleico; la M, que forma la membrana viral; y la E, que conforma la envoltura y siete proteínas no estructurales (4). El virus es trasmitido a través de la picadura de un mosquito infectado, el Aedes Albopictus y el Aedes Aegypti, implicado como el principal vector de la enfermedad (5, 6).
Los Síntomas del dengue presentan un amplio espectro clínico, que van desde formas subclínicas y leves (asintomáticas) hasta cuadros con severo compromiso vascular y de los mecanismos de coagulación. Según el grado de gravedad se clasifican como dengue y dengue severo. La infección con un serotipo crea inmunidad de por vida a ese serotipo, pero también crea anticuerpos que incrementan la susceptibilidad de infección por los tres restantes.
El dengue severo normalmente sucede cuando la infección con un serotipo es seguido por una segunda infección con otro serotipo. Sin tratamiento, cerca del 5% de los casos severos son fatales, pero con atención adecuada este porcentaje se reduce a menos de 2 %.
Aspectos clínicos. Para la OMS se tiene:
Dengue: Fiebre (
Dengue severo: Fiebre entre 2 y 7 días acompañados de los síntomas del dengue clásico. Manifestaciones de permeabilidad capilar y trastornos de la coagulación. Hematemesis y trombocitopenia (menores10 0000 plaquetas por mm3). Aumento de la permeabilidad vascular. Derrame pleural, ascitis o hipoproteinemia
Los vectores. Los mosquitos del genero Aedes (Diptera: Culicidae, Subgenero Stegomyia) son considerados los vectores naturales del dengue. Aedes Aegypti considerado como el principal vector en el sector urbano y Aedes Albopictus implicado como el segundo vector de importancia en las Américas. Los mosquitos Aedes luteocephalus, A.furcifer, A. taylori y A. vittatus, han sido descritos como vectores activos en el ciclo selvático en el oeste del continente Africano (7).
Aedes Aegypti. El mosquito Aedes Aegypti, vector de los virus del dengue, fiebre amarilla y oeste del Nilo, entre otros, tiene su origen en el cinturón tropical de África donde generalmente se encuentran las especies del subgénero Stegomyia. Se describe que llego a las Américas en los barriles de agua transportados por los navíos de los colonizadores y exploradores, también se cree que se introdujo en América, como una especie diseminada por el hombre por medio del transporte de sus adultos, huevos, larvas o pupas en barcos, aviones y transportes terrestres. Es una especie silvestre, habitando libre del contacto con el hombre. Ancestralmente, desde esas áreas, inició una dispersión efectuada por el hombre, que lo ha llevado a constituirse en un mosquito cosmopolita. Su presencia es detectada en la mayor parte de las áreas tropicales o subtropicales, comprendidas entre los 45 º de latitud norte y los 35 º de latitud sur, en las zonas isotermales intermedias a los
Ciclo de vida. Los huevos. Tienen dimensiones menores a 1mm de largo, son ovalados, inicialmente de color blanco, con el desarrollo del embrión se tornan de color negro, eclosionan en óptimas condiciones de temperatura y humedad en un lapso de
Las larvas. Inician un ciclo de cuatro estados larvarios, creciendo a lo largo de tres mudas desde un largo de
Poseen caracteres morfológicos típicos, fuertes espículas torácicas laterales queratinizadas, peine de escamas unilineal en octavo con forma de oliva corta, que destaca por su color negro se alimentan con el zooplancton y fitoplancton de los recipientes que habitan. Su desarrollo se completa en condiciones favorables de nutrición y con temperaturas de
El adulto. Es la fase reproductora del A. Aegypti.
Las hembras hematófagas poseen hábitos de alimentación diurnos, en cercanía a los domicilios humanos, con gran afinidad a la alimentación sobre el hombre. El adulto emergente es un mosquito de color negro, con diseños blanco-plateados formados por escamas claras que se disponen simulando la forma de una “lira”, en el dorso del tórax, y mostrando un anillado característico a nivel de tarsos, tibia y fémures de las patas (16).El periodo de vida del mosquito adulto se ve afectada por las características climáticas, principalmente la humedad y la temperatura, pues condicionan sus actividades de alimentación, reproducción y reposo.
A una temperatura inferior a 4°C o superior a los 40 °C generalmente no sobreviven. A. Aegypti en condiciones naturales sobrevive en promedio de
Se ha medido la distancia del desplazamiento de vuelo de los mosquitos entre las casas; la hembra de A. Aegypti puede volar en un radio promedio de 40 a 60 metrosy por alguna razón, los machos se desplazan hasta más de los
Aedes Albopictus (Stegomya Albopictus). Aedes Albopictus llamado también el mosquito tigre es un mosquito originario de Asia, que ha extendido su área de distribución en todo el mundo en las últimas décadas. Fue descrito por primera vez en La Reunión (isla del suroeste del Océano Índico) en 1913 (17). Mediante el transporte pasivo de larvas, con el desplazamiento de variadas mercaderías (neumáticos, brotes de bambú, etcétera), este culícido arribó a Texas, Estados Unidos en 1985 en neumáticos usados, provenientes de Asia y meses más tarde se encontraba en Río de Janeiro, Brasil. Siete años después se extendió a los países de Centro y Suramérica como República Dominicana y México. En 1995 fue reportado en Bolivia, Cuba y Honduras.
En 1995 se encontró en Guatemala y en 1996 en El Salvador. En 1997 fue hallado en Islas Caimán, en 1998 en Argentina, en 1999 en Paraguay, en 2002 en Panamá y en 2003 en Uruguay y Nicaragua. En Colombia el primer reporte de esta especie se efectuó en el municipio de Leticia, Amazonas, en 1998 donde no hay presencia de A. Aegypti (16).
Los datos sobre la biología de este vector son escasos, con la finalidad de describir el desarrollo inmaduro, la supervivencia, la longevidad, fecundidad y ciclos gonotrófico de A. Albopictus, estudios recientes, demostraron que el umbral mínimo de desarrollo de estados inmaduros se encontró a temperaturas de
El más corto de los ciclos gonotrófico se encontraron a
Es un mosquito de color oscuro, casi negro con unas características bandas blancas tanto en las patas como en abdomen. Mide entre 5 y
En general A. Albopicus produce una mayor cantidad de huevecillos que A. Aegypti. Las hembras de A. Aegypti prefieren ovipositar en recipientes que contengan agua limpia, mientras que las A. Albopicus lo hacen en recipientes con agua turbia que contenga cierta cantidad de material orgánico en descomposición (20). A. Albopicus mantiene una amplia variedad de criaderos, tanto en recipientes artificiales como naturales; tiene más habilidad de colonizar en criaderos naturales, como huecos de árbol, axilas de las hojas de algunas plantas y huecos de rocas; es común encontrarlo en lugares con vegetación abundante (19). Toda vez que los mosquitos han emergido, se alimentan por primera vez entre las 20 y las 72 horas posteriores. Tales características lo transforman en un vector de más difícil control e improbable eliminación, una vez que éste se radica (20).
Los hábitos alimenticios de las hembras hematófagas de A. Albopicus son muy parecidos a A. Aegypti, aunque prefieren alimentarse con más frecuencia afuera que adentro de las casas. Sus preferencias pueden variar hacia otras especies de mamíferos; en ocasiones se alimentan de animales de sangre fría, pero lo hacen principalmente de sangre humana (7). Se ha detectado una verdadera “competencia”, con A.Aegypti por los mismos tipos de criaderos en ambientes urbanos, donde A. Albopicus logra desplazar gradualmente a su competidor, con posterioridad a un tiempo de coexistencia (21).
En otros aspectos, su biología y ecología es comparable a la de A. Aegypti, siendo muy similares su morfología como larvas, pupas o adultos, diferenciándose por la estructura de las escamas del octavo segmento abdominal y del pecten, así como por sus espículas latero-torácicas cortas y hialinas en estado larvario y por los diseños de escamas plateadas, en cabeza y dorso de tórax pero en vez de un patrón en forma de lira, tiene una sola franja plateada en el dorso para los adultos (22) (Rey J. El Dengue in: ENY737S. 2007, Electronic Data Information source (EDIS), University of florida).
1. Porque convivir con el dengue. Modelo matemático
La modelación matemática de las enfermedades transmisibles permite conocer los alcances de las intervenciones que se utilizan en salud pública para su control o eliminación. En el presente estudio se utiliza un modelo matemático para simular tanto la dinámica de la enfermedad como del vector y del control biológico. Es entonces una herramienta para predecir la propagación del Dengue sin control 2. Solo en el estado larvario los vectores son y simular los alcances del control biológico como depredado. intervención en salud pública. 3. Los mosquitos inicialmente son sanos y pueden Se utiliza un modelo tipo “presa – depredador con infectarse con un solo serotipo. dinámica de la enfermedad” que articula: a) los 4. Una persona no se infecta con dos serotipos del estados de desarrollo de los vectores: huevo, larva virus al tiempo. y adulto; b) los serotipos del virus (dos); y c) las 5. Una persona que se infecta con un serotipo, crea capacidades de los depredadores para eliminar el inmunidad para el mismo. vector. 6. La persona inmunizada a un serotipo que es Supuestos del modelo. Para efectos de la dinámica infectada con otro serotipo, adquiere el Dengue del modelo se asume:
1. Los cuatro instares larvarios son resumidos en una variable
2. Solo en el estado larvario los vectores son depredado.
3. Los mosquitos inicialmente son sanos y pueden infectarse con un solo serotipo
4. Una persona no se infecta con dos serotipos del virus al tiempo.
5. Una persona que se infecta con un serotipo, crea inmunidad para el mismo.
6. La persona inmunizada a un serotipo que es infectada con otro serotipo, adquiere el Dengue Severo.
7. Los casos fatales de Dengue, son los de Dengue Severo.
Se tiene que:
1.Ausencia de dengue I D1 y de dengue I D2 por tanto de I DS Si la tasa de crecimiento intrínseca de la población de humanos es positiva, y si el vector existe, la enfermedad del dengue no se extinguirá. Ya que los puntos de equilibrio 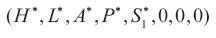 y
y 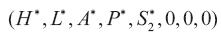 son inestables.
son inestables.
2. Ausencia del dengue I D1 o de I D2 por tanto de I DS . Si la tasa de crecimiento intrínseca de la población de humanos es positiva y si solo existe un serotipo de dengue, este presentara brotes periódicos en el tiempo. La matriz Jacobiana del sistema 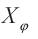 evaluada en los puntos de equilibrio
evaluada en los puntos de equilibrio 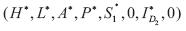 y
y 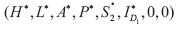 tiene valores propios imaginarios puros.
tiene valores propios imaginarios puros.
3. Presencia de dengue I D1 y de dengue I D2 , por tanto de I DS Si la tasa de crecimiento intrínseca de la población de humanos es positiva y existen dos serotipos de dengue, se presentarán epidemias periódicas. La matriz Jacobiana del sistema 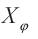 evaluada en el punto de equilibrio
evaluada en el punto de equilibrio 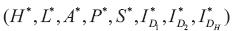 tienen valores propios imaginarios puros y los restantes tienen parte real negativa.
tienen valores propios imaginarios puros y los restantes tienen parte real negativa.
4. La enfermedad del dengue no se puede erradicar, aun controlando los vectores en todas sus formas, pero se puede hacer un manejo racional de ella. Se muestra que el punto de equilibrio 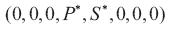 es inestable, aunque se tenga
es inestable, aunque se tenga 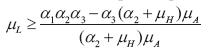
Discusión
Si no se mantiene un control adecuado en todas las etapas de los vectores del dengue, nunca se controlará la enfermedad y aparecerá periódicamente cada vez más complicado, aunque desaparezcan los vectores por algún tiempo. El dengue no se erradicará si existen vectores infectados, debido a que ellos pueden pasarse el virus transováricamente. La solución para erradicar el dengue es desapareciendo los vectores. La erradicación local de mosquitos es posible con un manejo ecológico, sin embargo, la continuidad espacial promueve la reaparición de brotes.
Manteniendo un manejo adecuado de la relación vector con personas infectadas con algún serotipos, se puede generar equilibrios estables, evitando que cada brote de la enfermedad sea más virulento. Mientras exista algún serotipo de dengue y los vectores, el dengue se presentara periódicamente en la sociedad.
Las conductas humanas crean condiciones ambientales que determinan si una enfermedad progresa o se extingue. El Control vectorial debe ser integral, combinando los distintos tipos de métodos con criterios de racionalidad, seguridad, eficacia, adaptabilidad y aceptabilidad, dirigidos a las etapas del ciclo de vida de los vectores. El control o erradicación de Ae, Albopicus es más difícil que el de A. Aegypti principalmente porque se encuentra más alejado de las habitaciones de los humanos y existe diversidad de hábitats. Las tres formas principales de control del vector son el control químico, el control biológico y el control ambiental.
Control químico. Se lleva a cabo con el uso principalmente de organofosforados, Dieldrin, Malation y HCH. El control químico no es recomendable aplicarlo seguido debido a que los vectores pueden crear resistencias como sucedió en 1986 donde se reportó que Ae. Albopicuses resistente a los organofosforados DDT, Dieldrin y HCH en la India, Malasia, Sureste de Asia, las Filipinas y Japón. En Singapur y Vietnam el vector es resistente a los organofosforado. En América datos preliminares en Louisiana mostraron resistencia parcial al Malation y Abate (Temephos).
Contra las larvas: Temefhos al 1 % (Abate) seis aplicaciones cada 27 días
Contra los adultos: Rociado espacial. Mosquiteros impregnados. Tratamiento peri focal. Jabones y lociones repelentes. El tratamiento focal, el tratamiento peri focal y la aplicación espacial. Cuatro aplicaciones seguidas dependiendo del tiempo residual del producto usado.
El control biológico de los vectores con depredadores de larvas nos ofrece la posibilidad de funcionamiento continuo, sin la necesidad de aplicaciones frecuentes como requieren los pesticidas. Esto se logra introduciendo especies de copépodos en criaderos de larvas. Se ha experimentado que las poblaciones de copépodos normalmente matan a más del 99 % de las larvas de Aedes Aegypti, y sobreviven en el contenedor mientras éste contenga agua, resisten temperaturas hasta 43 ºC. Si hay abundancia de larvas, los copépodos comen solo una parte de cada larva, lo cual le permite a cada copépodo matar entre 30 y 40 larvas cada día, un número muy superior al que realmente comen. Una hembra adulta reproduce entre 250 y 300 hembras adultas en un mes. Las hembras de los copépodos son inseminadas durante su adolescencia y no requieren de más contacto con los machos para seguir produciendo entre 50 y 100 huevos por semana durante el resto de su vida, que dura varios meses. También en el control larvario se usan bacterias (Bacillus thurigiencis H14 variedad israeliensis), peces, moluscos. En el control biológico de adultos se utiliza la esterilización, selección de especies de arañas, murciélagos entre otros,
El Control ambiental. El control ambiental sugiere la eliminación o reducción de las fuentes de crías de larvas, para romper el ciclo de vida del mosquito. La educación sanitaria es un factor protector importante para prevenir las enfermedades transmitidas por vectores (E.T.V) y tiene como objetivo lograr que las personas adopten hábitos y prácticas de comportamiento que reduzcan el riesgo de convivir con los vectores, generalmente es un control físico del vector tal como: a) drenaje, relleno o despeje de bordes de criaderos, destrucción de los depósitos inservibles y el uso de mallas protectoras ajustadas, para el control de larvas; b) para el control de adultos se usan mosquiteros, mallas en puertas y ventanas, trampas de luz y otros. c) variar el nivel del agua cada tres días a los depósitos de aguas. d) Cambiar los niveles de PH del agua de los estanques.
Vigilancia del vector. La vigilancia entomológica se emplea para determinar los cambios en la distribución geográfica del vector, para obtener mediciones relativas de la población de vectores a lo largo del tiempo. La vigilancia de la susceptibilidad de la población de vectores a los insecticidas.
La enfermedad del dengue se hace difícil de simular con datos reales, porque en la mayoría de los países, por lo general no se determina que serotipo está actuando en cada caso.
Referencias bibliográfica
1. Guzmán M, et al. El dengue y el dengue hemorrágico: prioridades de investigación. Rev Panam Salud Publica 2006; 19(3):204-215. [ Links ]
2. Halstead SB, Pathogenesis of dengue: challenges to molecular biology. Science 1988; 239(4839): p. 476-81. [ Links ]
3. Oviedo A., et al. Dengue: diagnóstico diferencial del síndrome febril en el viajero. Emergencias 2010; 22:203-205. [ Links ]
4. Caceres O, Detección rápida de los serotipos del virus dengue en el mosquito Aedes aegypti. Rev. perú. med. exp. salud publica 2003; 20(3):156-158. [ Links ]
5. Shepard DS, et al, Economic Impact of Dengue Illness in the
6. Potts J, et al. Prediction of Dengue Disease Severity among Pediatric Thai Patients Using Early Clinical Laboratory Indicators. PLoS Neglected Tropical Diseases 2010; 4(8):214-216. [ Links ]
7. Quintero D, Osorio J, and Martínez M., Competencia vectorial: consideraciones entomológicas y su influencia sobre la epidemiología del Dengue. IATREIA 2010; 23(2):146 – 156. [ Links ]
8. Fernández P, Martín Y, and Viera I. El vector AedesAegyptidurante la epidemia de dengue en Ciego de Ávila. MEDICIEGO 2010; 16(1):1-7. [ Links ]
9. Olleta JF, Dengue en América Latina y Venezuela. Med Interna 2006. 22(4):247-258. [ Links ]
10. Lazcano J, et al. Factores ecológicos asociados con la presencia de larvas de AedesAegyptien zonas de alta infestación del municipio Playa, Ciudad de La Habana, Cuba. Rev Panam Salud Publica 2006; 19(6):379
11. Trujillo M, et al. Dinámica estacional y temporal de AedesAegypti(Diptera: Culicidae) en el municipio Cienfuegos. Rev Cubana Med Trop 2010; 62(2): 98-106
12. Obando G, et al. Experiencia de un análisis entomológico de criaderos de AedesAegyptiy Culex quinquefasciatus en Cali, Colombia. Rev. Colomb. Entomol 2007; 33(2):148-156
13. Cabezas C. Dengue en el Perú: aportes para su diagnóstico y control. Rev. perú. med. exp. salud publica 2005; 22(3):212-228. [ Links ]
14. Jansen C, Beebe N. The dengue vector Aedes aegypti: what comes next. Microbes and Infection 2010; 12(4):272-279. [ Links ]
15. Badii M, et al. Ecología e historia del dengue en las Américas. International J Good Conscience 2007; 2(2):309 – 333. [ Links ]
16. Cuellar M, et al. Detección de Aedes Albopicus (Skuse)(Diptera: Culicidae) en la ciudad de Cali, Valle del Cauca, Colombia. Biomedica 2007; 27:273-9. [ Links ]
17. Delatte H, et al. Influence of temperature on immature development, survival, longevity, fecundity, and gonotrophic cycles of Aedes 18. Albopicus, vector of chikungunya and dengue in the
18. Wallace P, Geoffrey P. Infecciones transmitidas por artropodos, in Atlas de medicina tropical y parasitología,6 ed, España. Kindle Edition. Elsevier. 2007. [ Links ]
19. Vezzani D, Carbajo A. Aedes aegypti, Aedes Albopicus, and dengue in
20. Toto J, et al. First report of the oriental mosquito Aedes Albopicus on the West African
21. Guzman A, Istúriz R. Update on the global spread of dengue. International Journal of Antimicrobial Agents 2010; 3354(1):1-3. [ Links ]
22. Rey J, et al. Habitat segregation of mosquito arbovirus vectors in
1 Maestro en Biomatemáticas, Licenciado en Matemáticas, Universidad de Cartagena. ealmanzav@unicartagena.edu.co
2 Especialista en Administración de Obras Civiles, Ingeniero Civil, Universidad de Cartagena. epuellom1@unicartagena.edu.co
3 Medico General, Cartagena de Indias, Colombia. edilbertjose@hotmail.com
Recibido: 15 marzo 2013 Aprobado: 01 julio 2013













