Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Costarricense de Salud Pública
versión impresa ISSN 1409-1429
Rev. costarric. salud pública vol.16 no.31 San José dic. 2007
Determinación de salmonella spp. y endoparásitos en zanates (quiscalus mexicanus) del parque de Cañas, Guanacaste
Determination of species of salmonella and endoparasites in grackles (quiscalus mexicanus) in the park of Cañas, Guanacaste, Costa Rica.
Priscila Minott Picado1,
Magali Caballero Castillo2
1 Doctor Medicina Veterinaria, pri_minott@yahoo.com, tel.: 872 - 4026. Práctica privada.
2 MQC, MSC. Laboratorio ACOPSA, Mercedes Norte, Heredia.
Recibido: 25/6/07 Revisado: 23/10/07 Aprobado: 9/11/07
Resumen
Se determinó la prevalencia de Salmonella spp. en 60 muestras de heces de zanates (Quiscalus mexicanus) provenientes de Cañas, Guanacaste, debido a que se ha observado la presencia de estos animales en establecimientos dedicados a la producción exhaustiva de proteína animal (aves, cerdos, etc.). Tres muestras fueron positivas (5%) y se aislaron los serotipos Montevideo, Saint Paul y Carrau. Además, se comparó la efectividad del medio Rappaport-Vasiliadis Peptona de Soya perteneciente a una casa comercial, con el caldo Rappaport-Vasiliadis preparado en el laboratorio a partir de los ingredientes. Se obtuvo una diferencia significativa entre ambos caldos de enriquecimiento (p=0.04).
Se capturaron 28 individuos en la primera parte y en la segunda parte de esta investigación se capturaron 32. Las aves fueron eutanasiadas y se les realizó necropsia, exámenes de sangre y de contenido intestinal para determinar la presencia de endoparásitos. Se encontraron varios especímenes de céstodos y acantocéfalos en el intestino de las aves. En los exámenes de contenido intestinal se encontraron además huevos de nemátodos y ooquistes de coccidios del género Isospora. Las microfilarias fueron los únicos hemoparásitos encontrados en los frotis sanguíneos.
Palabras clave: Quiscalus mexicanus, Salmonella spp, Rappaport-Vasiliadis, endoparásitos de aves.
Summary
Prevalence of Salmonella spp. was determined in 60 fecal samples obtained from great tailed grackles (Quiscalus mexicanus) from Cañas, Guanacaste, since their presence has been observed in sites which produce animal protein (poultry, pork, etc.) Serovars Montevideo, Saint Paul and Carrau were isolated from 3 samples (5%). Effectiveness of commercially available Rappaport-Vasiliadis Soy peptone was compared with that of Rappaport-Vasiliadis broth prepared from the ingredients. A significant difference was obtained (p=0.04) between both enrichment broths.
28 grackles were captured for the first part and for the second part of this study, 32 great tailed grackles were captured and examined for endoparasites. Cestodes and acanthocephalan parasites were found during post mortem examination of the large intestine. Microscopic examination of intestinal samples revealed the presence of coccidian parasites of the genera Isospora, and two types of nematode eggs. Blood samples showed the presence of filarial infections.
Key words: Quiscalus mexicanus, Salmonella species, Rappaport-Vasiliadis, bird endoparasites.
Introducción
De las especies de pájaros residentes en el país, el zanate (Quiscalus mexicanus) se encuentra diseminada en todo el l territorio nacional. Esta espe cie es considerada como una plaga tanto agrícola y urbana en Costa Rica, principalmente en lugares como Liberia y Cañas. Son aves muy gregarias, siendo usual encontrarlas en parques urbanos donde perchan durante las noches en grupos superiores a los 6.000 individuos por hectárea (1). El nombre común de esta ave es clarinero grande o zanate. Es un ave perteneciente al orden Passeriformes, familia Icteridae (2)
Los hábitos del zanate favorecen su papel como vector de enfermedades infecciosas, pues es muy común encontrarlos merodeando los alrededores de centros de explotación animal, como fincas de ganado vacuno, porquerizas y granjas avícolas. También es un residente frecuente en los centros urbanos de población donde encuentran alimento fácil gracias a los desechos dejados por los humanos. Bacterias patógenas como Salmonella spp. podrían estar presentes en las poblaciones de zanates e infectar a otras especies de animales silvestres o domésticos en las vecindades donde se reúnen estas aves, constituyendo también un riesgo para la salud humana. Se sabe que Salmonella spp puede infectar no sólo a las aves de corral y a las anseriformes, sino a otros tipos de aves tales como paseriformes, rapaces, psitácidas, colúmbidas y láridas (3).
La avifauna silvestre generalmente se encuentra infectada por varias especies de parásitos, y se considera que la mayoría de estas aves toleran su carga de parásitos adecuadamente (4). Sin embargo, se tiene poco conocimiento sobre los ciclos de vida y patogenicidad de la mayoría de los parásitos de las aves silvestres (5, 6).
En nuestro país no conocemos estudios sobre agentes bacterianos y parasitarios que infectan a los zanates, ni hay investigaciones suficientes en el extranjero sobre el estatus sanitario de esta ave en particular. Existen numerosos estudios concernientes a la presencia de bacterias patógenas y de endoparásitos en otras aves paseriformes, sin embargo los resultados son poco aplicables en el caso de los zanates en Costa Rica, no sólo por tratarse de investigaciones realizadas en países con condiciones ambientales muy diferentes (geografía, clima, flora, fauna) que podrían influir en la ecología de las enfermedades, sino también porque el zanate presenta un hábitat, alimentación y conducta muy diferentes a la del resto de las aves silvestres estudiadas. Por esta razón se planteó la idea de realizar un estudio exploratorio para examinar lo que es un tema de investigación poco estudiado y que ayudará a establecer el carácter de investigaciones posteriores más rigurosas.
Este estudio es para investigar la presencia de un agente infeccioso de importancia para la salud pública tal y como lo es Salmonella, en la especie de ave Quiscalus mexicanus que habita en el territorio de Costa Rica.
Materiales y métodos
1. Área de estudio
La investigación se llevó a cabo en la ciudad de Cañas, perteneciente al cantón del mismo nombre, ubicado en la provincia de Guanacaste. La localización geográfica es de 10° 25´ 39´´ latitud norte y 85° 05´ 36´´ longitud oeste.
2. Población en estudio
Se tomó en cuenta a los zanates (machos y hembras adultos o jóvenes) que utilizaron como dormitorio el parque central de Cañas durante el periodo de investigación (31 de mayo del 2003 al 31 de mayo del 2004). En esta investigación no se calculó un tamaño de muestra determinado porque no había datos disponibles debido a la ausencia de estudios anteriores sobre el tema, así que se abordó la investigación como un estudio exploratorio. Se determinó la captura de no menos de 30 individuos, valor mínimo para obtener un aproximado de una curva normal (7).
3. Muestreo
3.1. Bacteriología
Se buscó la presencia de salmonelas paratifoides, puesto que son las más importantes en aves silvestres. Dado que estas bacterias se excretan en las heces de las aves infectadas, se recogieron deyecciones de los zanates para su análisis.
Las muestras fueron colectadas en la cuadra que comprende el Parque Central y la Iglesia de Cañas. Se recogieron solamente las deyecciones que estuvieran frescas. Las heces se colocaron en tubos de plástico, poniendo varias deyecciones por tubo, de manera que cada muestra fuera de aproximadamente tres gramos de heces. Se les agregó una pequeña cantidad de solución salina fisiológica (aproximadamente 0.1 ml) con el fin de evitar la desecación durante el transporte. Las muestras se transportaron al laboratorio a 4 °C. Se analizaron además 9 muestras de contenido intestinal de aves capturadas durante el muestreo parasitológico.
3.2. Metodología de captura
La cacería de aves se realizó entre el 31 de mayo y el 8 de noviembre del 2003. Los zanates fueron capturados bajo licencia de recolecta científica del Ministerio del Ambiente y Energía (MINAE) (resolución N° 043-2003-OFAU). Se utilizó una red de niebla de nylon negro (210 denier, 2 cordones) de 6 metros de ancho por 2,6 metros de alto, con 4 bolsas y 100 mm de luz de malla estirada (modelo HF6, Avinet, Inc., PO Box 1103, Dryden NY 13053-1103 USA).
La red se colocó en alguna de las orillas internas del parque, extendida frente a grupos de árboles en un sector diferente en cada sesión de captura. Los extremos de la red se ataron a tubos de aluminio (2 tubos de 1" diámetro y 2 metros de largo, 2 tubos de ¾ " diámetro por 2 metros de largo), los cuales median 3,70 metros una vez armados.
La caza se realizó durante las últimas horas de la noche y en la madrugada (11:30 pm a 4:30 am). Mientras los zanates se encontraban agrupados en los árboles se usó una vara de madera para golpear las ramas y espantarlos. Algunos al buscar refugio en otros árboles cayeron en la red.
Las aves capturadas se transportaron al Laboratorio de Patología Aviar de la Escuela de Medicina Veterinaria, Universidad Nacional. Allí se les practicó la eutanasia con pentobarbital sódico (Anestesal®, Pfizer) para realizar la necropsia y colecta de muestras.
4. Procesamiento laboratorial
4.1. Bacteriología
Método 1:
Se añadió a cada muestra de heces 15 ml de agua de peptona tamponada y se incubaron a 37°C por 18 horas. Posteriormente se inoculó 0.1 ml del cultivo en 10 ml de caldo Rappaport Vassiliadis peptona de soya (Oxoid®), incubando los tubos a 42 °C por 18 horas. Se realizó un subcultivo del caldo rayándolo en placas de agar verde brillante (Oxoid®) y XLD (Oxoid®).
Método 2:
Se realizó el mismo procedimiento que en el método 1, con la diferencia de que se utilizó caldo Rappaport Vassiliadis elaborado en el laboratorio con la fórmula que se detalla en la tabla 1.
En cada procedimiento se utilizaron 3 controles positivos y un control negativo. Para los controles positivos se utilizaron heces de caballo negativas por Salmonella. Se repartieron las heces en muestras de 3 gramos cada una y los controles positivos de cada procedimiento fueron inoculados con 106 UFC, 103 UFC y 10 UFC de Salmonella.
Identificación de Salmonella
Todas las colonias sospechosas fueron inoculadas en medios de TSI y urea. Las muestras con reacción característica de Salmonella spp. (urea negativo; TSI con declive rojo/alcalino, fondo amarillo/ácido y producción de H2S) fueron sometidas a prueba serológica de aglutinación de látex para el antígeno somático O (Antisuero Poli A-I, DIFCO®). Las cepas positivas fueron enviadas al laboratorio del INCIENSA para la identificación del serotipo.
Análisis estadístico
Se determinó la proporción de muestras con Salmonella spp. para los dos medios usados. Para estimar la significación de la diferencia entre las proporciones, se utilizó el test exacto de Fisher (7).
4.2. Parasitología
Colecta de parásitos
Durante la necropsia se revisó la cavidad peritoneal, sacos aéreos, pulmones, corazón, hígado y articulaciones de las extremidades para buscar parásitos internos. Se separó el tracto digestivo desde la molleja hasta la cloaca y se colocó en placas de Petri con solución salina. Se procedió luego a la disección con la ayuda de un estereoscopio para localizar los helmintos presentes.
Exámenes coproparasitológicos
Se realizó un frotis directo mezclando una pequeña cantidad de heces con solución salina sobre un portaobjetos. Se observó al microscopio con el objetivo 10x. Además se usó el método de flotación con azúcar, o Sheather (8), para analizar el contenido intestinal de las aves.
Los huevos, ooquistes, y larvas encontrados se midieron con un microscopio provisto de micrómetro ocular. La densidad parasitaria se determinó según el número de huevos u ooquistes por campo de 100x.
De las muestras positivas a coccidios, se tomó una pequeña cantidad de las heces y se colocó en tubos eppendorf con solución de dicromato de potasio al 2% y se mantuvieron a temperatura ambiente por 7 días para favorecer la esporulación de los ooquistes inmaduros. Pasado este tiempo se procedió a examinar las muestras de nuevo y a medir los ooquistes esporulados en un microscopio con micrómetro ocular. La medición se realizó a un aumento de 1000x.
Examen de hemoparásitos
Antes de la eutanasia se les recortó a las aves una de las uñas de las garras con el fin de colectar sangre suficiente para realizar un frotis sanguíneo. Los frotis fueron teñidos con Giemsa y vistos al microscopio con un aumento de 1000x.
Resultados
1. Bacteriología
Con el método 1 se procesaron 68 muestras, 60 de heces y 8 de contenido intestinal. Ninguna de ellas fue positiva con Salmonella spp. En el caso de los controles, sólo uno resultó positivo, el inoculado con la concentración más alta (106 UFC).
Con el método 2, se utilizaron 60 muestras de heces. Se pudo aislar Salmonella en tres muestras (5%). Los serovares encontrados fueron Saint Paul, Montevideo y Carrau.
Los controles inoculados con la bacteria fueron todos positivos. Se encontró una diferencia significativa entre los resultados obtenidos con ambos medios de enriquecimiento (p=0.04).
2. Parasitología
Se capturaron en total 32 aves. A todas ellas se les practicó el examen de necropsia. En la revisión macroscópica de los órganos se encontró que 17 estaban parasitadas por acantocéfalos (53.1%) y en 7 aves se hallaron céstodos (21.9%). Los helmintos se localizaron en el intestino grueso. En ningún caso se encontraron especímenes de nemátodos adultos ni de tremátodos.
Se recuperaron 62 especímenes de acantocéfalos de color blanco que variaban de 7 mm hasta 26 mm de longitud. La probóscide era cónica, armada de filas longitudinales de ganchos, con una porción anterior con ganchos y otra posterior con espinas. No fue posible hacer diferenciación de los sexos, ni realizar un conteo y descripción de los ganchos. El receptáculo de la probóscide presentaba una sola pared. El tronco era cilíndrico, sin espinas.
En la parte posterior de los intestinos delgados se recuperaron 10 de céstodos. Eran sumamente delgados, midiendo el más grueso de ellos 2 mm. En promedio medían 1 mm de ancho y 5 cm de largo. No se hallaron proglótides grávidos. Se observaron en los exámenes de heces cápsulas ovígeras con varios huevos esféricos de un diámetro promedio de 48,93 μm (42,5-57,5). Se recuperσ un solo escólex, el cual consistió de 4 ventosas inermes y un rostelo con una única fila de ganchos amartillados.
Debido a dificultades para tomar las muestras, sólo a 20 de las aves capturadas se les realizó frotis sanguíneos, de los cuales 8 (40%) resultaron positivos a microfilarias. No se halló otro tipo de hemoparásitos.
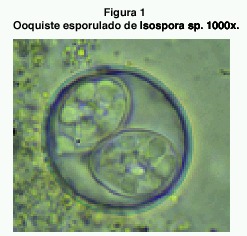
Los exámenes de contenido intestinal se realizaron a 23 aves. En 18 de ellas (78.3%) se encontraron ooquistes de coccidios del género Isospora. El 72,2 % de las muestras (n=13) tenía una carga alta de ooquistes en el examen directo, de 10 ooquistes por campo en adelante. La mayoría de los ooquistes eran esféricos o subesféricos, con algunos muy levemente ovoides. Se midieron 133 de ellos y se obtuvo un diámetro promedio de 26,13 x 26,13 μm (18-33 x 18-33). El índice morfológico (razón largo: ancho) resultó de 1,08 (máximo 1,27, mínimo 1,00). La pared era lisa, sin micrópilo y compuesta de dos capas. No se observó residuo de ooquiste, pero si la presencia de un gránulo polar en la mayoría de los casos. Los esporoquistes eran ovoides, en forma de gota de agua. Medían en promedio 17.63 X 11.69 μm (20-15 X 10-13). Su índice morfológico fue de 1.51. Los cuerpos de Stieda y sub-Stieda se hallaban claramente visibles en un extremo. El residuo del esporoquiste se presentaba en forma de gránulos dispersos (figura 1).
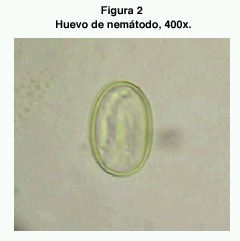
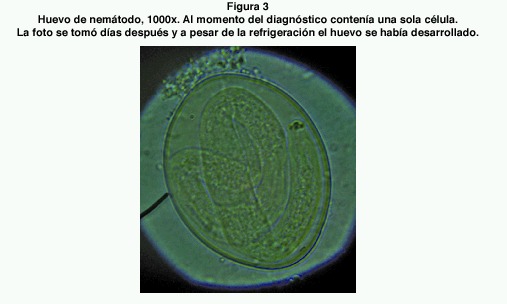
Mediante el método de flotación se pudieron hallar huevos de nemátodos en varias muestras. Los huevos encontrados fueron de dos tipos. El primero era un huevo relativamente pequeño, de cáscara lisa gruesa y con un embrión vermiforme (figura 2). Midieron un promedio de 37,22 x 23,89 μm (35-40 x 20-25). Estos se encontraron en 8 de las muestras analizadas (34.8 %). El otro tipo de huevo era subglobular, no embrionado al momento del exámen, y con ligeras proyecciones refráctiles en la cáscara localizadas en cada extremo (figura 3). Su medida promedio fue de 57,05 x 40,91 μm (50-67,5 x 35-52,5) y se hallaron en 7 muestras (30.4 %) de las 23 estudiadas.
Discusión y conclusiones
1. Bacteriología
El Rappaport-Vassiliadis (RV) se menciona en mucha de la literatura como un medio muy eficiente para el aislamiento de Salmonella en muestras ambientales, de heces y en alimentos (9, 10, 11, 12, 13, 14). Sin embargo, estas observaciones se basan en el medio preparado a partir de la fórmula original, no en las formulaciones comerciales.
En esta investigación se obtuvo una diferencia significativa entre la efectividad de dos medios para aislar Salmonella. Esta diferencia observada entre los medios preparados a partir de los ingredientes y los medios comerciales ya había sido reportada con anterioridad por Peterz et al. (15) y por June et al. (16). En ambos estudios los medios comerciales resultaron inferiores en el aislamiento de Salmonella. Peterz y colaboradores (15) creen que las variaciones en la tasa de crecimiento de Salmonella presentadas entre los diferentes tipos de Rappaport-Vassiliadis podrían ser explicadas por diferencias en la concentración de cloruro de magnesio (MgCl2).
El cloruro de magnesio (MgCl2) eleva la presión osmótica del caldo y junto con el verde malaquita suprime en gran parte el crecimiento de la flora microbiana encontrada en el intestino, pero no el crecimiento de la mayoría de las salmonelas. Las especies de Salmonella tienen la habilidad de sobrevivir a presiones osmóticas relativamente altas, se multiplican en valores relativamente bajos de pH, son más resistentes al verde malaquita y además tienen requerimientos nutricionales menos exigentes que el resto de las enterobacterias (17).
Una diferencia observada entre los controles positivos de ambos caldos de enriquecimiento fue que el RV preparado de los ingredientes inhibió mejor a otras bacterias contaminantes, pues se observó mucho menor crecimiento de éstas en las placas de XLD y agar verde brillante. Por lo tanto, consideramos que los pobres resultados obtenidos con el medio comercial se debieron a la menor concentración de MgCl2 que presenta su formulación (13,6 g/L). Esta cantidad parece no ser suficiente para inhibir a la flora bacteriana competitiva presente en muestras tan contaminadas como las heces de zanates.
En comparación, el caldo que se preparó en el laboratorio tenía una concentración de MgCl2 bastante más alta (36 g/L). Probablemente esto permitió el adecuado crecimiento de la Salmonella al limitar el desarrollo de las otras bacterias presentes.
Bajo otras circunstancias, donde la muestra posea una flora contaminante menos abundante, el desempeño del caldo puede variar. Por ejemplo, Maijala y colaboradores (18) utilizaron el mismo medio comercial probado en esta investigación y lo compararon con otros caldos RV de diferentes fabricantes. En este caso el medio dio resulta-dos bastante buenos, sin embargo las muestras fueron obtenidas de carne de pollo congelada. La flora bacteriana encontrada en estas muestras no es comparable a la encontrada en las heces de las aves.
La cantidad de muestras positivas por Salmonella en los zanates fue baja (5%), si bien el uso de "pooles" de heces en el muestreo hace que los datos no representen la verdadera prevalencia de contaminación en estas aves. Según lo revisado en la literatura, se dice que la prevalencia de Salmonella en la mayoría de las especies de aves silvestres es baja (19, 20, 21, 22). En la mayor parte de los casos la prevalencia en paseriformes ha sido reportada como menor a un 10% (21).
Las aves silvestres son usualmente portadoras asintomáticas de Salmonella (19, 20, 23). Steele y Galton (19) mencionan que "la incidencia reportada de infecciones por Salmonella en la población general de aves silvestres es extremadamente baja, por lo que no representan una gran amenaza como reservorio natural y fuente de infección para el ser humano y los animales domésticos". Sin embargo, en ciertas circunstancias, como cuando un número elevado de aves se agrupa en un mismo sitio, pueden ocurrir brotes y los portadores sobrevivientes de Salmonella representarían un peligro de salud potencial para humanos y otros animales (19, 20, 23).
Si bien no se tienen pruebas de que los zanates sean responsables de infecciones en humanos y animales domésticos, el aislamiento de Salmonella en estas aves indica que pueden ser portadoras y constituyen un riesgo potencial de transmisión.
2. Parasitología
En este estudio los ooquistes de coccidios encontrados se identificaron como protozoarios del género Isospora. La diferenciación con Atoxoplasma se basó en que los exámenes de necropsia y frotis sanguíneos practicados a los zanates. Los ooquistes de ambos parásitos tienen una morfología similar, causando alguna confusión en su identificación (24). Un examen fecal indicará la presencia de ooquistes de Atoxoplasma o Isospora, pero no es posible bajo condiciones normales de laboratorio diferenciar entre estos dos géneros (24). En 14 de los casos donde se encontraron ooquistes de coccidios, también se realizaron frotis sanguíneos y ninguno presentó esporozoítos de Atoxoplasma sp. A 4 de estas 14 aves también se les realizó examen histológico de hígado y pulmones, pues en sangre periférica la parasitemia no siempre es constante (25). No se encontraron formas del parásito en los órganos. Por este motivo se concluye que los ooquistes encontrados corresponden al género Isospora.
En aves de la familia Icteridae se tienen reportes de al menos 5 especies de Isospora distintas. Los ooquistes de Isospora cacici (26) tienen forma y medidas similares a los encontrados en los zanates de Cañas. Sin embargo, su pared es de una sola capa de 1.5 μm de grosor, mientras que los observados en este estudio cuentan con una pared de dos capas de 1 μm de grosor. Tambiιn existen muchas similitudes con los ooquistes de Isospora icterus (27), pero este posee un residuo de ooquiste pequeño que no se observó en ninguno de los coccidios medidos. Isospora graceannae (27) también presenta residuo del ooquiste. No se pudieron conseguir las referencias originales donde se dan las descripciones de Isospora bellicosa e Isospora divitis, ni tampoco las de otros varios casos de parasitismo por Isospora sp. en ictéridos (entre ellos Quiscalus quiscula) en donde no se definió la especie involucrada.
Para poder definir una nueva especie, como mínimo se requiere compararla en detalle con las especies más estructuralmente similares halladas dentro del mismo género de hospedador, y mejor aún, compararla con todas las especies encontradas dentro de la familia del hospedador para evitar crear una nueva especie basándose solamente en el hospedador (28). Para afirmar con seguridad que la especie en este estudio se trata de una no descrita anteriormente, sería necesario comparar los hallazgos con los realizados por los otros autores de los que se habló anteriormente.
En cuanto a los huevos de nemátodos encontrados es imposible determinar la especie a la que pertenecen sin haber obtenido un ejemplar del gusano adulto. A pesar de esto, fue posible realizar algunas inferencias a partir de sus características más relevantes.
En el orden Oxyurida existen varios parásitos con huevos subglobulares, como por ejemplo los géneros Subulura, Avilandros, Alaplectana y Syphaciella (29). Es posible que los huevos subglobulares hallados pertenezcan a este orden.
Los espirúridos poseen huevos de forma elíptica, con cáscara gruesa en la mayoría de los casos, conteniendo una larva al momento de la puesta (30). Son huevos de tamaño pequeño (31), que coinciden con las medidas de los encontrados en la investigación. Por las características citadas, se concluye que el segundo tipo de huevo encontrado pertenece al orden Spirurida.
Aunque se tuvo el cuidado de revisar los principales órganos internos y examinar el tracto gastrointestinal con estereoscopio, la presencia de pocos gusanos en el ave, sumado al hecho de que existen nemátodos que miden unos pocos milímetros; pudo influir en el hecho de que se pasaran por alto las formas adultas de los parásitos evidenciados en el examen de heces.
Debido a que no se hallaron filarideos adultos durante la necropsia de las aves, no es posible llegar a un diagnóstico del parásito al cual pertenecen las microfilarias en la sangre de los zanates, puesto que las características de las larvas no son suficientes para este fin.
Chanderella quiscali es un nemátodo que parasita el cerebro del clarinero común (Quiscalus quiscula versicolor). También se ha encontrado en el azulejo (Cyanocitta cristata bromia), vaquero cabeza parda (Molothrus ater ater) y el estornino pinto (Sturnus vulgaris). La prevalencia en clarineros puede ser de hasta 98% (32). Se cree que el vector es el mosquito Culicoides crepuscularis (33).
El helminto ha sido recuperado en gran cantidad de los ventrículos laterales de los clarineros infectados. Los nemátodos neurotrópicos del cerebro o médula espinal producen poca o ninguna reacción detectable en su hospedador normal. Al iniciar la investigación no se tenía conocimiento sobre la existencia de este nemátodo, y la información sobre él se obtuvo luego de finalizado el muestreo. Por lo tanto, el examen de los ventrículos laterales del cerebro de los zanates no se incluyó como procedimiento de rutina en la necropsia. Se recomienda su revisión en estudios posteriores sobre el tema.
Según el escólex encontrado, los céstodos pueden clasificarse dentro del orden Cyclophyllidea, al poseer cuatro ventosas y un rostelo armado (5). Por la forma de los ganchos se pueden ubicar en la familia Davaineidae, pues poseen forma de "T" (5). Debido a que no se hallaron proglotides grávidos, no es posible determinar el género al que pertenecen.
Los acantocéfalos se clasificaron dentro de la familia Gigantorhynchidae utilizando la clave elaborada por Amin (34). Debido a que no se pudo obtener una visualización clara de los órganos internos, y a que no fue posible describir en detalle la armadura de la probóscide; no es posible determinar con certeza a cual especie pertenecen los especímenes hallados, o si se trata de una especie nueva.
Los hallazgos de esta investigación son similares a los obtenidos por Amparán y Téllez (4), al menos en cuanto a lo que se refiere a los acantocéfalos y los céstodos. En ese estudio se encontraron acantocéfalos del género Mediorhynchus, tremátodos del género Conspicuum, y los céstodos Raillietina tetragona y Amoebotaenia cuneata, en 8 zanates de Nuevo León, México. Desafortunadamente, no realizaron exámenes de sangre ni de heces.
En el examen de necropsia no se detectaron lesiones macroscópicas importantes ocasionadas por los parásitos hallados. Con los acantocéfalos se observaron en algunas ocasiones pequeñas petequias en la mucosa en el lugar donde se localizaba la probóscide del parásito. La condición corporal de las aves no estaba visiblemente afectada, incluso en un caso en donde se encontraron hasta 15 acantocéfalos en el intestino grueso del ave. Con los céstodos tampoco se observaron cambios patológicos evidentes. En todos los casos, las aves parecieron tolerar la carga de parasitaria adecuadamente, y ninguno de los parásitos encontrados tenía marcada patogenicidad.
Los zanates albergan gran variedad de endoparásitos, que en su mayoría tienen un ciclo de vida indirecto como los acantocéfalos, céstodos y nemátodos del orden Spirurida. Por lo tanto, la alta prevalencia de infecciones en estas aves puede explicarse por su dieta de insectos, moluscos y otros animales pequeños.
Los parásitos identificados no representan un peligro para humanos y animales domésticos, pues son relativamente específicos de hospedador. Además, para la mayoría de los parásitos encontrados, la infección se adquiere por ingestión de hospedadores intermediarios.
Referencias
1. Alfaro, J. D. 1991. I. Eficacia de métodos para el control del zanate (Quiscalus mexicanus) en dormitorios urbanos de Costa Rica, II. Un método empírico para estimar el tamaño mínimo de muestra sobre morfometría del zanate (Quiscalus mexicanus) en Costa Rica. Tesis. Programa regional en manejo de vida silvestre para Mesoamérica y el Caribe, Universidad Nacional, Costa Rica. [ Links ]
2. Stiles, G & A. Skutch. 1995. Bolseros, Oropéndolas y Caciques. Página 462 en Guía de aves de Costa Rica. INBio, Heredia, Costa Rica.. [ Links ]
3. Sánchez, S., C. L. Hofacre, M. D. Lee, J. J. Maurer & M. P. Doyle. 2002. Animal Sources of Salmonellosis in humans. JAVMA. 221: 492-497. [ Links ]
4. Amparán, R. & J. Téllez. 1997. Contribución al conocimiento del parasitismo en dos especies de aves silvestres de Ciudad Universitaria, San Nicolás de los Garza, Nuevo León, México. Revista Biotam. 9: 60-67. [ Links ]
5. Tarazona, J. M. 1999. Parte VIII Parasitosis de las aves: Capítulo 42: Parasitosis del aparato digestivo, Cestodosis. Páginas 785-791 en: Parasitología Veterinaria. M. Cordero del Campillo et al., edts. McGraw Hill Interamericana. España. [ Links ]
6. Dolnik, O. 2002. Some aspects of the biology and host parasite interactions of Isospora spp (Protozoa: Coccidiida) of passerine birds. www.docserver.bis.uni_oldenburg.de/publikationen/dissertation/2003/dolsom02/pdf/kap02.pdf (Accesado Setiembre 17, 2003). [ Links ]
7. Norman, G. R. & D. L. Streiner. 1996. Bioestadística. Mosby-Doyma S. A. Madrid, España. [ Links ]
8. Sloss, M. W., Kemp, R. L. & Zajac, A. M. 1994. Fecal examination in the diagnosis of parasitism. Páginas 3-93 en: Veterinary Clinical Parasitology. 6TH edition. Iowa State University Press/Ames. Estados Unidos de Norteamérica. [ Links ]
9. Bager, F. & J. Petersen. 1991. Sensitivity and specificity of different methods for the isolation of Salmonella from pigs. Acta Vet Scand. 32: 473-481. [ Links ]
10. Schlundt, J. & B. Munch. 1993. A comparison of the efficiency of Rappaport-Vassiliadis, tetrathionate and selenite broths with and without pre-enrichment for the isolation of Salmonella in animal waste biogas plants. Zentralbl Bakteriol. 279: 336-343. [ Links ]
11. Busse, M. 1995. Media for Salmonella. Int J Food Microbiol. 26: 117-131. [ Links ]
12. June, G. A., P. S. Sherrod, T. S. Hammack, R. M. Amaguana & W. H. Andrews. 1996. Relative effectiveness of selenite cystine broth, tetrathionate broth, and Rappaport-Vassiliadis medium for the recovery of Salmonella spp. from raw flesh, highly contaminated foods, and poultry feed: collaborative study. J. AOAC. 79: 1307-1323. [ Links ]
13. Quinn, P. J., M. E. Carter, B. Markey & G. R. Carter. 1999. Enterobacteriaceae. Páginas 209-236, 254-258, 320-326 en Clinical Veterinary Microbiology. Mosby. [ Links ]
14. Wray, C & R. H. Davies. 2002. Enterobacteriaceae. Páginas 95-123 en: Poultry diseases. 5th edition. F. Jordan, M. Pattison, D. Alexander & T. Faragher, edits.W.B Saunders, USA.. [ Links ]
15. Peterz, M., C. Wilberg & P. Norberg. 1989. The effect of incubation temperature and magnesium chloride concentration on growth of Salmonella in home-made and in commercially available dehydrated Rappaport-Vassiliadis broths. J. Appl Bacteriol. 66: 523-528. [ Links ]
16. June, G. A., P. S. Sherrod, T. S. Hammack, R. M. Amaguana & W. H. Andrews. 1995. Relative effectiveness of selenite cystine broth, tetrathionate broth, and Rappaport-Vassiliadis medium for the recovery of Salmonella from raw flesh and other highly contaminated foods: precollaborative study. J. AOAC. 78: 375-380. [ Links ]
17. World Health Organization (WHO). 2001. Isolation, identification, serotyping and susceptibility testing of Salmonella. WHO/CSR. [ Links ]
18. Maijala, R., T. Johansson & J. Hirn. 1992. Growth of Salmonella and competing flora in five commercial Rappaport-Vassiliadis (RV) media. Int J Food Microbiol. 17: 1-8. [ Links ]
19. Steele, J. H & M. M. Galton. 1971. Salmonellosis. Páginas 51-58 en: Infectious and Parasitic Diseases of Wild Birds. First Edition. J. W. Davis, R. C. Anderson, L. Karstad & D. O. Trainer, edits. Iowa State University Press.. [ Links ]
20. Stroud, R. K. & M. Friend. 1987. Avian Salmonellosis. Páginas 101-106 En: Field Guide to Wildlife Diseases. Volume I: General Field Procedures and Diseases in Migratory Birds. M. Friend, edit. National Wildlife Health Center. Washington, D. C. [ Links ]
21. Morishita, T. Y., P. P. Aye, E. C. Ley & B. S. Harr. 1999. Survey of pathogens and blood parasites in free-living passerines. Avian Dis. 43: 549-552. [ Links ]
22. Kirk, J.H., C. A. Holmberg & J. S. Jeffrey. 2002. Prevalence of Salmonella spp. in selected birds captured on California dairies. JAVMA. 220: 359-362. [ Links ]
23. Mikaelian, I., D. Daignault, M. Duval & D. Martineau. 1997. Salmonella infection in wild birds from Quebec. Can Vet J. 38: 385. [ Links ]
24. McNamee, P., T. Pennycott & S. McConnell. 1995. Clinical and pathological changes associated with Atoxoplasma in a captive bullfinch (Pyrrhula pyrrhula). Vet Rec. 136: 221-222. [ Links ]
25. Quiroga, M. I., N. Alemán, S. Vázquez & J. M. Nieto. 2000. Diagnosis of Atoxoplasmosis in a canary (Serinus canarius) by histopothologic and ultrastructural examination. Avian Dis. 44: 465-469. [ Links ]
26. Lainson, R. 1994. Observations on some avian Coccidia (Apicomplexa: Eimeriidae) in Amazonian Brazil. Mem Inst Oswaldo Cruz. 89: 303-11. [ Links ]
27. Upton, S. J. & B. Whitaker. 2000. New species of Isospora (Apicomplexa, Eimeriidae) from the troupial and white-edged oriole (Icterus spp.) (Aves, Passeriformes, Icteridae). Acta Parasitologica. 45: 67-70. [ Links ]
29. Yamaguti, S. 1961. Nematodes of birds. Páginas 197-330 en Sistema Helminthum: The nematodes of vertebrates. Part I, Vol III. Interscience Publishers Inc, New York. [ Links ]
28. Duszynski, D. W. & S. J. Upton. 2001. Enteric Protozoans: Cyclospora, Eimeria, Isospora and Cryptosporidium spp. Páginas 416-459 en Parasitic Diseases of Wild Mammals. 2nd edition. W. M. Samuel, M. J. Pybus & A.A. Kocan. ed. Iowa State University Press, Estados Unidos de América. [ Links ]
30. Wehr. C. 1971. Nematodes. Páginas 185- 225 en: Infectious and Parasitic Diseases of Wild Birds. First Edition. J. W. Davis, R. C. Anderson, L. Karstad & D. O. Trainer, edits. Iowa State University Press. [ Links ]
31. Barriga, O. 1997. Chapter 20: The Order Spirurida: Superfamilies Spiruroidea and Filaroidea. Páginas 20.2-20.25 en: Veterinary Parasitology for Practitioners. 2nd edition. Burgess International Group Inc. U.S.A. [ Links ]
32. Granath, W. O. 1980. Fat of the wild avian filarial nematode Chandlerella quiscali (Onchocercidae: Filarioidea) in the domestic chicken. Poult Sci. 59: 996-1000. [ Links ]
33. Law, J. M., T. N. Tully & T. B. Steward. 1993. Verminous encephalitis apparently caused by the filarioid nematode Chandlerella quiscali in emus (Dromaius novaehollandiae). Avian Dis. 37: 597-601. [ Links ]
34. Amin, O. M. 1987. Key to the families and subfamilies of Acanthocephala, with the erection of a new class (Polyacanthocephala) and a new order (Polyacanthorhynchida). J. Parasit. 73: 1216-1219. [ Links ]