Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Costarricense de Salud Pública
Print version ISSN 1409-1429
Rev. costarric. salud pública vol.16 n.30 San José Jul. 2007
Variabilidad geográfica en la detección temprana del cáncer cervicouterino entre servicios integrados de atención en Costa Rica, 2004 - 2005*
Amada Aparicio Llanos1
Melvin Morera Salas2
* Este proyecto contó con el apoyo de una beca parcial sin condiciones del PPPI de la Merck Company Foundation, brazo filantrópico de Merck & Co. Inc., Whitehouse Station, New Jersey, USA.
1 Caja Costarricense de Seguro Social y Centro Centroamericano de Población, Universidad de Costa Rica. Teléfono: (506) 369 -0183 Tele/Fax: (506) 278 - 2644. Apartado Postal: 332 - 100 San José, Costa Rica. E-mail: aaparicio@ccss.sa.cr o aaparicio@fce.ucr.ac.cr
2 Caja Costarricense de Seguro Social y Centro Centroamericano de Población, Universidad de Costa Rica.
Resumen
Objetivo: Realizar un análisis comparativo de los resultados de la detección temprana del cáncer cervicouterino, mediante la identificación de patrones geográficos en los tres servicios integrados del sistema público de salud costarricense. Material y métodos: Se realizó un análisis de variabilidad para el período 20042005 del porcentaje de cobertura de Papanicolaou ajustada por edad, utilizando como indicadores la razón de variación (RV P95-5), el coeficiente de variación (CVP95-5) y el gráfico de puntos. En la representación geográfica se usó el índice de cobertura estandarizada, que compara la cobertura de cada área de salud con el promedio nacional, utilizando el mapa de Costa Rica para representar los tres servicios integrados de salud. Resultados: El área de salud ubicada en el percentil 95 registró una cobertura 2,3 veces mayor que la ubicada en el percentil 5. Entre servicios integrados, se observó moderada variabilidad en los servicios 1 y 2 (CV= 19% y 21% respectivamente) y baja en el servicio 3 (CV= 12.9%). Se determinó un patrón geográfico de baja cobertura de Papanicolaou en las áreas de salud de la zona costera del caribe, frontera norte con Nicaragua y centro del país, las cuales están ubicadas en los servicios integrados 1 y 3. Conclusiones: Las estrategias actuales de cobertura de la toma del Papanicolaou no parecen estar enfocadas a priorizar las áreas de salud más pobres y con mayores tasas de mortalidad evitable por esta patología, ya que éstas son una de las principales características de las zonas identificadas como de baja cobertura respecto al nivel nacional.
Palabras clave: Papanicolaou, variabilidad geográfica, cáncer cérvicouterino.
Abstract
Objective: To carry out a comparative analysis of the early screening results of cervico-uterine cancer, by means of the identification of geographic patterns in the three comprehensive health services of the Costa Rican Social Security system.
Materials and methods: A variability analysis for carried out for the period 2004-2005 for the age-adjusted percent coverage by Pap smear using as indicators the variation ratio (RV p95-5), the coefficient of variation (CV p95-5) and a dot graphic. For the geographic representation, was used an adjusted index which compares the coverage in each health area with the national average, using the map of Costa Rica to represent the three integrated health services.
Results: The health area located in the 95th. percentile showed coverage that was 2.3 times greater than that located in the 5th. percentile. Among integrated services, a moderate degree of variability in services 1 and 2 (CV= 19% and 21%, respectively) and a low degree of variability in service 3 (CV=12.9%) were observed. A geographic pattern of low Pap smear coverage was seen in the health areas of the Caribbean coastal area, the northern border with Nicaragua as well as the middle part of the country, both of which are located in integrated health services 1 and 3.
Conclusions: The present coverage strategies for taking a Pap smear appear not to emphasize the priorization of the poorest health areas which also have the greatest preventable mortality due to cervicouterine cancer since we observed that this was one of the main characteristics of the areas identified as having low national coverage.
Key words: Pap smear, geographic variability, cervicouterine cancer.
Introducción
El cáncer cervicouterino es el segundo cáncer más frecuente en las mujeres en todo el mundo, con lo que se constituye en un problema de salud pública, especialmente en los países en vías de desarrollo, ya que el 80% de las muertes por esa causa ocurre en estos países. En Latinoamérica y el Caribe la incidencia llega al doble, y la mortalidad al triple, de la que se presenta en los países desarrollados [1,2].
En Costa Rica los tumores malignos de útero constituyeron la tercera causa de muerte por cáncer en las mujeres (tasa de 8.6/100 mil), en el período 2000-2005. La mitad de estas defunciones se produjeron entre los 15 y 64 años, las cuales son consideradas como muertes evitables por existir intervenciones suficientemente efectivas para evitarlas.
El tamizaje mediante el examen de un frotis cervical, más el tratamiento adecuado de seguimiento, han demostrado grandes reducciones de las tasas de incidencia y mortalidad [3].
Algunos autores [4,5] consideran que esta neoplasia es 100% prevenible, dado que la lenta evolución de la enfermedad y la accesibilidad a las células de la zona de transición del cuello del útero permite su estudio mediante la prueba del Papanicolaou. Esta prueba de tamizaje permite detectar alteraciones citológicas premalignas y ha demostrado ser una acción costo-efectiva en el número de carcinomas detectados en fase preinvasora y el número de años de vida ganados [6].
Según la literatura [5-9], se ha demostrado que los mejores resultados en la reducción de la incidencia y mortalidad por cáncer cervicouterino se logra cuando se siguen programas organizados de detección sistemática de lesiones preinvasoras y de estadíos tempranos de aparición del carcinoma invasor de cuello de útero y en los casos que no se ha logrado el éxito esperado, se atribuye en gran parte a la implantación inadecuada de las políticas [10].
En Costa Rica a pesar de que el programa de detección temprana del cáncer cervicouterino no existe como tal, desde el año 2000 contamos con el Manual de normas y procedimientos de atención integral a la mujeres para la prevención y manejo del cáncer de cuello de útero, y su actualización publicada el siete de julio de 2006, la cual establece que la cobertura del tamizaje de Papanicolaou debe ser al menos 85% de la población de mujeres de 20 años y más que haya iniciado relaciones sexuales coitales, sin importar su condición de asegurada, cada dos años [11].
El objetivo de este trabajo es realizar un análisis comparativo de los resultados en la detección temprana del cáncer cérvicouterino, mediante la identificación de patrones geográficos en los servicios integrados del sistema público de salud costarricense y las áreas de salud con tasas de mortalidad superiores al promedio nacional.
Material y métodos
Unidad de estudio y fuentes de información
La unidad geográfica primaria seleccionada para esta investigación son las 103 áreas de salud (AS) que componen el primer nivel de atención, las cuales se agrupan en tres servicios integrados del sistema público de salud de Costa Rica a cargo de la Caja Costarricense de Seguro Social (CCSS). Las áreas de salud se circunscriben a un espacio geográfico poblacional según la división geográfica establecida por la CCSS, cuya población promedio nacional es de 39,500 habitantes.
El número de Papanicolaou realizados para el periodo 2004-2005 fue suministrado por las AS y la población femenina de dichas áreas corresponde a las proyecciones de la Dirección Actuarial de la CCSS, con base en el censo de población del 2000. Para esta investigación se agrupó la información en los rangos de 15 a 34 años y de 35 años y más, dado que son los rangos de edad que estableció la CCSS para la evaluación de las metas de cobertura de Papanicolaou en los años 2004-2005.
Medidas de variabilidad
Para el análisis de variabilidad se utiliza el porcentaje de cobertura de Papanicolaou ajustada por edad con el método directo [12], empleando como población de referencia la registrada en el censo del 2000. El porcentaje de cobertura ajustada por edad (CAE) se representa en términos algebraicos de la siguiente forma:
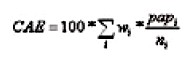
En la anterior ecuación "i" son los grupos de edad de 15-34 y 35 años y más, "wi" es la proporción de cada grupo de edad correspondiente a la población estándar, "papi" el número de Papanicolaou en el grupo de edad "i" y "ni" la población femenina en el grupo de edad "i".
En el análisis de variabilidad se considera el rango entre los percentiles 5 y 95 y se utilizaron como indicadores la razón de variación (RV P95-5), el coeficiente de variación (CV P95-5) y el gráfico dot plot [13,14].
Presentación de los resultados
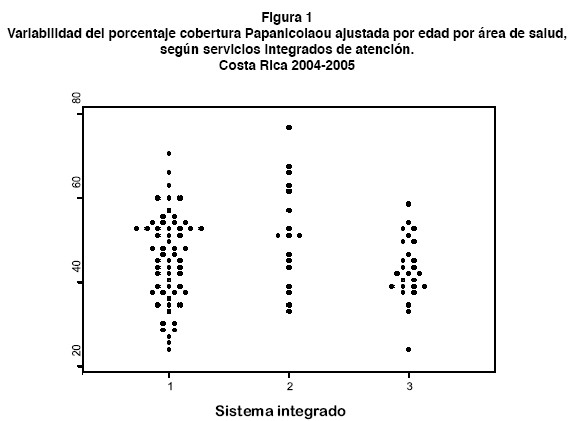
Se presenta el gráfico de puntos (dot plot) donde cada punto representa el porcentaje de cobertura de Papanicolaou en un AS. Las AS con porcentajes similares se representan al mismo nivel, con lo que los dot plot adoptan una forma de rombo, que será más simétrica cuanto más se aproxime la distribución estudiada a una normal.
Para la representación geográfica se utiliza el índice de cobertura estandarizada de Papanicolaou (ICE) que compara la cobertura de cada área de salud con el promedio nacional [12]. En términos algebraicos el ICE se representa de la siguiente forma

En la anterior ecuación "wi" es la proporción de cada grupo de edad estudiado con respecto a la población estándar, "papi" representa los Papanicolaou y "ni" es la población del grupo de edad "i" en el AS de estudio, y "PAPi"y"Ni" los correspondientes valores nacionales.
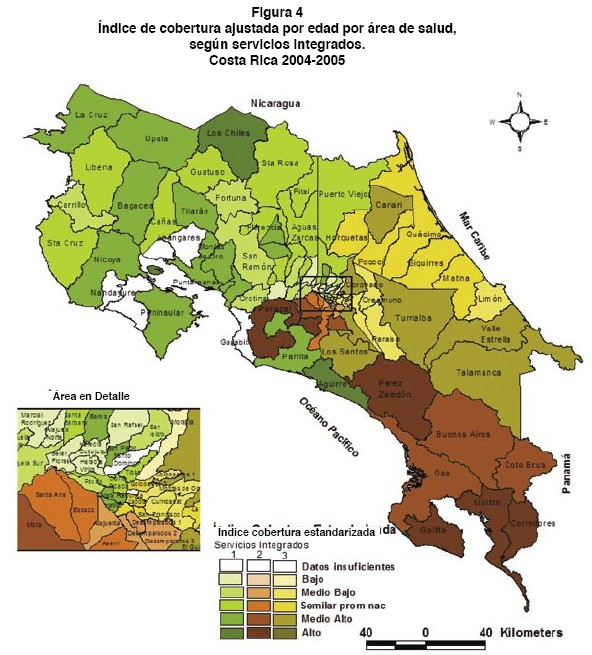
En la representación geográfica del ICE se utiliza como puntos de corte los valores de 70, 90, 110 y 140. Estos valores representan una cobertura de aproximadamente un 40% y un 10% inferior al promedio nacional y un exceso de cobertura del 10% y 40% respecto al promedio nacional, respectivamenteI. Para la clasificación se utiliza una escala cromática de cinco colores correspondiente a la degradación del color asignado a cada servicio integrado; así el color verde corresponde a las áreas de salud del servicio integrado 1, el café para el servicio 2 y el amarillo para el servicio integrado 3. De menor a mayor, los colores más claros corresponde a las áreas de salud cuyo ICE es inferior al promedio nacional y los más oscuros a las áreas de salud con un ICE superior al nacional.
Ajuste para números pequeños
Para solucionar el problema de inestabilidad de las tasas en áreas pequeñas, se calcularon intervalos de confianza y se eliminó del análisis las áreas de salud que registraron una población promedio igual o inferior al percentil 5 en el período 2004-2005. Las áreas de salud excluidas del análisis son Abangares, Catedral Noreste, Colorado, Nandayure, Hojancha y Garabito.
En el cálculo de los intervalos de confianza se utilizó el siguiente modelo:
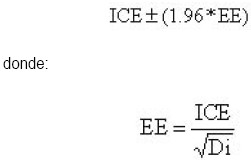
donde:
En las ecuaciones anteriores "1.96" es el valor tabular de una distribución normal con significancia del 5%, "EE" es el error estándar y "Di" son las muertes observadas en cada área de salud.
Los datos se procesaron en los programas Stata versión 8.0 y SPSS 10.0. La representación geográfica se realizó con el sistema de georeferenciación del Proyecto de Investigación en Farmacoeconomía del Centro Centroamericano de Población de la Universidad de Costa Rica, utilizando el paquete de cómputo ArcView GIS 3.3. Este mapa utilizó como base para la georeferenciación el Proyecto Lambert Costa Rica Norte Datum Ocotepeque.
Resultados
En el período 2004-2005 el servicio integrado 2 alcanzó una cobertura de Papanicolaou del 50% de la población meta del país, nivel superior al logrado por los restantes sistemas integrados que rondan el 42%. Estos porcentajes son más bajos en el grupo de 15-34 años que el de 35 años y más (Tabla 1).
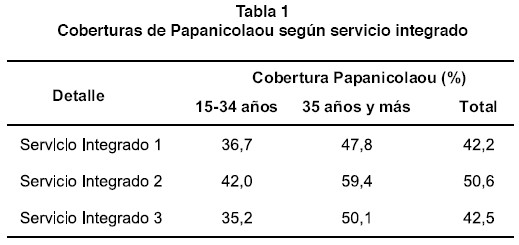
Se presentan diferencias en la variabilidad del porcentaje de cobertura ajustada por edad, tanto a nivel nacional como entre servicios integrados de salud. Se registra una variabilidad baja a nivel nacional (CV=11,3%) y en el tercer servicio integrado (CV=12.9%), pero los servicios integrados 1 y 2 registraron un nivel de variación moderado (coeficiente de variación de 19% y 21% respectivamente). En la Tabla 2, se presentan las principales medidas de variabilidad, según servicio integrado de salud y para el total del país.
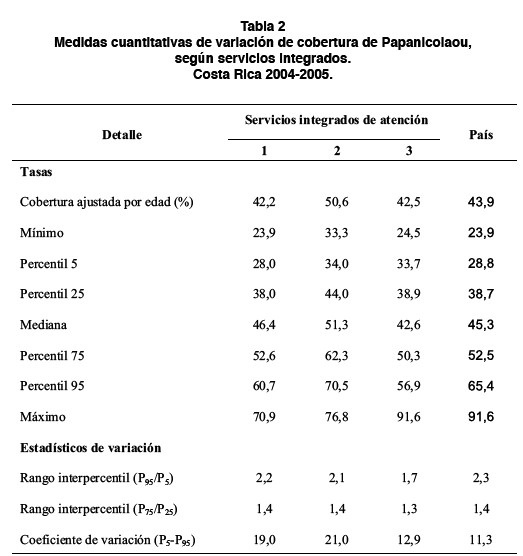
En la figura 1 se muestra una impresión visual de las diferencias del porcentaje de cobertura, según servicios integrados de salud. Se registra una mayor variación en el segundo servicio integrado, donde el área de salud ubicada en el percentil 95 presentó una cobertura 2.1 veces mayor que el área ubicada en el percentil 5.
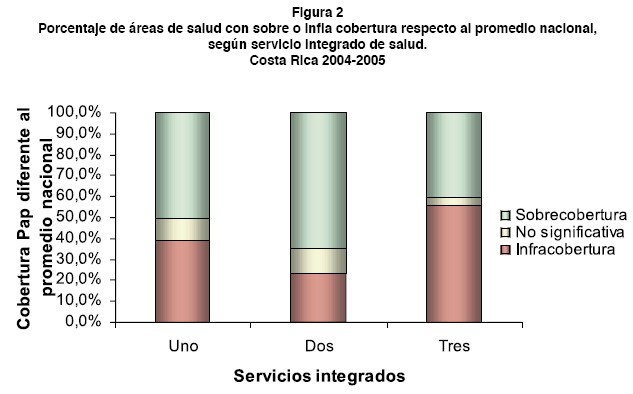
Una agrupación del ICE muestra que el 41% de las áreas de salud presenta porcentajes de cobertura de Papanicolaou inferiores al nivel nacional (infracobertura); un 50% de las áreas registra porcentajes superiores que lo esperado a nivel nacional (sobrecobertura) y el restante 9% presenta niveles de cobertura que no resultaron estadísticamente diferentes al promedio nacional. El mayor porcentaje de áreas con infracobertura la registró el servicio integrado 3 (figura 2).
En la figura 3 se representa la distribución geográfica del ICE de las áreas de salud de cada uno de los tres servicios integrados, en la cual se observa un gran contraste visual ya sea porque la cobertura del Papanicolaou esté por encima o por debajo del promedio nacional. No obstante, en algunos servicios integrados se presenta uniformidad en la intensidad de color, lo que sugiere la posibilidad de patrones de alta o baja cobertura. Tal es el caso de las áreas de salud con baja cobertura (ICE<100%) que se presentan en la zona costera del Caribe, frontera norte con Nicaragua y centro del país.
Discusión
El análisis espacial de la cobertura mostró alta variabilidad geográfica entre áreas de salud; una con
fluencia de áreas de salud con bajas coberturas en las zona noroeste del país y en la costa Atlántica y un patrón bien definido de infracobertura en la región Atlántica (patrón-costa interior), donde un grupo de áreas de salud presentó porcentajes de cobertura inferiores al nivel nacional y esas diferencias fueron estadísticamente significativas.
A lo interno de cada "Sistema de Servicios Integra-dos", y entre ellos, se presenta una alta variabilidad, lo que implica debilidades en la gestión del proceso de detección temprana de la patología cervical. Esta situación mejoraría si se gestionara como un proceso asistencial integrado que implica un proceso continúo de evaluación.
En el planteamiento de estrategias de mejora en el programa de Papanicolaou es importante determinar la influencia de factores individuales (edad, nacionalidad e ingreso, entre otros) y contextuales (acceso a los servicios de salud y disponibilidad de equipo diagnóstico entre otros) sobre la variabilidad en los porcentajes de cobertura entre áreas de salud, pues se ha demostrado que la probabilidad de realizarse un Papanicolaou aumenta conforme se incrementa el nivel educativo y la clase social y disminuye entre las mujeres mayores de 65 años, las solteras y las que tienen menor acceso a los servicios de salud [15-19].
Esto implica que mejorando el proceso de "detección temprana" al abordar los factores condicionantes de las lesiones precancerosas cervicouterina en las mujeres que habitan en las áreas de salud de la región Atlántica, frontera con Panamá y algunas áreas del Pacífico Central del país donde se ha determinado un patrón geográfico de alta mortalidad evitable [20], se podría lograr disminuir la brecha entre áreas, medida con el indicador de mortalidad evitable por cáncer cérvicouterino.
Las expectativas de una reducción de la mortalidad evitable por cáncer de útero se podrían lograr aumentando la cobertura de Papanicolaou desde el nivel actual (50%) hasta el estándar óptimo (85%) recomendado por la norma de atención. Para ello se debería priorizar el aumento de cobertura a partir de los 25 años, ya que el riesgo relativo de morir es 15 veces mayor a partir de esta edad que en el grupo de 15-24 años [20]; y además focalizar el esfuerzo en las áreas de salud con menor cobertura y alta tasa de mortalidad evitable.
Resultan prioritarias ocho áreas de salud que registraron tasas de mortalidad evitable inferiores al promedio nacional y a su vez, poseen un porcentaje de cobertura inferior al promedio nacionalii, a saber:
- Áreas de Salud de Moravia, Cartago, Limón y Guácimo del servicio integrado 3.
- Áreas de Salud de Desamparados 1 y Desampaparados 2 del servicio integrado 2.
- Alajuela oeste y Carrillo del servicio integrado 1.
Como limitaciones de este estudio se tienen la no existencia de información sobre el número de mujeres que se realizan la prueba en los servicios privados de salud y la ausencia de una metodología estadística para suavizar las tasas de coberturas de áreas con tamaños pequeños de población.
Bibliografía
1. Organización Mundial de la Salud. Datos sobre el cáncer. Nota descriptiva N° 297, (febrero 2006). http://www.who.int/ mediacentre/factsheets/fs297/es/print.html [ Links ]
2. Organización Panamericana de la Salud. Situación de salud en las américas: Indicadores básicos 2005. OPS, 2006. http://www.paho.org/spanish/dd/ais/IB-folleto-2005.pdf. [ Links ]
3. Miller AB et al. Report of a workshop of the UICC project on evaluation of screening for cancer. International Journal of Cancer, 1990, 46:76-769. [ Links ]
4. Dzul K, Puerto M, González M. Cáncer cervicouterino: métodos actuales para su detección. Rev Biomed 2004; 15:233-241. [ Links ]
5. Nazzal O, Reinero M, Abarzúa A, Liendo R y Palma C. Patología preinvasora del cerviz. Rev. Chil. Ginecol. 2003; 68(3): 189-196. [ Links ]
6. Novoa Vázquez R. Análisis coste-efectividad del programa de detección sistemática del cáncer cervical en la región de Algarbe Portugal. Rev Esp Salud Pública 2004; 78:341-353. [ Links ]
7. Sasiensi P, Adams J. Effect of screening on cervical cancer mortality in England and Wales. Analysis of trends with an age period cohort model. BMJ 1999; 318:1244-5. [ Links ]
8. Parkin DM, Moss SM. An evaluation of screening policies for cervical cancer in England and Wales using a computer simulation model. J Epidemiol Community Healt 1986; 40: 143-53. [ Links ]
9. Herrero R, Brinton L, Reeves W, Brenes M, De Britton R, Gaitan E, Tinoco F. Screening for Cervical Cancer in Latin America: a case-control study. Int J Epidemiol 1992; 21: 1050-6. [ Links ]
10. Gómez Jáuregui J. Costos y calidad de la prueba de detección oportuna del cáncer cervicouterino en una clínica pública y en una organización no gubernamental. Rev Salud Pública de México 2001; 43:279-288. [ Links ]
11. Ministerio de Salud. Normas y Procedimientos de Atención a la Mujer para la Prevención y Manejo del Cáncer de Cuello de Útero, para el I y II Nivel de Atención y Normas de Laboratorio de Citología. La Gaceta N°43, 2006, pp 1-24. [ Links ]
12. Organización Panamericana de la Salud. La Estandarización: Un Método Epidemiológico Clásico para la Comparación de Tasas. Boletín Epidemiológico, Vol 23, N° 3, setiembre 2002. [ Links ]
13. Peiró, S y Meneu, R Variaciones en la práctica médica: implicaciones para la práctica clínica y la política sanitaria. Gac. Sanit. 1998; 11:55-58. Disponible en: http://db.doyma.es/ cgi-bin/wdcgi.exe/doyma/mrevista.fulltext?pident=13008304 [ Links ]
14. Martínez B, Librero J, Sotoca R. Por el grupo VPM-IRYSS. Necesidad u oferta ¿Qué hay detrás de las variaciones geográficas en la práctica? Atlas Var Pract Med. Sist Nac Salud 2005; 1:5-10.
15. Pujol A, Cabeza E, Esteva M, Thomas V y Sánchez-Contador C. Desigualdades sociales en la realización de prácticas preventivas según la encuesta de salud de Islas Baleares. Gac Sanit 2002; 16(Supl 1):33-132. [ Links ]
16. Trejo Amador U, Granados Cosme JA, Ortiz Hernández L y Delgado Sánchez G. Diferencias sociales en la detección oportuna decáncer cervicouterinoenlas mujerestrabajadoras de una universidad de la Ciudad de México. Rev Esp Salud Pública 2005; 79(3): 403-414. [ Links ]
17. Lazcano Ponce E, Moss S, Cruz Valdez A, Alonso de Ruiz P, Casares Queralt S, Martínez León C y Hernández Ávila M. Factores que determinan la participación en el tamizaje de cáncer cervical en el estado de Morelos. Salud pública de México 1999; 41(4): 278-285. [ Links ]
18. Pham CT, McPhee SJ. Knowledge, attitudes, and practices of breast and cervical cancer screening among Vietnamese women. Journal of Cancer Education 1992; 7(4):305-310. [ Links ]
19. McPhee SJ, Stewart S, Brock KC, Bird JA, Jenkins CNH, Pham GQP. Factors associated with breast and cervical cancer screening among Vietnamese American women. Cancer Detection and Prevention 1997; 21(6):510-521. [ Links ]
20. Morera Salas M y Aparicio Llanos A. Análisis espacial y temporal de mortalidad evitable por cáncer cervicouterino en Costa Rica. AMC. En prensa 2006. [ Links ]
21. Watkins M, Gabali C, Winkleby M., Gaona E, Lebaron S. Barriers to cervical cancer screening in rural Mexico International Journal of Gynecological Cancer 2002; 12(5): 475–479. [ Links ]
i Los dos primeros cortes deberían haberse fijado exactamente en 90.9 y 71.4 para responder a un riesgo de defunción un 10% y un 40% inferior al nacional, pero se redondearon a 90 y 70 respectivamente para facilitar el análisis.
ii Ambos indicadores con significancia estadística al 5% de confianza.














