Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Pediátrica Costarricense
Print version ISSN 1409-0090
Acta pediátr. costarric vol.16 n.3 San José Jan. 2002
El pilar fundamental para desarrollar con éxito un programa de trasplante de órganos es la existencia paralela de un sistema efectivo de generación de órganos. Los avances en las técnicas quirúrgicas y de los cuidados intensivos, y el desarrollo de nuevos fármacos inmunosupresores han hecho posible que un gran número de pacientes pueden recibir un trasplante de órgano, única alternativa terapéutica posible para poder sobrevivir o mejorar en sus condiciones de vida, en todo el mundo. Sin embargo, la escasez de órganos para trasplantes (donantes) constituye hoy día el mayor obstáculo para conseguir su desarrollo completo, a la vez que supone un barrera infranqueable para la generación de estos tratamientos. Todo esto, ha traído como resultado que se intenten poner todos los medios necesarios para detectar a todos los posibles donantes.
Muchos enfermos mueren o deben de continuar recibiendo tratamiento sustitutivo (insuficiencia renal crónica terminal – IRCT), porque la oferta de órganos para trasplante no cubre las necesidades actuales. La mortalidad en lista de espera para corazón, hígado y pulmón oscila entre el 5-30% dependiendo del tipo de órgano. Se dispone de datos que indican claramente que las necesidades de trasplantes son mayores, ya que los profesionales del trasplante se ven obligados a ser muy prácticos y selectivos al decidir que pacientes van a ser incluidos en una lista de espera, dado que no tiene sentido aceptar enfermos sin una esperanza real de encontrar un órgano adecuado.
Como resultado de esta creciente demanda y esta estabilización en el a disponibilidad de órganos, en algunos países se asiste a una creciente proliferación de personas dispuestas a ceder uno de sus riñones a cambio de dinero o alguna otra compensación. Además del innegable problema ético que plantea la venta de órganos y tejidos, existe el problema de la insuficiente garantía de calidad y seguridad de los mismos.
La promoción de la donación altruista de órganos de cadáver es, por tanto, la única solución razonable y realista, al menos hasta que los xenotrasplantes y/o terapia genética sean una realidad. El binomio donación/trasplante es indivisible. Sin embargo, históricamente la segunda parte ha recibido mucha más atención por parte de la sociedad científica, tanto por que se refiere a la investigación como a los recursos invertidos. Afortunadamente, esta situación está empezando a cambiar. Los responsables sanitarios nacionales e internacionales, y diferentes instituciones, también comienzan a demostrar su preocupación por este problema y comienzan a promover diferentes iniciativas, como la recreación de diferentes grupos internacionales de trabajo, en un intento de desarrollar el marco de cooperación necesario entre los profesionales y las Administraciones sanitarias. El coordinador de trasplantes debe ser un profesional de plantilla del centro generador y debe estar disponible las 24 horas del día y todos los días del año. La labor del coordinador de trasplantes en un hospital se centra fundamentalmente en la detección y consecución de los donantes de órganos y tejidos.
La obtención de órganos y tejidos se produce fundamentalmente a través de cuatro tipos de donadores:
Donantes vivos: Este tipo de donantes (de órganos) se emplea para trasplante entre familias y con preferencia entre aquellos genéticamente emparentados
a. Donante de tejidos,
b. Donante de tejidos regenerables: sangre, médula ósea.
c. Donantes de tejido no regenerable. Hueso.
d. Donantes de órganos,
e. Órgano doble: riñón
f. Órganos únicos: (principalmente para receptores infantiles) segmento hepático, segmento pulmonar).
Donantes fallecidos en muerte encefálica (donante a corazón latiente). Se puede obtener órganos y tejidos.
Tejidos obtenidos de donantes cadáver (huesos, córneas, válvulas cardiacas, piel, islotes pancreáticos, segmento vasculares...)
Donantes en muerte encefálica
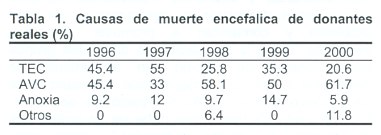
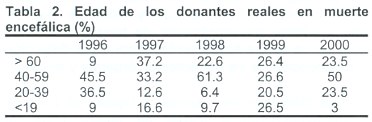
La mayor proporción de donantes procede del grupo de pacientes que fallecen en situación de muerte neurológica (MN), constituyendo aproximadamente el 96-98% del total de donantes. Para conocer el perfil del donante y poder detectarlo adecuadamente es preciso poder dar respuesta a una serie de interrogantes, tales como: ¿Quién es un posible donante? ¿Qué patologías tiene? ¿Dónde suelen estar localizados? ¿Cuántos hay?, Etc. además, necesitamos saber cuál es la tasa de donación potencial en nuestra área de influencia, esto representa el número de personas que fallecen en situación del MN y cuantos de ellos son identificados como potenciales donantes. Debemos considerar como posible donante a todo paciente con patología cerebral grave, cuya situación neurológica se haya deteriorado hasta tal punto que la aparición de ME parezca inevitable. En las tablas 1 y 2 se detallan las causas de la muerte encefálica y la edad de los donantes reales en el Sector 1 de Andalucía (Cádiz).
El proceso donación/ trasplante es complejo y prolongado, y consta de diferentes etapas. El proceso comienza con la detección e identificación de las personas que fallecen en situación ME. Después de una cuidadosa evaluación en busca de cualquier contraindicación que represente un riesgo potencial para el receptor, tenemos el potencial donante identificado.
A. Detección del donante potencial en ME
Esta parte del proceso constituye el paso inicial y probablemente el que resulte más difícil estandarizar. La mejora en la tasa de detección de potenciales pasa por una identificación precoz y una posterior monitorización de todos aquellos pacientes que pueden llegar a ser diagnosticados de ME. Por ello, parece adecuado evaluar a todos los pacientes portadores de lesiones cerebrales graves y que presenten un nivel de conciencia bajo (SGC < 7 puntos). Es necesario además, que mantenga una buena relación con el personal sanitario que trabaja en esas áreas y que establezca con ellos una estrategia clara para conocer inmediatamente todas las sospechas de ME. Diversos estudios realizados muestran que entre el 1-4% de los pacientes realizados muestran que entre el 1-4% de los pacientes que fallecen en un hospital lo hacen en situación de ME; cuando se consideran sólo los fallecidos en Unidades de Cuidados Intensivos (UCI) esta proporción se estima en 14% en la UCIs de hospitales con Servicio de Neurocirugía esta proporción es mucho mayor (hasta un 30%). La incidencia esperada de fallecimientos en situación de ME puede fijarse entre 50-60 personas/año/millón de habitantes. Aunque donantes potenciales, existe circunstancias que produce la pérdida de un número no despreciable de donantes:
i. Contraindicación médica 16-32%
ii. Problemas de mantenimiento del donante 7-9%
iii. Negativa familiar 10-60%
iv. Negativa judicial y otros problemas 5-10%
Así pues, el número de pacientes que fallecen en ME y que llegan a ser donantes reales se sitúa alrededor del 0.5-2% del total de las muertes hospitalarias. Es imprescindible que el Coordinador de trasplantes articule los mecanismos adecuados a su medio hospitalario para detectar por sistema todo paciente que fallezca en situación de ME.
B. Mecanismos de detección de los donantes en ME:
En esencia, la detección de los donantes depende de tres factores fundamentales:
i. La existencia de una persona o personas directamente encargada de la detección y seguimiento de estos enfermos (equipo de coordinación de trasplantes)
ii. La existencia de protocolos que faciliten la detección a identificación de los posibles donantes. Cada coordinador debe establecer el sistema de detección más adecuado a las particularidades de su hospital. En líneas generales, existen varias vías para la detección de los donantes: control diario de los ingresos hospitalarios que procedan del área de urgencias, visita diaria del coordinador a las distintas áreas o unidades en las que puedan estar ingresados los posibles donantes y finalmente, el aviso del personal sanitario de la unidad correspondiente ante la presencia de un paciente en situación de ME.
iii. La colaboración del personal médico y de enfermería que participa en el proceso de la generación y mantenimiento de los posibles donantes. Para que exista esa colaboración y el personal sanitario asuma el proceso de detección como una conducta asistencial habitual el coordinador ha de llevar a cabo una motivación adecuada del personal, sensibilizando a todos los profesionales sobre la necesidad de la donación de órganos para el trasplante.
En cualquier caso la responsabilidad recae en el Coordinador de los ingresos realizados por el servicio de apropiadas según el centro donde desarrolle su trabajo y los mecanismos más ágiles de acceso a la información. En líneas generales y a título orientativo podremos considerar tres vías de detección:
1. Vía administrativa: control por parte del coordinador de los ingresos realizados por el servicio de urgencias, de aquellos pacientes con patologías neuroquirúrgicas graves, así como destino intrahospitalario par su posterior seguimiento.
2. Visita diaria del coordinador a las distintas áreas y unidades especiales en las que pueden estar ingresando un posible donante. Aviso del personal sanitario de las unidades correspondientes a la coordinación de trasplante, ante la presencia de un paciente en situación ME. Control de todos los TACs revisados de urgencias por el servicio de neuroradiología para su valoración. Mediante el desempeño de la labor asistencial del coordinador de trasplante cuando realiza su trabajo en unidades especiales.
3. Relaciones con otros centros (sistemas multihospitalarios): el establecimiento de acuerdos en centros detectores para la colaboración y detección de posibles donantes. En estos casos hay que tener siempre previsto el apoyo logístico necesario; dependerá de la dotación del referido centro, existiendo una estrecha colaboración por parte del hospital de referencia a fin de facilitar el proceso.
A. Evaluación clínica del donante en ME:
Cuando el coordinador detecta la existencia de un paciente en posible situación de ME, debe poner en marcha una exhaustiva colaboración clínica para evaluar su idoneidad como donante una vez conformada la ME. Son pocos los criterios de exclusión absolutos que impiden la donación de órganos (tabla 3).
Se deben desarrollar protocolos estándar para determinar la variabilidad de los órganos y asegurar que no va a haber un riesgo potencial par los receptores de los mismos (transmisión de enfermedades virológicas o neoplásticas). Las características a definir están en constante evolución debido a que los criterios de aceptación de los sonantes se van ampliando, tanto por la experiencia que adquieren los equipos de trasplantes, como por la presión que impone la escasez de órganos, por lo tanto, estos protocolos deben ser suficientemente flexibles para poder admitir la evolución de los cambios en las características de los donantes.



Donantes a corazón parado
Todos los principios que se han ido estableciendo para los donantes en ME pueden ser aplicados para los donantes a corazón parado. Sin embargo hay características especiales de este proceso que hacen necesaria su consideración por separado. La extracción de órganos de donantes a corazón parado fue una práctica habitual durante los años 70 gracias a los trabajos de investigación de García Rinaldi. Posteriormente esta técnica cayó en desuso, dando paso al desarrollo de la extracción de órganos de los donantes a corazón latiente (ME). En la actualidad, como consecuencia de la escasez de órganos, hay in renovado o interés por este tipo de donación, ya que constituye una fuente adicional de órganos y tejidos para trasplante. Algunos autores han apuntado la posibilidad de que este tipo de donantes pueda incrementar un 20% el número de riñones para trasplantes. Donante a corazón parado es aquel donante de órganos y tejidos que sufre un cese irreversible de la actividad cardiaca, siempre que cumpla los requisitos generales para la donación. Los potenciales candidatos a la donación a corazón parado son personas que han sufrido una parada cardiaca como resultado de muerte súbita o politraumátismos antes, en o después de llegar al servicio de urgencias o en la UCIs. Por tanto los posibles donantes a corazón parado son detectados en el área de urgencias o en las unidades de cuidados intensivos. Ante un paciente menos de 50 años en situación de parada cardiaca refractaria y que no tenga ninguna contraindicación para ser donante de órganos, se avisa al equipo de coordinación de cadáver, como posible donante, permanece con masaje cardiaco externo y ventilación asistida, o bien se inicia las maniobras de enfriamiento corporal total o local, según protocolo. En este tipo de donantes se hace necesario aplicar un método de preservación que disminuye el daño de los órganos secundario a la siquemia que sufren en el tiempo que transcurre desde el diagnóstico de muerte hasta la extracción. Tabla 5.
De acuerdo a los criterios adoptados en la conferencia de Maastricht distinguiremos cuatro tipos diferentes de donantes a corazón parado.
- Clase I: admisión en el hospital en parada cardiaca. Sólo se consideran con posibles donantes en caso de saber con exactitud el tiempo que llevan sin latido cardiaco (isquemia caliente).
- Clase II: reanimación cardiopulmunar ineficaz. Pacientes que sufren parada cardiorespiratoria no esperada en los que se inician maniobras de reanimación cardiopulmonar que resultan ineficases.
- Clase III: paciente ingresado en una unidad de cuidados intensivos ( o similar) con enfermedad cardiológica o neurológica irreversible, en los que se decide la suspensión de la medidas de soporte. Esta clase de donante a corazón parado no se contempla en nuestro país.
- Clase IV: donante con diagnóstico de ME, que sufre parada cardiaca antes de proceder a la extracción de los órganos.
En este tipo de donantes se requiere una gran colaboración por parte del personal del servicio de urgencias y de UCI, no sólo para su detección y aviso al personal de coordinación, sino por el apoyo médico- sanitario que se requiere para la práctica de las diferentes acciones que hay que realizar en corto espacio de tiempo.
Detección de donantes de tejidos.
Habitualmente, la mayoría de los tejidos se obtienen de donantes de órganos en ME y en asistolia. Sin embargo, han de establecerse mecanismos de detección para aquellos casos de fallecimientos que no llegan a ser donantes de órganos. Se requiere una gran mentalización por parte del personal sanitario, las vías de detección se pueden establecer:
- Vía administrativa: control diario de todos los exitus ocurridos en sus respectivas unidades.
- Vía asistencial: aviso del personal sanitario de los exitus ocurridos en sus respectivas unidades.
- Vía familiar: en ocasiones es la propia familia la que solicita la donación, el equipo de información que colabora con los familiares en la tramitación de la documentación del fallecido, avisa a la coordinación de trasplantes.
Dependiendo del tejido a donar, habrá que tener en cuenta el periodo de isquemia, a temperatura ambiente este tiempo oscila entre 6 y 12 horas o de 12 a 24 horas si se conserva el cadáver en frigorifico (a 4°C).
Donante vivo
El donante vivo se ha utilizado en el trasplante renal desde los años 50, incluso antes que los de cadáver. En nuestro país el trasplante vivo representa menos el 1% del total de los trasplantes realizados (en nuestro sector, sector I de Andalucía, el trasplante renal de vivo representa el 2% del total). En otros países, con alto nivel de renta y sistemas sanitarios avanzados, la actividad de trasplante renal de vivo es muy significativa (30% en USA, 29% en Canadá, 29% en países escandinavos, 22.5% en Suiza). En países en vías de desarrollo el trasplante renal de vivo se convierte prácticamente en la única alternativa terapéutica frente a la mortalidad de los pacientes con IRCT. En la mayoría de los países del Latinoamérica (con la excepción de Cuba y Uruguay) el trasplante renal de vivo representa más el 50% de total de la actividad.
Hoy día continúa siento motivo de debate la utilización de órganos para trasplantes procedentes de donantes vivos. Diversos aspectos son motivo de controversia, entre ellos: la cantidad y calidad de la información ofrecida a los potenciales donantes, como garantizar la libertad a aceptar o no la donación de los potenciales donantes, los riesgos para el donante, cuestionamiento de los profesionales a infringir una mutilación a una persona sana, etc.
Los cuatro principios básicos de la ética en biomedicina se refiere a:
- Autonomía: la persona elige y actúa libre y racionalmente, es decir, autodeterminación.
- Non-maleficiencia: implica no lesionar o infligir un daño intencionadamente (nefrectomía mortalidad 0,03%).
- Beneficiencia: implica hacer el bien. Este principio sobrepasa el de maleficiencia si la probabilidad de beneficio supera con creces el riesgo de la lesión a infligir.
- Justicia: implica acciones o tratamientos adecuados, equitativos e imparciales hechos por o debidos a las personas (justicia distributiva).
Al objeto de garantizar el mínimo de riesgo al donante es necesario realizar una evaluación de su estado de salud, evaluación que debe abarcar tanto aspectos fisiológicos como psicológicos, y en orden de proteger su principio de autonomía debe ser realizado por profesionales sanitarios independientes de aquellos encargados de cuidar el potencial receptor y de aquellos que integren el equipo de trasplantes. A continuación detallaremos los exámenes y análisis a realizar:
i. Evaluación inicial: historia clínica y examen físico, evaluación psicosocial, estudios analíticos y pruebas complementarias
ii. Estudios adicionales: estudios serológicos y microbiológicos; estudio de la función renal, urografía intravenosa, test de embarazo en mujeres.
iii. Otras pruebas: despistaje de diabetes (en caso de historia familiar o glucemia en ayuno elevada); despistaje de enfermedad cardiaca (en caso de donantes de edad avanzada, sintomáticos o con factores de avanzada, sintomáticos o con factores de riesgo); despistaje de enfermedad pulmonar ( en fumadores)
iv. Tipaje HLA y prueba cruzada.
v. Arteriografía renal.
La donación de vivo es un hecho éticamente aceptable en base a:
i. La nefrectomía en individuos sanos comporta un riesgo muy bajo.
ii. La donación beneficia tanto al donante como al receptor.
iii. La limitada disponibilidad de órganos procedentes de cadáver es una realidad.
iv. La donación voluntaria es un acto moralmente bueno y expresión de la autonomía de las personas.
Actualmente, ya se han realizado trasplantes de segmentos hepáticos de vivos (SPLIT), sobre todo en niños y en otros países también hay experiencia con el implante de segmentos pulmonares procedentes de donantes vivos.
Mantenimiento del donante de órganos
Actualmente, el aumento de la demanda de órganos para trasplante, como único tratamiento eficaz en algunos casos, condiciona el que hoy día el médico no termine su trabajo con el diagnóstico de muerte encefálica (ME) de un paciente. El RD 2070 de 30 de diciembre de 1999 regula las actividades de obtención y utilización clínica de órganos humanos y la coordinación territorial en materia de donación y trasplante de órganos y tejidos.
La exploración clínica de muerte cerebral o encefálica (muerte del troncoencefálico) se basa en la demostración de la ausencia de función, a través del examen clínico de todos los pares craneales, sus núcleos y de la ausencia de consciencia. Es muy importante que la exploración sea sistemática, completa y extremadamente rigurosa, debiendo quedar reflejados todos los datos de la exploración en la historia. Debemos demostrar.
1- Ausencia de reflejo fotomotor.
2- Ausencia de reflejo craneal.
3- Ausencia de movimientos faciales.
4- Ausencia de movimientos musculares espontáneos o provocados.
5- Ausencia de reflejos oculocefálicos.
6- Ausencia de reflejos oculovestibulares.
7- Ausencia de reflejo tusígeno y nauseoso.
8- Test de la atropina negativo.
9- Ausencia de respiración espontánea.
Antes debemos comprobar la ausencia de fármacos que pueden alterar la respuesta como: sedantes, relajantes, hipotermia, ototóxicos, drogas anticolinérgicas de uso tópico etc. además de la exploración clínica, pueden ser utilizadas las siguientes pruebas complementarias:
1- Pruebas que evalúan la función neuronal.
a. Electroencefalografía
b. Potenciales evocados.
2- Pruebas que evalúan el flujo sanguíneo cerebral:
a. Arteriografía de los 4 vasos.
b. Arteriografía cerebral por sustracción digital.
c. Angiogammagrafía cerebral con radiofármacos capaces de atravesar la barrera hematoencefafálica intacta.
d. Sonografía doppler transcraneal.
Una vez realizado el diagnóstico de ME y por tanto la perdida de las funciones del encéfalo, se van a producir una serie de alteraciones fisiopatológiocas que producen a la parada cardiaca en un plazo de cuarenta y ocho a setenta y dos hora, si no se realiza un tratamiento adecuado. El donante de órganos requiere un control médico y de enfermería muy estrecho. Los problemas más frecuentes que presenta el mantenimiento y manejo del cadáver donante de órganos derivan fundamentalmente de la abolición de la función encefálica, por tanto más que complicaciones constituyen características del donante de órganos.
La actitud terapéutica en el mantenimiento del donante potencial viene determinando por las alteraciones secundarias a la muerte encefálica:
1- Ausencia de respiración espontánea.
2- Shock neurogénico por la perdida de la regulación vasomotora.
3- Alteraciones en la secreción hormonal junto a alteraciones hidroelectroliticas.
4- Perdida del control de la temperatura corporal.
Todas estas alteraciones convierten al donante multiorgánico en un paciente crítico. El mantenimiento y el manejo del cadáver donante de órganos implica el diagnóstico precoz del estado de muerte encefálica, la evaluación rápida del cadáver como donante, el correcto mantenimiento del estado fisiológico así como agilidad en la organización, proceso de distribución y extracción de órganos.
Un incorrecto mantenimiento y manejo del cadáver potencial donante de órganos en una de las causas más importantes de perdidas de donantes y es la primera causa de disfunción primaria del órgano trasplantado. De otro lado el correcto mantenimiento y manejo del donante, reduce a cero la aparición de asistolia durante la fase de mantenimiento e incrementa la viabilidad de los órganos a trasplantar.
Los objetivos fundamentales en el mantenimiento del donante son: conseguir una estabilidad hemodinámica y oxigenación adecuada, así como la correción de la hipotermia, la diabetes insípida y las alteraciones hidroelectroliticas, para ello debemos intentar conseguir:
1- Frecuencia cardiaca alrededor de 100 spm.
2- TAS mayor de 95 mmHg.
3- PVC: 10-12 cm H2O
4- PCP: 8-14 mmHg.
5- Diuresis mayor de 1mi/kg/h en adultos y mayor de 2ml/kg en niños.
6- Temperatura superior a 35ºC.
7- Gasometría arterial: pH: 7.35 – 7.45., PaO2 mayor de 90 mmHg y PaCO2 entre 35 t 45 mmHg.
8- Hematocrito superior a 30 por 100 8si el donante es multiorgánico igual o superior a 35 por 100).
Mantenimiento clínico del donante
Monitorización de las constantes vitales.
1- Electrocardiograma continuo.
2- Tensión arterial
3- Presión venosa central.
4- Diuresis
5- Gasometría arterial.
6- Pulsioximetria continual
7- Temperatura
8- Cateterismo derecho mediante Swan-Ganz (según estabilidad hemodinámica y situación clínica del donante).
El donante de órganos es un cadáver al que debemos mantener hemodinámica y ventilatoriamente de forma artificial. La destrucción del encéfalo determina la perdida absoluta de la hemostasia del donante, por lo cual requieren un control muy estrecho y una monitorización casi continua de sus diferentes constantes fisiológicas.
Todos los donantes deben tener monitorización cardiaca continua, saturación arterial de órganos, presión arterial, para el registro continuo de la monitorización de la presión venoso central para la monitorización de la presión venosa central (PVC), sonda uninaria para registro continuo de la diuresis. La temperatura central set debe medir, al menos de forma horaria, si no se puede monitorizar de forma continua, debemos en ocasiones utilizar termómetros calibrados para registrar temperaturas por debajo de 35°C. La utilización del catéter de Swan-Ganz no es necesario, salvo en determinadas circunstancias.
Debemos monitorizar periódicamente los parámetros sanguíneos: hematocrito, glucosa, urea, creatinina, sodio, potasio, gases arteriales, equilibrio ácido – base, etc.
Hemodinámica
El objetivo fundamental, es conseguir una establidad hemodinámica que permita una adecuada perfusión de los órganos que posteriormente van a ser trasplantados. Los trastornos hemodinámicos en el donantte cadáver aparecen en ocasiones antes de producirse la ME, relacionados con la isquémia cerebral y la hipertensión intracraneal. Es frecuente la crisis hipertensiva durante el proceso de enclavamiento que se acompaña con la liberación de catecolaminas. Eso puede producir microinfartos vasculares con especial importancia sobre el corazón, que debe ser tenido en cuenta a la hora de la extracción o no del corazón para trasplante.
Otras complicaciones que se producen en la fase de enclavamiento son las bradiarritmias transitorias que se acompañan a la respuesta hipertensiva (reflejo de Cushing). Estas bradiarritmias se pueden acompañar de hipotensión severa incluso asistólica. No debemos olvidar que al atropina es ineficaz en estos casados y los fármacos de elección son la adrenalina y el sioproterenol.
Una vez producida la herniación completa del encéfalo se produce la destrucción de los centros vasomotores pontinos y medulares. La hopotensión arterial es la alteración hemodinámica más frecuente y tiene un origen mulsifactorial, estando algunas ocasiones en relación con la situación y el tratamiento del paciente antes de producirse la muerte la muerte encefálica. La destrucción del centro vasomotor (shock neurogénico) con vasodilatación y disminución de las resistencias vasculares, la presencia de la diabetes mellitus o insípida, la poliuria osmótica por hiperglucemia si existió administración de diuréticos y sustancias hipersmolares para el tratamiento del edema cerebral. El deterioro de la función miocárdica por contunsión miocárdica o microinfartos, la hipovolemia en donantes politraumatizados debido a las pérdidas sanguíneas y la hiportermia. Todos pueden ser factores de la parición de la hipotensión arterial. Se ha demostrado que el factor más importante relacionada con la viabilidad y funcionamiento de un órgano trasplantado es la presión de perfusión. Así la incidencia de necrosis tubular aguda postrasplante se incrementa de forma importante cuando la presión arterial sistólica (PAS) de donantes es < 90 mmHg. Por tanto es muy importante mantener una PAS entre 100-120 mmHg.
La administración de fluidos en forma de colides o cristaloides es la primera medida terapéutica en el tratamiento de la hipotensión. Las perdidas sanguíneas deben ser remplazadas con concentrados de hematíes para mantener un hematocrito del 30% y una hemoglobina superior a 10 mg/dl. La reposición de fluidos debemos realizarla bajo un control estricto de la PVC o de la PCP. La utilización de un catéter de Swan-Ganz estaría indicada en aquellos donantes que se encuentren inestables a pesar de tener una volemia adecuada y requieran dosis altas de inotropos. Dependiendo de la situación hidroelectolítica del donante utilizaremos cristaloides (Fsiológico, Ringer, Glucosalino) o coloides. Las soluciones de glucosa isotónicas no están indicadas generalmente, pues pueden provocar hiponatremia e hiperglucemia. Estas soluciones se deben utilizar para remplazar las perdidas urinarias que origina la diabetes insípida o cuando existe hipernatremia. Las soluciones de cristaloides ricas en sodio, en pacientes con osmolaridad aumentada por la restricción hídrica, pueden ocasionar la aparición de una hipermatremia, para evitar la sobrecarga cardiaca, la aparición de edema pulmonar, hipoxemia y por tanto el deterioro de los órganos para trasplante.
Una vez conseguida una PVC o PCP adecuada, si el donante continua hipotenso, debemos iniciar dopamina en dosis crecientes sin sobrepasar los 10mcg/Kg/min, pueden ser utilizados en aquellos donantes politraumatizados que presentan confusión miocárdica, sin embargo no debemos olvidar su efecto vasodilatador sistémico. Su asociación con la dopamina nos permitirá en ocasiones reducir la dosis de esta. La noradrenalina un potente vasoconstrictor solo debe ser utilizado en aquellos donantes muy inestables, a pesar de tener una volemia adecuada y dosis elevadas de dopamina, la dosis de 0.14 mcg/kg/min. Esas drogas alfa-estimulantes deben ser utilizadas el menor tiempo posible, su utilización nos obligan a vigilar estrechamente los órganos y debe ser comunicado a los equipos quirúrgicos. El donante que requiere de perfusión de adrenalina para su estabilidad hemodinámica debe pasar lo antes posible a quirófano para proceder a la extracción de órganos.
La vasopresina a dosis presoras (1-2 unidades/horas), cuando se utiliza con otras catecolaminas, consigue un mantenimiento adecuado por aumento de las resistencias vasculares sistémicas. La hipotensión no debe considerarse de forma aislada, ya que puede existir una vasodilatación global y una buena perfusión tisular. Una diuresis superior a 10 ml/h, además de otros parámetros hemodinámicos adecuados, pueden ser la mejor guía de que existe una adecuada perfusión tisular. Si durante el mantenimiento aparece la parada cardiaca debemos realizar maniobras de reanimación cardiopulomar.
Arritmias
Los pacientes en muerte cerebral pueden presentar arritmias tanto supraventriculares como ventriculares, así como diferentes grados de bloqueo A-V. La etiología de las arritmias es multifactorial (hipotermia, hipovolemia, administración de catecolaminas, alteraciones hidroelectroliticas, etc) siempre debemos intentar corregir estas causas para evitar la aparición. La bradicardia es debida a la falta de transmisión de estímulos simpáticos. La destrucción del núcleo ambiguo del tronco cerebral produce una abolición del tono vagal resistente al tratamiento con parasimpaticoliticios (atropina), por tanto su la bradicardia esta asociada a inestabilidad hemodinámica debemos utilizar dopamina a dosis menores de 10 mcg/kg, si no fuera eficaz, se puede iniciar a de adrenalina. Las arritmias supra y ventriculares, deben ser trastadas según su etiología, y si no son controladas utilizaremos fármacos antiarritmicos como al amiodarona, de elección en las arritmias supraventriculafres y la lidocaina para las ventriculares.
Soporte respiratorio.
Al no existir respiración espontánea es necesario la ventilación mecánica controlada, por lo tanto utilizaremos un volumen tidal de 10 ml/kg, y una FiO2 necesaria para conseguir saturaciones de oxigeno y del gasto cardiaco, por tanto, para mantener una oxigenación óptima es necesario corregir los valores de la hemoglobina y gasto cardiaco. Si utilizamos PEEP, debemos tener en cuenta la posibilidad del descenso de la tensión arterial ya que la PEEP incrementa la presión intratorácica media, provocando un descenso del retorno venoso, del gasto cardiaco y por tanto e la perfusión de los órganos. En los pacientes en muerte cerebral al no existir tono muscular ni metabolismo cerebral y además presentar hipotermia, la producción de CO2 es baja por lo que es frecuente observar hipocapnia. Las aspiraciones encotraqueales así como el resto de las maniobras invasivas deben realizarse siempre con la máxima asepsia para reducir el riesgo de las infecciones.
Alteraciones metabólicas
La presencia de poliuria secundaria a la presencia de la diabetes insípida neurogénica determina cambios en la volemia y alteraciones electrolíticas, siendo, muy frecuente observar hipermatrenmia, hipopotasemia, hipomagnesemia, hipocalcemia e hipofosfatemia. Por lo tanto debemos realizar ionogramas cada 4 horas y determinar las perdidas urinarias para efectuar una reposición adecuada y evitar la aparición de arritmias que pudieran provocar una inestabilidad cardiovascular.
En el donante de órganos la hiperglucemia es frecuente y puede ser debida a la reanimación con líquidos que contiene dextrosa, liberación de catecolaminas, utilización de corticiodes previo al diagnóstico de muerte cerebral, hiportermia y administración de drogas inotropas en el tratamiento de la hipotensión. Las principales consecuencias de la hiperglucemia son la acidosis metabólica, la cetosis, la hipersormolaridad del medio extracelular que conduce a deshidratación y a cambios electrolíticos intracelulares y, por otro lado, la hiperglucemia produce poliuria por diuresis osmótica con pérdidas urinarias de agua y electrolitos contribuyendo a la hipovolemia y por tanto a la inestabilidad hemodinámica. Debemos iniciar tratamiento con insulina rápida intravenosa en perfusión continua para mantener la glucemia entre 150 y 200 mg/dl.
La aparición de hipopotasemia puede ser debido a un aporte inadecuado, alcalosis metabólica, tratamiento con insulina o aumento de las perdidas. Su tratamiento esta basado en el aporte de potasio en las soluciones de perfusión. La hiperpotasemia puede ser debido a un aporte inadecuado, destrucción tisular (politraumatizados, etc.), etiológico, además de la utilización de gluconato cálcico, bicarbonato y de la administración de glucosa con insulina. La hipernatremia tienen un origen multifactorial: aporte inadecuado, hipovolemia y diabetes insípida. La hipermatremia puede originar daño hepático. El tratamiento esta basado en la administración de soluciones glucosadas hasta su normalización. La hiponatramia puede ser producida por un aporte inadecuado, aumento de las perdidas digestivas (SNG) o renales (diuréticos, hiperglucemia) o fallo renal entre otras. La restricción hídrica, la restauración de la osmolaridad con suero salino isitónico forma parte del tratamiento.
Cuando se asocia la existencia de hipopotasemia, hipomagnesemia e hipofosfatemia, la administración en 500ml de suero glucosalino de una ampolla de sulmetin (cada ampolla contiene 1.5 fr de sulfato de magnesio en 10ml de H2=), una ampolla de fosfato monopotasio y 20-30 mEq de CLK a pasar de 6-8 horas puede ser un tratamiento adecuado.
Hipotermia
Al desaparecer la función del centro termorregulador del hipotálamo, se produce una hipotermia progresiva, que si no se controla, puede llegar a provocar graves complicaciones. La hipotermia altera la actividad enzimática, lo que determina una disminución en el metabolismo de determinados fármacos, vasocontricción progresiva, alteraciones en la bomba sodio potasio, alteraciones de la función renal con disminución del filtrato glomerular y de la capacidad para mantener los gradientes de concentración tubular ("cold diuresis"), alteraciones de la coagulación, desplazamiento hacia la izquierda de la curva de disociación de la hemoglobina reduciendo la liberación de oxígeno, etc. la presencia de arritmias cardiacas y asitolia está favorecida por la hipotermia. Todas estas alteraciones afectan a la estabilidad hemodinámica.
La mayoría de los donantes requieren medidas externas para elevar la temperatura por encima de 35°C. la primera medida es la utilización sistemáticamente mantas aislantes en pacientes con Glasgow < de 5p.
Según las necesidades, a la manta eléctrica se pueden añadir otras medidas de apoyo: manta de aluminio para evitar la perdida de calor, foco térmico e incluso, calentar los líquidos de infusión y el oxígeno insufaldo entre 40 y 46°C. cunado existen arritmias cardiacas graves con la aparición de asistolia, además de la reanimación cardiopulmonar avanzada, es de gran utilidad el tosilato de bretillo en dosis de 500mg en bolo intravenoso, pudiendo repetir la dosis 2-3 minutos después si no hubo respuesta.
Alteraciones hematológicas
Su origen puede ser debido a graves perdidas sanguíneas (politraumatizados), transfusiones previas con sangre citrada, hipotermia y a la continua liberación de grandes cantidades de agentes fibrionolíticos del tejido, isquémico-necrótico (tromboplastina). Podemos encontrar desde anomalías inespecíficas hasta cuadros de coagulación intravascular diseminada. El tratamiento se realizará mediante la administración de plasma y plaquetas, así como concentrados de hermatíes si el hemoatocrito es inferior al 30 por 100 de los donantes renales o al 35 por 100 si el donante es multiorgánico.
Alteraciones hormonales
La aparición de diabetes insípida (DI) en el donante cadáver es debido al déficit de producción en los núcleos hipotalámicos o de su liberación a nivel del lóbulo posterior de la hipófisis de hormona antidurética (ADH). Su presentación según las series oscila entre el 9% y el 87%. El diagnóstico incluye una diuresis superior a 4ml/kg/h, hipermatremia y densidad urinaria inferior a 1.005 (osmolaridad urinaria menor guíneas (politraumatizaados) transfusiones previas con sangre citrada, hipotermia y a la continua liberación de grandes cantidades de agentes fibrinolíticos del tejido, isquémico-necrótico (tromboplastina). Podemos encontrar desde anomalías inespecíficas hasta cuadros de coagulación intravascular diseminada. El tratamiento se realizará mediante la administración de plasma y plaquetas, así como concentrados de hematíes si el hemoatocrito es inferior al 30 por 100 de los donantes renales o al 35 por 100 si el donante es multiorgánico.
Alteraciones hormonales
La aparición de diabetes insípida (DI) en el donante cadáver es debido al déficit de producción en los núcleos hipotalámicos o de su liberación a nivel del lóbulo posterior de la hipófisis de hormona antidurética (ADH). Su presentación según las series oscila entre 9% y 87%. El diagnóstico incluye una diuresis superior a 4ml/kg/h, hipermatremia y densidad urinaria inferior a 1.005 (osmolaridad urinaria menor de 300 miliosmoles/kg) y osmolaridad plastmática superior a 300 miliosmoles/kg. Estas alteraciones hidroelectrolíticas pueden contribuir o desencadenar inestabilidad hemodinámica, por lo que su diagnóstico y su tratamiento debe realizarse precozmente. Las perdidas urinarias deben ser remplazadas cada hora. El tipo de fluido administrativo dependerá de las concentraciones de los iones en sangre a 5-7ml/kg y persisten las alteraciones hidrolectricas el tratamiento con vasopresina o análogas debe iniciarse.
Iniciaremos el tratamiento con vasopresina intravenosa a dosis de 1-2 unidades em perfusión continua, incrementando la dosis para conseguir una diuresis entre 100-200ml/h. El inconveniente de la vasopresión es su importante efecto vasocontrictor, aumentando la tensión arterial y pudiendo producir isquemia en los órganos a trasplantar fundamentalmente el corazón. La desmopresina o d-DAVP es el tratamiento de elección actualmente de la diabetes insípida neurogénica. Tiene un efecto antidiurético potente y mínimo presor. Posee una acción 3-5 veces más duraderas que la hormona nativa. Puede administrarse por vía intranasal, sublingual, oral, intramuscular, siendo la vía intravenosa la más utilizada en el donante cadáver. La relación entre vasopresina y desmopresina con respecto al cociente efecto antidiurético/efecto presor es la siguiente: la vasopresina 1:1 y la desmopresina 2.000:1. Dada es mínimo efecto vasoactivo de la desmopresina, ha sido recomendada para el tratamiento de la diabetes insípida en los donantes de tratamiento de la diabetes insípida en los donantes de órganos ya que no produce isquémia. La dosis de desmopresina (Minirin, un vial contiene 4mcg en 1ml de agua) en la muerte cerebral oscila entre 0.03-0.15 mcg/kg para mantener una diuresis entre 2-3 mk/kg/h. La perfusión continua permite la suspensión de su efecto al detener la perfusión.
Las complicaciones descritas con el uso de la desmopresina son intoxicaciones hídricas con hiponatermias severas. Además de la utilización de estos fármacos en el tratamiento de la diabetes insípida, no debemos olvidar nunca la reposición horaria del volumen y electrolitos perdidos por la diuresis. La existencia de algunos estudios publicados en cuanto a la utilización de T3 en el mantenimiento hemodinámico del donante con rsultados dispares, junto con el hecho de que no existe una correlcación entre los valores de T3 y la necesidad de inotropos y estabilidad hemodinámica del donante, justifica el que en la actualidad no se recomiende de forma generalizada en tratamiento hormonal sustitutorio en los donantes en muerte cerebral.
Oliguria
Si el donante se encuentra oligúrico, diureses < 0.5 ml/kg/h a pesar de mantener un a presión arterial y PVC adecuadasdque garanticen una adecuada presión de perfusión. Si la volemia es adecuada, será necesario administrar diurético. Los más frecuentemente utilizados son la furosemida (Seguril) a dosis entre 20-60 mg intravenoso y el manitol a dosis de 0.25-0.50g/kg.
Antibióticos
Los antibióticos se administrarán específicamente ante una infección documentada o empíricamente ante la sospecha de una infección. Debemos evitar siempre los antibióticos nefrotóxicos. Cuando exista signos clínicos de infección en un donante debemos tomar cultivos antes de instaurar el tratamiento de antibióticos.
Debemos conocer que la existencia de una infección respiratoria y/o urinaria perfectamente documentada (cultivo), no complicada (sépsis, shock, séptico), y con tratamiento antibiótico adecuado instaurado antes de la extracción, no contraindica la extracción de los órganos para trasplante. El diagnostico de muerte cerebral junto a un adecuado mantenimiento del donante, ha permitido en los últimos años que el número de personas en espera de un trasplante, junto a una escasa morbimortalidad del receptor.
Referencias
Valero R, Cabre CA, Mañalich M, García - Fages LC. Mantenimiento del donante de órganos. Rev Esp Anestesiol Reanim, 1992; 39:293-300.
Darby Jm Stein K, Grenvik A, Stuart SA. Approach to management of the hearbeating "brain dead" organ donor. JAMA 1989; 261: 2222-2228.
Debelak L, Pollk R, Reckard C. Arginine vasoprsin versus desmopresin for the treatment of diabetes isipidus in the brain dead organ donor. Transplant Poc 1990; 22: 351-352 [ Links ]
Bodenham A, Park GR. Care of the multiple organ donor. Intesive care Med 1989; 15: 340-348. [ Links ]
Wight C, Cohem B, Shortage of organs for transplantion. Crisis measures must include better detection and maintainence of donors. BMJ 1996; 312: 989:990. [ Links ]
(1) Coordinador Sectorial de trasplantes: Hospital universitario Puerta del Mar. Cádiz.
(2) Medido Adjunto Servicio Medina Intensiva, Coordinador Sectorial de Trasplantes, Hospital Universitario Reina Sofía, Córdoba, España.













