Introducción
La enfermedad arterial periférica (EAP) comprende un rango de síndromes arteriales no coronarios que son causados por la alteración en la estructura y función de las arterias a nivel de la circulación no coronaria. Muchos son los procesos fisiopatológicos que pueden contribuir a la formación de oclusiones en la circulación arterial no coronaria, sin embargo la ateroesclerosis continua siendo la principal causa que afecta la aorta y sus diferentes ramas (1).
Muchos estudios han demostrado el incremento en el riesgo de mortalidad y morbilidad cardiovascular (CV) en pacientes con enfermedad arterial periférica en miembros inferiores. Un índice tobillo-brazo (ABI)  0,90 se asocia con más del doble de tasas de eventos coronarios, mortalidad por eventos CV y mortalidad total a 10 años. Después de 5 años, el 20por ciento de los pacientes con claudicación intermitente (CI) presentan infarto de miocardio (IM) o ictus y la mortalidad es de 10 a 15por ciento. (2-3). El diagnóstico temprano y adecuado manejo de esta enfermedad son relevantes para minimizar sus complicaciones.
0,90 se asocia con más del doble de tasas de eventos coronarios, mortalidad por eventos CV y mortalidad total a 10 años. Después de 5 años, el 20por ciento de los pacientes con claudicación intermitente (CI) presentan infarto de miocardio (IM) o ictus y la mortalidad es de 10 a 15por ciento. (2-3). El diagnóstico temprano y adecuado manejo de esta enfermedad son relevantes para minimizar sus complicaciones.
El presente trabajo consistió en una revisión bibliográfica descriptiva para brindar información sobre factores de riesgo, presentación clínica, diagnóstico y manejo de la enfermedad arterial periférica de causa ateroesclerótica en miembros inferiores. Esta revisión bibliográfica fue elaborada a partir de información consultada en diferentes bases de datos disponibles BioScientifica, Clinical Key, Clinical Science y PubMed.
Fisiopatología
EAP se refiere al conjunto de cuadros sindrómicos, agudos o crónicos, que son producidos generalmente por la presencia de una oclusión a nivel arterial, que conlleva a un flujo sanguíneo insuficiente en las extremidades. En la gran mayoría de los casos, el proceso patológico subyacente es la acumulación de material lípidico y fibroso entre las capas de la arteria que produce estrechez en el lumen del vaso. Existen muchos factores involucrados en el desarrollo de la ateroesclerosis (4).
El endotelio forma una interfase biológica entre la sangre y el resto de los tejidos. Tiene además propiedades de resistencia trombótica, regulación del tono, crecimiento y hemostasia. La disfunción en el endotelio, principalmente la pérdida de liberación de Óxido Nítrico es el paso inicial en el desarrollo de la ateroesclerosis (5). El óxido nítrico es un vasodilatador que además reduce la adhesión de los leucocitos al endotelio. A nivel de transcripción, interfiere con la vía de señalización del factor nuclear kappa B, inhibiendo la expresión del gen de la molécula de adhesión de la célula vascular 1 (VCAM-1) en las células endoteliales. Cuando el flujo sanguíneo es laminar se aumentan las concentraciones locales de óxido nítrico, potenciando así sus acciones antiinflamatorias y vasodilatadoras. Por el contrario, el flujo turbulento, atenúa su actividad antiinflamatoria (6). La inflamación también cumple un papel central en el desarrollo de la ateroesclerosis (4).Se ha observado evidencia de inflamación en las lesiones ateroscleróticas desde las primeras observaciones histológicas. Se desarrolla simultáneamente con la acumulación de LDL mínimamente oxidado en la pared arterial. La célula endotelial expresa varias moléculas de adhesión, incluidas las selectinas P y E y VCAM-1, que se unen a los leucocitos circulantes (7).
Después de la adherencia de los leucocitos, las quimioquinas quimioatrayentes potencian la migración de las células a la íntima. Esto conduce a la acumulación de macrófagos inflamatorios y células T dentro de la pared arterial. Estos leucocitos activados liberan enzimas proteolíticas y una variedad de factores de crecimiento peptídicos y citoquinas que degradan las proteínas de la matriz y estimulan las células musculares lisas, las células endoteliales y los macrófagos.
Las células en espuma se agregan como resultado de la acumulación de macrófagos de LDL oxidadas (8). Estás células son la etapa más temprana en la formación de la estría grasa. El aumento de la acumulación de células de espuma en la íntima transforma la estría grasa en una placa más avanzada, la cual se vuelve cada vez más fibrosa a medida que las células musculares lisas se acumulan dentro de la lesión y elaboran macromoléculas extracelulares que forman una matriz fibrosa. El calcio se acumula en el ateroma progresivo con la expresión de las células del músculo liso vascular de las proteínas involucradas en la osteogénesis (8). De esta forma la acumulación de estos materiales en las arterias de los miembros inferiores produce una estrechez que progresa hasta desarrollar insuficiencia arterial.
Factores de riesgo
Los factores de riesgo para EAP son similiares a aquellos que promueven el desarrollo de la ateroesclerosis coronaria:
Edad: La prevalencia de la CI se ha estimado que incrementa de aproximadamente un 3por ciento en pacientes a los 40 años a un 6por ciento en pacientes de 60 años (9).
Género masculino: La prevalencia de la EAP, sintomática o asintomática es mayor en hombres que en mujeres, principalmente en los grupos más jóvenes. En pacientes con CI la relación de hombres a mujeres es entre 1:1 y 2:1, esta incrementa en algunos estudios al menos a 3:1en estadios más avanzados como isquemia crítica de miembros inferiores (9).
Raza negra: The National Health and Nutrition Examination Survey en los Estados Unidos encontró que un ABI
 0.90 era más frecuente en negros no hispánicos (7.8por ciento) que en blancos (4.4por ciento) (9).
0.90 era más frecuente en negros no hispánicos (7.8por ciento) que en blancos (4.4por ciento) (9).Tabaquismo: Es el factor de riesgo con mayor correlación con el inicio y la progresión de EAP. Los fumadores tienen de 1.7 a 5.6 veces más probabilidades de desarrollar la enfermedad comparado con los no fumadores (10). La severidad de la EAP tiende a incrementar con el número de cigarrillos fumados (4).
Dislipidemia: En el estudio de Framinghan un nivel de colesterol en ayunas mayor de 7 mmol/L (270mg/dL) se asoció con una duplicación de incidencia de CI (11). Anormalidades en otros componentes del perfil lipídico como LDL elevada, disminución de HDL e hipertrigliceridemia han sido también asociadas con la progresión y las complicaciones sistémicas de EAP (12).
Diabetes: Muchos estudios han demostrado la asociación entre la Diabetes Mellitus y el desarrollo de EAP. La CI es aproximadamente el doble de frecuente en pacientes diabéticos que en los no diabéticos (13). Existe además un mayor riesgo de enfermedad CV, incluida la EAP, en los pacientes con diabetes más grave por el aumento de la hemoglobina glicosilada, la duración de la diabetes y el uso de insulina (14).
Hiperhomocisteinemía Se ha reportado la presencia de hiperhomocisteinemía en alrededor de 30por ciento de los pacientes jóvenes con EAP. La hiperhomocisteinemía como factor de riesgo independiente para ateroesclerosis se ha confirmado en la actualidad por muchos estudios (11).
Presentaciones clínicas
Los pacientes con EAP en algunas ocasiones no presentan ninguna sintomatología, las manifestaciones clínicas aparecen cuando el flujo sanguíneo disminuye en un grupo muscular, debido a la progresión del estrechamiento en el lumen arterial y este no es suficiente para satisfacer los requerimientos metabólicos (1).
Asintomático: Dentro de los pacientes asintomáticos, la enfermedad ateroesclerótica de las arterias iliaca y femoral es la más prevalente (15). Detectar la presencia de EAP asintomática es de gran valor por el riesgo de presentar ateroesclerosis en otros sitios, además de que el paciente se verá beneficiado de terapia médica que reduzca el riesgo de infarto de miocardio, enfermedad cerebrovascular y muerte (16).
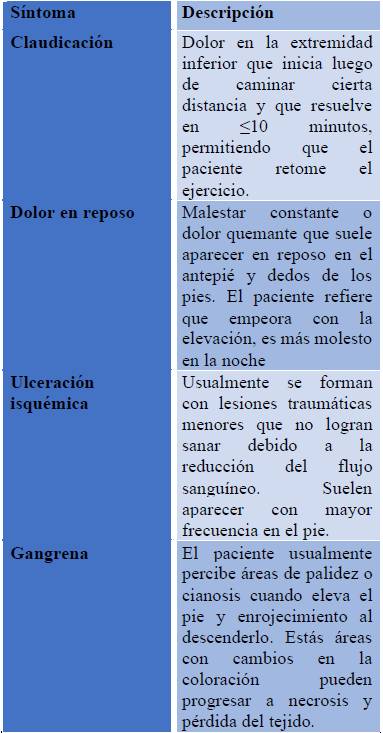
Claudicación Intermitente: Claudicación es el malestar reproducible en un grupo muscular específico, inducido por el ejercicio y que alivia con el reposo. Los síntomas típicamente se localizan en el grupo muscular distal al sitio de la oclusión arterial (1).
Isquemia crítica de miembros inferiores: Isquemia crítica de la extremidad se define como dolor en la extremidad que ocurre en reposo. Este término implica cronicidad y debe ser utilizado para todos los pacientes con dolor isquémico en reposo, diversos grados de pérdida tisular, úlceras y gangrena atribuibles a enfermedad oclusiva arterial, demostrado de forma objetiva (1)
Diagnóstico
Historia Clínica: El diagnóstico de EAP oclusiva inicia con una adecuada historia clínica que incluya la evaluación de factores de riesgo y comorbilidades, así como una revisión de los síntomas relacionados causados por la disminución del flujo sanguíneo, que es inadecuado para satisfacer las demandas metabólicas. Los mismos se describen en la Tabla No. 1 (18).
Estilo de vida, patrones dietéticos y actividad física debe ser interrogado. La historia familiar debe incluir enfermedad arterial coronaria, enfermedad cerebrovascular, aneurisma aórtico, así como enfermedad arterial periférica de miembros inferiores (17).
Examen Físico: Se deben registran los signos vitales y notar si hay alguna anormalidad presente. Los pacientes con EAP en la exploración comúnmente pueden presentar disminución o ausencia de pulsos por debajo del nivel de la estenosis arterial. Esta exploración puede revelar además la presencia de heridas, como úlceras, sin sanar en el área de disminución de la perfusión. Se debe examinar también por la presencia de cambios en las uñas o coloración de la piel, además de un tiempo de llenado capilar anormal (19).
ABI: La prueba más frecuentemente utilizada para el diagnóstico de EAP es el índice tobillo-brazo, ABI por su traducción en inglés ankle-brachial index, este es el radio de las presiones sistólicas sanguíneas del tobillo y el brazo (16). ABI es también un predictor de ateroesclerosis generalizada, ya que niveles bajos en el ABI están relacionados con un incremento en la incidencia de infarto de miocardio e ictus, mortalidad total y cardiovascular (17). Tradicionalmente se ha establecido.que valores de ABI menores a 0.90 es indicativo de riesgo aumentado, sin embargo altos niveles en el ABI  1.40, también pueden estar relacionados con compresibilidad arterial disminuida como resultado de la rigidez y calcificación, por lo que son pacientes que también se encuentran en mayor riesgo de eventos CV y mortalidad (20).
1.40, también pueden estar relacionados con compresibilidad arterial disminuida como resultado de la rigidez y calcificación, por lo que son pacientes que también se encuentran en mayor riesgo de eventos CV y mortalidad (20).
Tabla No2. Clasificaciones de isquemia arterial crónica de Rutherford y Fontaine
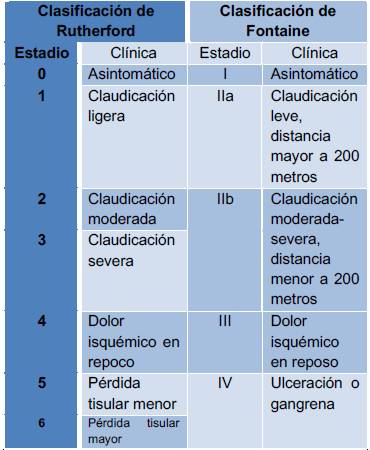
Fuente: Rutherford RB, Baker JD, Ernst C, et al. Recommended standards for reports dealing with lower extremity ischemia: revised version. J Vasc Surg 1997; 26:517.
Ultrasonido Dúplex, la Tomografía
computarizada y resonancia magnética de los miembros inferiores han sido de utilidad para determinar la localización y grado de estenosis de la EAP en pacientes sintomáticos en quienes se considera la revascularización (21,22).
Clasificación
Existen diversos sistemas para clasificar la isquemia arterial según la gravedad de los síntomas. El sistema de clasificación de Rutherford y Fontaine ha sido utilizado por décadas, estás se describen en la Tabla No. 2 (23). WifI (Wound, Ischemia, foot Infection), es un sistema actualizado que clasifica la severidad de la extremidad en riesgo, pretende reflejar con mayor precisión las consideraciones clínicas que afectan en las diferentes opciones de manejo (24). Herida (Wound):
Grado 0: Dolor en reposo, no heridas, no úlcera ni gangrena.
Grado 1: Úlcera (s) pequeña (s) de poca profundidad en la pierna distal o pie, cualquier hueso expuesto solo se limita a la falange distal; no gangrena.
Grado 2: Úlcera más profunda en la pierna distal o pie, con huesos, articulaciones o tendones expuestos, o úlcera superficial del talón sin afectación del calcáneo; cambios gangrenosos limitados a los dedos.
Grado 3: Úlcera profunda y extensa en el antepié y / o parte media del pie o úlcera del talón de espesor total con o sin afectación del calcáneo. Gangrena extensa que involucra antepié y / o parte media del pie; necrosis del talón de espesor total con o sin afectación del calcáneo. Isquemia (Ischemia):
Grado 0: ABI
 0.8, Presión Sistólica (PS) del tobillo
0.8, Presión Sistólica (PS) del tobillo 100 mmHg, Presión del dedo del pie (TP) / Presión de oxígeno transcutánea (TcPO2)
100 mmHg, Presión del dedo del pie (TP) / Presión de oxígeno transcutánea (TcPO2)  60.
60.Grado 1: ABI 0.6 a 0.79, PS de tobillo 70 a 100mmHg, TP/TcPO2 40 a 59.
Grado 2: ABI 0.4 a 0.59, PS del tobillo 50 a 70 mmHg, TP/TcPO2 30 a 39.
Grado 3: ABI
 0.39, PS del tobillo
0.39, PS del tobillo 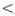 50 mmHg, TP/TcPO2
50 mmHg, TP/TcPO2  30. Infección en el pie (Foot Infection):
30. Infección en el pie (Foot Infection):Grado 0: No síntomas ni signos de infección.
Grado 1:
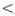 2 manifestaciones de infección como secreción purulenta, dolor, sensibilidad, induración, calor local, eritema a
2 manifestaciones de infección como secreción purulenta, dolor, sensibilidad, induración, calor local, eritema a  2 cm alrededor de la úlcera, limitado a piel y tejidos subcutáneos. Sin complicaciones sistémicas. Grado 2: Infección local que se extiende más de 2 cm alrededor de la úlcera o que involucra estructuras más profundas que la piel y los tejidos subcutáneos. No hay signos clínicos de respuesta inflamatoria sistémica.
2 cm alrededor de la úlcera, limitado a piel y tejidos subcutáneos. Sin complicaciones sistémicas. Grado 2: Infección local que se extiende más de 2 cm alrededor de la úlcera o que involucra estructuras más profundas que la piel y los tejidos subcutáneos. No hay signos clínicos de respuesta inflamatoria sistémica.Grado 3: Infección con toxicidad sistémica o metabólica.
Manejo
El manejo de los pacientes con EAP en miembros inferiores va dirigido al alivio de síntomas y disminución del riesgo de progresión de enfermedad CV y sus complicaciones. Los pacientes deben ser instruidos sobre la cesación de tabaco. Deben iniciar un programa de ejercicio supervisado para mejorar el estado funcional y la calidad de vida, además de que promueve la reducción de los síntomas en aquellos pacientes con CI (21). Perfil lípidico, presión sanguínea y glicemia deben mantenerse bajo control (20).
Se recomienda el uso de aspirina en dosis de 75- 325mg por día o clopidogrel 75 mg por día para reducir el riesgo de IM, ictus y muerte vascular (25). Cilostazol es un inhibidor de la fosfodiesterasa que aumenta las concentraciones de AMPc en el interior de las plaquetas y células sanguíneas, inhibiendo así la agregación plaquetaria (9). La adición del uso de este fármaco en el manejo de los pacientes con CI puede incrementar la distancia en la que estos se presentan al caminar (21).
Tratamiento quirúrgico
Revascularización: está indicada en aquellos pacientes con síntomas significativos que no responden a los cambios realizados en el estilo de vida ni a la terapia farmacológica. Tiene que ser además una prioridad en los pacientes con isquemia crítica, para reestablecer el flujo sanguíneo en la extremidad (9).
Amputación: indicada cuando la intervención vascular no es posible o cuando el deterioro de la extremidad persiste a pesar de una reconstrucción. La enfermedad vascular no reconstructible se ha convertido en la indicación más frecuente para amputación secundaria. Infección que persiste a pesar de reconstrucción vascular es la segunda indicación (9).
Conclusiones
La enfermedad arterial periférica en miembros inferiores de causa ateroesclerótica, tiene un alto riesgo de comorbilidad con enfermedades cardiovasculares tales como infarto de miocardio e ictus y un incremento en el riesgo de la mortalidad.
Es de gran relevancia que el profesional médico tenga conocimiento sobre los factores de riesgo de esta enfermedad, la sospeche y la considere como diagnóstico diferencial de ser necesario durante su práctica clínica, recordando que esta puede presentarse con ausencia de síntomas.
El diagnóstico temprano mediante una adecuada historia clínica y examen físico, sumados a la realización del cálculo del índice tobillo-brazo, es indispensable para brindar el tratamiento óptimo y así minimizar las importantes complicaciones de esta patología.