Introducción
Las intoxicaciones agudas son una causa importante de morbilidad y mortalidad en la infancia y edad adulta. En adolescentes las intoxicaciones voluntarias de deben a la ingesta de alcohol, fármacos y drogas ilegales, y las accidentales a inhalación de gas, principalmente CO. En niños las intoxicaciones accidentales son debido a la ingesta de fármacos, seguido por productos de limpieza, lejía y gases (Fleta et al, 2005).
Definición
El monóxido de carbono (CO) es un gas incoloro, no irritante, inodoro e insípido que se produce por la combustión incompleta de hidrocarburos como carbón y gas (butano, propano); todas las personas están expuestas al CO en distintos niveles, pero inhalarlo en grandes cantidades puede ser mortal, sin que la víctima se dé cuenta, por lo cual se le conoce como “asesino silente” (Fleta et al, 2005) (ATSDR, 2012) (Buchelli et al, 2014).
Existen fuentes naturales y humanas; la principal fuente humana es la emisión por los tubos de escape de automóviles, además de aparatos que funcionen de forma inadecuada con gas o madera; algunas fuentes naturales son los volcanes e incendios forestales (ATSDR, 2012). La concentración de CO en la atmósfera es menor de 0,001%, pudiendo ser mayor en áreas urbanas (Clardy et al, 2015).
Un 60% del CO está presente en el medio producto de la combustión de tabaco, biomasa y combustibles fósiles, el otro 40% de forma natural (Buchelli et al, 2014). Una vez liberado el monóxido de carbono pasa hasta 2 meses en la atmósfera, donde puede ser convertido en dióxido de carbono/anhídrido carbónico por interacción con otros gases o por medio de microorganismos. No se acumula en plantas ni tejidos animales (ATSDR, 2012).
El CO se utiliza en la industria para la producción de anhídrido acético, policarbonatos, policetona y ácido acético (ATSDR, 2012).
Existen reglamentos y recomendaciones para proteger la salud pública, pero estas recomendaciones no pueden ser impuestas por ley; estas recomendaciones generalmente se exponen como niveles que no deben excederse, estos pueden cambiar según la organización que lo aconseje; respecto al monóxido de carbono: la EPA ha establecido como límite ambiental de 10 mg/m3 (9 ppmv) de CO en el aire promediado sobre 8 horas (este límite no debe excederse más de una vez al año) y la OSHA establece el límite de CO en el aire del trabajo como 55 mg/m3 (50 ppmv) en el aire promediado sobre una jornada de 8 horas diarias/40 horas a la semana(ATSDR, 2012) (ATSDR, 2009).
Concentraciones ambientales superiores a 1/20 producen muerte fulminante (Sibón et al, 2007).
Epidemiología
Cada año en los Estados Unidos mueren al menos 430 personas por envenenamiento accidental con CO, en España aproximadamente 125 persona por año (CDC, 2016) (Buchelli et al, 2014).
La intoxicación por monóxido de carbono es la principal causa de muerte por intoxicación en Estados Unidos, y en general es la causa más común de lesiones y muertes por envenenamiento en todo el mundo (Buchelli et al, 2014)
(ATSDR, 2012). Además, es la primera causa de intoxicación por gases y el agente que mayor número de muertes por intoxicación produce (Fleta et al, 2005). Lo anterior tomando en cuenta que existe un infradiagnóstico y las cifras reportadas son menores que las reales (Yurtseven et al, 2015).
La incidencia en niños es de aproximadamente 15-30% de todas las intoxicaciones agudas por gases, y 1,5-2% de todas las intoxicaciones infantiles (Fleta et al, 2005).
Los casos son más comunes en época de invierno por aumento en el uso de hornos, estufas, calentadores y chimeneas con mal funcionamiento o en espacios poco ventilados (Buchelli et al, 2014).
La evolución es favorable en muchos casos, pero presentan mayor cantidad de muertes que las demás intoxicaciones (Fleta et al, 2005).
Fuentes exposición
El CO se encuentra en distintas fuentes y se puede acumular en espacios cerrados o parcialmente cerrados causando intoxicación (CDC, 2016). En casi todos los ambientes hay exposición de monóxido de carbono, en distintas medidas, según el tráfico de vehículos, el humo del cigarrillo y aparatos que funciona con gas, gasolina o quema de madera (ATSDR, 2012).
El consumo de tabaco, es la principal causa de elevación de los niveles de COHb, y es lo primero que debe sospecharse ante niveles elevados de la misma (Buchelli et al, 2014).
Uso de fuentes alternativas de energía, como por ejemplo ante emergencias en las cual se corta la electricidad producen altos niveles de monóxido de carbono. También se encuentra en gases producidos por generadores portátiles, estufas de cocina, linternas a combustible, y calefactores o por la quema de carbón y madera (CDC, 2016).
También es emitido por motores de botes o embarcaciones. Inclusive herramientas y motores pequeños a gasolina también pueden emitir altos niveles de monóxido de carbono en corto tiempo (ATSDR, 2012).
El diclorometano es un solvente industrial y componente de los removedores de pintura, el cual posterior a la inhalación es metabolizado por el hígado a CO, por lo cual es una causa de intoxicación por CO sin estar este en el ambiente (Clardy et al, 2015).
Hay muchos factores que determinan si la exposición al CO será perjudicial: dosis, duración, forma de contacto (inhalación, ingerir, contacto con piel), exposición a otras sustancias químicas, edad, sexo, dieta, características personales, estilo de vida y condición de salud (ATSDR, 2012)
Fisiopatología
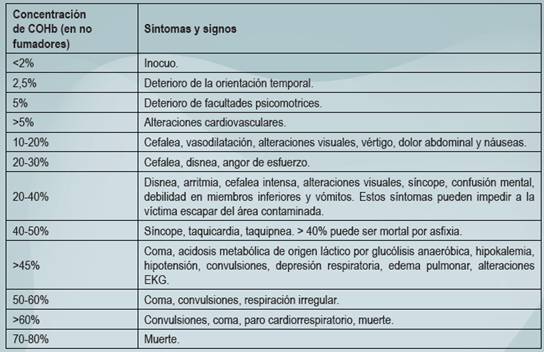
La producción endógena de CO en sujetos sanos representa una saturación de COHb de 0.4-0.7% (inclusive los no fumadores pueden tener hasta 3% de COHb), que puede llegar hasta 9 -15% en fumadores, los niveles superiores a estos se consideran anormales (Sibón et al, 2007) (Theodore, 2015).
La toxicidad de CO depende esencialmente de la especial afinidad que tiene por los grupos heme de las proteínas, como globinas (hemoglobina, mioglobina) y por citocromos de las enzimas respiratorias mitocondriales (CYP - 450 y A3) y la NADPH reductasa. Además, produce una interrupción en el transporte de oxígeno y precipita la cascada inflamatoria. También produce la peroxidación de lípidos cerebrales, lo que produce pérdida de consciencia. La alteración de la mioglobina produce trastornos del metabolismo celular y rabdomiólisis, además de hipoxia tisular por alteración del metabolismo celular (Fleta et al, 2005) (Oliu et al, 2010) (Clardy et al, 2015).
Los daños tisulares (cardiacos) y efectos tardíos de la intoxicación por CO dependen en gran medida de las alteraciones en la cadena respiratoria mitocondrial y liberación de radicales libre intracelulares; mientras que la intoxicación aguda se debe a la hipoxia tisular por ocupación de la hemoglobina por CO con disminución del transporte de oxígeno (Oliu et al, 2010) (Clardy et al, 2015).
Una vez inhalado el CO pasa al torrente sanguíneo y se une a la hemoglobina de forma competitiva y reversible, formando la carboxihemoglobina (Sibón et al, 2007) (Buchelli et al, 2014) (Oliu et al, 2010).
La afinidad de la hemoglobina por el CO es 200-300 veces mayor que por el oxígeno; tanto así que una concentración de 50% de COHb se puede alcanzar con niveles de CO inspirado de 0,08%, una exposición de 1 hora a una concentración de 0,1% puede llevar a niveles de COHb de 80%. Por lo anterior el CO desplaza el oxígeno y produce una disminución de trasporte de oxígeno a los tejidos, generando hipoxia. Aunado a lo anterior, al unirse produce un cambio alostérico en la conformación de la proteína que genera una desviación de la curva de disociación de la hemoglobina hacia la izquierda por mayor dificultad de la cesión de oxígeno al llegar a los tejidos (Fleta et al, 2005) (Sibón et al, 2007) (Oliu et al, 2010) (Clardy et al, 2015).
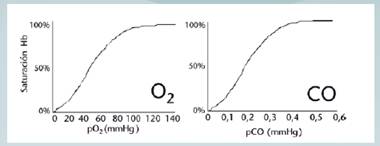
Imagen No.1 Comparación de presión parcial de CO y oxígeno para saturar al 100% la hemoglobina. Tomada de: Oliu et al, 2010.
El CO atraviesa la placenta y el feto es muy sensible a este, ya que la hemoglobina fetal es aún más afín al CO que la de adulto; por lo cual niveles de CO no tóxicos para la madre pueden generar hipoxia en el feto. Aunado a lo anterior, el tiempo de eliminación del CO del feto es 5 veces mayor que el de la madre (Fleta et al, 2005) (Yurtseven et al, 2015).
Se tardan un día para que el CO absorbido sea exhalado en su totalidad (ATSDR, 2012).
Signos y síntomas
• Intoxicación aguda: se manifiesta de forma anodina, síntomas leves o inespecíficos: cefalea, vértigo, mareos, náuseas/vómitos, somnolencia, letargia, confusión, alteraciones visuales (visión borrosa), dolor torácico, debilidad muscular, dolor abdominal, midriasis. Síntomas graves: afectación neurológica, coma, insuficiencia cardiaca, dificultad para respirar, convulsiones, hidrocefalia, muerte (ATSDR, 2009) (Fleta et al, 2005) (Sibón et al, 2007).
Se puede presentar facies rojo cereza, características (Fleta et al, 2005).
Puede haber sufrimiento miocárdico por hipoxia ante el levantamiento de los niveles de COHb, como trastornos de repolarización en forma de isquemia subendocárdica o subepicárdica (Fleta et al, 2005) (Yurtseven et al, 2015).
Alteraciones electrocardiograma: depresión del segmento ST, taquicardia, ondas T patológicas, arritmias ventriculares, fibrilación ventricular (Sibón et al, 2007) (Yurtseven et al, 2015).
Síndrome neurológico tardío (hasta en 40%): por insuficiente recuperación de la lesión celular, afectación de los núcleos de la base o liberación de CO por citocromos celulares, se puede presentar de 3-240 días después de la aparente recuperación. Se manifiesta como: cefalea, vértigo, depresión, falta de concentración, trastornos de funciones superiores (apraxia, agnosia, afasia, déficit de cálculo, fallos de memoria, desorientación), alteraciones del carácter (agresividad, apatía, irritabilidad), mialgias, astenia, déficit visual o parkinsonismo.
Por esta razón al egresar al paciente se debe citar en neurología 1 mes después (Fleta et al, 2005) (Oliu et al, 2010) (Clardy et al, 2015).
Intoxicación crónica: lesiones cerebrales por anoxia repetida. Presentan deterioro intelectual, convulsiones, trastornos de la memoria, trastornos sensoriales y síndrome piramidal o extrapiramidal. En TAC o RM se puede observar atrofia cortical y dilatación ventricular (Fleta et al, 2005).
Las personas con enfermedades cardiacas o pulmonares son más susceptibles a los efectos tóxicos del CO. Niveles bajo de COHb puede ocasionar crisis de angor en pacientes con arterioesclerosis (ATSDR, 2009) (Sibón et al, 2007).
Los niños asmáticos, los ancianos y las embarazadas son más susceptibles a la afectación por inhalación de monóxido de carbono (ATSDR, 2009) (Oliu et al, 2010).
El cuadro también puede agravarse ante anemia, concentración ambiental de CO elevada o situaciones que incrementen la necesidad de oxígeno (ejercicio, fiebre) (Fleta et al, 2005).
Inhalar niveles altos de CO durante el embarazo puede causar: aborto espontáneo; niveles más bajos pueden causar: retraso en el desarrollo mental del niño, y en animales se ha visto afectación del peso, sistema nervioso central, corazón y desarrollo (ATSDR, 2009).
Diagnóstico
Se estima que hay un alto porcentaje de infradiagnóstico ya que concentraciones bajas pero repetidas de CO pasan inadvertidas, pero van aumentando los niveles de COHb hasta producir intoxicación crónica (Buchelli et al, 2014).
Por la clínica inespecífica el diagnóstico depende de la sospecha, orientan la sospecha: una clínica aguda, una posible fuente de contaminación, la mejoría sintomatológica al apartar del lugar y la mejoría clínica con administración de oxígeno (Oliu et al, 2016).
Además, se debe sospechar intoxicación por CO en un niño sin fiebre con síntomas neurológicos y digestivos agudos, en síndromes gripales sin fiebre (astenia mialgias, cefalea), en cuadros similares a intoxicación alimentaria (náuseas, vómitos y diarrea) (Fleta et al, 2005) (Oliu et al, 2010).
En la historia clínica se debe buscar un foco contaminante (mala combustión), hábitos de riesgo (tabaco) o presencia de mismos síntomas en cohabitantes (Fleta et al, 2005).
Se deben realizar controles electrocardiográficos, radiografía de tórax (para descartar lesiones pulmonares en caso de aspiración de humo o broncoaspiración en paciente con alteraciones de la consciencia), exámenes analíticos y otras técnicas de imagen (Fleta et al, 2005). En niños se realiza hemograma completo, carboxihemoglobina (COHb),gasometría y ECG (Fleta et al, 2005) (Oliu et al, 2010).
Existen oxímetros para monóxido de carbono, ya que los oxímetros convencionales no funcionan, pues dan cifras de oxihemoglobina falsamente elevadas pues no diferencia entre carbo y oxihemoglobina. Pero el diagnóstico se basa en la determinación de COHb en sangre o de CO en el aire espirado. Podría haber falsos negativos si la medición se realiza una vez iniciada la oxigenoterapia (Oliu et al, 2010) (ATSDR, 2012) (Clardy et al, 2010).
Los valores de hasta 2% de COHb en sangre son tolerados, a partir de 4% empiezan los síntomas, pero los valores de concentración no se relacionan directamente con la sintomatología; los fumadores toleran hasta >9% sin sintomatología (Fleta et al, 2005).
La determinación de valores de COHb en no fumadores mayor de 2-5% confirman el diagnóstico (Fleta et al, 2005).
La medición de hemoglobinas anormales rara vez se indica, algunos laboratorios requieren una solicitud específica de pruebas cuando se sospechan niveles anormalmente altos (Theodore, 2015).

Imagen No.3 Propuesta de preguntas para detectar fuentes exposición a CO. Tomado de: (Buchelli et al, 2014)
El daño miocárdico por la intoxicación aguda por CO general elevación de marcadores cardiacos (como la troponina I cardiaca que se ha propuesto como un marcador confiable del daño miocárdico e indicador de inicio de cámara hiperbárica) y creatinin fosfocinasa (CPK). Este daño miocárdico no se relaciona de forma directa con los niveles de COHb, puede haber daño miocárdico ante bajos niveles de COHb (Yurtseven et al, 2015).
Además en las pruebas de laboratorio se pueden encontrar leucocitosis con desviación izquierda, acidosis láctica por la interferencia del CO con la respiración celular (si es muy severa se debe pensar en intoxicación concomitante con cianuro u otros tóxicos) y aumento de creatincinasa por rabdomiólisis (Oliu et al, 2010).
En casos de intoxicaciones que lleven a coma en las primeras 6 horas de intoxicación, se pueden ver en el TAC disminución de la densidad de la masa blanca y el globo pálido, además de edema cerebral. La baja densidad de áreas en el globo pálido son un signo de mal pronóstico (Yurtseven et al, 2015).
La RM es más efectiva para detectar lesiones cerebrales, hemorragias y atrofia cerebral permanente por intoxicaciones por CO (Yurtseven et al, 2015).
Se debe realizar diagnóstico diferencial con accidentes vasculares transitorios, epilepsia, trastorno del ritmo, otras etiologías de dolor torácico, descartar otros tóxicos concomitantes (cianuro en casos de incendio en lugares con material sintético y benzodiacepinas, neurolépticos, alcohol o antidepresivos en intentos suicidas) (Oliu et al, 2010).
Tratamiento
Extrahospitalario
Alejar al paciente del ambiente tóxico y colocar en zona bien ventilada, el personal de rescate debe utilizar equipo de protección. Después realizar desobstrucción orofaríngea, posición en decúbito lateral y de ser necesario iniciar maniobras de soporte cardiaco básico (Fleta et al, 2005) (Oliu et al, 2010).
Se debe mantener al paciente en reposo estricto (Fleta et al, 2005).
Hospitalario
No existe ninguna forma de depuración del CO del organismo, aparte de la expulsión fisiológica por la espiración. El único tratamiento es la aplicación de oxígeno de forma normobárica o hiperbárica; el papel del oxígeno es desplazar el CO de la COHb, acelerar la eliminación, disminuir la llegada de CO a las células, potenciar la disociación del CO con proteína extravasculares y disminuir la producción de radicales libres (Oliu et al, 2010).
Ante los pocos efectos adversos del oxígeno normobárico, se debe iniciar su administración ante la mínima sospecha.
Si el paciente se encuentra comatosa o con depresión respiratoria es preciso intubarlo e iniciar ventilación mecánica con FiO2 de 1. Si no, se coloca nasocánula o mascarilla con reservorio con alto flujo de oxígeno al 100%. Ambos métodos se mantienen hasta encontrar valores de COHb menores a 5%, en intervalos de 1-2 horas. Las cifras de carboxihemoglobina se empiezan a normalizar tras 2-4 hrs de tratamiento (Fleta et al, 2005) (Oliu et al, 2010).
La eliminación del CO de la sangre puede acelerar con aumento de la concentración de oxígeno en el aire inspirado o aumento de la presión atmosférica. La vida media del CO es de 4-5 horas en aire ambiente, que se disminuye a 1 hora con terapia de oxígeno al 100% y a 20 minutos en cámara hiperbárica. Además, ante la administración de oxígeno los niveles de oxígeno disuelto en sangre aumentan (Yurtseven et al, 2015).
Una vez confirmado el diagnóstico y decididos los criterios de gravedad, si se elige la cámara normobárica como tratamiento se debe mantener por al menos 8-12 horas (Oliu et al, 2010).
La cámara hiperbárica consiste en administrar oxígeno a presiones mayores que las atmosféricas (2,2 a 2,5 veces más) para lograr FiO2 mayores a 1; esta acorta el tiempo de mejoría de los síntomas, la incidencia de mortalidad y disminuye los hallazgos de síndrome neurológico tardío, en comparación con la terapia normobárica de oxígeno (Yurtseven et al, 2015). El empleo de cámara hiperbárica (sesión de 1 hora a una presión de 2-3 atmósferas) está indicado en (Fleta et al, 2005) (Oliu et al, 2010):
Valores de COHb >20- 40% (>10% en niños o gestantes).
Estado comatoso.
Síntomas cardiacos (isquemia o arritmias) o neurológicos (convulsiones o alteraciones neurológicas).
Acidosis metabólica.
Pacientes con historia de enfermedad cardiaca isquémica y COHb (>15%).
Embarazo (porque el feto tiene una presión parcial arterial de oxígeno inferior y los valores de CO son de
10-15% mayores que el adulto, con efectos de muerte fetal o malformaciones).
Efecto rebote de síntomas tras aplicación de oxígeno.
Síntomas persistentes después de 4-6 horas de administración de oxígeno normobárico.
En general se recomienda el inicio temprano de la terapia hiperbárica en el período agudo de la intoxicación, de preferencia en las primeras 6 horas de la intoxicación; si la pérdida de consciencia persiste posterior a la terapia, la misma se debe repetir en 6-8 hrs (Yurtseven et al, 2015).
Los probables efectos adversos por barotrauma de la terapia hiperbárica se pueden ver en oído medio (hemotímpano), senos y pulmón (Yurtseven et al, 2015).
La terapia hiperbárica se encuentra contraindicada ante imposibilidad de traslado seguro, inestabilidad hemodinámica o neurológica no controlada y centros no equipados para resolver complicaciones (Oliu et al, 2010).
Prevención
La prevención de la intoxicación con CO es muy importante, pues los niveles de CO peligrosos suelen ocurrir en espacios cerrados. Existen detectores de CO, a los cuales se les debe cambiar la batería cada 6 meses (CDC, 2016).
Se debe reducir la exposición al humo del tabaco y evitar deambular por caminos con mucho tráfico vehicular (ATSDR, 2012).
Se debe brindar mantenimiento anual a aparatos que funcionen con gas, aceite o carbón; además de mantener los conductos de ventilación libres de suciedad o bloqueos (CDC, 2016).
Nunca se debe utilizar una estufa u horno de gas para calentar un hogar (CDC, 2016).
No se debe quemar en una estufa o chimenea que no tenga escape al exterior (CDC, 2016).
No se debe dejar encendido el motor de un vehículo estacionado en un espacio cerrado o parcialmente cerrado, como un garaje aunque tenga la puerta abierta. Tampoco se debe encender un vehículo motorizado, un generador, una lavadora a presión o cualquier motor a gasolina a menos de 20 pies de un conducto, ventana o puerta, a través de los cuales los gases puedan ingresar a un área cerrada (CDC, 2016).
Nunca se debe encender un generador, una lavadora a presión o cualquier motor a gasolina dentro de una estructura cerrada (CDC, 2016).
Nunca se deben utilizar calentadores con brasas, linternas a combustible, parrillas de carbón o estufas portátiles de campamento (o cualquier otro aparato que funciona con gasolina o carbón) dentro de una casa, tienda de campaña o espacio cerrado (CDC, 2016).