Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina Legal de Costa Rica
On-line version ISSN 2215-5287Print version ISSN 1409-0015
Med. leg. Costa Rica vol.27 n.1 Heredia Mar. 2010
Revisión Bibliográfica
Microquimerismo natural ¿Existen humanos con varios genomas?
José Luis Quirós Alpízar*
Isabel Cristina Arce Jiménez**
* Profesor Departamento de Anatomía, Escuela de Medicina, Universidad de Costa Rica. Médico Patólogo Hospital Max Peralta, Cartago. dr.quiros@gmail.com
** Estudiante Escuela de Medicina, Universidad de Costa Rica. isabel.arce.cr@gmail.com
Resumen:
El microquimerismo humano se define como la presencia dentro de un individuo de una pequeña población de células originadas en un individuo genéticamente distinto. El microquimerismo adquirido de forma natural se desarrolla a lo largo del embarazo, como una consecuencia del ampliamente demostrado tráfico bidireccional transplacentario de células. Esta trasferencia resulta en un estado microquimérico a décadas posparto, tanto para la madre (microquimerismo fetal) como para su progenie (microquimerismo materno). Aún más, el establecimiento de esta condición ocurre, iatrogénicamente, posterior al trasplante de órganos y la transfusión de sangre. Actualmente el microquimerismo es un tema de gran interés alrededor del mundo, dadas sus múltiples posibles implicaciones en la salud y en la enfermedad. Su estudio comenzó a raíz del potencial para el desarrollo de técnicas de diagnóstico prenatal no invasivo, en el presente se tienen amplias expectativas de su utilidad en la terapia con células madre. Se ha propuesto que el microquimerismo podría estar implicado en la patogénesis de ciertas enfermedades autoinmunes, en la reparación de tejidos, el cáncer y la inducción de tolerancia.
Palabras clave:
Microquimerismo, embarazo, placenta, microquimerismo natural, microquimerismo materno, microquimerismo fetal.
Abstract:
Human microchimerism is defined as the presence within one individual of a small population of cells originated in a genetically distinct individual. Naturally acquired microchimerism develops throughoutpregnancy, as a consequence of the clearly demonstrated bidirectional transplacental traffic of cells. This transference results in a long-term postpartum microchimeric state for both, the mother (fetal microchimerism) and her progeny (maternal microchimerism). Furthermore, the establishment of this condition occurs, iatrogenically, after organ transplantation and blood transfusions. Microchimerism is subject of current interest worldwide, given its multiple possible implications for health and disease. Initial investigation was promoted because of its potential for the development of new techniques in noninvasive prenatal diagnosis, nowadays its feasible utility for stem cell therapy is being explored. Hypotheses propose that microchimerism could be involved in the pathogenesis of some autoimmune diseases, tissue repair, cancer and tolerance induction.
Key words:
Microchimerism, pregnancy, placenta, naturally acquired microchimerism, maternal microchimerism, fetal microchimerism.
Introducción
El mitológico concepto "quimera" y el actual concepto biológico difieren significativamente. Este último también describe la convivencia de seres distintos en un cuerpo, pero esta vez a nivel celular (1). Con esto, el término microquimerismo se define como la presencia dentro de un individuo de bajos niveles de células derivadas de otro individuo (2) (3).
El concepto apareció por primera vez en las investigaciones de Liégeois et al. en 1977, cuando se utilizó para denominar este fenómeno luego del trasplante de médula ósea en ratones de laboratorio(4). No obstante, este primer hallazgo no evidenció la fuente más común de estas células forasteras: el embarazo(5 y 6), según se comprobaría años después en animales y humanos.
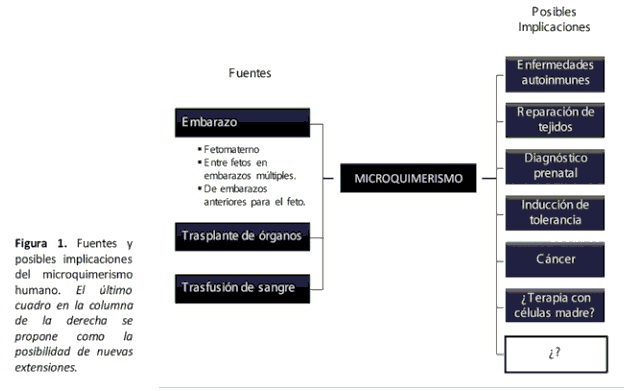
Muchas, quizá todas las personas, hospedamos un pequeño número de células de individuos genéticamente diferentes –de nuestra madre y en las mujeres que han estado embarazadas, de sus hijos. (7). Otras fuentes, iatrogénicas, de estas células son el trasplante de órganos y la trasfusión sanguínea (8). [Ver figura 1]
Aunque el tráfico celular bajo las condiciones mencionadas es bien reconocido(9), lo que resulta novedoso es que este traspaso de células ajenas persista a largo plazo(10). Estas células pueden alojarse en su nuevo hospedero tanto en circulación sanguínea como formando parte de varios tejidos(7). La condición ha sido diagnosticada tanto en individuos enfermos, como sanos(5 y 6).
Distintos ADN’S, un organismo
Se han determinado varias condiciones en las cuales todas las células de un organismo multicelular no tienen genomas idénticos(11). Aunque esta convivencia no resulte innovadora, hasta hace poco se consideraba inusual. Esto se puede ilustrar con las reconocidas formas de mosaicismo y quimerismo espontáneo humano. Una quimera es el resultado de la fusión de líneas celulares de diferente origen (dos cigotos) en un único individuo (12). Mientras que el organismo mosaico está conformado por dos genomas diferenciados por la mutación de la línea celular original de un único cigoto (13). Se supone que, de ambas, la condición de mosaicismo es mucho más común, por su parte el quimerismo resulta extremadamente raro (14).
No obstante, en tiempos recientes ha relucido la universalidad de esta coexistencia de ADN’s a baja escala: el microquimerismo natural. Como resultado del embarazo la extensión de células fetales microquiméricas a la madre se denomina microquimerismo fetal, mientras que la persistencia de células maternas en la progenie se conoce como microquimerismo materno (1).
Del área de trasplantes se ha obtenido parte de la evidencia y de las primeras pistas en la investigación del microquimerismo(5). También se han definido nuevos conceptos relacionados, como quimerismo hematopoyético completo, quimerismo mixto y macroquimerismo(15).
Con estas clasificaciones, se ha fijado una definición cuantitativa de las proporciones de ADN propio/ajeno para la condición de microquimerismo. En el área de trasplantes, se ha propuesto que este se da cuando la presencia de las células foráneas en sangre ocurre a niveles por debajo de lo detectable en una citometría de flujo (<1%) y solo puede detectarse por métodos más sensibles, como la Reacción en Cadena de la Polimerasa (PCR) (16).
Anatomía de la relación fetomaterna
Anteriormente se consideró a la placenta como una separación perfecta entre el feto semialogénico y la madre(17). Ahora, una abrumadora cantidad de evidencia indica que la placenta es un sitio de tráfico bidireccional de células a lo largo del embarazo(18). La transferencia de células ocurre también entre fetos en embarazos multigestacionales(19).
La placenta, sorprendentemente, está compuesta tanto por células derivadas del cigoto como de la madre(20), aunque se desarrolla primariamente a partir de tejido embrionario(21). Seis o siete días después de la concepción, el blastocisto se adhiere e invade al endometrio uterino, a través de su capa trofoblástica(18).
Luego de la implantación inicial, el trofoblasto se diferencia en un sincitio multinucleado(22) derivado de la fusión de la capa interna de células mono nucleadas, citotrofoblástica(23). La proliferación del citotrofoblasto, el crecimiento del mesodermo coriónico y el desarrollo de los vasos sanguíneos fetales dan origen a las vellosidades coriónicas (cronológicamente: primarias, secundarias y terciarias) 21), por las cuales fluye la sangre fetal [ver figura 2].
Con esto, la capa sincitiotrofoblástica se convierte en la línea de frente del tejido fetal invasor. Los capilares y vénulas maternos son encubiertos por este tejido fetal y se produce la extravasación de la sangre materna y la formación de pequeñas lagunas(24). En este órgano, hemocorial, la sangre materna entra en contacto directo con las células trofoblásticas fetales que cubren las vellosidades (25).
En su estado más delgado la membrana placentaria está formada por: el sincitiotrofoblasto, una capa citotrofoblástica interna discontinua, la lámina basal del trofoblasto, tejido conjuntivo de la vellosidad, la lámina basal del endotelio y el endotelio de los capilares placentarios fetales en la vellosidad terciaria(21).
Progreso del embarazo y traspaso de células microquiméricas
El tiempo trascurrido desde la concepción es importante para el establecimiento del microquimerismo, ya que parece ser requerido cierto lapso (26). Sin embargo, un embarazo a término no es necesario para la conexión microquimérica (6), de hecho los niveles y frecuencia parecen ser mayores en los casos de aborto, particularmente en los casos de aborto quirúrgico (27).
Investigaciones han demostrado que el número de células fetales en la circulación materna aumenta con el tiempo (28). En embarazos normales, el ADN fetal aparece en circulación materna temprano en el primer trimestre, aproximadamente en la 4ta semana desde la fecha de última menstruación (FUM) (29) y puede ser identificado en todos los embarazos para la 7ma semana (30).
La fuente más probable del ADN fetal encontrado en circulación materna hasta la 8va semana son las células trofoblásticas (31). No es probable que la fuente de ADN fetal sea hematopoyética (30 y 31), ya que las células sanguíneas fetales se forman inicialmente en la cuarta semana, en el saco de vitelino, y que estas no circulan hasta que el corazón comienza a latir en la quinta semana (30). Además, los vasos fetales no están presentes en las vellosidades coriónicas hasta la semana 8, por lo que no es probable que elementos hematopoyéticos fetales sean capaces de escapar hacia la circulación materna aun en la semana 5 (30).
Para el segundo trimestre, el número de células fetales circulantes se estima es de 2-6 por mililitro de sangre venosa materna (28). Se ha observado un transitorio incremento a bajo nivel en el ADN fetal durante las semanas 7 a 16 de gestación, que es continuado por un aumento firme que alcanza un máximo a término (29).
Estos hallazgos concuerdan con cambios anatómicos de la membrana placentaria, ya que esta a medida que el embarazo prospera se adelgaza de forma progresiva (32). La membrana placentaria casi hasta la semana 20 se compone de cuatro capas, pero después de esta ocurren alteraciones histológicas en las ramas de las vellosidades, que hacen que muchas de ellas se atenúen en la capa citotrofoblástica (33).
Por su parte, el sincitiotrofoblasto reduce su grosor de 15μm en el primer trimestre a 3,5μm en el tercero(25). En la placenta madura, las vellosidades son delgadas y contienen una capa continua, aunque muy adelgazada, del sincitiotrofoblasto(34). Con estas condiciones, hay sitios en los que el sincitiotrofoblasto entabla contacto directo con el endotelio de los capilares fetales, creando una membrana placentaria sincitio- vascular(33).
En ciertas regiones de la membrana sincitio-vascular, la membrana vellosa que separa la circulación materna y fetal puede ser tan pequeña como 1-2μm (35), y en estos una disrupciσn fácilmente conlleva al sangrado fetal hacia el espacio intervelloso (25). En la figura 2 se muestran microfotografías de cortes histológicos de una placenta temprana y a término, su comparación evidencia este adelgazamiento de la membrana placentaria con la evolución embarazo.
Más aún, es común encontrar defectos en la continuidad trofoblástica de las vellosidades, al menos un 7% de la superficie vellosa no tiene la barrera sincitiotrofoblástica (25). En los sitios en los cuales el sincitiotrofoblasto es interrumpido por degeneración, el defecto es rellenado con un fibrinoide de tipo fibrina, que podría servir como ruta para el intercambio fetomaterno de células (36).
Muestras de plasma materno obtenidas de embarazos tardíos muestra hasta un 6,2% de AND fetal en el ADN circulante total (37). Para el final del embarazo virtualmente todas las mujeres cuentan con cierta cantidad de células fetales en circulación. Los niveles de ADN fetal disminuyen rápidamente post-parto (38). Sin embargo, se considera que algunas células son acogidas en el organismo materno, puesto que su presencia en la circulación materna ha sido comprobada ampliamente décadas después del parto (39).
Por otra parte, en el cordón umbilical es bastante común encontrar células maternas. No se sabe cuando específicamente se da esta trasferencia, pero células de origen materno se han detectado en varias concentraciones en la circulación fetal a partir de la semana 13 y hasta los 46 años de edad en individuos sanos(40).
Mecanismos de transferencia celular transplacentaria
El mecanismo por el cual células son intercambiadas en la placenta aún no está claro. Posibles explicaciones incluyen 1.Deportación de trofoblastos, 2.Ruptura microtraumática de canales de sangre placentarios o 3.Que tipos específicos de células sean capaces de adherirse a los trofoblastos de las paredes de los canales sanguíneos fetales y migren a través de la barrera placentaria trofoblástica [mecanismo activo] (20).
Frecuentes defectos histológicos en la continuidad trofoblástica e identificación de trombos intervellosos que comprometen sangre materna y fetal, apunta hacia la hipótesis de la hemorragia fetomaterna ocasionada por un microtrauma (41). Esto implicaría que el microquimerismo fetomaterno no tiene valor adaptativo para el feto, pero concuerda con la hipótesis que el microquimerismo es un epifenómeno del embarazo, con posibles consecuencias patológicas (20).
Desde estudios histológicos trofoblásticos, no existe evidencia de que las células fetales crucen activamente a través de las vellosidades para ingresar al flujo materno (25). Sin embargo, una hipótesis propone que las células cruzan la barrera placentaria por un mecanismo similar al de adhesión activa y transmigración que ocurre en las vénulas de endotelio alto en los nódulos linfáticos periféricos y la barrera sanguínea del cerebro (20).
Se debe considerar que, probablemente, no sea únicamente uno de estos mecanismos el que explique el tráfico celular, por el contrario una combinación de estos parece más acertado (29).
Células fetales identificadas en circulación materna
Distintas investigaciones han descubierto varios tipos de células en la circulación materna durante el embarazo, entre ellas: células trofoblásticas, linfocitos B y T, monocitos, eritroblastos nucleados, plaquetas, células NK, neutrófilos, algunos tipos de células progenitoras/madre y posiblemente células mesenquimáticas (28 y 42).
Es de notar que el descubrimiento de células microquiméricas años después del embarazo implica que algunas de las células migrantes originales deben ser células madre o sus descendientes, pues estas son las únicas capaces de persistir al dividirse infinitamente (7). Estas células madre podrían ser tanto hematopoyéticas como mesenquimáticas (26).
Así mismo cabe hacer distinción entre el tráfico de células durante el embarazo y el tráfico de ADN y mARN libre-de-célula fetal. Se cree que estos podrían ser el resultado de su ingreso a circulación desde el sincitio multinucleado trofoblástico o de la lisis o necrosis de células fetales (42).
Resulta importante destacar que el análisis de este ADN libre fetal ha permitido que el diagnóstico prenatal de algunas condiciones fetales desde la circulación materna sea una realidad clínica (43). Así mismo, se reconoce que la posibilidad de desarrollar terminos no invasivas de diagnóstico prenatal ha sido la raíz de estudio en el área de microquimerismo (44).
Factores que afectan en tráfico celular
Distintos factores pueden influir en el desarrollo del microquimerismo fetal. El tráfico celular fetomaterno aumenta cuando la placenta es anormal, así como en ciertas complicaciones del embarazo (37 y 45), como en las aneuplodias fetales y pre- eclampsia (26). La histocompatibilidad entre la madre y el feto podría afectar la frecuencia y extensión del microquimerismo fetal celular (7), de hecho se ha identificado que la presencia de tipos específicos de antígenos, como el HLA- DQA1*0501, influye en el desarrollo de microquimerismo (26).
Se estima que células femeninas y masculinas fetales cruzan la placenta con igual magnitud (26 y 41). No obstante los estudios de microquimerismo incurren en la demostración del cromosoma Y en los tejidos maternos como principio de prueba (46). También estudios con ratas han mostrado que la cantidad de células microquiméricas aumenta con el número de embarazos (26).
Es importante aclarar que la cuantificación de células microquiméricas depende de la técnica de detección que se utilice así como del proceso de enriquecimiento al que se recurra. Esto porque existen algunos procedimientos más sensibles que otros, incluso algunos no han detectado célula microquimérica alguna (45).
Papel de células microquiméricas fetales
El papel de las células microquiméricas en el organismo hospedero no se ha esclarecido por completo. La primera hipótesis de su rol, propuesta por Nelson J., propone que las células extranjeras podrían participar en la patogénesis de ciertas enfermedades autoinmunes (4 y 47). Esto fundamentado en la prevalencia de este tipo de patologías en las mujeres y la similitud de algunas con el síndrome de injerto vs hospedero que ocurre con la introducción de células ajenas en los trasplantes (5 y 37).
Los estudios iniciales se centraron en la esclerosis sistémica (43), subsecuentemente se han investigado otras enfermedades autoinmunes como el lupus eritematoso sistémico, artritis reumatoide, síndrome de Sjögren, cirrosis biliar primaria, tiroiditis y diabetes tipo I (6).
Recientes estudios han mostrado que las células fetales tienden a concentrarse en los tejidos afectados clínicamente, aunque con esto no es posible concluir que éstas sean las causantes de la enfermedad (48). Más aún, otra línea de investigación dirigida por Bianchi, D. propone que esta migración celular cumple más bien un papel de reparación en los tejidos dañados (26).
Nacientes sub-líneas de investigación nexan estas células a la inducción de tolerancia en trasplantes, al cáncer (49 y 50) y también se ha formulado su capacidad para el expansión de terapias de células madre. Incluso se ha propuesto que la persistencia de células fetales podría crear otras ventajas para la salud materna e influenciar la longevidad, especialmente si células madre están involucradas (41).
Papel De Células Microquiméricas maternas
El microquimerismo materno ha ganado menos atención que el microquimerismo fetal, con esto la información acerca de células maternas en tejidos fetales es escasa. Sorprendentemente, Jonsson et al reportaron la presencia de células madre hematopoyéticas maternas en un caso de un feto de segundo trimestre con malformaciones. También se ha especulado que el microquimerismo materno podría estar relacionado con el origen de varios desordenes durante la infancia, como lo son inmunodeficiencia severa combinada, dermatomiositis juvenil, síndrome de lupus neonatal, atresia biliar y pitiriasis liquenoide (40).
Conclusiones
- En el cuerpo humano existe un genoma dominante, pero adicionalmente puede existir pequeñas cantidades de otro(s) genomas en células provenientes del tráfico placentario.
- La placenta es un órgano que continúa sorprendiéndonos y cuyo estudio amplia las fronteras de la medicina.
- El microquimerismo natural está demostrado, no así su papel en la salud y la enfermedad.
Recibido para publicación: 12 de enero 2010 Aceptado: 20 de febrero 2010
Bibliografía
1. Stevens, A. (2005). Maternal michochimerism - Allogenic target of autoimmune disease or Normal Biology? Clinical and Applied Immunology Reviews, 5, 325-38. [ Links ]
2. Régnier, S. y Aractingi, S. (2002). Microchimerism and autoinmune diseases. European Journal of Internal Medicine, 13, 365-68. [ Links ]
3. Nelson, L. (2002). Microchimerism: incidental byproduct or pregnancy or active participant in human health? TRENDS in molecular medicine, 8, 109-13. [ Links ]
4. Johnson, K. & Bianchi, D. (2004). Fetal cells in maternal tissue following pregnancy: what are the consequences? Human Reproduction Update, 10, 497-502. [ Links ]
5. Sarkar, K. y Miller, F. (2004). Possible roles and determinants of microchimerism in autoimmune and other disorders. Autoimmunity Reviews, 3, 454-463. [ Links ]
6. Nelson, J. (2009). Naturally acquired microchimerism: for better or for worse. Arthritis Rheum, 60, 5-7. [ Links ]
7. Nelson, L. (2008). Your Cells Are My Cells. Scientific American, 298, 72-9. [ Links ]
8. Carter, A. y Fuggle, S. (1999). Detection of microchimerism after blood transfusion and solid organ transplantation: A delicate balance between sensitivity and specificity . Transplantation Reviews, 13, 98-108. [ Links ]
9. Bianchi, D. y Romero, R. (2003). Biological implications of bi-directional fetomaternal cell traffic: a summary of a National Institute of Child Health and Human Development-sponsored conference. The Journal of MaternalFetal & Neonatal Medicine, 14, 123-29. [ Links ]
10. Adams, K. y Nelson, L. (2004). Microchimerism, an Investigative Frontier in Autoinmunity and Transplantation. Journal of American Medical Association, 291, 1127-31. [ Links ]
11. Teplitz, R. y Beutler, E. (1966). Mosaicism, Chimerism and Sex-Chromosome Inactivation. Blood, 27, 258-71. [ Links ]
12. Ramsay, M. (1998). Different causes for true hermaphroditism. Molecular Medicine Today, 4, 143. [ Links ]
13. Quirós, J. y Alpízar, K. (2009). Quimerismo genético un nuevo paradigma para la medicina legal. Medicina Legal de Costa Rica, 26, 73-8. [ Links ]
14. Boklage, C. (2006). Embryogenesis of chimeras, twins and anterior midline asymmetries. Human Reproduction, 21, 579-91. [ Links ]
15. Sykes, M. y Sachs, D. (2001). Mixed Chimerism. Philosophical Transactions of The Royal Society, 356, 707-26. [ Links ]
16. Janes, S., Dhaliwal, P. y Wood, K. (2009). Tolerance in renal transplantation: is mixed chimerism the missing link? Nephrology Dialysis Transplantation, 24, 1726-29. [ Links ]
17. Gammill, H. y Nelson, J. (2010). Naturally acquired microchimerism. The International Journal of Developmental Biology, 54, 531-43. [ Links ]
18. Black, L. y Maheshwari, A. (2009). Disorders of the Fetomaternal Unit: Hematologic Manifestation in the Fetus and Neonate. Seminars in Perinatology, 33, 12- 9. [ Links ]
19. Arlett, C. (2002). Microchimerism in Health and Disease. 2, 525-35. [ Links ]
20. Dawe, G. Wei Tan, X. y Xiao, Z. (2007). Cell migration from baby to mother. Cell Adhesion & Migration, 1, 19-27. [ Links ]
21. Ross, M., Kaye, G. y Pawlina, W. (2006). Histología. Texto y Atlas Color con Biología Celular y Molecular. (4° ed.). Buenos Aires: Médica Panamericana. [ Links ]
22. Cunningham, F. Leveno, K. Bloom, S. Hauth, J. Rouse, D. y Spong, C. (2009). Chapter 3. Implantation, Embryogenesis, and Placental Development. Williams Obstetrics. (23° ed.). España: McGraw Hill Professional. [ Links ]
23. Taylor, R. y Lebovic, D. Chapter 17. The endocrinology of Pregnancy. [book auth.] D. y Shoback, D. Gardner. Greenspan’s Basic and Clinical Endocrinology. [ Links ]
24. Knuppel, R. (2006). Chapter 8. MaternalPlacental-Fetal Unit; Fetal & Early Neonatal Physiology. [book auth.] A. y Nathan, L. DeCherny. Current Diagnosis & Treatment Obstetrics & Gynecology. 10. McGraw-Hill Medical [ Links ]
25. O’Donoghue, K. (2006). Implications of fetal stem cell trafficking in pregnancy. Reviews in Gynaecological and Perinatal Practice, 6, 87-98. [ Links ]
26. Bianchi, D. (2007). Fetomaternal cell traffickin: a story that begins with prenatal diagnosis and may end with stem cell therapy. Journal of Pediatric Surgery, 42, 12-18. [ Links ]
27. Sato, T. Fujimori, K. Sato, K. y Ohto, H. (2008). Microchimerism after induced or spontaneous abortion. American College of Obstetricians and Gynecologists, 112, 593-97. [ Links ]
28. Klonisch, T. y Drouin, R. (2009). Fetal-maternal exchange of multipotent stem/progenitor cell: microchimerism in diagnosis and disease. Trends in Molecular Medicine, 15, 510-18. [ Links ]
29. Ariga, H. Ohto, H. Busch, M. Imamura, S. Watson, R. Reed, W. y Lee, T. (2001). Kinetics of fetal cellular and cell-free DNA in the maternal circulation during and after pregnancy: implications for noninvasive prenatal diagnosis. Transfusion, 41, 1524-1530. [ Links ]
30. Thomas, M. Tustschek, B. Frost, A. Rodeck, C. Yazdani, N. Craft, I. y Williamson, R. (1995). The time of apperance and disappearance of fetal DNA fron the maternal circulations. Prenatal Diagnosis, 15, 641-46. [ Links ]
31. Bianchi, D. (2004). Circulating fetal DNA: Its origin and diagnostic potencial - A review. Placeta, 25, S93-S101. [ Links ]
32. Gilbert, E. y Harmon, J. (2003). Incompatibilidad hemolítica. Manual de embarazo y parto de alto riesgo. (3° ed.). Capítulo 20. España: Elsevier. [ Links ]
33. Moore, K. y Persaud, T. (2009). Embriología Clínica. (8° ed.). España: Elsevier. [ Links ]
34. Botella, J. y Claveo, J. (1993). Tratado de ginecología: fisiología, obstetricia, perinatología, ginecología y reproducción. (14° ed.). España: Ediciones Díaz de Santos. [ Links ]
35. Burton, G. y Tham, S. (1992). Formation of vasculo-syncytial membranes in the human placenta. Journal of Developmental Physiology, 43, 7. [ Links ]
36. Benirschke, K. y Kaufmann, P. (2000). Pathology of the human placenta. (4° ed.). Springer, 947. [ Links ]
37. Bianchi, D. (2000). Fetal cells in the mother: from genetic diagnosis to diseases associated with fetal cell microchimerism. Reproductive Biology, 92, 103-08. [ Links ]
38. Gammill, H. y Nelson, L. (2010). Naturally acquired microchimerism. The International Journal of Developmental Biology, 54, 531-43. [ Links ]
39. Lambert, N. y Nelson, L. (2003 Microchimerism in autoimmune disease: more questions than answers? Autoimmunity Reviews, 2,133-39. [ Links ]
40. Jonsson, A. Uzunel, M. y Götherström, C. (2008). Maternal michochimerism in human fetal tissues. American Journal of Obstetrics & Ginecology, 198, 325, e1-e6. [ Links ]
41. O’Donoghue, K. (2008). Fetal microchimerism and maternal health during and after pregnancy. Obstetric Medicine, 1, 56-64. [ Links ]
42. Hahn, S. Huppertz, B. y Holzgreve, W. (2005). Fetal cells and cell free fetal nucleic acids in maternal blood: New tools to study abnormal placentation? Placenta, 26, 515- 26. [ Links ]
43. Wolfgang, H. Sinuhe, H. Zhong, X. Lapaire, O. Höslie, I. Tercanli, S. y Mindy, P. (2007). Genetic communication between fetus and mother: short- and long-term consequences. American Journal of Obstetrics & Ginecology, 196, 372-81. [ Links ]
44. Bischoff, F. Hahn, S. Johnson, K. Simpson, J. Bianchi, D. Lewis, D. et al. (2003). Intact fetal cells in maternal plasma: are they really there? The Lancet, 361, 139-40. [ Links ]
45. Smid, M. Galbiati, S. Vassallo, A. Gambini, D. Ferrari, A. Viora, E. et al. (2003). No evidence of fetal DNA persistence in maternal plasma after pregnancy. Human Genetics, 112, 617-18. [ Links ]
46. Bianchi, D. y Fisk, N. (2007). Fetomaternal Cell Trafficking and the Stem Cell Debate: Gender Matters. Journal of the American Medical Association, 297, 1489-91. [ Links ]
47. Nelson, J. (2001). HLA relationships of pregnancy, michochimerism and autoimmune disease. Journal of Reproductive Immunology, 52, 77-84. [ Links ]
48. Sunami, R. Komuro, M. Yuminamochi, T. Hoshi, K. y Hirata, S. (2010). Fetal cell microchimerism develops through the migration of fetus-derived cells to the maternal organs early after implantation. Journal of Reproductive Immunology. Article in Press. doi:10.1016/j.jri.2009.11.006. [ Links ]
49. Fugazzola, L. Cirello, V. y Beck, P. (2010). Fetal cell microchimerism in human cancers. Cancer letters, 287, 136-41. [ Links ]
50. Gadi, V. (2009). Fetal micochimerism and cancer. Cancer Letters, 276, 8-13. [ Links ]