Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Médica del Hospital Nacional de Niños Dr. Carlos Sáenz Herrera
Print version ISSN 1017-8546
Rev. méd. Hosp. Nac. Niños (Costa Rica) vol.39 n.1 San José Jan. 2004
Dr. Oscar Porras M. PhD*
Introducción
Costa Rica dentro de su sistema de salud, ofrece un esquema de inmunizaciones para niños y adultos completo, actualizado y que provee protección contra un grupo importante de enfermedades infecciosas prevenibles por vacunación.
En este artículo ofrecemos en una forma esquemática y de consulta rápida, las alternativas de vacunación disponibles en la Caja Costarricense de Seguro Social y en las farmacias para uso en la práctica privada.
Se discuten los esquemas para niños, adolescentes, adultos y mujeres embarazadas. Además se comentan las opciones para aplicar vacunas en hospederos con situaciones de salud especiales.
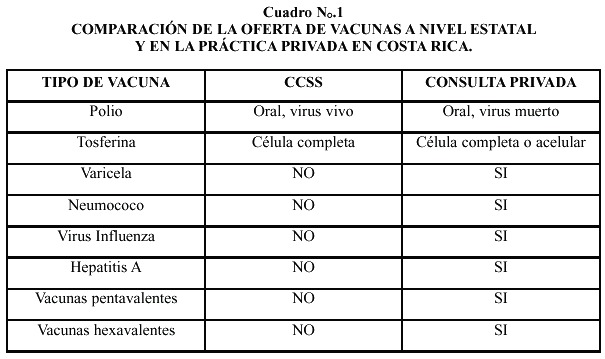
Las diferencias fundamentales entre la vacunación que reciben los niños y niñas de Costa Rica en las facilidades de la CCSS y las que reciben cuando acuden a la consulta privada se muestran en el Cuadro N ° .1.
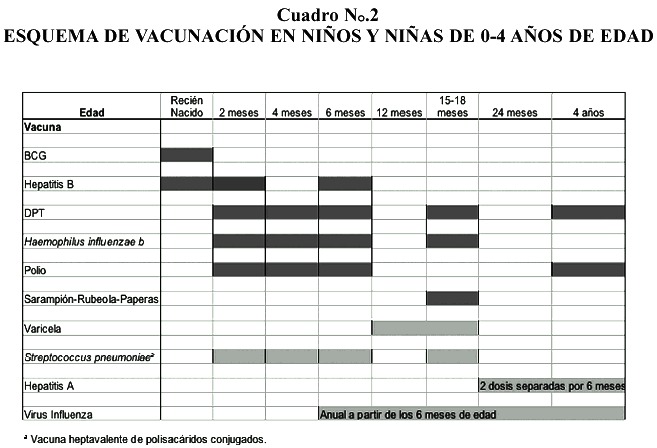
Esquema de vacunación en niños y niñas de 0-4 años de edad
En el Cuadro N ° .2, se muestran las recomendaciones para vacunación en niños y niñas de 0 a 4 años de edad, utilizando el esquema oficial de vacunación de Costa Rica y las vacunas que están disponibles fuera del sistema de salud cubierto por la CCSS (7,16,18,21,23,39)
La vacuna que más recientemente se ofrece para el uso en este segmento de edad es la vacuna de polisacáridos conjugada contra Streptococcus pneumoniae y conocida como (Prevenar®) Esta vacuna produce una respuesta adecuada en menores de 2 años, lo cual resuelve la falta de respuesta en este grupo de edad que se presenta con el uso de la vacuna de polisacáridos contra S. pneumoniae (Pneumovax23®) La vacuna conjugada contiene 7 polisacáridos a diferencia de la no conjugada que contiene 23 (2,14,17,22,24,38,40)
Otro aspecto de decisión reciente es la vacunación universal anual contra Virus Influenza a partir de los 6 meses de edad. Esta vacuna se recomienda también para adolescentes y adultos de todas las edades (20,38)
Vacunación para escolares y adolescentes
Una vez cumplida la vacunación básica y los refuerzos de los 4 años, es importante aplicar, en la edad escolar y en la adolescencia (5-18 años de edad), los refuerzos de algunas vacunas y las inmunizaciones que no se aplicaron en la infancia (7,18,21,23,39):
a. Difteria y tétanos: aplicar una dosis de dT a los 9 años de edad y continuar con refuerzos cada 10 años.
b. Sarampión-Rubeola-Paperas: aplicar 1 dosis a los 6 años de edad y otra 10 años después (16-18 años de edad
c. Virus Influenza: aplicar una dosis anual, entre los meses de Diciembre a Marzo.
d. Si no recibió las dosis de la infancia y no ha padecido la enfermedad, se recomiendan las siguientes vacunas:
1. Hepatitis B: aplicar 3 dosis, separadas la primera de la segunda por 2 meses y la 2 de la tercera por 4 meses.
2. Hepatitis A: aplicar 2 dosis separadas por 6 meses.
3. Varicela: aplicar 2 dosis separadas por 2 meses en los individuos sin historia de varicela en la infancia.
Recomendaciones para actualizar esquemas de vacunación
No hay necesidad de reiniciar un esquema de vacunas a pesar del tiempo que ha pasado desde la última dosis. Solamente es importante respetar los intervalos mínimos que deben transcurrir entre las diferentes dosis (17,18,39)
a. El intervalo mínimo entre cada una de las tres primeras dosis de DPT, Hib y polio es de 4 semanas.
b. El intervalo mínimo entre las dosis de refuerzo de DPT es de 6 semanas.
c. La 4ta dosis de Hib se aplica con un intervalo mínimo de 8 semanas y solamente si el niño o niña, tiene una edad entre 12 meses y 5 años y las tres primeras dosis se aplicaron antes de los 12 meses de edad. Después de los 15 meses de edad solo se aplica una dosis.
d. Para la vacuna contra el Virus de Hepatitis B (HVB), el intervalo mínimo entre la 1ra y 2 da dosis es de 4 semanas y entre la 2 da y la 3 ra dosis, de 8 semanas.
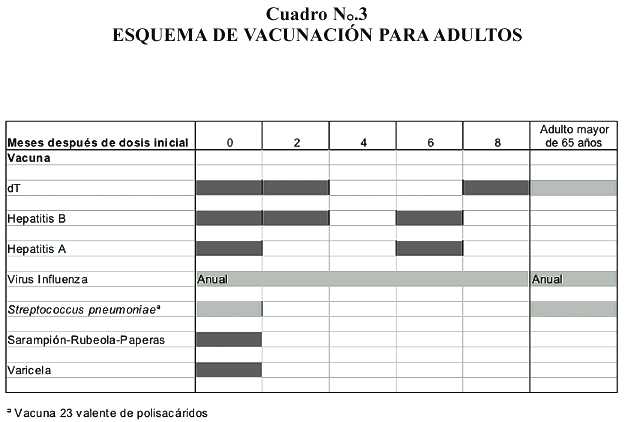
Vacunación para adultos
Las políticas de salud pública sobre inmunizaciones en Costa Rica han estado orientadas a evitar enfermedades prevenibles por vacunación en la población menor de 4 años y solo recientemente, se han desarrollado actividades en la población escolar y adolescente. Es tiempo de revisar los requerimientos de inmunizaciones de la población adulta y de ofrecer un esquema que permita evitar enfermedades prevenibles por vacunación en el adulto mayor y en los adultos menores de 65 años.
Las actividades de vacunación en adultos producen una población más sana, evitan la transmisión de enfermedades a niños y niñas y reducen el ausentismo laboral (6,7,23,39) Una iniciativa mínima es la que esquematizamos en el Cuadro N ° .3 y discutimos a continuación:
a. Difteria y tétanos: aplicar una dosis de dT cada 10 años, como refuerzo de la vacunación de la infancia. Si el adulto nunca ha recibido esta vacuna, se deben aplicar 3 dosis, las primeras 2 separadas por 2 meses y la tercera 6 meses después de la 2 da dosis. La formulación dT contiene una cantidad reducida de toxoide diftérico en relación con la concentración en la formulación pediátrica ("2 Lf units vs 6,7-12,5 Lf units"), pero produce respuesta adecuada contra difteria en adultos y evita los efectos adversos del toxoide diftérico relacionados con la edad de la vacunación primaria y la cantidad de antígeno (28)
b. Hepatitis B: aplicar 3 dosis, separadas la 1ra de la 2 da por 2 meses y la 2 da de la 3 ra por 4 meses.
c. Hepatitis A: aplicar 2 dosis separadas por 6 meses.
d. Virus Influenza: aplicar una dosis anual, entre Diciembre y Marzo. Esta vacuna es especialmente importante en adultos mayores de 65 años (4)
e. Streptococcus pneumoniae: aplicar una dosis de la vacuna de polisacáridos (Pneumovax 23®) La aplicación de esta vacuna es especialmente importante en adultos mayores de 65 años (5)
f. Varicela: aplicar 2 dosis separadas por 2 meses en los individuos sin historia de varicela en la infancia.
g. Sarampión-Rubeola-Paperas: aplicar 1 dosis.
Vacunación en mujeres embarazadas
El riesgo de algún daño al feto durante su desarrollo por alguna vacuna aplicada a la madre durante el embarazo, es básicamente teórico. No existe evidencia de riesgo por vacunación de la mujer embarazada con virus inactivados, vacunas bacterianas o toxoides. Si hay evidencia del daño sobre el feto de algunas enfermedades infecciosas prevenibles por vacunación.
En general las vacunas con virus vivos están contraindicadas en mujeres embarazadas por el riesgo teórico de transmisión del virus al feto. La mujer que recibe una vacuna de virus vivos durante el embarazo o que se embaraza en las 4 semanas siguientes a la vacunación, debe recibir consejo sobre los riesgos para el feto, pero este hecho no se debe tomar como indicación de aborto terapéutico (13,26,39) Las vacunas que se pueden aplicar sin restricción en la mujer embarazada son: Hepatitis B, Influenza, Difteria y Tétanos (27,36,39) Las vacunas contraindicadas en la mujer embarazada son: Sarampión, Rubeola, Paperas, Varicela, BCG y la vacuna viva atenuada para virus Influenza (18,27,39)
Vacunación en situaciones especiales
a. Uso de inmunoglobulina i.v: no se debe utilizar inmunoglobulinas simultáneamente con SRP, si no se puede evitar, entonces aplicar los productos en diferentes sitios, revacunar o evaluar seroconversión 3 meses después de aplicar la vacuna. Si se aplica SRP se debe distanciar la aplicación de inmunoglobulina por 2 semanas. Si se aplica la inmunoglobulina primero por vía i.v como tratamiento para inmunodeficiencias esperar 8 meses, para púrpura trombocitopénica idiopática esperar 8-10 meses, para enfermedad de Kawasaki esperar 11 meses. La vacunación posparto en mujeres susceptibles, con vacuna de rubeola o SRP no se debe diferir por el uso de Globulina anti-Rho(D) o cualquier otro producto sanguíneo aplicado durante el último trimestre del embarazo o durante el parto. La mujer debe recibir la vacuna inmediatamente después del parto y de ser posible detectar seroconversión para rubeola y sarampión tres meses después de la inmunización (26,39)
b. Inmunodeficientes: se debe evitar la vacunación de varicela en casos de inmunodeficiencia de tipo celular, pero se puede aplicar en casos de inmunodeficiencia de tipo humoral. Cuando existe historia familiar de inmunodeficiencia, se debe demostrar la inmunocompetencia del individuo que se va a vacunar antes de aplicar varicela. No se deben utilizar en inmunodeficientes las vacunas de: SRP, Polio vía oral y BCG. Evitar el uso de vacuna de polio oral incluso en los familiares del paciente (11,26,39)
c. Quimioterapia, inmunosupresión o esteroides: el intervalo entre la vacunación y el inicio del tratamiento debe de ser de por lo menos 2 semanas. Se debe evitar la vacunación durante quimioterapia o radioterapia. No vacunar con SRP ni con BCG. Evitar el uso de vacuna de polio oral incluso en los familiares del paciente. Una dosis de 2 mg/Kg. pc o 20 mg/día de prednisona (o la dosis equivalente de otro esteroide) por 2 o más semanas es inmunosupresiva y se debe evitar el uso, en estos pacientes, de vacunas que contienen virus vivos y se debe tener en cuenta que puede haber una respuesta inmune reducida a otras vacunas. Se debe esperar al menos 1 mes después de que ha terminado la terapia con esteroides para administrar vacunas que contengan virus vivos. Terapia con esteroides menor de 2 semanas, a dosis bajas o moderadas, dosis a largo plazo por días alternos con preparaciones de acción corta, terapia de reemplazo a dosis fisiológicas, productos tópicos (piel y ojos), aerosoles e inyecciones articulares no contraindican el uso de vacunas con virus vivos (11,26,39)
d. Prematuridad: los niños de pre-término (menor de 37 semanas de gestación) y de bajo peso al nacer (menor de 2500gramos) deben recibir todas las vacunas del esquema de vacunación a la misma dosis y edad cronológica que los niños de término. Sin embargo se debe tomar en cuenta que se ha demostrado respuestas inmunológicas disminuidas en recién nacidos con peso menor de 1500 gramos o edad gestacional menor de 29 semanas. Si el peso es menor de 2000 gramos no aplicar BCG y en el caso de Hepatitis B se debe aplicar al egreso, pero si el recién nacido pesa menos de 2000 gramos, se debe hacer un esquema con tres dosis más de Hepatitis B. Para el resto del esquema, la edad apropiada de vacunación es la cronológica, utilizando las mismas dosis e indicaciones que en los niños nacidos a término (13,39,47)
e. Infección por VIH: no usar vacuna de polio oral en los hijos de madres VIH+ ni en los pacientes infectados por VIH. Se puede usar varicela si el porcentaje de linfocitos T es mayor al 25% (11,26,46)
f. Asplenia: la condición de asplenia puede ser el resultado de una esplenectomía, de padecer enfermedades como la drepanocitosis (funcional) o de la ausencia congénita del bazo. Para evitar la infección por S. neumoniae, además de la profilaxis con penicilina, es importante tener presente la vacunación en estos pacientes y en los que se programan para una esplenectomía. La inmunización con vacuna contra S. pneumoniae de polisacáridos con 23 antígenos, se debe aplicar por lo menos 2 semanas antes de la esplenectomía. En las esplenectomías de emergencia la vacuna se puede aplicar con buena respuesta hasta 2 semanas después de la cirugía. El refuerzo de esta vacuna se recomienda que se aplique cada 5 años. La misma recomendación sobre la vacunación inicial se aplica a otras vacunas a base de polisacáridos en estos pacientes como Haemophilus influenzae tipo b y Neisseria meningitidis del grupo C. El resto de las vacunas en estos casos no tienen restricciones. En niños menores de 23 meses es preferible utilizar la vacuna 7v conjugada contra S. pneumoniae, porque la vacuna de polisacáridos no produce una respuesta adecuada antes de los 2 años de edad (10, 33,34,35,37,39,44).
Temas de controversia en relación con vacunas
a. Timerosal: el timerosal es una sustancia que se agrega a las vacunas como preservante contra contaminación bacteriana desde 1930. Contiene cerca de 49% de etil-mercurio. La baja concentración en las vacunas de mercurio no produce efectos adversos, además son muy pocas las vacunas que actualmente contienen timerosal (algunas de influenza y dT) No hay evidencia de asociación entre timerosal y autismo (3,19,43)
b. Autismo: muchos estudios han revisado si existe una relación entre vacunas y autismo, sin embargo no se ha encontrado evidencia de asociación alguna. Una publicación reciente del "Institute of Medicine", en la cual se analiza la evidencia sobre la relación entre autismo y vacuna de SRP concluye que no hay asociación entre estos dos hechos (9,46)
c. Enfermedad neurológica: se ha planteado la hipótesis de que la vacuna de Hepatitis B pueda asociarse con la generación de esclerosis múltiple u otras enfermedades desmielinizantes, sin embargo los estudios sobre el tema no demuestran alguna asociación (15)
Vacunas combinadas
Un opción actual de vacunas es el uso de vacunas combinadas, que permite reducir el número de inyecciones que se aplican al niño o la niña. Estas vacunas combinan DPT con Polio, HVB, Hib (6,29,30)
Algunos grupos en el Reino Unido (31) han reportado interferencia de la vacuna acelular de pertusis de dos o tres componentes con la respuesta a Hib, sin embargo no esta claro si las diferencias en la respuesta se deben a que solo se aplican 3 dosis de esta vacuna y no las cuatro que se recomiendan en Costa Rica.
Otros estudios han demostrado respuestas adecuadas a todos los antígenos en las vacunas combinadas (8,25,41)
También están disponibles combinaciones de Hepatitis A y Hepatitis B.
La vacuna DPT se ofrece con varias opciones para el componente contra Tosferina: como célula completa que corresponde a un macerado de Bordetella pertussis o como la mezcla de 2 (toxoide de pertusis (PT), hemaglutinina filamentosa (FHA)), 3 (PT, FHA, pectactina ) o 5 (PT, FHA, pectactina, fimbria tipos 2 y 3)) componentes que representan los inmunógenos de B. pertussis. La eficacia es similar en las diferentes vacunas con componente acelular, y tienden a producir menos efectos adversos que la vacuna de célula completa (12,29,32,42)
Conservación y manejo de vacunas
Tan importante como conocer aplicación, dosis y efectos adversos de las vacunas, es tener el conocimiento para conservar las vacunas adecuadamente y garantizar, que se aplica un producto que tiene las condiciones de calidad para producir el estimulo sobre el sistema inmune que permita, una adecuada protección contra las enfermedades prevenibles por vacunación.
El cuidado de la cadena de frío, la temperatura de conservación y la fecha de vencimiento, son elementos que el vacunador debe controlar y mantener dentro de las recomendaciones para cada vacuna.
Información sobre vacunas en internet
1. Para consultas sobre vacunas y sus efectos adversos en Costa Rica: vacunas@hnn.sa.cr
2. Sobre inmunizaciones en general:
http://brightoncollaboration.org/en/index.html
http://www.chop.edu/consumer/jsp/microsite/microsite.jsp?id=75918
http://www.vaccineinformation.org/
3. Vacunas y autismo:
http://www.nap.edu/books/030909237X/html/
http://www.cdc.gov/nip/vacsafe/concerns/autism/default.htm
4. Vacunas y timerosal:
http://www.cdc.gov/nip/vacsafe/concerns/thimerosal/default.htm
5. Contraindicaciones de las vacunas:
http://www.cdc.gov/nip/recs/contraindications_guide.pdf
Esta página contiene una guía excelente sobre el tema.
http://www.cdc.gov/nip/recs/contraindications.htm
6. Vacuna contra Hepatitis B y enfermedad neurológica:
http://www.nap.edu/books/0309084695/html/index.html
7. Vacunas y viajes:
8. Readecuación de esquemas de vacunación:
http://www.cdc.gov/nip/recs/child-catchup.pdf
9. Conservación y almacenamiento:
http://www.cdc.gov/nip/menus/vaccines.htm#Storage
Bibliografía
1. Advisory Committee on Immunization Practices. Combination vaccines. MMWR 48(RR5):1,1999. [ Links ]
2. Advisory Committee on Immunization Practices. Diphtheria, tetanus, and pertussis: recommendations for vaccine use and other preventive measures. MMWR 40(RR10):1,1999. [ Links ]
3. Advisory Committee on Immunization Practices. General recommendations on immunization. MMWR 51(RR2):1, 2002. [ Links ]
4. Advisory Committee on Immunization Practices. Guidelines for vaccinating pregnant women. Atlanta: U.S. Department of Health and Human Services 2003. [ Links ]
5. Advisory Committee on Immunization Practices. Preventing pneumococcal disease among infants and young children. MMWR 49(RR9):1, 2000. [ Links ]
6. Advisory Committee on Immunization Practices. Prevention and control of Influenza. MMWR 53(RR6):1, 2004. [ Links ]
7. Advisory Committee on Immunization Practices. Recommended adult immunization schedule-United States, 2003-2004. MMWR 52:965, 2003. [ Links ]
8. Advisory Committee on Immunization Practices. Update: vaccine side effects, adverse reactions, contraindications, and precautions. MMWR 45 (RR-12):1, 1996. [ Links ]
9. Advisory Committee on Immunization Practices. Use of diphteria toxoid-tetanus toxoid-acellular pertussis vaccine as a five-dose series. MMWR 49(RR13):1, 2000. [ Links ]
10. Advisory Committee on Immunization Practices. Use of vaccines and immune globulins in persons with altered immunocompetence. MMWR 42 (RR-4):1, 1993. [ Links ]
11. American Academy of Pediatrics Committee on Infectious Diseases. Recommendations for influenza immunization of children. Pediatrics 113: 1441, 2004. [ Links ]
12. American Academy of Pediatrics. Active and passive immunization. En: Pickering LK, ed. Red book: 2003 Report of the Committee on Infectious Diseases. 26th ed. Elk Grove Village IL: American Academy of Pediatrics; 2003. [ Links ]
13. American Academy of Pediatrics. Combination vaccines for childhood immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP), the American Academy of Pediatrics (AAP), and the American Academy of Family Physicians (AAFP). Pediatrics 103:1064, 1999. [ Links ]
14. American Academy of Pediatrics. Immunization in special clinical circumstances. En: Pickering L. ed. Red book: 2003 Report of the Committee on Infectious Diseases. 26th ed. Elk Grove Village IL: American Academy of Pediatrics, 2003. [ Links ]
15. American Academy of Pediatrics. Pertussis. En: Pickering L. ed. Red book: 2003 Report of the Committee on Infectious Diseases. 26th ed. Elk Grove Village IL: American Academy of Pediatrics, 2003. [ Links ]
16. American Academy of Pediatrics: Committee on Infectious Diseases. Recommended childhood and adolescent immunization schedule-United States, January-June 2004. Pediatrics 113:142, 2004. [ Links ]
17. Asociación española de pediatría. Manual de vacunas en pediatría. 2da ed. EGRAF: España, 2002. [ Links ]
18. Breukels M., Zandvoort A., van den Dobbelsteen G. et al.: Pneumococcal conjugate vaccines overcome splenic dependency of antibody response to pneumococcal polysaccharides. Infect. Immun. 69:7583, 2002. [ Links ]
19. Centers for Disease Control and Prevention. Recommended childhood and adolescent immunization schedule United States, July-December 2004. MMWR 53:Q1-Q4, 2004. [ Links ]
20. Chokephaibulkit K., Phongsamart W., Vanprapar N. et al : Catch-up vaccination against Haemophilus influenzae type b in human munodeficiency virus-infected Thai children older than 2 years old. Vaccine 22:2018, 2004. [ Links ]
21. Clover R.: Preventing invasive pneumococcal disease in children. J. Amer. Board. Fam. Pract. 16:464, 2003. [ Links ]
22. Davies J., Barnes R. & Milligan D.: Update of guidelines for the prevention and treatment of infection in patients with an absent or dysfunctional spleen. Clin. Med. 2:440, 2002. [ Links ]
23. DeStefano F. : Vaccines and autism. Pediatr. Infect. Dis. J. 20:887, 2002. [ Links ]
24. Edwards K. & Griffin M.: Great expectations for a new vaccine. N. Engl. J. Med. 349:1312, 2003. [ Links ]
25. Geier D., Geier M.: An evaluation of serious neurological disorders following immunization: a comparison of whole-cell pertussis and acellular pertussis vaccines. Brain Develop. 26:296, 2004. [ Links ]
26. Hellwig S., Rodríguez M., Berbers G. et al: Crucial role of antibodies to pertactin in Bordetella pertussis immunity. J. Infect. Dis. 188:738, 2003. [ Links ]
27. Huiid A., Stellfeld M., Wohlfahrt J. et al.: Association between thimerosal-containing vaccine and autism. JAMA 290:1763, 2003. [ Links ]
28. Immunization safety review committee. Immunization safety review: vaccines and autism. Institute of Medicine of the National Academies. Washington: The National Academies Press 2004. [ Links ]
29. Immunization safety review committee. Immunization safety review: Hepatitis B vaccine and demyelinating neurological disorders. Institute of Medicine of the National Academies. Washington: The National Academies Press 2002. [ Links ]
30. Jenson HB, Baltimore RS. Impact of pneumococcal and influenza vaccines on otitis media. Curr. Opin. Pediatr. 16:58, 2004. [ Links ]
31. Knezevic I., Griffiths E., Reigel F. et al.: Meeting report. Thiomersal in vaccines: a regulatory perspective. WHO Consultation, Geneva, 15-16 April 2002.Vaccine 22:1836, 2004. [ Links ]
32. Mallet E., Belohradsky B., Lagos R. et al: A liquid hexavalent combined vaccine against diphteria, tetanus, pertussis, poliomyelitis, Haemophilus influenzae type b, and hepatitis B: review of immunogenicity and safety. Vaccine 22:1343, 2004. [ Links ]
33. Mallet E., Matisse N., Mathieu N. et al.: Antibody persistence against diphteria, tetanus, pertussis, poliomyelitis and Haemophilus influenzae type b (Hib) in 5-6-year-old children after primary vaccination and first booster with a pentavalent combined acellular pertussis vaccine: immunogenicity and tolerance of a tetravalent combined acellular pertussis vaccine given as a second booster. Vaccine 22:1415, 2004. [ Links ]
34. Mangtani P., Cutts F. & Hall A.: Efficacy of polysaccharide pneumococcal vaccine in adults in more developed countries: the state of the evidence. Lancet Infect. Dis. 3:71, 2003. [ Links ]
35. National Advisory Committee on Immunization. Canadian immunization guide. 6 ed. Ottawa: Minister of Public Works and Government Services, 2002. [ Links ]
36. Posfay-Barbe K. & Wald E.: Pneumococcal vaccines: do they prevent infection and how? Curr. Opin. Infect. Dis. 17:177, 2004. [ Links ]
37. Principi N. & Esposito S.: Are we ready for universal influenza vaccination in pediatrics? Lancet Infect. Dis. 4:75, 2004. [ Links ]
38. Schmitt H., Booy R., Weil-Olivier C. et al.: Child vaccination policies in Europe: a report from the Summits of Independent European Vaccination Experts. Lancet Infect. Dis. 3:103, 2003. [ Links ]
39. Shatz D., Romero-Steiner S., Elie C. et al.: Antibody responses in postsplenectomy trauma patients receiving the 23-valent pneumococcal polysaccharide vaccine at 14 versus 28 days postoperatively. J. Trauma 53:1037, 2002. [ Links ]
40. Shatz D., Schinsky M., Pais L. et al: Immune responses of splenectomized trauma patients to the 23-valent pneumococcal polysaccharide vaccine at 1 versus 7 versus 14 days after splenectomy. J. Trauma 44:760, 1998. [ Links ]
41. Shatz D.: Vaccination practices among North American trauma surgeons in splenectomy for trauma. J. Trauma 53:950, 2002. [ Links ]
42. Slack M., Schapira D., Thwaites R. et al.: Responses to a fourth dose of Haemophilus influenzae type b conjugate vaccine in early life. Arch. Dis. Child. Fetal Neonatal 89:F269, 2004. [ Links ]
43. Vernon J., Andrews N., Slack M. et al. : Risk of vaccine failure after Haemophilus influenzae type b (Hib) combination vaccines with acellular pertussis. Lancet 361:1521, 2003. [ Links ]
44. Watson L., Wilson B. & Waugh N.: Pneumococcal polysaccharide vaccine: a systematic review of clinical effectiveness in adults. Vaccine 20:2166, 2002. [ Links ]
45. Whitney C., Farley M., Hadler J. et al. :Decline in invasive neumococcal disease after the introduction of protein-polysaccharide conjugate vaccine. N. Engl. J. Med. 348:1737, 2003. [ Links ]
46. Working Party of the British Committee for Standards in Hematology Clinical Hematology Task Force. Guidelines for the prevention and treatment of infection in patients with an absent or dysfunctional spleen. B.M.J. 312:430, 1996. [ Links ]
47. Zepp F., Knuf M., Heininger U. et al. : Reactogenicity and immunogenicity of a combined hexavalent tetanus, diphteria, acellular pertussis, hepatitis B, inactivated poliovirus vaccine and Haemophilus influenzae type b conjugate vaccine, for primary immunization of infants. Vaccine 22:2226, 2004. [ Links ]
* Servicio de Inmunología y Reumatología Pediátrica
Hospital Nacional de Niños "Dr. Carlos Sáenz Herrera"
Caja Costarricense de Seguro Social
Apartado 1654, 1000 San José, Costa Rica
Teléfono / fax: (506) 223 512
Email:oporrasm@hnn.sa.cr