Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Médica del Hospital Nacional de Niños Dr. Carlos Sáenz Herrera
versão impressa ISSN 1017-8546
Rev. méd. Hosp. Nac. Niños (Costa Rica) vol.36 no.1-2 San José Jan. 2001
Dra. Patricia Venegas *
Introducción
En niños con leucemia linfocítica aguda (LLA) las alteraciones cromosómicas tienen importancia biológica e influyen en el diagnóstico y pronóstico.
Tratar de entender los procesos leucomogénicos va de la mano con la identificación de las alteraciones cromosómicas específicas, el que dirige los sitios para estudios moleculares e identificar los genes que participan en la transformación y proliferación de las células leucémicas. Las alteraciones cromosómicas son un apoyo cuando los hallazgos morfológicos, citoquímicos e imnunofenotípicos son inconclusos.
Varias alteraciones estructurales cromosómicas han sido correlacionadas con el pronóstico (6). Esta información ha sido usada para designar protocolos de tratamiento, modificar terapias y clasificar pacientes en base a su riesgo.
Las alteraciones del cromosoma 11 en la banda q23 son relativamente frecuentes en niños con LLA, y pueden involucrar: translocaciones balanceadas y desbalanceadas, delaciones y duplicaciones. Aunque generalmente caracterizadas por hiperleucocitosis, edad muy temprana, falta de expresión CD 10, y una pobre respuesta al tratamiento, pertenecen a un grupo heterogéneo de leucemias de línea B o T y llevan una variedad de translocaciones incluyendo las t(4; 11), t(11; 19) entre otras (3).
La translocación t(4; 11) es una de las más frecuentes en infantes con LLA, también en leucemias secundarias (inhibidores de tipo isomerazas).
A nivel molecular el gen MLL sobre el cromosoma 11 q23 se fusiona con el gen AF4 en la región 4q21, produciendo un trascripto fusional quimérico MLL/AF4 (5,9).
Materiales y Métodos
4 pacientes infantes menores de 1 año fueron diagnosticados con LLA; el análisis del inmunofenotipo se llevó a cabo por citometría de flujo.
Las muestras de médula ósea fueron cosechadas por un método directo, los cromosomas fueron sometidos a un bandeo G (Tripsina-Giemsa), y se analizaron 20 mitosis por paciente.
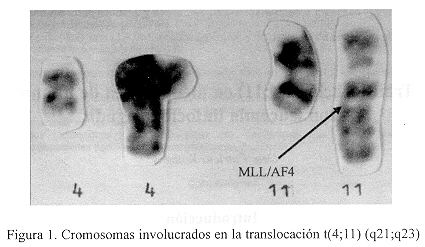
La foto del cariotipo parcial fue tomada por el Sistema Chantall, Leica, equipo instalado en el Laboratorio Clínico, Sección de Citogenética.
Resultados
El análisis de 20 mitosis de cada uno de los pacientes mostró la presencia de la translocación entre los brazos largos de los cromosomas 4 y 11, mostrando la t(4;11) (q21;q23), como único hallazgo citogenético. Se realizó un cariotipo parcial que se presenta en la Figura 1.
Citometría de Flujo: en análisis inmunofenotipo mostró los siguientes resultados: pro-B-LLA, HLA-DR+, CD10-, CD20CD19+, CD34+.
Marcador mieloide (CD15) positivo en un 75% de los pacientes.
Discusión
En la Figura 1 se muestra el hallazgo en médula ósea de la translocación entre los brazos largos de los cromosomas 4 y 11 resultando en una t(4;11), esta alteración cromosómica marca una área de contraste en la citogenética colocando a la LLA en un subset caracterizado por un inmunofenotipo pro-B y que presenta un pronóstico desfavorable. Esta translocación fusiona el gen MLL: "mixed lineage leukemia" (sinónimos ALLI, HRX y HRTXI) sobre la banda cromosómica 11q23 y el gene AF4 sobre el cromosoma 4q21 originando la expresión de un transcripto por la fusión de los cromosomas transiocados. El transcripto quimérico MLL-AF4 es el mediador de la transformación leucémica (10).
El gen MLL se involucro frecuentemente en translocaciones cromosómicas en LLA y en leucemia mielocítica aguda (LMA); alrededor de 30 diferentes parejas cromosómicas han sido descritas en rearreglos con el MLL (9), esto se conoce como "Promiscuidad Genética", otro gen que presenta el mismo comportamiento es el ETV6/TEL en la banda 13 del cromosoma 12. El estudio de estos rearreglos es de particular importancia porque permite conocer mejor la función de los genes involucrados, su contraparte nonnal y analizar los mecanismos que favorecen que los rearreglos cromosómicos ocurran en los procesos malignos (2).
Los rearreglos en 11q23 fueron también frecuentes en infantes con LMA, pero la restauración clínica fue similar en pacientes sin tales rearreglos (8).
En leucemia pediátrica esta translocación t(4;11) mostrada en la Figura 1 es una de las más importantes translocaciones cromosómicas y ocurre en un 2-5% en los niños con LLA, con un pico de incidencia de 42-66% en infantes. En adultos con LLA la incidencia es de 36%.
Nuestros infantes con la t(4;11) presentaron un fenotipo earlyB-precursor (también referido como pre-pre-B-LLA, pro-B-LLA o early B-LLA) y fueron caracterizados con la expresión de HLA-DR y CD-19 y la falta de expresión de CD-10 como es reportado por la literatura. La incidencia de pro-B es más alta en adultos con LLA (11- 12%) que en niños con LLA (5-6%). Las pro-B-ALL están asociadas con una alta incidencia de rearreglos en el gen MLL y con la coexpresión de antígenos mieloides (63%) (7); en nuestros infantes fue de un 75%.
De este modo una LLA con fenotipo proB-LLA y coexpresión de antígenos mieloides es altamente predictiva de t(4;11).
Debido al impacto de esta translocación en el pronóstico de la LLA su detección debe ser rápida y precisa. Algunos rearreglos de MLL fueron detectados por FISH (fluorescente in situ hibridization) en donde la citogenética fue normal (1).
La incidencia de translocaciones involucrando el gen MLL en 11q23 está muy aumentada en las leucemias que ocurren en infantes menores de 1 año de edad; datos moleculares y epidemiológicos han demostrado que algunas de estas translocaciones permitieron la oncogénesis en el útero (4).
Conclusiones
La translocación t(4; 11) es la alteración cromosómica más común en infantes con LLA y representa el factor pronóstico más importante para predecir una falla en la recuperación clínica y que requerirá una quimioterapia más intensiva, comparados con los pacientes negativos para esta translocación. Recientes avances en comprender las alteraciones que sufren los genes normales al fusionarse por translocaciones proveerá información importante para escoger nuevas estrategias terapéuticas lo cual permitirá una mejor respuesta clínica con menor toxicidad.
Resumen
La translocación t(4; 11) es el hallazgo cromosómico más común en infantes con LLA, es un indicador de pobre pronóstico y es un factor de riesgo independiente. Estos pacientes requieren de una quimioterapia intensiva.
Recientes avances en comprender la alteración en la función de los genes fusionados al compararlos con los genes normales provee conocimiento para nuevas estrategias terapéuticas, que permitirá mejorar la respuesta clínica, con menor toxicidad.
Summary
The translocation t(4; 11) is the most common finding in infants with ALL, and is a poor prognostic indicator and is a significant indepent risk factor. The patient with the t(4; 11) require more intensiva quimiotherapy.
Recent advances in understanding the alterations in the function of the fusion genes as compared with normal genes provide insights regarding new therapeutic strategies, wich should lead to improve clinical responsos with less toxicity.
Bibliografía
1- Avet-Loiseau H.: Fish analysis at diagnosis in acute lymphoblastic leukemia. Leuk Lymphoma. 33:5, 1999. [ Links ]
2- Berger R.: Prorniscuous genes and chromosomal rearrangement of haematopoietic malignancies. Ann. Genet. 42:1, 1999. [ Links ]
3-Behm F., Raimondi S., Frested t J. et al: Rearrangement of the MLL gene confers a poor prognosis in Childhood Acute Lymphoblastic Leukemia, Regardless of presenting age. Blood 87:7, 1996. [ Links ]
4- Hunger S., McGavran L., Meltesen L. et al: Oncogenesis in utero: fetal death due to acute myelogenous leukaemia with an MLL translocation. Brit. J. Haematol. 103: 2, 1998. [ Links ]
5- Konig M., Reichel M., Marschalek R. et al: A highly specific and sensitiva fluorescense in situ hybridization assay for the detection of t(4;11)(q2l;q23) and concurrent submicroscopic deletions in acute leukaemias. Brit. J. Haematol. 11 6:4, 2002.
6- Pui C-H., Crist W., Look A.: Biology and clinical significance of cytogenetic abnormalities in childhood acute lymphoblastic leukemia. Blood 76, 1990. [ Links ]
7- Richard A., Wendy S., Dieter F. et al: Acute Lymphoblastic Leukemia in adults. American Society of Hematology. Education Program Book. Miami Beach, Florida. 1998. [ Links ]
8- Satake N., Maseki N., Nishiyama M. et al: Chromosome abnormalities and MLL rearrangements in acute myeloid leukemia of infants. Leukemia 13:7, 1999. [ Links ]
9- van der Burg., Beveloo H., Langerak A. et al: Rapid and sensitive detection of all types of MLL gene translocations with a single FISH probe set. Leukemia. 13:12, 1999. [ Links ]
10- vonBergh.,Gargallo P., De Prijck B. Et al: Cryptict (4;11) enconding MLL-AF4 dueto insertion of 5 MLL sequences in chromosome 4. Leukemia. 15: 4, 2001. [ Links ]
* Laboratorio Clínico, Sección de Citogenética. Hospital Nacional de Niños "Dr. Carlos Sáenz Herrera", C.C.S.S. San José, Costa Rica.