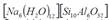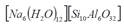Introducción
El objetivo general del presente trabajo fue investigar la factibilidad de sintetizar, a nivel de laboratorio, zeolitas utilizando como materia prima lodos provenientes del tratamiento de los efluentes industriales de los procesos químicos y electroquímicos de anodizado del aluminio de una industria de Ecuador.
La síntesis se realizó por activación alcalina de los óxidos de aluminio contenidos en el lodo de anodizado con silicato de sodio hidratado más hidróxido de sodio. La caracterización física y la microestructura de los lodos de anodizado se realizó por absorción atómica, por difracción de rayos X y por escaneado electrónico de barrido. La mineralogía y morfología de las zeolitas sintetizadas se realizó por difracción de rayos X y por escaneado electrónico de barrido, respectivamente.
La gestión ambiental de lodos de anodizado consiste en su disposición en vertederos. Otra práctica de disposición es el landfarming o disposición en el suelo (1). Al respecto Kiely (2) hace conocer que en aguas cuyo pH fluctúa entre 4,0 y 4,5 el aluminio se encuentra como un monómero lábil biodisponible y en esta forma es tóxico para las especies acuáticas. Esta forma lábil del aluminio puede ser muy inestable termodinámicamente.
La investigación sobre la síntesis de zeolitas a partir de los residuos industriales resultantes de los procesos de oxidación anódica del aluminio, como una alternativa de manejo sustentable, es aún escasa, pues en su mayoría se enfocan en la utilización en pequeñas proporciones para la obtención de cementos refractarios o ladrillos en mezcla con arcillas (3), (4), (5), o la obtención de aluminato de sodio o sulfato de aluminio (6), (7).
Se ha reportado la síntesis de zeolita A con base en los efluentes del baño agotado del decapado alcalino (6), (8). La presente investigación utilizó como materia prima, no los efluentes de los procesos intermedios, sino el lodo final que sale del filtro prensa de la planta de tratamiento de la industria.
Las zeolitas son aluminosilicatos cristalinos microporosos, en los que los átomos centrales de Silicio o Aluminio están enlazados por un oxígeno, formando una estructura tetraédrica de puentes de oxígeno no lineales. La unidad de construcción primaria de las zeolitas son los tetraedros 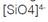 y
y 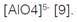
Como resultado del presente trabajo, se comprobó la hipótesis alternativa (H1), demostrando que es posible valorizar los lodos provenientes de los procesos de anodizado de aluminio, a través de la síntesis de la zeolita Na-P1 GIS. Esta zeolita tiene amplia aplicación en el área ambiental para la retención de elementos contaminantes en el tratamiento de aguas residuales y en el campo industrial (10).
Materiales y métodos
Muestreo y caracterización
Se tomaron muestras compuestas de lodos almacenados en cantidades de 7,92 m3 y 11,0 toneladas. Se determinó la humedad por gravimetría y el contenido de aluminio por el método de absorción atómica. Se analizó la microestructura y morfología de lodo seco y pulverizado, así como su composición elemental, utilizando la tecnología de escaneado electrónico de barrido.
La cristalinidad del lodo seco y pulverizado se determinó por difractometría de rayos X, con un ángulo 2θ variando desde 20° hasta 60° a intervalo constante.
Las mismas técnicas de difracción de rayos X y escaneado electrónico de barrido se emplearon para caracterizar las zeolitas sintetizadas. Los resultados del ángulo 2θ obtenidos por difracción de rayos X se contrastaron con los ángulos 2θ de las zeolitas sintéticas que constan en la tabla de patrones de identificación de zeolitas del Manual de patrones de zeolitas obtenidas por simulación y difracción de rayos X (11).
Método experimental de síntesis
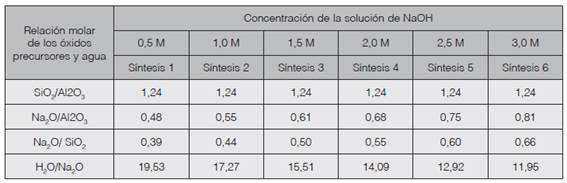
Para determinar las condiciones químicas de síntesis se realizó el balance de masa de entradas al sistema de reacción. Los cálculos de realizaron con base en los resultados del análisis de microscopía en las muestras de lodos y el aporte químico del silicato de sodio más soluciones de hidróxido de sodio en concentraciones de 0,5 M, 1,0 M, 1,5 M, 2,0 M 2,5 M y 3,0 M. Así la variable independiente a ser estudiada es el efecto de la concentración de NaOH en la síntesis. El cuadro 1 presenta las relaciones molares resultantes del ajuste de la composición química del gel y dentro de las cuales se realizó la investigación.
Las relaciones molares en estudio se han definido como las variables específicas de la síntesis de zeolitas, en tanto que la temperatura, la naturaleza de los reaccionantes y su forma de mezclado se mencionan como las variables cinéticas (12).
Se mantuvo constante la temperatura de activación envejecimiento y cristalización y el tiempo, en 100°C y 48 horas, respectivamente.
Resultados y discusión
Lodos de anodizado
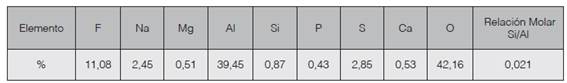
En las primeras muestras el contenido de humedad fue de 82,4% en tanto que en las segundas se redujo a un promedio de 42,75%, probablemente debido a una mejora en el equipo de filtración mecánica. El contenido de aluminio elemental en las primeras muestras, determinado por absorción atómica fue de 25,3%, en tanto que en las segundas muestras se obtuvo una media de 39,45% por escaneado electrónico (cuadro 2). Se observa la presencia de iones alcalino y alcalino térreos, que son necesarios para balancear la carga en la zeolita.
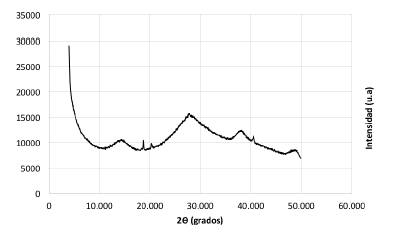
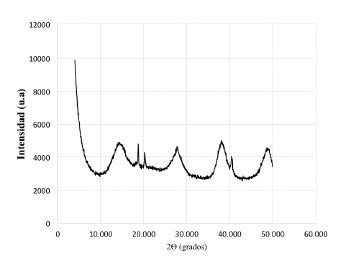
En la figura 1 no se observa la presencia de picos claramente definidos que puedan dar evidencia de alguna estructura cristalina. Los lodos sometidos a una segunda etapa de secado, igualmente no presentan ninguna fase cristalina (figura 2). En los dos casos el residuo anódico se encuentra en estado amorfo.
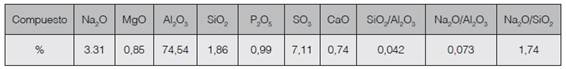
Las relación molar de SiO2/AI2O3 en la materia prima es 0,042 (cuadro 3), valor que no es adecuada para que se desarrolle el proceso de síntesis, por lo que se ajustó a un valor constante de 1,24. Dentro de este contexto se ha reportado un valor de 1,76 como adecuado para la síntesis de zeolitas de baja relación molar al utilizar lodos de plantas de tratamiento de agua (13), en tanto que lodos de los procesos de fabricación de papel con una relación molar SiO2/AI2O3 de 1,4 han sido favorables para la síntesis de zeolita A (14).
Cuadro 2 Composición elemental promedia de ocho escaneados en la muestra de lodo de anodizado secado a 100°C por 24 horas, determinada por MEB y relación molar Al/Si.
Cuadro 3 Óxidos presentes en la muestra de lodo de anodizado secado a 100°C por 24 horas, determinada por MEB y relaciones molares SiO2/Al2O3; Na2O/Al2O3 y SiO2/Na2O
Previo al tratamiento, los lodos de anodizado son amorfos, es decir, no presentan una microestructura definida, como se puede observar en la imagen electrónica de la figura 3, que corresponde al escaneado número 1 de los realizados en forma aleatoria y en diferentes sitios de la misma muestra.

Figura 3 Imagen de microscopía electrónica de barrido de lodo de anodizado seco a 100°C por 24 horas, no presenta ninguna microestructura definida.
Síntesis con solución de NaOH 0,5 M
En la figura 4 no se observan picos que puedan atribuirse a determinados minerales, es así que el lodo se encuentra aún en estado amorfo, lo cual indica que la concentración del activador químico y las relaciones molares en estudio aún no son las adecuadas.
La figura 5 evidencia que los lodos de anodizado activados con una solución alcalina 0,5 M, no presentan ninguna microestructura cristalina, permanecen amorfos. El nivel de alcalinidad de 19,53 de la prueba, definido por la relación molar H2O/Na2O aún es muy bajo como para solubilizar los iones de aluminio y de silicio en el agua para hacerlos disponibles para la síntesis.
Síntesis con solución de NaOH 1,0 M
La activación con la solución 1, 0 M aún no es efectiva en solubilizar el aluminio y el silicio en el agua para que se produzca la síntesis de la zeolita, pues el difractograma no evidencia aún picos que correspondan a un determinado compuesto químico (figura 6).
La imagen electrónica de la figura 7 exhibe un material amorfo, no presenta una microestructura definida, lo que significa que la concentración de la solución activante es aún insuficiente para activar la reacción de los precursores.
Síntesis con solución de NaOH 1,5 M a volumen constante
La activación de los elementos precursores con una solución de sosa 1,5 M condujo a la síntesis de la zeolita Na-P1 GIS ([Na6(H2O)12] [Si10Al6O32]), con tres tipos de mineralogía, además se obtuvo la zeolitas ACP-1 y sodalita octahidrato (cuadro 4).
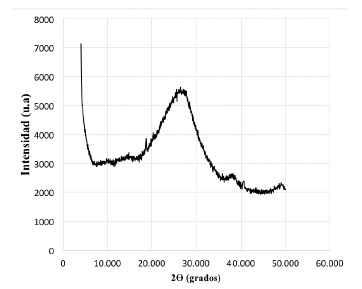
Figura 4 Difractograma de lodos de anodizado de aluminio activados con solución de NaOH 0,5M y con un módulo de SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,48; 0,39 y 19, 53 respectivamente

Figura 5 Imagen de microscopía electrónica de barrido de lodos amorfos de anodizado de aluminio activados con NaOH 0,5 M y con un módulo de SiO2/ Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,48; 0,39 y 19, 53 respectivamente.
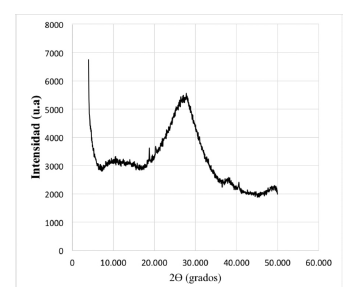
Figura 6 Difractograma de lodos de anodizado de aluminio activados con solución de NaOH 1,0 M y con un módulo de SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,55; 0,44 y 17, 27 respectivamente.

Figura 7 Imagen electrónica MEB de lodos amorfos de anodizado de aluminio activados con NaOH 1,0 M y con un módulo de SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/ Na2O de 1,24; 0,55; 0,44 y 17, 27 respectivamente
Cuadro 4 Zeolitas sintetizadas con una solución activante de sosa 1,5 M y con un módulo de SiO2/Al2O3; Na2O/ Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,61; 0,50 y 15,51 respectivamente
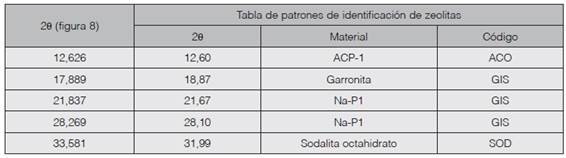
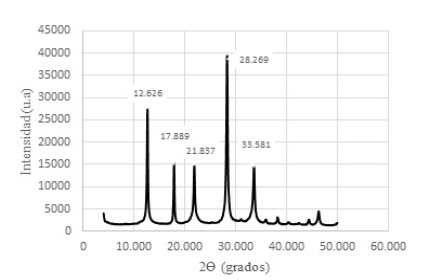
Figura 8 Difractograma de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 1,5 M y con un módulo de SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,61; 0,50 y 15,51 respectivamente.
Los ángulos 2θ, como ordenadas x en el difractograma de la figura 8 se han contrastado con los ángulos 2θ de la tabla patrón de identificación de zeolitas sintéticas y muestran una estrecha relación de valores, lo cual evidencia que en las condiciones de ensayo se han sintetizado las zeolitas con los códigos mencionados en el cuadro 4. La relación molar, que define el nivel de alcalinidad, H2O/Na2O con un valor de 15,51 prueba ser la adecuada para la síntesis.
La figura 9 evidencia una clara microestructura de zeolitas sintetizadas en las condiciones mencionadas de relaciones molares de los óxidos precursores. Para una mejor apreciación la imagen está ampliada a 7 μm.
De los datos procesados se obtiene un promedio de 10,07% de sodio en el gel de síntesis, esto representa un incremento del 311% con respecto al 2,45% presente en la materia prima.
Los valores promedios de las relaciones molares en el material zeolítico sintetizado, tomados de los resultados de escaneado electrónico, SiO2/Al2O3; Na2O/Al2O3; Na2O/SiO2 son respectivamente 4,84; 1,00 y 0,22.
Síntesis con soluciones de NaOH en concentraciones 2,0 M; 2,5 M y 3,0 M y a volumen constante
Las soluciones molares de NaOH en concentraciones 2,0 M, 2,5 M y 3,0 M, favorecen la síntesis de las mismas zeolitas obtenidas a la concentración de 1,5 M. El sobrenadante es muy alcalino, siendo un efluente que debe ser neutralizado para poder gestionarlo ambientalmente. Las figuras 10, 11 y 12 constituyen los difractogramas que muestran los ángulos 2θ de los materiales zeolíticos sintetizados.
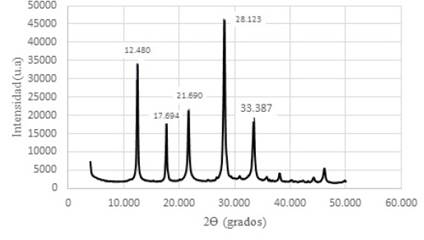
Figura 10 Difractograma de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 2,0 M y con un módulo SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,68; 0,55 y 14,09 respectivamente.
Como puede observarse los valores de los ángulos 2θ son aproximadamente iguales a los ángulos de los productos sintetizados con la solución de activación 1,5 M; lo que demuestra que no se logra resultados diferentes a concentraciones mayores de solución activante. Más bien es importante puntualizar que el exceso de NaOH es complejo de eliminar vía lavados sucesivos, centrifugación y filtrada, hasta lograr condiciones de pH no reactivas.
Las figuras 13, 14, 15 y 16 son las imágenes electrónicas de las zeolitas sintetizadas, que reflejan una clara microestructura.
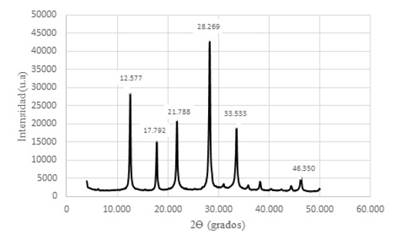
Figura 11 Difractograma de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 2,5 M y con un módulo SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,75; 0,60 y 12,92 respectivamente.
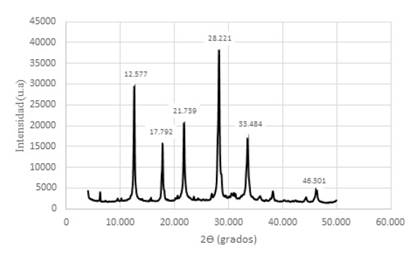
Figura 12 Difractograma de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 3,0 M y con un módulo de SiO2/Al2O3; Na2O/Al2O3; Na2O/ SiO2 y H2O/Na2O de 1,24; 0,81; 0,66 y 11.95 respectivamente

Figura 13 Imagen de escaneado electrónico de barrido de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 1,5 M

Figura 14 Imagen de escaneado electrónico de barrido de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 2,0 M
Se observa que a medida que la concentración de hidróxido de sodio aumenta, por sobre el valor de 1.5 M se crea un medio agresivo alcalino, que en lugar de mejorar la síntesis, provoca la deformación de los cristales (figuras 14, 15 y 16). El rango de pH en el sobrenadante al final del tiempo de reacción varió entre 11 y 12 para las soluciones molares de 3,0 M a 3,0 M y fue ligeramente menor para la solución 1,0 M.

Figura 15 Imagen de escaneado electrónico de barrido de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 2,5 M

Figura 16 Imagen de escaneado electrónico de barrido de Zeolitas GIS, ACP-1 y Sodalita octahidrato sintetizadas con solución activante de NaOH 3,0 M
La eliminación del exceso de sosa por centrifugación a 10 000 rpm por 15 minutos y filtración con papel filtro y mediante bomba de vacío, no es muy efectiva pues la disminución del Ph luego de cada operación no es muy significativa. Se realizaron 4 operaciones de lavado. Los valores de pH en las soluciones sobrenadantes, estuvieron en el rango de 11, 43 y 12, 17. En estas condiciones se perderá parte del aluminio como Al(OH)4 -, pues esta forma existe a valores de pH superiores a 9.