Introducción
Durante mucho tiempo las plantas han sido usadas con fines medicinales con base en las propiedades que poseen sus diversos compuestos químicos acumulados en distintos órganos. Actualmente la ingeniería genética de plantas, ha desarrollado sistemas que se basan en el uso células vegetales para la producción de proteínas recombinantes, lo cual permite el desarrollo de plataformas para la elaboración de biofármacos, enzimas y metabolitos secundarios. Las tecnologías establecidas de producción de biofármacos se basan en su mayoría en la utilización de bacterias, levaduras y células animales, sin embargo, el uso de células vegetales presenta ciertas ventajas con respecto a los organismos usados hasta ahora, por ejemplo ausencia de patógenos humanos, secuencias de ADN oncogénico, priones y endotoxinas (1).
En cuanto a la trasformación estable, Navarre y colaboradores (2), apuntan que las células de Nicotiana tabacum, en particular la línea BY-2, son las células más utilizadas para expresión de proteínas recombinantes, esto gracias a su rápido crecimiento, alta densidad y que son aptas para la transformación genética mediada por A. tumefaciens. En Nicotiana sp, el proceso de formación de callo ha sido esencial para el estudio morfológico y compresión del comportamiento de las células, aparte de su importancia en el desarrollo de poblaciones clonales, propagación masiva de plantas y manipulación genética (3).
La agroinfiltración es un proceso en el cual se rellena el espacio intercelular de la hoja con una suspensión de la bacteria que contiene el plásmido de interés (4). Los ensayos de agroinfiltración comúnmente se llevan a cabo usando N. tabacum, debido a que sus hojas son fáciles de infiltrar y manipular, y además porque A. tumefaciens no tiene ningún efecto visible en la salud de la planta, a diferencia de plantas como el tomate (Solanum lycopersicum) y Arabidopsis thaliana, en las cuales se produce una necrosis al realizar la agroinfiltración (5). Con esta técnica se busca lograr una expresión transitoria del gen de interés ya sea para estudios proteicos o para producción de proteínas a gran escala con fines comerciales.
Por otra parte, Agrobacterium tumefaciens posee ciertas características que la convierten en un organismo ideal para la introducción de genes foráneos a células vegetales, una de ellas es su capacidad para transferir la región T-DNA del plásmido Ti a la planta. Por lo tanto realizando intervenciones con técnicas biotecnológicas, es posible cambiar esa región del plásmido por una que contenga la secuencia de un gen de interés. Esta es la razón por la cual este plásmido, es el vector más utilizado para introducción de genes foráneos a las plantas (6).
Con el fin de establecer un protocolo de transformación estable y transitoria de forma que esté disponible para próximas investigaciones relacionadas con obtención de proteínas recombinantes en células vegetales de Nicotiana tabacum, se realizaron diferentes metodologías de transformación mediada por Agrobacetrium tumefaciens LBA 4404.
Materiales y Métodos
El presente trabajo se realizó en el Centro de Investigación de Biotecnología (CIB) del Instituto Tecnológico de Costa Rica (TEC) en Cartago, Costa Rica. Se empleó material vegetal (callos y plantas) previamente establecido en el CIB y además se utilizó la línea celular de BY-2 la cual fue facilitada por Centro Nacional de Innovaciones en Biotecnológicas (CENIBiot). La cepa bacteriana utilizada en el proyecto es A. tumefaciens LBA 4404, suministrada por el Dr. Andrés Gatica, investigador de la Escuela de Biología de la Universidad de Costa Rica. El plásmido que se utilizó para la transformación de la cepa fue pCAMBIA 1303, proveniente de E. coli, el cual posee regiones que codifican para GFP, GUS, resistencia a higromicina y resistencia a kanamicina.
Establecimiento del material vegetal in vitro
Introducción de semillas y micropropagación de N. tabacum L
Para obtener plantas in vitro de N. tabacum L se tomaron semillas en una gasa y se procedió a desinfectarlas con una solución de Agrimicyn® y Benlate® (5 g L-1) durante 30 minutos en constate agitación. Se le realizaron tres lavados con agua destilada estéril antes de colocar las semillas en una solución del 60% v/v de hipoclorito de sodio (3.5% i.a.). El material fue llevado a cámara de flujo laminar donde se hicieron nuevamente tres lavados con agua destilada estéril previo a ser colocadas en una solución del producto comercial Zerotol® al 15% por 3 minutos y seguidamente las semillas se colocaron en alcohol al 70% por 1 minuto. Las semillas se lavaron tres veces en agua destilada estéril antes de cultivarlas en medio MS al 100% de sales y fueron llevadas al cuarto de crecimiento a una temperatura de 25° ± 2°C, un fotoperiodo de 16 horas luz y 8 horas oscuridad y una luminosidad de 2000 lux. Una vez que las vitroplantas alcanzaron buen tamaño, se subcultivaron en medio MS (7) al 100% de sales.
Inducción de callogénesis y mantenimiento
Se siguió la metodología descrita por Ali y colaboradores (3), para lo cual se utilizaron explantes foliares de 1 cm2 de las vitroplantas obtenidas de Nicotiana tabacum L. en medio semisólido MS 100% (Murashigue y Skoog, 1962) al 3% m/v de sacarosa y suplementado con 2 mg L-1 de Ácido Naftalenacético (ANA) y 0,2 mg L-1 de 6-bencilaminopurina (BAP) como reguladores de crecimiento. Los explantes se cultivaron en condiciones de oscuridad a una temperatura de 25° ± 2°C según lo indicado por Santos y colaboradores (8). El subcultivo del material de callo se realizó en medio de cultivo con las mismas concentraciones de ANA y BAP. Por su parte el subcultivo de la línea celular de callo de tabaco BY-2 se realizó cada 5 semanas en medio de cultivo MSBY.
Pruebas de viabilidad de los callos con TTC
Para este ensayo se tomaron tres segmentos de callo de 1 cm2 aproximadamente de la línea T1 y BY-2 y se colocaron en un vial por separado. Se añadió solución de TTC (Cloruro de trifeniltetrazolio) al 1% hasta cubrir los segmentos de callo. Cada vial se incubó a 37°C por 36 horas. Para cada línea de callo el ensayo se realizó por duplicado.
Ensayos de sensibilidad
Se evaluó la sensibilidad de la bacteria Agrobacterium tumafaciens y de las células vegetales (callos de líneas celulares T1 y BY-2 y segmentos de planta) ante los antibióticos Higromicina B y Ceftriaxona (Axtar®), con el fin de obtener la concentración adecuada para ser utilizados como agentes selectivos durante el ensayo de la transformación genética (9).
Preparación de A. tumefaciens LBA 4404
Se creció la bacteria A. tumefaciens LBA 4404 transformada con el vector pCAMBIA 1303 en un medio LB líquido suplementado con 50 mgL-1 de kanamicina, rifampicina, y de acetosiringona. Las condiciones de crecimiento proporcionadas fueron una temperatura 25° ± 2°C y 150 rpm de agitación. La OD600 utilizada fue 0.5 - 0.6.
Ensayo de transformación estable
Transformación de los callos de N. tabacum
De cada línea celular se tomaron 50 callos de aproximadamente de 1 cm2 y se colocaron en placas Petri estériles (10 callos por placa) con 20 mL de la suspensión bacteriana de A. tumefaciens LBA 4404 transformada previamente preparada. Para cada línea de callo se establecieron dos tratamientos donde se evaluaron diferentes tiempos de transformación de 15 (T1 15m y BY-2 15m) y 30 minutos (T1 30m y BY-2 30m). Todos los tratamientos se agitaron de forma orbital durante la transformación. Una vez transcurrido el tiempo se eliminó el exceso de bacteria colocando los callos en un papel filtro estéril (9).
Co-cultivo y selección de callos transformados
Los callos se cultivaron en placas Petri con medio (MSBY y T1) suplementado con 50 mgL-1 de acetosiringona durante 48 horas que corresponde al tiempo de co-cultivo, en condiciones de oscuridad a 25° ± 2°C. Se colocaron 4 callos por placa (9). Luego del co-cultivo, los mismos se subcultivaron en medio suplementado con Higromicina B y Ceftriaxona.
Ensayo de transformación transitoria
Agroinfiltración al vacío y con jeringa
Para realizar la agroinfiltración al vacío se tomó como base la metodología propuesta por Medrano y colaboradores (9). Primeramente se cortaron las hojas de las plantas de N. tabacum y colocaron en una placa conteniendo solución bacteriana (aproximadamente 3 hojas por placa), con el envés de la hoja en contacto con la solución. Seguidamente se colocaron dichas placas en un desecador al vacío y se procedió a sellarlo adecuadamente. A continuación se aplicó vacío durante 40 segundos a una presión de 20 in.Hg y luego se soltó rápidamente el vacío.
En la agroinfiltración con jeringa primeramente se cortaron las hojas de las plantas de N. tabacum y se procedió a realizar una herida superficial (con ayuda de una aguja) en la parte abaxial de la hoja. Seguidamente, con una jeringa (sin aguja) conteniendo la solución bacteriana se forzó la entrada de la misma empujando suavemente el pistón de forma que se mantuvo una presión uniforme durante la infiltración del tejido. Una misma hoja se agroinfiltró en varios puntos.
En ambos casos se eliminó el exceso de bacteria y se colocaron en placas con medio MS 100% (7), al 3% m/v de sacarosa, suplementado con ceftriaxona.
Evaluación de la expresión estable/transitoria de los genes bajo estudio
PCR para los genes GUS y resistencia a Higromicina
Para el análisis de los callos, se tomó una muestra de cada una de los tratamientos y cada uno de los controles, las mismas se llevaron lioflizar para extraer ADN genómico. De igual forma las muestras tomadas fueron luego de 10 semanas desde que se establecieron los ensayos. Se utilizó el Kit de extracción Wizard® Genomic DNA Purification Kit, de la casa comercial Promega. Se cuantificó el ADN utilizando el Nanodrop para emplear el ADN en una PCR para amplificar el gen de resistencia a Higromicina (htp 400pb) y el gen GUS (677 pb), para lo cual se utilizaron los imprimadores htp (HF-5’-GATGTTGGCGACCTCGTATT-3’; y HR-5’-GTGTCACGTTGCAAGACCTG3’) y GUS (GF-5’-TAGAGATAACCTTCACCCGG-3’; y GR-5’-CGCGAAAACTGTGGAATTGA-3’ Los productos de PCR fueron analizados mediante una electroforesis en gel de agarosa al 1.5% (9).
Observación bajo microscopio de fluorescencia
Para verificar si la proteína de interés (GFP) estaba presente, se realizó una detección visual de la fluorescencia de GFP utilizando el microscopio de fluorescencia que se encuentra en el Laboratorio de Cultivo de Tejidos Animales del Instituto Tecnológico de Costa Rica, modelo Olympus BH2-RFL-T3.
Resultados
Establecimiento del material vegetal in vitro
Introducción de semillas y micropropagación de N. tabacum L
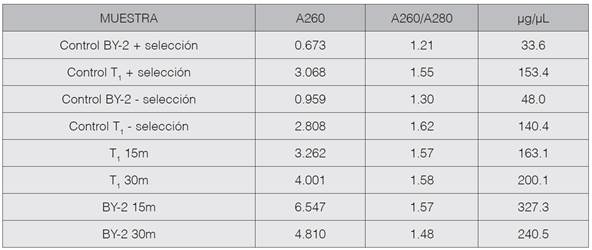
Luego de 2 semanas se evaluó la introducción donde se obtuvo un porcentaje de germinación del 100%. Las plántulas alcanzaron un tamaño apropiado para ser subcultivadas luego de 5 a 6 semanas. No se observó contaminación del cultivo por hongos o bacterias. La figura 1 muestra las vitroplantas obtenidas después de 2 y 4 semanas desde su introducción y subcultivo.
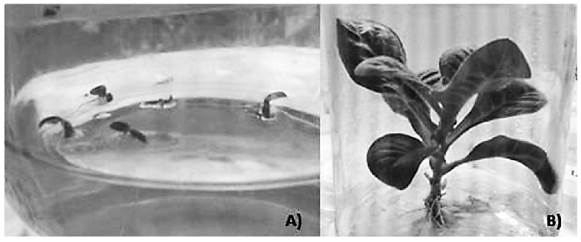
Figura 1 Vitroplantas de Nicotiana tabacum L después de 2 (A) y 4 (B) semanas desde su introducción y multiplicación respectivamente.
Inducción de callogénesis y mantenimiento
La figura 2 muestra el proceso de formación de callo a partir de tejido foliar de N. tabacum L., luego de una y dos semanas de su inducción, sin embargo, fue luego de 4 semanas que se observó la formación de callo completa. La frecuencia de formación para el callo T1 (Nicotiana tabacum L.) fue del 100%, sin embargo, se dio la formación de raíces, las cuales se eliminaron en posteriores subcultivos. El callo obtenido poseía una textura suave y friable, y su coloración fue blanca-amarilla.

Figura 2 (A) Explante foliar de N. tabacum después de una y tres (B) semanas de inducción. (C) Callo obtenido luego de un subcultivo de cuatro semanas.
Pruebas de viabilidad de los callos con TTC
Luego de las 36 horas de incubación, se obtuvo coloración roja en todos los segmentos de callo que se sometieron a la prueba, tanto para la línea BY-2 como para la línea T1. La coloración roja o rosada indica la transformación del TTC (2, 3, 5- cloruro de trifenil tetrazolio) a formazán por parte de las deshidrogenasas (11).
Ensayos de sensibilidad
La concentración más baja de Higromicina B que inhibió el crecimiento de los callos para la línea BY-2 fue de 100 mgL-1, por lo tanto ésta fue la concentración utilizada durante el proceso de selección de los callos transformados. Por otra parte la selección de los callos para la línea T1 fue de 50 mgL-1. Con respecto a sensibilidad a ceftriaxona, los ensayos permitieron determinar que para el caso de los callos 600mgL-1 fue la concentración más adecuada para no dañar las células vegetales. En el caso de las hojas para agroinfiltración, la concentración más adecuada fue 700mgL-1.
Ensayo de transformación estable
Luego de que se transcurrió el tiempo de co-cultivo, el crecimiento y desarrollo de los callos trasformados, ambos tratamientos de cada línea celular fueron comparados visualmente con los tratamientos control. Luego de 1 semana, fue posible observar que los callos (de la línea T1) se tornaron oscuros gradualmente. La necrosis u oscurecimiento se observó tanto en los tratamientos T1 15m y 30m como para los tratamientos control en medio de selección (figura 3). Con respecto a los callos de la línea BY-2, no se mostró un cambio que permitiera evidenciar la trasformación de estos callos. Por lo que se cultivaron los callos en medio con 200 mgL-1 con el fin de que la selección fuera más agresiva, sin embargo luego de 4 semanas, tal como se muestra en la figura 4 no se obtuvo más que cambio de color (marrón).
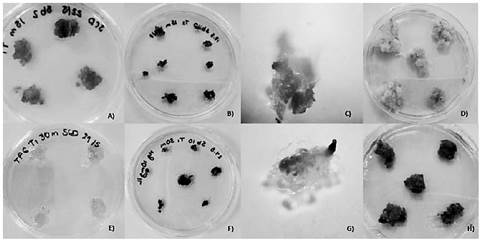
Figura 3 Proceso de selección de callos transformados de la línea T1 de los tratamientos 15m y 30m A) Tratamiento T1 15m luego de 2 semanas de establecido B) Separación de callos T1 15m cultivados en medio de selección (10 mgL-1 Hg) C) Callo (T1 15m) observado bajo el estereoscopio (10X) D) Control callo sin transformar en medio sin selección E) Tratamiento T1 30m luego de 2 semanas de establecido F) Separación de callos T1 30m cultivados en medio de selección (10 mgL-1Hg) G) Callo (T1 30m) observado bajo el estereoscopio (10X) H) Control callo sin transformar en medio de selección.
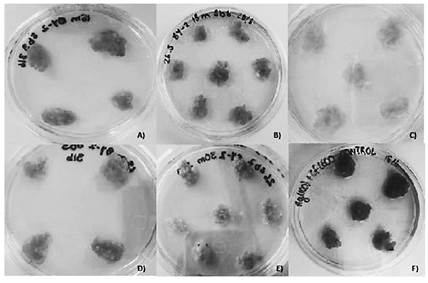
Figura 4 Proceso de selección de callos transformados de la línea BY-2 de los tratamientos 15m y 30m A) Tratamiento BY-2 15m luego de 2 semanas de establecido. B) Separación de callos BY-2 15m cultivados en medio de selección (200 mgL-1 Hg) C) Control callo sin transformar en medio sin selección. D) Tratamiento BY-2 30m luego de 2 semanas de establecido. E) Separación de callos BY-2 30m cultivados en medio de selección (200 mgL-1 Hg) F) Control callo sin transformar en medio de selección.
Observación bajo microscopio de fluorescencia
A partir de los posibles callos transformados, se prepararon muestras para ser observados bajo el microscopio de fluorescencia. Se observó fluorescencia débil para los tratamientos controles (no transformados), mientras que para los callos transformados sí se observó fluorescencia más intensa (figura 5).
En el caso de los ensayos de agroinfiltración al vacío (figura 6) y por jeringa (figura 7), fue posible observar fluorescencia en sistema vascular, estomas y tricomas principalmente, mientras que en el ensayo control (figura 8) se observaron estomas, tricomas y sistema vascular que emitían muy poca o ninguna fluorescencia.
PCR para los genes GUS y resistencia a Higromicina
El siguiente cuadro muestra la cuantificación del ADN extraído de cada uno de las muestras a analizar, donde se obtuvieron concentraciones adecuadas (cuadro 1.), sin embargo se considera que la integridad del ADN fue baja. Por otra parte, los valores obtenidos con respecto a la absorbancia A260/A280 no indican alta pureza, sin embargo se emplearon para realizar la PCR.
La PCR se realizó utilizando primers específicos para detectar los genes hpt y GUS. Los productos de PCR a la hora de que se realizó la electroforesis, mostraron ser positivos, debido a que se logró amplificar el gen de resistencia a Higromicina (htp 400pb) para todos los tratamientos de callos transformados (T1 15 m, T1 30 m, BY-2 15m, y BY-2 30m). Los controles de línea BY-2 mostraron ser negativos, sin embargo los controles para la línea T1 fueron positivos para este gen, lo cual no se esperaba (figura 9.). De igual forma sucedió para el gen GUS (677 pb), en donde se observa el amplicón para todos los tratamientos, excepto para el BY-2 15m. Además, los controles muestran nuevamente ser negativos para la línea BY-2, pero no así para los de la línea T1. De tal manera, que se logró confirmar molecularmente la integración de los genes del vector en el ADN nuclear del callo transformado de la línea BY-2.
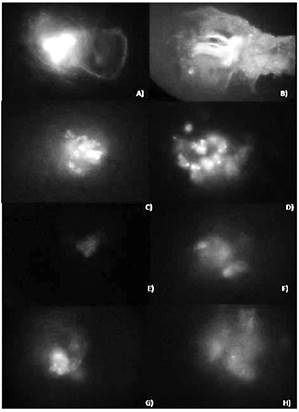
Figura 5 Expresión de GFP en callo transformado observado bajo microscopio de fluorescencia para los tratamientos A) T1 15 m B) T1 30 m C) BY-2 15m D) BY-2 30m E) Control T1 en medio de selección F) Control T1 en medio sin selección G) BY-2 en medio de selección H) BY-2 en medio sin selección.
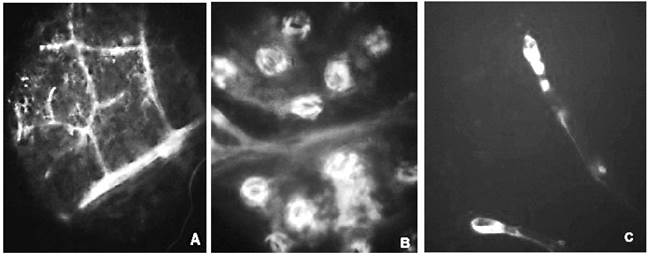
Figura 6 Corte paradermal abaxial de hojas agroinfiltradas al vacío de Nicotiana tabacum. A: 40X (A) nervadura reticulada (B) estomas (C) tricomas.
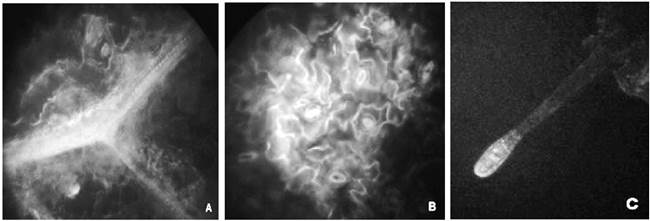
Figura 7 Corte paradermal abaxial de hojas agroinfiltradas con jeringa de Nicotiana tabacum. A: 40X (A) nervadura reticulada (B) estomas (C) tricomas.
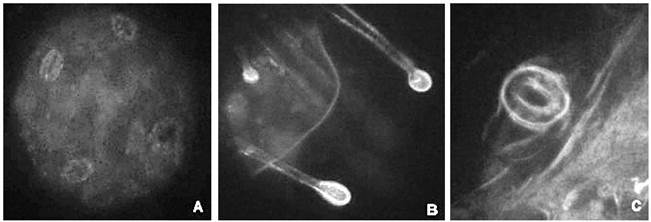
Figura 8 Corte paradermal abaxial de hojas del ensayo control de Nicotiana tabacum. A: 40X (A) estomas (B) tricomas (C) estoma.
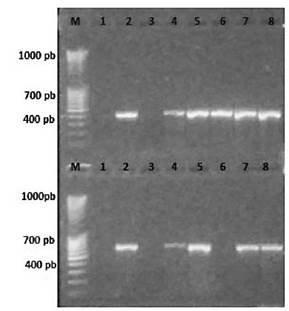
Figura 9 Electroforesis en gel de agarosa (1.5%) de los productos de PCR obtenidos de los callos transformados: M. Marcador Mass Ruler DNA 1. BY-2 en medio de selección 2. Control T1 en medio de selección 3. BY-2 en medio sin selección. 4. Control T1 en medio sin selección 5. BY-2 30m 6. BY-2 15m 7. T1 30 m 8. T1 15 m.
Discusión
Ensayo de transformación estable
Como se mencionó, la ventaja de utilizar callos en los procesos de transformación genética radica en que hay bajo riesgo en que se generen mutaciones quiméricas en las plantas, a diferencia de otros tejidos diferenciados, sin embargo posee la desventaja de que es un proceso muy lento (12). Por otra parte, en la mayoría de los protocolos de transformación genética se recomienda el uso de compuestos fenólicos como inductores de los genes vir. En este caso se utilizó acetosiringona, con el fin de incrementar la eficiencia del proceso de transformación (13) (14).
Por otra parte, durante el proceso de transformación, para la línea T1 fue más fácil reconocer los posibles callos transformados ya que al subcultivarlos en medio selectivo con menor concentración de Higromicina (10 mgL-1), se observó el crecimiento aislado de los callos, coincidiendo con los reportado por Al Abdallat et al. (9), quienes obtuvieron crecimiento de callos transformados de Crataegus aronia luego de mantener y subcultivar durante 4 semanas en medio de selección a esta misma concentración de Higromicina.
La oxidación y necrosis que se observó en los callos (principalmente de la línea T1), se debe a la respuesta a las condiciones de estrés que genera la composición del medio de cultivo. Barbosa y Chaparro (15) explican que a partir de 25 mgL-1 la Higromicina B causa necrosis en los callos, por esta razón es que la concentración del antibiótico se bajó a 10 mgL-1 para favorecer el crecimiento de los posibles callos transformados. Por otra parte, según los mismos autores, es posible que los callos resistan de alguna forma a la acción tóxica de la Higromicina B, por lo que no todos mueren, lo cual puede ser una explicación al comportamiento observado en los callos de la línea BY-2, el cual presento únicamente un leve cambio de color a marrón.
Esto podría relacionarse con lo expuesto por Padilla y Burgos (16), quienes explican que en respuesta al antibiótico puede haber un incremento en las metilaciones del ADN, y por ende un reducido crecimiento de las células.
Ensayo de transformación transitoria
El análisis de la expresión de GFP se llevó a cabo el día siete después del procedimiento de la agroinfiltración. En este punto del ensayo fue posible observar importantes lesiones en las hojas agroinfiltradas. Estas lesiones consistían en un deterioro del material vegetal en las regiones próximas a los puntos de agroinfiltración. Según Rico et al. (5), los ensayos de expresión transitoria mediante Agrobacterium se llevan a cabo generalmente en N. tabacum debido a que dicha bacteria no genera ningún efecto visible en la salud de la planta. Hernández & González (17), reportan que antibióticos como rifampicina y cefotaxima (cefalosporina) pueden generar mínimos efectos secundarios (no fitotóxicos). Las pruebas realizadas para determinar la fitotoxicidad de ceftriaxona mostraron que no existe ningún efecto visible sobre la salud de la planta hasta una concentración de 700 mg. Sin embargo estas pruebas se realizaron con material vegetal que no se encontraba bajo condiciones de estrés (heridas, cambios de presión, introducción de una bacteria), por lo tanto poseían una mayor capacidad para soportar una concentración de antibiótico alta, a diferencia de aquellas hojas que fueron agroinfiltradas.
Di Sansebastiano y colaboradores (18) reportan que la expresión de GFP inhibió la organogénesis en células de N. tabacum transformadas de forma estable. Además indica que la saturación de las vacuolas con GFP causa efectos negativos en las células de Nicotiana tabacum, por lo tanto se puede asumir que la expresión transitoria de este gen marcador afecto la salud del tejido.
Evaluación de la expresión estable / transitoria de los genes bajo estudio
Observación bajo microscopio de fluorescencia
La proteína verde fluorescente es el gen reportero más utilizado y más efectivo en la ingeniería genética de plantas (19).
En el caso de los callos, los tratamientos T1 15m, T1 30m, BY-2 15 m y BY-2 30m, mostraron fluorescencia verde intenso, lo cual indica la expresión de la proteína verde fluorescente para cada muestra.
Con respecto a los ensayos de agroinfiltración, la localización de la proteína fluorescente observada en los estomas principalmente, se debe a que el GFP es un marcador que es soluble en las vacuolas (18). Estas últimas se encuentran en abundancia en las células oclusivas de los estomas, ya que ayudan a controlar procesos de intercambio gaseoso de la planta, por lo tanto se observa muy bien la expresión transitoria del GFP en estas estructuras.
En ambos ensayos, en el caso de los tratamientos control se observó una fluorescencia muy débil, sin embargo esto según Al Abdallat y colaboradores (9), se puede atribuir a la posible autofluorescencia que presentan las células. Además Gupta y Ibaraki (20), explican que es posible tener fluorescencia leve que puede deberse a compuestos producidos por la planta, en este caso la producción de algunos compuestos fenólicos o ciertos pigmentos característicos de N. tabacum pueden influir.
PCR para los genes GUS y resistencia a Higromicina
Una vez que se logró hacer una selección de los callos y estos se observaron en el microscopio de fluorecencia, se realizó una PCR para confirmar la presencia de los genes de hpt y GUS, presentes en el vector pCAMBIA 1303 y transferidos mediante la transformación con Agrobacterium. Los resultados de este análisis de ADN genómico afirman la presencia del gen hpt para todos los tratamientos como lo muestra la Figura 1, sin embargo para los tratamientos control de la línea T1 se obtuvieron bandas, lo cual no se esperaba ya que ambos son controles negativos.
A pesar de este resultado, puede considerarse despreciable ya que anteriormente las muestras al ser observadas bajo el microscopio de fluorescencia, no indicaron estar transformadas por ausencia de fluorescencia intensa.
De manera similar sucedió a la hora de comprobar la presencia del gen GUS, sin embargo no se obtuvo una banda para la muestra BY-2 15m (Figura 1). Lo anterior se puede deber que le producto de PCR no amplificara bien por la influencia de diferentes compuestos fenólicos generados por la necrosis celular, que como se mencionó, la línea BY-2 presentó inicio de necrosis o simplemente pérdida de viabilidad. En el Cuadro 1. se observa que la A260/A280 nm luego de cuantificarla en el Nanodrop ® para esta muestra fue de 1.57, lo cual según Garrido (20), indica que se obtuvo una baja calidad y pureza del ADN. El mismo autor menciona que es importante tener en cuenta este parámetro, esto porque la relación A260/A280 nm se espera que tenga un valor entre 1.8 y 2, por tanto las condiciones de calidad y pureza no eran óptimas.
Conclusiones
Se concluye que, bajo las condiciones de laboratorio y la metodología desarrollada se logró la germinación de las semillas y el crecimiento de las plántulas de Nicotiana tabacum L de forma exitosa, además se logró la inducción y establecimiento de un sistema de callogénesis somática a partir de segmentos de hojas de N. tabacum L, empleando ANA y BAP como reguladores de crecimiento.
La Higromicina B es un agente de selección adecuado para el desarrollo de ensayos de ingeniería genética de plantas, sin embargo, se debe de analizar el efecto sobre la viabilidad de las células sometidas a la transformación estable.
Respecto a los ensayos de transformación estable, se concluye que ambos tiempos de contacto entre la suspensión bacteriana y el callo (15 min y 30 min) son adecuados para el proceso de trasformación genética para ambas líneas utilizadas.
Al observar bajo el microscopio de fluorescencia la expresión de la proteína verde fluorescente (GFP) y por medio de la amplificación del gen htp y GUS por la técnica de PCR, se logró comprobar la integración de los genes reporteros en el genoma de N. tabacum L y N. tabacum L. cv. Bright Yellow 2.
El desarrollo de los ensayos de agroinfiltración por jeringa y al vacío fueron exitosos utilizando Nicotiana tabacum L y la cepa de Agrobacterium tumefaciens LBA 4404-2915 bajo las condiciones controladas proporcionadas en el laboratorio, estos resultados indican que la agroinfiltración es una buena técnica para producción de proteínas de interés farmacológico o industrial en un tiempo muy corto y con bajos costos.
Se recomienda el uso de agentes antioxidantes como el ácido cítrico, previo a que se realice la transformación estable, ya que se evita considerablemente la oxidación de los callos a transformar (13). Por otra parte, se recomienda que se añada L-cisteína, ditiotreitol (DDT) y tiosulfato de sodio al medio de co-cultivo ya que esto puede incrementar la eficiencia del proceso de transformación.
Secuenciar los productos de PCR de los callos transformados obtenidos usando primers específicos para detectar los genes de resistencia a Higromicina (hpt) y β-glucoronidasa (GUS) y de la proteína verde fluorescente (gfp) para así tener mayor certeza de la transformación del ADN genómico de las células de callo.
Con respecto a la transformación transitoria, se recomienda que para producción de proteínas a mayor escala, se optimice el protocolo establecido, ya que los niveles de expresión óptimos de la proteína se obtienen entre 2-3 días después de la agroinfltración (21)(22). Además se recomienda considerar el uso de material vegetal establecido en invernadero con el fin de disminuir costos (10).
Con respecto a la detección de GFP en el material transformado de forma transitoria, el microscopio que se utilizó solo permitía hacer una comprobación visual de la expresión del gen, por lo tanto se recomienda que para futuros proyectos se utilicen otras técnicas para comprobar esta expresión, como PCR. En caso de utilizar los mismos genes marcadores utilizados en este proyecto, se recomienda realizar además una detección de expresión transitoria evidenciando GUS.