Introducción
En Costa Rica se siembran 1633,6 ha de cebolla (1) y en la zona alta de Cartago, específicamente en los cantones de Oreamuno y Alvarado, se ubica la mayoría de los agricultores. Una de las principales fitopatologías fungosas que afecta a esta hortaliza es la enfermedad de la raíz rosada, cuyo agente causal es Setophoma terrestris, conocido anteriormente como Pyrenochaeta o Phoma (Mycobank, accesión MB514659). Este ascomiceto infecta el sistema radical de la planta, presentando un color rosado característico, cuya tonalidad varía en función de la severidad y el tiempo transcurrido desde la infección. Las plantas continúan emitiendo raíces pero sin lograr satisfacer sus requerimientos nutricionales, lo que provoca que el follaje se torne amarillento y presente enanismo, afectando la calidad y productividad, con pérdidas en algunos casos superiores al 90% (2), (3). Además en algunas ocasiones se confunde con la pudrición basal causada por Fusarium spp., que se caracteriza por su gran capacidad para colonizar el tejido deteriorado, en este caso por S. terrestris (4), (5). Por lo anterior, resulta de mucha utilidad aislar adecuadamente estos patógenos para crear estrategias para su combate.
El cultivo de microorganismos en medio líquido facilita la cuantificación del material y el análisis de sus características principales (6). Además, la producción es mayor en relación con medios semisólidos y es más económico. El objetivo de esta investigación consistió en establecer un protocolo para la optimización del crecimiento y la multiplicación en medio líquido de S. terrestris y Fusarium spp., para facilitar su identificación, manipulación y trabajos experimentales posteriores.
Materiales y métodos
El inóculo se inició con material (Fusarium spp. y S. terrestris) aislado previamente en el Centro de Investigación en Biotecnología (CIB) del Instituto Tecnológico de Costa Rica (ITCR). Este se subcultivó en varias ocasiones en medio de papa dextrosa acidificado (PDA acidificado), para garantizar la estabilidad de los cultivos axénicos. Los pre-inóculos se obtuvieron de secciones de agar de los medios de 5-6 días de crecidos.
Optimización de las condiciones de crecimiento
Para determinar los parámetros óptimos de incremento del micelio se evaluaron diferentes condiciones de temperatura, pH, agitación y fotoperiodo (cuadro 1). Se empleó un inóculo estándar de secciones de medio PDA de 6 días. Para cada uno se realizaron 4 repeticiones.
La producción de biomasa se cuantificó mediante la diferencia gravimétrica entre peso fresco y seco. En cada prueba, se evaluó durante 15 días el parámetro de interés y las demás condiciones se mantuvieron según lo informado en la literatura, como los óptimos para cada patógeno (pH 4 para S. terrestris, pH 6 para Fusarium spp., temperatura ambiente (22-24°C) oscuridad y 100 rpm para ambos). Se utilizó medio caldo PD marca comercial Difco® en Erlenmeyer de 250 ml con 100 ml de medio. Para determinar el peso seco las muestras se secaron en una estufa a 70°C por 24 h.
Cultivo en diversos medios de crecimiento
Se evaluaron cinco medios para S. terrestris y seis para Fusarium spp. durante 15 días (cuadro 2 ), bajo las siguientes condiciones físicas: S. terrestris: pH 4, oscuridad, 100 rpm y temperatura ambiente, Fusarium spp.: pH 6, oscuridad, 100 rpm y temperatura ambiente. Se realizaron cuatro repeticiones y como control se utilizó agua destilada.
Cuadro 2 Medios de cultivo evaluados en Setophoma terrestris y Fusarium sp.
| SETOPHOMA TERRESTRIS | FUSARIUM SP |
| Vaina de Judías | Papa dextrosa casero |
| Papa Dextrosa Casero | Papa dextrosa comercial |
| Papa Dextrosa Comercial | Spezieller Nährstof-farmer (SNA) |
| Avena | V8 |
| Extracto Mínimo | Avena |
| Agua (Control) | Sabouraud dextrosa |
| Agua (Control) |
El medio óptimo para cada hongo se estimó con los resultados obtenidos de biomasa, también se determinó el mejor para inducir la mayor cantidad de formación de estructuras reproductoras (conidios). Posteriormente se realizaron las curvas de crecimiento en los que indicaron ser los más adecuados. Se evaluaron siete frascos Erlenmeyer para cada hongo y se cuantificó por 17 días la producción de peso fresco, peso seco y conidios viables, tomando muestras cada 3 días.
Resultados
Optimización de las condiciones de crecimiento
Temperatura:
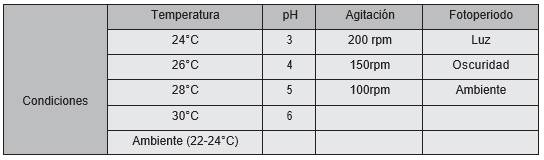
Se determinó que la mayor producción en peso fresco de Fusarium spp. se produjo a 30°C, con 12,2 g y la menor producción se obtuvo a 24 °C. En cuanto a S. terrestris la mayor producción de peso fresco se obtuvo a temperatura ambiente con 17,2 g y la menor a 24°C con 11,3g. En cuanto al peso seco se observó que la mayor cantidad de biomasa para Fusarium spp. fue significativamente mayor (p=0.000336) bajo condiciones de 30°C y temperatura ambiente, donde se registró una biomasa de 0,3 g. Para S. terrestris el mayor peso seco se logró a 28°C con 0,5g, con diferencias significativas (p=0.00000002337) (figura 1).
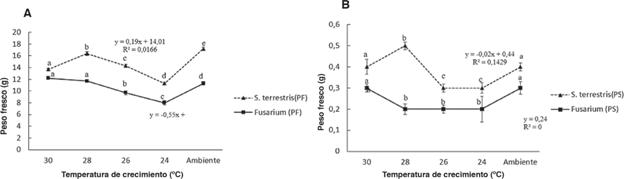
Figura 1 Datos promedio obtenidos del peso fresco (A) y seco (B) de Setophoma terrestris y Fusarium spp. a diferentes temperaturas.
pH:
La mayor producción en peso fresco de Fusarium spp. se dio a un pH de 6 con 10g ; a pH de 3, 4 y 5 la diferencia no es significativa (p=0.000262). En cuanto a S. terrestris el mayor peso fresco fue a pH de 4 con 17,8g y el menor a pH de 3 con 11,5g. Para el peso seco se observa que el pH no marcó diferencia, ya que los resultados obtenidos en la mayoría de los casos son de 0,2g. Para S. terrestris el mayor peso seco se obtuvo a pH de 4 con 0,7g (figura 2).
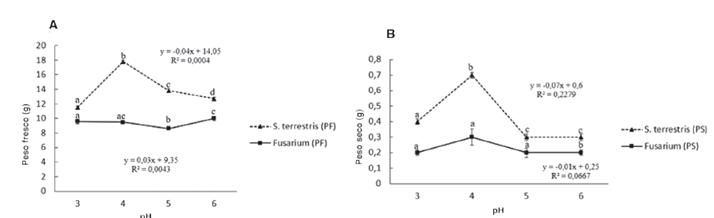
Figura 2 Datos promedio obtenidos de la biomasa correspondiente a los distintos pH utilizados, tanto de peso fresco (A) como de seco (B).
Agitación:
Se determinó que la velocidad de agitación apropiada para ambos microorganismos, tanto en peso fresco como seco es de 100 rpm, ya que con ésta se alcanzó el mayor crecimiento del micelio. A mayor número de revoluciones, disminuye la cantidad de biomasa producida por los hongos (figura 3). El análisis de varianza determinó que existen diferencias significativas en las velocidades de agitación utilizadas y todas eran relevantemente diferentes y afectaban directamente la producción de micelio (S. terrestris 3.53E-07; Fusarium 1.30E-08).
Fotoperiodo:
Para S. terrestris en la oscuridad se consiguió el mayor peso fresco 17,2g y seco 0,4g. El análisis de varianza indicó diferencias significativas entre los diferentes tratamientos (S. terrestris p=1.17E-05). A nivel cuantitativo, se evidencia que la oscuridad favorece la producción del micelio (figura 4), pero a nivel cualitativo, la luz continua induce la multiplicación del hongo. En el caso de Fusarium spp. se obtuvieron 11,3g en la oscuridad de peso fresco y 0,3g de peso seco. Se evidenciaron diferencias significativas (Fusarium p=0.000247), el mayor contenido se logró en la oscuridad.
Figura 3. Datos correspondientes a la biomasa promedio obtenida tanto en peso fresco (A) como seco (B) a diferentes revoluciones de agitación.
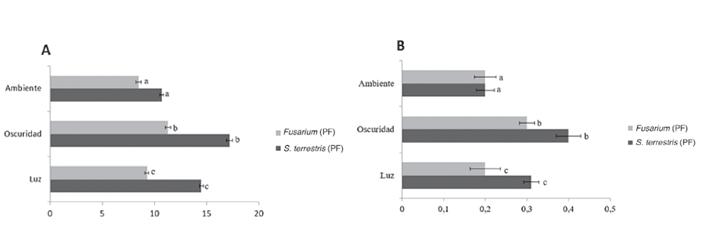
Figura 4. Resultados de biomasa promedio de peso fresco (A) y seco (B) obtenida en las pruebas realizadas bajo diferentes condiciones de fotoperiodo.
Pruebas con medios de cultivo
En los cuadros 3 y 4 se observan los resultados obtenidos de S. terrestris y Fusarium sp. con los medios evaluados.
El medio de papa dextrosa comercial en S. terrestris mostró pellets grandes y en Fusarium spp., indujo una formación heterogénea poco óptima, donde las macroconidias no estaban bien definidas. En papa dextrosa casero se favoreció el desarrollo de S. terrestris, con pellets más pequeños que los del comercial, donde la acumulación formó un micelio algodonoso en la capa superficial del Erlenmeyer. En el caso de Fusarium spp., papa dextrosa casero fue el que mostró una mayor tasa de crecimiento homogéneo con formación de pellets pequeños.
El medio avena en S. terrestris indujo una morfología irregular, ya que no presentaba pellets definidos. Se obtuvo un peso fresco significativamente alto de 41g de 0.8g (cuadro 3 y 4). En Fusarium spp., este medio no fue tan bueno. En agua se obtuvo la respuesta esperada para un control, ya que ninguno de los dos se pudo desarrollar en este medio.
Cuadro 3 Biomasa obtenida de S. terrestris en los diferentes medios de cultivo evaluados
| Medio | Peso Fresco | Peso Seco | Diferencia |
| Vaina de Judías | 45.05g | 1.90g | 43.15g |
| Papa Dextrosa Casero | 34.70g | 1.70g | 33.00g |
| Papa Dextrosa Comercial | 17.20g | 0.40g | 16.80g |
| Avena | 41.00g | 0.80g | 40.20g |
| Extracto Mínimo | 26.85g | 1.30g | 25.55g |
| Agua (Control) | 0g | 0g | 0g |
Cuadro 4 Biomasa obtenida de Fusarium sp en los diferentes medios de cultivo evaluados
| Medio | Peso Fresco | Peso Seco | Diferencia |
| Papa Dextrosa Casero | 21.65g | 0.80g | 20.85g |
| Papa Dextrosa Comercial | 11.30g | 0.30g | 11.00g |
| Spezieller Nährstof-Farmer (SNA) | 8.35g | 0.45g | 7.85g |
| V8 | 18.20g | 0.40g | 17.80g |
| Avena | 3.50g | 0.30g | 3.20g |
| Sabourad Dextrosa | 13.00g | 0.45g | 12.55g |
| Agua (Control) | 0g | 0g | 0g |
El de vaina de judías se utilizó solo para S. terrestris. Se formó un pellet más pequeño y homogéneo, donde se aprovechó todo el medio y presentó un incremento micelial significativo. Este fue el que logró la mejor respuesta por la cantidad producida y las características morfológicas de la misma.
En el SNA se observó un crecimiento regular de Fusarium sp., pero con una morfología diferente, ya que la consistencia era gomosa y densa, con una coloración blancuzca. El Sabouraud dextrosa produjo una buena cantidad de micelio pero con una morfología heterogénea.
Curvas de crecimiento
De los medios evaluados para S. terrestris el compuesto por vaina de judías, fue el que presentó los mayores pesos (fresco y seco) de micelio, además de la mayor cantidad de conidias viables por mililitro (figura 5).
Para Fusarium spp el medio compuesto por papa dextrosa comercial fue el que presentó los mayores pesos (fresco y seco) de micelio, además de la mayor cantidad de conidias viables por mililitro (figura 6).
Para facilitar el análisis, en los cuadros 5 y 6 se resumen los resultados obtenidos para los dos patógenos, con los diferentes medios de utilizados.
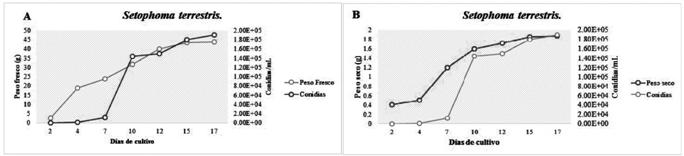
Figura 5 Muestra la relación existente entre el incremento de biomasa (peso fresco A y seco B) y la producción de conidias viables por ml en Setophoma terrestris, evaluado en medio vaina de judías.
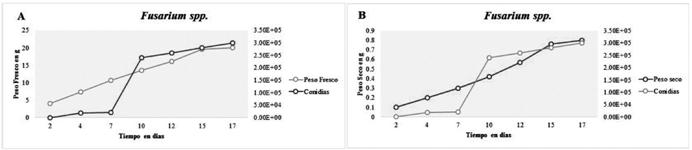
Figura 6 Muestra la relación existente entre el incremento de biomasa (peso fresco A y seco B) y la producción de conidias viables por ml en Fusarium spp Evaluado en medio papa dextrosa casero.
Cuadro 5 Resumen de la evaluación de los medios de cultivo utilizados en Setophoma terrestris.
| Medio | Biomasa obtenida | Inducción de estructuras reproductoras |
| Vaina de Judías | +++ | +++ |
| Papa Dextrosa Casero | +++ | ++ |
| Papa Dextrosa Comercial | ++ | ++ |
| Avena | +++ | + |
| Extracto Mínimo | ++ | ++ |
| Agua (Control) | 0 | 0 |
Cuadro 6 Resumen de la evaluación de los medios de cultivo utilizados en Fusarium spp.
| Medio | Biomasa obtenida | Inducción estructuras reproductoras |
| Papa Dextrosa Casero | +++ | +++ |
| Papa Dextrosa Comercial | ++ | + |
| Spezieller Nährstof-Farmer (SNA) | + | ++ |
| V8 | ++ | ++ |
| Avena | + | + |
| Sabouraud Dextrosa | ++ | + |
| Agua (Control) | 0 | 0 |
Discusión
Optimización de las condiciones de crecimiento
Temperatura
Los seres vivos requieren de un rango de temperatura óptimo para poder desarrollar sus funciones vitales, el cual si disminuye o aumenta puede afectar su sobrevivencia. En hongos, por debajo de la mínima no hay formación de micelio y por encima de la óptima se produce la muerte celular, por lo que es importante conocer el rango en el cual los microorganismos alcanzan la máxima velocidad de crecimiento celular, para lograr los mayores rendimientos. Este factor es uno de los más influyentes en el desarrollo de los fitopatógenos y en la expresión de los síntomas que producen. La óptima para Fusarium sp. fue a 30°C y la mejor esporulación se dio entre 24°C-26°C. Estos resultados indican que Fusarium sp posee una mayor capacidad para adaptarse a diferentes rangos de temperaturas. Watanable (7) y Bohórquez & Díaz (8) han demostrado esta capacidad e indican que los daños causados por este patógeno suelen ser mayores en áreas tropicales y subtropicales, aumentando su incidencia en temporadas de lluvia, por las variaciones ambientales que se relacionan con la capacidad de germinación de sus conidios.
La temperatura ambiente (22-24°C) fue la óptima para el desarrollo de S. terrestris, siendo más sensible a los cambios de temperatura que Fusarium sp., lo que coincide con la literatura y se relaciona con las técnicas que se utilizan para combatirlo, como es la solarización para la desinfección del suelo (2), (9). Se observa que S. terrestris es más susceptible a los cambios producidos por este factor, por lo que su presencia se centraría en ciertos rangos, mientras que Fusarium spp., presenta niveles más amplios, por lo que a nivel de agricultura es un fitopatógeno más problemático, con una gran variedad de hospedantes.
pH
Dentro de las características que tiene Fusarium sp de adaptarse a diversas condiciones, se muestra como el pH, no incide en la formación de masa micelial (peso fresco) y seco, esto quiere decir que es un hongo con particularidades, que le permiten ajustarse a diferentes condiciones agroambientales, encontrando nichos u hospederos muy variados, en los cuales se puede desarrollar. Este es uno de los más importantes en la agricultura, por los daños que provoca en el sistema radical y vascular de la planta. Se informa que la mayoría de las especies de Fusarium spp están capacitadas para crecer entre pH 2 a 9 y en ocasiones superiores. La influencia este factor puede variar dependiendo de la especie (10). Para S. terrestris, el pH del medio es más determinante para el hongo, ya que se puede observar que a pH 4, alcanza la mayor producción de micelio y decae conforme este valor se incrementa (2).
Agitación
Se observó que la velocidad de agitación de 100rpm, es la que produce la mayor cantidad de micelio y disminuyó su producción conforme se incrementó (200rpm), lo cual puede ser consecuencia del estrés oxidativo provocado en las células (11). Uno de los aspectos más relevantes a tener en cuenta durante el cultivo líquido con estos microorganismos, es la peculiaridad de que desarrollan diversas morfologías. A nivel macroscópico, existen dos tipos de morfología extremas: filamentosa (micelio disperso), o agregados de hifas compactos semiesféricos (pellets). Además existen morfologías intermedias, con formas más o menos agregadas de micelio en suspensión, como se obtuvo en Fusarium sp, donde se presentaron masas amorfas (11).
Fotoperiodo
El fotoperiodo puede generar un efecto diferente en los hongos filamentosos y se ha relacionado con la capacidad de inducir esporulación. En S. terrestris esto se evidenció notablemente en el tratamiento de luz continua, ya que los pellets obtenidos eran cuantitativamente mayores, en comparación con los sometidos a oscuridad y a luz ambiental. Se observó que la oscuridad favoreció la producción de biomasa pero a nivel cualitativo; la luz continua induce la multiplicación del hongo, lo que se podría explicar porque se promueve una reacción de estrés, que propicia reacciones de supervivencia, como la reproducción. Esta variable física es apropiada cuando se quiere inducir la formación de conidios.
Esta producción es mayor en la oscuridad, por lo que si el objetivo es el crecimiento, es recomendable mantener el cultivo bajo esta condición, que es la natural en que se encuentra el hongo en las raíces de sus hospederos, mientras que si lo que se busca es la multiplicación del patógeno, es preferible inducir un estrés, al exponer el material a una fuente de luz directa continua, lo que concuerda con lo reportado en la literatura (2).
Pruebas con medios de cultivo
Papa dextrosa comercial: es uno de los medios más utilizados, ya que al poseer una composición estandarizada favorece la reproducibilidad de los ensayos. La principal ventaja que presenta en relación con su equivalente casero, es el carácter translúcido, que permite evidenciar el crecimiento y la presencia de alguna contaminación. Este medio presentó una buena respuesta en S. terrestris pero no fue el idóneo para Fusarium spp.
Papa dextrosa casero: posee los mismos componentes que el medio comercial, pero al ser un extracto, su composición puede variar acorde a la variedad de papa que se utilice, la época del año, la ubicación, las condiciones ambientales y nutricionales. Esto afecta la reproducibilidad del experimento, aunque es favorable al reducir el costo en contraste con el comercial. En S. terrestris promovió la morfología de pellets con un acumulo de biomasa considerable. Para Fusarium spp. fue con el que se obtuvo mayor producción de micelio.
Avena: además de ser muy nutritivo, posee fosfato monopotásico (KH2PO4), que sirve como solución buffer e inductor en la producción de ácidos grasos, vitaminas y enzimas (12). En S. terrestris no existió una relación lineal entre el peso fresco y seco, lo que indica que el tejido se encontraba más hidratado, estaba más extendido y menos denso en contraste con los pellets que se obtuvieron con otros medios. En Fusarium sp la respuesta obtenida tampoco fue la óptima.
Vaina de judías: Existe una relación al exponer un hongo fitopatógeno a un extracto de un potencial huésped, como es el frijol (Phaseolus vulgaris), donde se da una respuesta inmediata de patogenicidad, en la cual se estimula la producción de estructuras reproductivas para colonizar el medio, esto fue evidente y el incremento significativo de estas estructuras en pellet permite correlacionarlo con un incremento en la producción de picnidios, que a su vez liberan conidios.
SNA: este medio pobre en nutrientes, se utiliza para la identificación y mantenimiento de especies de Fusarium sp., porque es capaz de inducir la esporulación y un buen desarrollo de células conidiogénicas, aunque la morfología de las macroconidias obtenidas no fue tan uniforme, a diferencia de la de los microconidios, igualmente muchas especies pueden formar clamidósporas fácilmente (13).
Sabourad dextrosa: utilizado comúnmente, está compuesto de dextrosa como fuente de carbono y digerido enzimático de caseína. Sirve para el aislamiento y mantenimiento de hongos en tubo inclinado. Debido a su composición, los microorganismos crecen exuberantemente. Es el medio estándar para observar la morfología típica, pero no fue el ideal para biomasa o para estudiar la esporulación.
V8: se encuentra entre los medios orgánicos más recomendados, por la presencia de tomate, espinacas, pepino, pimento rojo, zanahoria, remolacha, apio y esterol, que estimula la formación de micelio y de las estructuras reproductivas (14). La respuesta fue buena pero no la mejor.
Curvas de crecimiento
Se estima que la determinación del peso seco del micelio producido en medio líquido puede ser una medida válida de su proliferación, porque el desarrollo de las hifas no se ve restringido en ninguna dirección. En ambos se observó un crecimiento gradual del peso fresco y seco, así como de conidias intensificándose entre los 7 a 10 días de evaluación. Es importante conocer el tiempo en que los hongos incrementan la producción de conidios, si se desea usar como fuente de inóculo para futuros ensayos.
La gran cantidad de conidios viables que produce Fusarium spp., cerca de 30.000 /ml, lo convierte en uno de los patógenos más importantes para el sector agrícola.
En cuanto a S. terrestris se observó que los tejidos retienen mucha agua, porque al extraer la humedad, disminuyó aproximadamente en 40 g.
Conclusiones
Se propagaron S. terrestris y Fusarium spp. en medio de cultivo líquido, ambos produjeron diversas estructuras morfológicas, útiles para su identificación, incluidos los pellets. Se concluyó que Fusarium sp crece óptimamente a 30°C, pH 6, 100 rpm y oscuridad, mientras que S. terrestris lo hace a 28°C, pH 4, 100rpm, oscuridad (biomasa) y luz continúa para inducir la reproducción. Fusarium tiene la capacidad de crecer a diversas temperaturas y pH, mientras que S. terrestris es más sensible a las variaciones de temperatura y fotoperiodo.
Estos hongos tuvieron la capacidad de crecer en todos los medios de cultivo evaluados, pero para S. terrestris se determinó que su crecimiento micelial se favorece en el medio de papa dextrosa casero y su multiplicación en el de vaina de judías. Para Fusarium sp, se concluyó que crece significativamente mejor en el de papa dextrosa casero.
Agradecimientos
Se agradece a la Vicerrectoría de Investigación y Extensión el financiamiento de esta investigación.