Introducción
La laguna de Gandoca constituye la laguna costera más grande del Caribe Sur costarricense. En el 2010, presentaba una sucesión de agua salobre a agua dulce desde la confluencia al mar hasta la entrada del río Gandoca (1). Esto favorecía la diferenciación de las zonas boscosas asociadas, según el gradiente de salinidad, que empezaba con un área amplia de manglar con influencia de la marea y se extendía hasta el bosque tropical húmedo cercano al cuerpo de agua dulce (2) que está formado por pantanos y ríos.
La fuerte influencia de la marea sobre esta laguna provocaba condiciones que pueden afectar la distribución de la fauna (3). En el caso de la herpetofauna (anfibios y reptiles), se ha observado que son pocas las especies que pueden habitar o beneficiarse, estos ambientes con gradiente salino debido a que factores físicos extremos como los altos niveles de radiación solar, altas temperaturas, pero sobre todo la salinidad puede generar condiciones difíciles que provocan estrés fisiológico, principalmente para los anfibios, los cuales son organismos hipoosmóticos y poseen una piel extremadamente permeable (4). En las condiciones anteriores se incrementaban la posibilidad de desecación la pérdida de iones de agua en el medio marino (5), que ponían en riesgo la vida de los individuos y, por ende, de la población.
En esas condiciones, los reptiles presentaron mayor número de especies (riqueza de especie) capaces de tolerar el gradiente de salinidad, así como la temperatura y la radiación solar, ya que poseen una piel impermeable que les sirve como un mecanismo eficaz de protección (4). Además, especies de reptiles pelágicas y estuarinas poseen glándulas que les ayudan a excretar los excesos de sal (6), lo cual les permite explotar con mayor facilidad este tipo de hábitat sin entrar en condiciones de estrés fisiológico.
Considerando la amenaza creciente sobre el ecosistema de Gandoca, la escasa información publicada sobre los anfibios y los reptiles en estos ambientes con gradiente salino se propuso como objetivo de este trabajo caracterizar la herpetofauna de las asociaciones vegetales durante la época lluviosa, en la laguna del mismo nombre.
Materiales y métodos
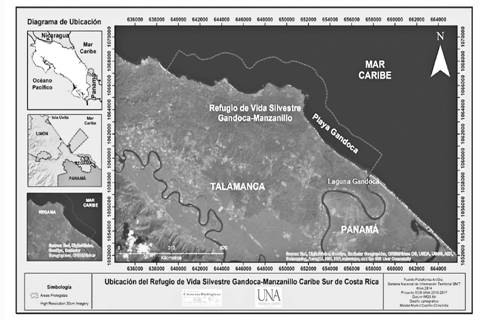
La Laguna de Gandoca se ubica en el Refugio Nacional de Vida Silvestre Gandoca-Manzanillo, valle de Sixaola, provincia de Limón, Costa Rica, en las coordenadas 09° 35’ 26’’ N y 82° 35’ 46’’ O. Presentaba en el momento de esta investigación una extensión de 1,2 km desde la desembocadura hasta la entrada del río. El espejo de agua y la vegetación circundante cubrían un área aproximada de 266 hectáreas (ha); el primero tenía una profundidad aproximada de 6,4 m (figura 1) (2).
La laguna de Gandoca está en la zona de vida de bosque muy húmedo tropical. La precipitación presenta valores entre los 2500 mm y 3100 mm anuales, con temperaturas promedio de 26° C y se clasifica como un humedal del sistema estuarino. En el 2010, se encontraban en el área una variedad de asociaciones vegetales que constituían humedales característicos de la zona, como yolillales (Rhaphia taedigera), manglares, pantanos herbáceos, bosque de cativo (Prioria copaifera) y bosque inundable influenciado por la laguna. Además, presentaba vegetación típica de playa como almendros (Terminalia catappa), cocoteros (Cocos nucifera) y uva de playa (Coccoloba uvifera).
Durante el mes de julio del 2010, se realizaron muestreos en tres asociaciones vegetales, a saber: manglar (9° 35’ 20” N y 82° 35’ 50” O), yolillal (9° 35’ 17” N y 82° 36’ 12” O) y bosque inundable influenciado por la laguna (9° 34’ 53” N y 82° 35’ 49” O). En cada asociación se efectuaron cuatro transectos, cada uno con una longitud de 50 m y una anchura de 3 m, ubicados a 10 m de la línea de agua y paralelos a esta. Se realizaron dos muestreos diurnos entre 7:00 a.m. y 12 p.m., y dos muestreos nocturnos entre 6:30 p.m. y 11:30 p.m.
Se utilizó el método de encuentros visuales (7) y búsquedas auditivas de individuos (8). En cada transecto, empleando búsqueda intensiva, se revisaron sustratos como troncos caídos, piedras, cuevas y la vegetación hasta una altura máxima de 2 m, para lograr la detección. Los individuos fueron capturados para su identificación en el mínimo taxón posible, empleando la literatura existente (9). Durante el muestreo, los individuos colectados se mantuvieron en recipientes plásticos para evitar recapturarlos, y posteriormente, fueron liberados. Además, se midieron la temperatura ambiente con un termómetro de alcohol, la cobertura vegetal con un densiómetro esférico (Modelo A) y la profundidad de la hojarasca con una regla milimétrica (±0,005).
En el análisis de los datos, se determinaron la equidad de especies con el índice de Shannon-Wiener (10), la diversidad con el índice de Margalef (11) y la dominancia con el índice de Berger-Parker (12). Para establecer la heterogeneidad entre las asociaciones vegetales, se calculó el índice cuantitativo de Sorensen utilizando el programa BioDiversity Pro and Richness 4 (13).
Resultados
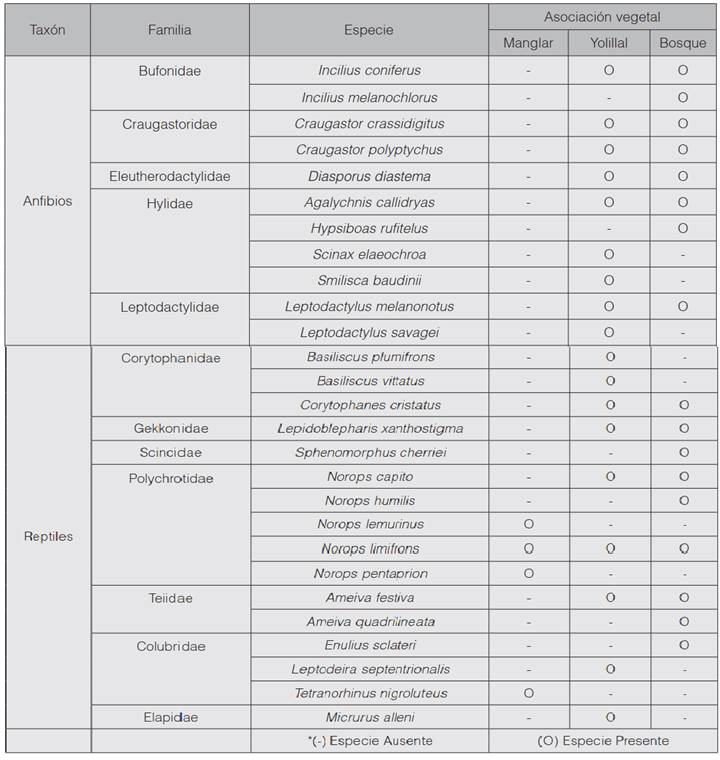
Se observaron 26 especies de herpetofauna, de las cuales 11 eran anfibios, ubicados en cinco familias, y las restantes, reptiles, que representaban a 7 familias. El yolillal fue la cobertura vegetal que presentó mayor riqueza de especies, con 18 (9 de anfibios y 9 de reptiles); seguido del bosque inundable influenciado por la laguna, con 17 (8 especies de anfibios y 9 de reptiles), y el manglar, con 4 especies de reptiles (cuadro 1).
Se ubicaron un total de 144 individuos, de los cuales 79 se encontraban en el yolillal, 59 en el bosque inundable influenciado por la laguna y 6 en el manglar. Norops limifrons fue la especie de reptil representada por el mayor número de individuos, con 24 en el yolillal, 10 en el bosque inundable influenciado por la laguna y solamente 3 en el manglar. Mientras que Craugastor polyptychus fue el anfibio que se halló con mayor frecuencia en el bosque inundable influenciado por la laguna, y Diasporus diastema, la especie representada por el mayor número de individuos en el yolillal (figura 2).
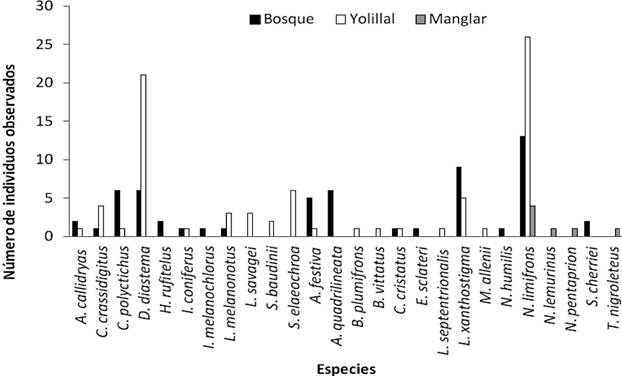
Figura. 2. Individuos por especie de anfibios y reptiles observados en las asociaciones vegetales que rodean la Laguna de Gandoca.
El bosque inundable influenciado por la laguna fue la asociación vegetal en la que se determinó la mayor equidad H = 2,47; seguido por el yolillal, con H = 2,18, y por último, el manglar, con H = 1,15. El índice de diversidad de Margalef presentó la misma tendencia, siendo el bosque inundable influenciado por la laguna, la asociación vegetal en la que se determinó el mayor valor DMg = 3,97; seguido del yolillal, con DMg = 3,87, y finalmente, del manglar, con DMg = 1,54. La asociación vegetal en la que se determinó mayor valor de dominancia fue el manglar d = 0,57; seguido del yolillal, con d = 0,3, y finalmente, del bosque inundable influenciado por la laguna, con d = 0,18. La similitud entre el bosque inundable influenciado por la laguna y el yolillal fue de 0,63; entre el bosque y el manglar, 0,092, y entre el yolillal y el manglar, 0,09.
El valor medio de temperatura encontrado en el bosque inundable influenciado por la laguna fue de 27,02 ± 1,13 °C; en el yolillal, de 27,29 ± 1,62 °C, y en el manglar, de 27,39 ± 1,95 °C. De cobertura boscosa, el valor medio encontrado en el bosque inundable influenciado por la laguna fue de 94,66 ± 2,25%; en el yolillal, de 85,46 ± 1,66%, y en el manglar, de 92,12 ± 1,48%, mientras que, de profundidad de hojarasca, los valores medios encontrados en el bosque inundable influenciado por la laguna fueron de 3,25 ± 1,12 mm; en el yolillal, de 42,50 ± 24,63 mm, y en el manglar, de 7.50±2.58 mm.
En el caso de las variables ambientales medidas en las asociaciones vegetales que bordeaban la laguna, que fueron profundidad de hojarasca, cobertura boscosa y temperatura, ninguna explicó las causas de la riqueza de herpetofauna en estos sitios (P-Value > 0,05) (cuadro 2).
Cuadro 2 Relación obtenida a partir de la regresión lineal múltiple entre la riqueza de especies de herpetofauna y las variables ambientales.
| Coeficiente | Error Estándar | t | P | |
| Intercepto | 26,05 | 13,427 | 1,940 | 0,058 |
| Profundidad de hojarasca | 0,019 | 0,022 | 0,832 | 0,410 |
| Cobertura Boscosa | -0,180 | 0,118 | -1,521 | 0,135 |
| Temperatura | -0,255 | 0,255 | -1,002 | 0,322 |
Discusión
La cobertura vegetal que rodea la Laguna de Gandoca se caracterizaba, en el 2010, por presentar una transición claramente establecida manglar-bosque inundable influenciado por la laguna, dentro de la cual se encuentra un área amplia de palmar pantanoso (yolillal), que se mezclaba con la vegetación del bosque muy húmedo tropical, con un cambio de sustrato pantanoso (lodo de partículas muy finas) a sustrato firme (1).
Esta mezcla de asociaciones vegetales y de suelos con sustrato firme, con mayor grado de consolidación que el manglar, posiblemente explique la semejanza en la riqueza de especies y la diversidad entre el yolillal y el bosque inundable influenciado por la laguna, aunada al alto porcentaje de similitud de las especies halladas entre estos sitios, ya que según Medina Rangel (14), el mayor recambio de especies ocurre entre hábitats con diferencias notorias en su estructura vegetal.
Sin embargo, Bonilla, Gómez y Sasa (15) reportaron una mayor riqueza de especies de herpetofauna en áreas boscosas adyacentes al yolillal, lo cual no se observó en este estudio, y puede explicarse porque los autores citados realizaron los muestreos en el interior del bosque, mientras que en este trabajo se realizaron los muestreos en las cercanías de la línea del agua, lo que limitó la detección de especies propias de bosque.
El yolillal, por su parte, es un sistema pantanoso que favorece a especies con preferencia por zonas inundables, como los lagartos del género Basiliscus y la rana Scinax elaeochroa (9). También, se ven favorecidas especies de anuros que utilizan estos cuerpos de agua para depositar sus huevos directamente en ellos, como Leptodactylus savagei y Smilisca baudinii o en la vegetación como Agalychnis callidryas. Junto a estas especies, se agruparán también sus posibles depredadores, como es el caso de la serpiente Leptodeira septentrionalis, que basa su dieta principalmente en ranas y sus huevos (9) (16).
El yolillal también presenta una reducida cobertura de sotobosque y un dosel con estructura simple, lo que beneficia a especies de anfibios y reptiles generalistas (15). Esto se evidenció por la dominancia de especies como Norops limifrons y Diasporus diastema, que son adaptables a ambientes con baja complejidad estructural o a ambientes alterados (9).
El bosque es una asociación vegetal con mayor heterogeneidad, debido a que presenta un mayor número de estratos, por tanto, es un sistema con mayor complejidad estructural que el yolillo. Esto implica una amplia gama de microhábitats que pueden ser utilizados equitativamente por diversas especies de anfibios y reptiles (17) pertenecientes a diferentes gremios tróficos, por ejemplo, especies propias de hojarasca como las ranas del género Craugastor, y lagartijas como Norops humilis y Sphenomorphus cherriei; especies terrestres como los sapos del género Incilius, y las especies arbóreas como Hypsiboas rufitelus y Corytophanes cristatus (9). Esto podría explicar los valores bajos de dominancia observados en este sitio.
Además, se debe tener en consideración una alta ocurrencia de especies generalistas en la zona boscosa, debido probablemente al efecto de borde provocado por la cercanía de la línea de agua con los sitios donde se realizó el muestreo (18) (19). El manglar solamente favorecía a especies muy especializadas como Tretanorhinus nigroluteus, serpiente semiacuática de sistemas salobres que basa su dieta principalmente en peces y utiliza las raíces de los mangles para camuflarse y cazar a sus presas (16). Además, los manglares son sistemas productivos empleados por especies de fauna como aves, peces, crustáceos e insectos. Los insectos son la principal fuente de alimento de lagartijas del género Norops, lo que explica en parte, la presencia de las tres especies en este sitio. No era de esperar una alta presencia de especies en el sitio por las condiciones de estrés que produce la salinidad, tanto en el suelo y el aire como en el agua.
Respecto a las variables ambientales, Walting y Donnelly (20) observaron mayor diversidad de anfibios y reptiles en sitios con mayor acumulación de hojarasca, posiblemente debido a que estas zonas mantienen estable la humedad proveniente de la precipitación, proporcionando microclimas adecuados para este grupo. Además, a mayor profundidad la hojarasca alberga mayor cantidad de invertebrados que pueden ser consumidos. El mantenimiento de esa humedad es fundamental cuando las condiciones de salinidad limitan el acceso a este recurso.
Muchas de las lagartijas encontradas, como Ameiva festiva, A. quadrilineata, B. plumifrons, B. vittatus y C. cristatus, por ser organismos poiquilotermos necesitan de altos niveles de radiación solar para almacenar suficiente energía y para realizar una búsqueda activa de sus presas en el suelo y entre la hojarasca (4). Este comportamiento puede explicar la relación negativa entre la riqueza de especies y la cobertura boscosa, debido a que menores porcentajes de cobertura permiten una mayor entrada de luz solar a los estratos más bajos de las asociaciones vegetales, dándoles a los reptiles acceso a la radiación solar, fundamental para realizar sus funciones básicas.
Conclusiones
Cuantos más recursos disponibles, más tiende a aumentar la diversidad en el bosque inundable influenciado por la laguna y el yolillal. Tales sitios brindan gran cantidad de microhábitats para las especies de reptiles y anfibios. Esto se ve reflejado también, en la alta similitud de especies entre ambos sitios. Por su parte, el manglar es poco utilizado por la herpetofauna, pero se encontró a las lagartijas haciendo uso de este sistema; además es importante para especies con hábitos especializados, como T. nigroluteus. Debido a esto, es necesario proteger los diferentes ecosistemas boscosos en las zonas costeras, con la finalidad de conservar adecuadamente la biodiversidad presente en esos sitios.
Se concluye que el manglar es una asociación vegetal poco empleada, pero muy relevante para especies con hábitos especializados. Por otra parte, el manglar, el yolillal y el bosque inundable influenciado por la laguna proveen un gradiente de complejidad estructural de bosque, siendo el manglar el menos complejo y el bosque inundable influenciado por la laguna el de mayor complejidad, por lo que este último presenta la comunidad de herpetofauna más rica.