Introducción
Los materiales poliméricos han tomado gran relevancia durante los últimos años en aplicaciones médicas. Múltiples polímeros de origen biológico, sintéticos e híbridos son usados para múltiples aplicaciones médicas. Esto debido a que un amplio rango de polímeros disponibles tiene la ventaja de que sus propiedades físicas, químicas, y biológicas pueden ser modificados en una extensa variedad para poder cumplir con los requerimientos de aplicaciones específicos. Poliesters bioestables y biodegradables son usados en medicina. Poliesters con pequeñas presencias de ácido glicolicos alifático o de ácido láctico son los polímeros degradables más comunes e.g. ácido poliglicolico (PGA, por sus siglas en inglés), ácido poli(L)lactico (PLLA) y el ácido poli(D)-lactico (PDLA) (1).
El alcohol polivinílico (PVA) es un biopolímero sintético lineal producido a través de la hidrólisis parcial o total de acetato de polivinilo para eliminar los grupos acetato. Este polímero es altamente utilizado en la medicina debido a sus propiedades e.g. baja absorción de proteínas, buena biocompatibilidad, no tóxico, alta solubilidad en agua, resistencia química y es capaz de exhibir el enlace de hidrógeno en virtud de los grupos hidroxilo presentes en las unidades de repetición (2). El PVA puede formar hidrogeles ya sea vía química o por reticulación física, los cuales presentan alto contenido de agua (3). Estas propiedades hacen que los hidrogeles de PVA sean buenos candidatos para ser usados en materiales que sustituyan tejidos (4). Otras aplicaciones médicas de este polímero son en lentes de contacto e implantes de menisco y cartílago.
La policaprolactona (PCL) ha sido utilizada para muchas aplicaciones biomédicas debido a su lenta tasa de degradación y sus propiedades biocompatibles (5), (6). El PCL es un polímero alifático semi-cristalino que tiene una baja temperatura de transición vítrea (-60°C), una baja temperatura de fusión y una gran estabilidad térmica. Además, cuenta con una alta temperatura de descomposición de 350°C (7). La biocompatibilidad y baja degradación del PCL han permitido su uso en la fabricación de fármacos (5). Sin embargo, algunas de sus aplicaciones relacionadas con la regeneración de tejidos se ven limitadas por sus bajas propiedades mecánicas, razón por la cual es necesario modificar el PCL mediante la adición de materiales de refuerzo (8). El uso del PCL para implantes médicos implica dos retos importantes. En primer lugar, se debe controlar el proceso de degradación o resorción y en segundo lugar, el material debe cumplir con un módulo de elasticidad similar al del hueso roto regenerado, ya que sus propiedades mecánicas cambiarán según la tasa de resorción (8).
El término “impresión 3D” es usado en este trabajo para referirse a todas las tecnologías SFF (Solid Freeform Fabrication) e.g. FDM (fused deposition modelling), selective laser sintering, etc.) (9). La técnica de fabricación con filamento fundido o modelado por deposición fundida (FDM) es una de las técnicas de prototipado y fabricación rápida que se ha vuelto muy popular, que añade una capa tras otra de un material fundido para crear un modelo o producto (10).
Filamentos para impresoras 3D que trabajan por la técnica FDM pueden fabricarse por medio de extrusión. Los filamentos por lo general se extruyen con dimensiones específicas, en dependencia de la boquilla que se utilice. El proceso de extrusión es una operación en la que inicialmente se introduce material en forma de gránulos (pellets) en una tolva, que estará alimentando constantemente un tornillo sin fin o un husillo. El material al caer al husillo se expone a una alta temperatura. El mismo es transportado de forma continua por el tornillo a lo largo de toda la máquina extrusora. Durante el proceso de transporte del material, se realizará el proceso de fundido del mismo, por el efecto conjunto de la temperatura del sistema y de la presión que ejerce el tornillo. Posteriormente, el material fundido es forzado a atravesar un orificio o boquilla de salida, para darle la forma final deseada. De esta forma es posible crear un producto que presente una sección transversal constante con una longitud determinada (11). Finalmente, con un sistema de enfriamiento a la salida de la boquilla, se evitan deformaciones en el proceso, de esta forma se asegura la calidad del producto.
El fosfato de calcio (Ca10(PO4)6(OH)2) o hidroxiapatita, es especialmente utilizado como material de injerto óseo en aplicaciones médicas y dentales, debido a su gran similitud con la composición natural de los huesos (12), (13). La HAp es biocompatible y bioactiva, sin embargo, presenta malas propiedades mecánicas. La HAp ha pasado a tener un papel secundario como lo es el recubrir otros materiales con propiedades mecánicas superiores. Otra característica a resaltar es la inestabilidad térmica que presenta el componente, en donde se dan variaciones desde los 800°C hasta los 1200°C, en dependencia de su estequiometria (14).
Este trabajo consistió en la fabricación de filamentos de PVA y PCL por medio de extrusión. Estos filamentos fueron reforzados internamente con HAp con el objetivo de aumentar la resistencia mecánica de estos. Los filamentos fueron caracterizados por medio de difracción de rayos-X, espectrometría infrarroja y análisis térmicos para comprender su comportamiento previo al proceso de fabricación. Los filamentos fueron usados en impresión 3D para verificar su el comportamiento de estos durante la fabricación de geometrías 3D. Finalmente, los filamentos fueron caracterizados usando microscopia electrónica para observar la distribución de la HAp en las matrices poliméricas.
Materiales y Metodología
Materiales
En este trabajo se utilizaron los polímeros en forma de resina o pellets de Poly (vinyl alcohol) (PVA) 99+% hidrolizado con Mw: 146 000-186 000 y Policaprolactona (PCL) con Mn: 80 000 todos fabricados por Aldrich. Estos polímeros fueron procesados por medio del proceso de extrusión para obtener filamentos para ser usados en el proceso de impresión 3D. Pellets de PVA y PCL fueron mezclados (figura 1) con hidroxiapatita (HCa5O13P3) con una pureza ≥90% y tamaño de partícula de aprox. 100 ± 20 µm fabricado por Aldrich.
Metodología
Caracterización de los Materiales
Análisis térmico
El comportamiento térmico del PVA, PCL y HAp se evaluó por medio de Calorimetría Diferencial de Barrido (DSC). Esta técnica permitió la identificación de la temperatura de fusión y degradación de los polímeros y HAp. En este estudio se analizaron 3 muestras por material. Los equipos utilizados fueron el DSC-Q200 del Laboratorio Nacional de Alta Tecnología (LANOTEC) para las muestras PVA; y el SDT-Q600 del Centro de Investigación y de Servicios Químicos y Microbiológicos (CEQIATEC) del Instituto Tecnológico de Costa Rica, para las muestras de HAp y PCL. La metodología usada durante estas pruebas incluyó barridos de 23°C hasta 400°C con una tasa de calentamiento de 10°C min-1 para las muestras de PVA y PCL. La muestra de HAp se analizó térmicamente con un barrido de 23°C hasta 1500°C con una tasa de calentamiento de 20°C min-1. Los puntos de fusión y descomposición de las muestras fueron analizados mediante el software TA Universal Analysis.
Análisis por difracción de rayos-X
El análisis de Difractometría de una muestra de PVA y PCL se realizó con un tubo de Cobre (λ=1.54 Å) a una potencia de 45 kV y 40 mA, con un barrido de 5 a 50° (2Ɵ) con una velocidad de 0.02° por segundo. En este análisis se utilizó un Soller de 0.04 radianes en el extremo del tubo de rayos-X y un Soller large de 0.04 radianes en el extremo del detector, un slit de divergencia de 1/2° y un slit antiscatter de 1°. La filtración de radiación Kβ se realizó con un filtro de Niquel. La adquisición de datos se efectuó con el Software Data Collector y para el análisis de los difractogramas (resultados obtenidos con el DRX) se utilizó el software HighScore Plus y artículos especializados. En este estudio se analizaron 3 muestras por material. Las muestras de PVA fueron partículas o virutas de máximo 1 mm de largo, luego estas fueron montadas en el porta-muestras del equipo. Las probetas de PCL fueron placas de polímero que se fundieron usando un molde de 32mm de diámetro x 1 mm de profundidad.
Análisis por espectrometría infrarrojo
Espectrometría infrarroja se usó para poder analizar los grupos funcionales y características químicas del PVA y PCL previo a los procesos de manufactura. El equipo Nicolet 380 del laboratorio CEQUIATEC se usó para estos análisis. En este estudio se analizaron 3 muestras por material. Las muestras se prepararon cortando pequeños fragmentos procurando que estos fueran lo suficientemente plano para una adecuada obtención de resultados.
Análisis por microscopia
Los filamentos fabricados fueron analizados mediante un microscopio estereoscópico OLYPUS SZX10 y un microscopio electrónico de barrido (SEM) Hitachi TM 3000, con el fin de comparar la calidad superficial, la distribución de HAp y el espesor de cada uno de los filamentos. Las muestras de polímeros fueron recubiertas con oro-paladio mediante Sputtering a 37-38 mA.
Fabricación de filamentos
La fabricación de filamentos de aproximadamente 2.85 mm de diámetro se realizó mediante una extrusora Filabot Original TM. La fabricación se realizó a una temperatura de 200ºC en el caso del PCL y de 230°C en el caso del PVA. Inicialmente, se agregaron los polímeros a la tolva de alimentación hasta alcanzar un 50% de su capacidad máxima. Los biopolímeros sin reforzar se agregaron hasta obtener el espesor y longitud del filamento adecuado. Los filamentos reforzados se fabricaron con pellets mezclados con HAp al 7% m/m hasta obtener el filamento con las características adecuadas de espesor. La velocidad de giro del tornillo en ambos casos fue regulada según la forma y el diámetro del filamento obtenido, de manera que se ajustó a un 25% de su máxima capacidad. Finalmente, la medición del diámetro de los filamentos obtenidos se realizó mediante un calibrador Vernier digital.
Análisis del comportamiento de los filamentos durante la impresión 3D
El proceso de impresión 3D con los filamentos producidos en este estudio se desarrolló por medio de la maquina Ultimaker 2 (ver figura 2a) , la cual funciona con tecnología FDM y cuenta con una boquilla de impresión de 0.4 mm diámetro interno. La figura 2b) muestra la geometría impresa, la cual tenía el propósito de ser una geometría simple y en la cual se podría validar el proceso de impresión 3D usando los filamentos fabricados. Previo a la impresión, los diferentes filamentos fueron colocados en el sistema de alimentación de la máquina y se realizaron diferentes ajustes para calibrar las impresoras dependiendo del tipo de polímero y de la estructura a imprimir.
La impresión fue realizada a una velocidad de impresión de 40 mm s-1, con una temperatura de boquilla de 230°C para el PVA y 200°C para el PCL con una temperatura en la plataforma de 60°C para el PVA y 35°C para el PCL. El proceso de impresión se ejecutó primeramente calentando los polímeros hasta que alcanzó un estado semilíquido y se depositó a lo largo de la trayectoria definida en el software Cura, el cual fue usado en el proceso de impresión 3D.
Resultados y discusión
Caracterización de los Materiales
Análisis térmico
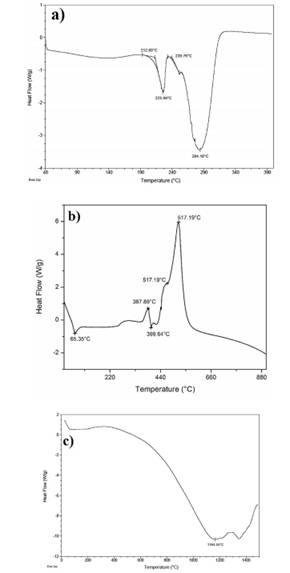
En la figura 3 se observa el análisis DSC de una muestra representativa de PVA, PCL y HAp. La temperatura de fusión del PVA encontrada fue de 225.96°C y la degradación de este material se encontró entre 239.76°C y 284.10°C (figura 3a). La información proporcionada por este análisis permitió determinar que a una temperatura de 230°C el PVA se encontraría completamente en forma fundida y su procesamiento en el proceso de extrusión podría ser exitoso. Sin embargo, un factor crítico que debió tomarse en cuenta fue que la temperatura de degradación se encontró muy cercana a la de fusión. Este resultado, sumado a resultados reportados anteriores (15) hizo pensar que la cercanía de la temperatura de fusión y la de degradación podría tener implicaciones durante el proceso de extrusión y consecuentemente en las propiedades finales de este material. En otras palabras, el proceso de extrusión se debe realizar manteniendo una estabilidad térmica que no exceda un ±5°C de la temperatura seleccionada, con el fin de mantener el PVA en estado fundido y no en degradación.
El comportamiento térmico del PCL durante el análisis DSC se puede observar en la figura 3b, en donde se identifica la temperatura de fusión en 65.35°C y la temperatura de oxidación fue de aproximadamente 387.89°C. La temperatura de fusión encontrada es similar a la encontrada en estudios previos (16), sin embargo, se puede notar que el cambio entalpático sufrido por el PCL durante el calentamiento hasta esta temperatura no fue tan grande como el del PVA. Esto hace pensar que si bien el material funde a una temperatura de aprox. 65°C su viscosidad es aún alta, pudiendo presentar problemas para poder ser extruido en filamentos y posteriormente durante el proceso de impresión 3D. Por esta razón, se podría considerar una temperatura de trabajo de 65°C hasta aprox. 250°C, intervalo en el cual el PCL se mantendría en estado fundido sin riesgo de oxidación o degradación.
Por otro lado, la figura 3c muestra el resultado obtenido del análisis de DSC de la hidroxiapatita. El comportamiento de la HAp fue particularmente interesante ya que hasta 400°C no se observan alguna transformación entalpática. Posterior a esa temperatura, inicia el periodo de cambios de entalpía de la muestra hasta llegar a 1164.55°C, el cual puede ser interpretado como la temperatura de fusión de la HAp. Aprox. a 1300°C se observa otro aumento en el calor, lo cual podría deberse a cambios polimórficos de la hidroxiapatita (17), (18). Lo cambios sufridos por la HAp posterior a los 400°C no resultan importante para este trabajo ya que ningún polímero fue procesado a temperaturas superiores a esta. La importancia del análisis de DSC a la HAp radica en poder asegurar el comportamiento estable de la HAp a las temperaturas de extrusión de los polímeros.
Difracción de rayos-X
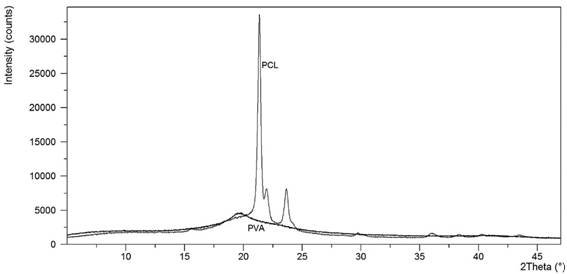
El análisis de difracción de rayos-X fue utilizado para poder determinar el grado de cristalinidad del PVA y PCL. La cristalinidad de un polímero incide sobre el procesamiento y propiedades mecánicas de estos materiales. Los polímeros termoplásticos con alto grado de cristalinidad poseen propiedades mecánicas más estables (19). La figura 4 presenta el comportamiento amorfo del PVA, contrastando con el comportamiento semi-cristalino del PCL. En el caso del PVA se aprecia un pico bastante extenso, el cual es característico de materiales amorfos. El grado de cristalinidad del PCL se puede apreciar que es alto en la cercanía de 22° y 24° (ángulo de difracción 2θ) en donde se notó que los picos fueron bastante definidos y con una alta intensidad.
Espectrometría infrarroja
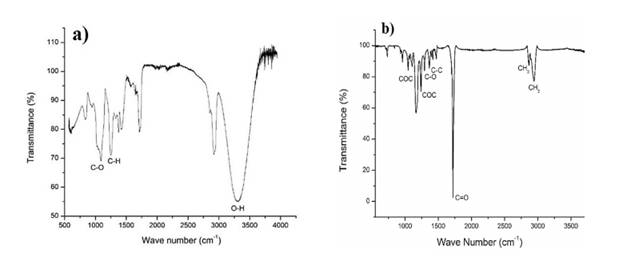
El análisis de espectrometría infrarroja (figura 5) realizado en este trabajo permitió determinar los tipos de enlace presentes en la estructura polimérica y su respectiva intensidad. En la figura 5a se observa el comportamiento del PVA. En el intervalo de 1000 a 1200 cm-1, se puede apreciar la presencia de enlaces C-O. Posteriormente, alrededor de los 1250 cm-1 se registró la presencia de enlaces C-H. En el rango de aproximadamente 3290 cm-1 se encuentran los enlaces O-H. Estos enlaces fueron comprobados con los encontrados en trabajos previos (20), (21) respectively. Drug loading was performed with valsartan as a model drug. Characterization of hydrogels was performed by SEM, FT-IR, XRD, TGA and DSC. Hydrogels were evaluated for pH responsive behavior by equilibrium swelling ratio and swelling dynamics at low and high pH. Formation of hydrogel was confirmed by FT-IR, XRD, TGA and DSC studies. Maximum swelling, drug loading and release has been observed at pH 7.4. It is concluded that highly stable PVA and AA based polymeric matrices are developed, which are highly pH-sensitive. These polymeric matrices have potential to be used as a carrier for controlled delivery of valsartan. RESUMEN. El prop\u00f3sito de este estudio fue desarrollar qu\u00edmicamente un hidrogel reticulado de polivinilo alcohol-co-poli\u00e1cido acr\u00edlico (hidrogel de PVA-AA.
El comportamiento del PCL durante el análisis de espectroscopia infrarroja del PCL se puede observar en la figura 5b, en donde se aprecian los principales grupos funcionales del polímero que fueron comparados con la literatura (22). Las señales más importantes a identificar fueron el estiramiento en tensión del carbonilo C=O perteneciente al grupo éster de la policaprolactona a 1721 cm-1 (23). Otras señales importantes identificadas corresponden al estiramiento en tensión de los hidroxilos O-H a 3433 cm-1, el estiramiento del enlace C-H de la policaprolactona a 2942 cm-1 asimétrica y a 2865 cm-1 simétrica , el estiramiento del enlace C-O-C de la policaprolactona a 1242 cm-1 asimétrica y 1042 cm-1 simétrica, además del estiramiento C-O en y C-C en 1293 cm-1.
Fabricación de los filamentos
Filamentos de PVA
La extrusión de filamentos de PVA fue compleja debido a múltiples factores e.g. la deshidratación acelerada y la degradación de este polímero al pasar mucho tiempo en la extrusora. Los primeros filamentos de PVA extruidos presentaron una expansión al salir de la boquilla extrusora. Esta expansión al poco tiempo se transformó en porosidad o espacios de aire atrapados en el polímero extruido (ver figura 6). En la figura 6a , se muestra que el filamento poroso tuvo un espesor de aprox.10 mm, además, su coloración amarillo oscuro pudo ocasionarse por la degradación térmica del PVA. La degradación del polímero pudo deberse a un aumento en la velocidad de rotación del tornillo, el cual tiende a ocasionar incremento en el calentamiento por disipación viscosa. La formación de porosidad en el interior del filamento se dio por la deshidratación del PVA. Esto podría estar relacionado con la temperatura aplicada en el proceso que indujo a la evaporación del agua o formación de volátiles atrapados en el material fundido. Otro de los factores pudo haber facilitado la aparición de poros fue la poca cantidad de material agregado en la extrusora, lo cual no permitió la formación de una capa sólida que sea compactada y comprimida por el pozo de fundido, de manera que quedó aire atrapado.

Figura 6 a) Filamento poroso de PVA; b) corte transversal del filamento y c) micrografía SEM del filamento poroso de PVA.
El análisis de la sección transversal del filamento de PVA mostrado en las figuras 6 b y c evidenció un tamaño de poro entre 2 y 3 mm, los cuales no se encuentran interconectados entre sí. Esto conllevo a descartar estos filamentos como posibles implantes porosos a menos que se lograra mejorar la interconectividad de los poros para poder permitir eventuales movimiento de fluidos corporales a través de ellos (24)-(26). Por esta razón, el proceso de producción de filamentos se mejoró para poderlos usar en la impresión 3D.
Filamentos sin reforzar fueron fabricados con un diámetro de aprox. 2.77 ± 0.2 mm y coloración amarilla oscura (figura 7a), haciendo pensar que pudo haber una deshidratación en el polímero durante la extrusión. Los filamentos reforzados con HAp (figura 7b) tuvieron un diámetro de aprox. 2.80 ± 0.2 mm y una coloración amarilla clara que indicó la ausencia de deshidratación o degradación en el PVA.
En las micrografías SEM de la figuras 8a y 8b se observa la distribución heterogénea de las partículas de HAp (señaladas por la flechas), en el filamento de PVA. Esto conllevó a pensar que el material cerámico tiende a formar cúmulos del biocerámico dependiendo de diferentes factores e.g. el tamaño de partícula de la HAp (aprox. 100 µm), proceso de mezcla mecánica de PVA y HAp, etc. Otra razón por lo cual la distribución de HAp en el PVA no fue completamente homogénea en toda la matriz polimérica, pudo deberse a la retención y perdidas de partículas de HAp en el cilindro y tornillo durante la extrusión.

Figura 8 Micrografías SEM de la distribución de HAp en el filamento de PVA: a) sección longitudinal y b) corte transversal.
La inestabilidad térmica del PVA fue considerada para tomar la decisión de dejar el material en la extrusora durante poco tiempo y de no reprocesarlo, ya que este se degrada y obstruye la boquilla. Asimismo, una vez finalizado el proceso, no se debe dejar la extrusora con hidroxiapatita, ya que este reacciona con el polímero presente y ocasiona la obstrucción de la boquilla o del tornillo.
Filamentos de PCL
Los filamentos de PCL sin reforzar y reforzados con HAp tuvieron un diámetro promedio de 2.83 ± 0.2 mm. El diámetro de los filamentos producidos fue bastante difícil de mantener constante. La variación del diámetro de estos filamentos se debe a que el extruido solidifica lentamente en comparación al PVA. Por lo que se debe controlar el material en la salida desde la boquilla hasta el sistema de enfriamiento para que no ocurra un gran estiramiento del extruido y por ende una disminución drástica en el espesor del filamento. El filamento de PCL reforzado se puede apreciar en la figura 9, en donde se detalla la distribución de HAp en la matriz polimérica. En el corte longitudinal (figura 9a) y transversal (figura 9b) del filamento se observa que la hidroxiapatita se encuentra presente en toda la matriz. Sin embargo, la HAp no estuvo distribuida uniformemente, obteniéndose zonas con aglomeraciones de HAp (flecha en la figura 9a) y zonas donde no se observó el cerámico (cuadro de figura 9b). La distribución inhomogénea de HAp en el PCL pudo deberse a la retención de partículas del cerámico entre las diferentes partes de la extrusora y a la baja viscosidad del PCL, ocasionando la falta de arrastre de las partículas de HAp hasta la boquilla y su posterior integración en el filamento.
Comportamiento de los filamentos durante la impresión 3D
Los filamentos de PVA sin reforzamiento no fundieron durante la impresión 3D. Estos se degradaron en la boquilla de la maquina ocasionando la obstrucción de esta. Esto se puede deber a que el filamento obtenido durante la extrusión presentaba una coloración oscura, lo cual inducía a pensar que se encontraba en el inicio de la degradación del polímero y que, por lo tanto, no se pudiera reprocesar. Por otro lado, los filamentos de PVA reforzados demostraron mejores resultados comparados con los no reforzados. El polímero logró fundir en la boquilla de la impresora, con lo que se comprobó que el filamento presenta las características adecuadas para ser utilizado en impresión 3D. Sin embargo, no se logró depositar y pegar el filamento en la plataforma de la impresora debido a que el polímero salía frío. Este proceso se puede corregir al variar los parámetros impresión, tales como temperatura de plataforma y del sistema de enfriamiento.

Figura 9 Micrografía SEM de la distribución de HAp en la matriz de PCL: a) Corte longitudinal y b) corte transversal.
Los filamentos de PCL reforzados y sin reforzar fueron usado en la impresión de la figura 2b. Esto se logró al ajustar varios parámetros de la impresora y se determinó que la temperatura óptima de la boquilla debía ser superior a 200°C y la plataforma debía tener una temperatura de aprox. 60°C. Estas condiciones permitieron que la adherencia casi completa del biopolímero en la plataforma con lo que se obtuvo la impresión de la primera capa de la figura a imprimir (ver figura 10a). Las secciones en donde no se logró depositar el PCL pudieron darse por la falta de material adherente en la superficie o a que esas zonas se encontraban a una temperatura más baja de la adecuada. El proceso se podría optimizar al modificar la temperatura de la plataforma de manera que la capa de polímero extruido se mantenga caliente, pero que no llegue a su fusión. Además, la velocidad del sistema de enfriamiento se puede modificar de manera que se reduzca la velocidad de solidificación del polímero.
La distribución de HAp en la pieza impresa de PCL (figura 10b) fue homogénea en toda la superficie. Este resultado es muy importante al ser la primera vez que se logró imprimir una estructura con este biopolímero reforzado con HAp. Este proceso podría llegar a producir implantes con mejores bioactividades, permitiendo las altas tasas de regeneración de tejido para futuras aplicaciones biomédicas.

Figura 10. Muestra impresa de PCL reforzada con HAp; b) Microscopia SEM de la distribución de HAp en muestra impresa de
Conclusiones
Los resultados obtenidos en este trabajo representan importantes avances en el desarrollo de bio-filamentos reforzados con HAp para ser usados en impresión 3D. El procesamiento de los pellets de PVA y PCL junto con el HAp para la obtención de los filamentos fue posible gracias a la caracterización de estos materiales previo a ser extruidos. En ambos casos se logró obtener filamentos cercanos a los 2.85 mm de diámetro, sin embargo se evidencio que el procesamiento del PVA es mucho más complicado que el del PCL. El reforzamiento de los biopolímeros con HAp puede tener primordial importancia en el mejoramiento de sus propiedades mecánicas y biocompatibles. Sin embargo, trabajo aun es necesario para obtener mejores filamentos con los polímeros usados. Soluciones como la implementación de plastificantes, lubricantes y aditivos podrían ayudar en la obtención de filamentos más homogéneos y fácil de extrudir. La impresión 3D llevada a cabo en este estudio usando los biopolímeros reforzados comprobó que es posible tener una distribución de homogénea del HAp aun después de una segunda extrusión, es decir con la boquilla de la impresora. Sin embargo, especial cuidado en no exceder las temperaturas de trabajo debe tenerse en cuenta para evitar degradaciones de los polímeros durante sus procesamientos.
Agradecimientos
Se agradece el apoyo económico de la Vicerrectoría de Investigación y Extensión del TEC por el proyecto con código 5402-1490-2201. Al señor Esteban Rodriguez, técnico de los laboratorios de Difracción de rayos-X y Mecánica de Materiales de la escuela de Ciencia e ingeniería de los Materiales por el apoyo en los análisis realizados en este trabajo. Al CEQUIATEC y al Laboratorio de Microscopia Institucional por le poyo en los análisis realizados. A la MSc. Laura Barillas Mora, a los ingenieros Silvia Elena Rojas, Christopher Castro Arias, Pamela Jara Vargas, Evelyn Araya Núñez, Adrián Travieso Disotuar y al estudiante Roberto Vargas Sanchez por sus aportes en este trabajo.