Introducción
El sodio y el potasio son elementos químicos muy reactivos que se oxidan al contacto con el aire y reaccionan violentamente con el agua. Además, se consideran entre los elementos más abundantes de la corteza terrestre, en el agua de mar y en los sistemas biológicos (1). A nivel biológico, estos cationes se consideran como elementos esenciales, ya que su presencia en el cuerpo humano tiene al menos una función biológica conocida, por lo que son indispensables para el buen funcionamiento del organismo (2).
El potasio se considera un catión imprescindible, es el más abundante en el cuerpo y se encuentra mayormente en el fluido intracelular (3). Este elemento es vital para la homeostasis del organismo, además se ha demostrado que sus funciones en la célula no pueden ser reemplazadas por otros cationes sin generar alteraciones. El potasio se encuentra en alimentos como la espinaca, la harina de trigo, el plátano, el aguacate, la papa, entre otros (4). Por su parte, el sodio se encuentra principalmente en el espacio extracelular; este elemento regula la presión osmótica de los fluidos extracelulares y el agua en los tejidos (5). Alimentos como la leche y sus derivados, embutidos, mariscos, conservas, etc., son ricos en sodio. Sin embargo, la sal y los aditivos alimenticios son las principales fuentes de sodio; la sal de mesa o NaCl contiene un 40% de sodio (6).
Los niveles de sodio y potasio en el cuerpo humano son alterados por las pérdidas excesivas de líquidos, es decir, cuando se presenta un proceso de deshidratación. La terapia de rehidratación oral (TRO) es uno de los tratamientos aplicados en la corrección de la deshidratación aguada (7). Para realizar la TRO existen diversas opciones, entre ellas las sales de rehidratación oral, las cuales son consideradas como una opción ideal para tratar el problema de la deshidratación, estas corresponden a una mezcla de sales, glucosa y agua en cantidades exactas (8). Con la implementación de soluciones electrolíticas en el tratamiento de la deshidratación, surgen interrogantes respecto a la seguridad y calidad de las mismas. Dichas preguntas están mayormente relacionadas con la concentración de sodio y potasio en las formulaciones.
En esta investigación se logró adecuar una metodología analítica para determinar la concentración de sodio y potasio en muestras de sales de rehidratación oral, mediante la técnica de espectroscopía de absorción atómica, misma que no es oficial para sodio y potasio en la matriz de estudio, según material consultado para el estudio.
La espectrofotometría de absorción atómica es una técnica de análisis cuantitativos ampliamente utilizada en el estudio de metales; los primeros estudios relacionados con esta técnica se desarrollaron por el científico A. Walsh en 1955 (9). Esta técnica es aplicada en la industria alimenticia, ambiental, farmacéutica, entre otros.
En el campo ambiental la espectrofotometría de absorción atómica es utilizada para determinación cuantitativa de diferentes metales en matrices como suelo y agua. El caso específico del sodio y potasio se han realizado estudios en aguas de riego, permitiendo evaluar la calidad de la mismas en relación con los nutrientes aportados al área de cultivo (10). Por otra parte, Alvarado y Peñaloza (11) desarrollaron un estudio comparativo entre diferentes técnicas utilizadas para el análisis de sodio y potasio en suero humano; una de las técnicas aplicada fue la espectrofotometría de absorción atómica, en relación con esta las autoras concluyeron que la técnica es sensible y específica, además, de ser rápida y confiable.
En relación con estudios realizados en alimentos, Noël et al. (12) desarrolló una investigación enfocada en la determinación de sodio, potasio, calcio y magnesio en derivados de la leche, para cuantificar estos minerales aplicó la espectrofotometría de absorción atómica. Así mismo Ieggli et al (13), implementó esta técnica en la cuantificación de diferentes minerales; el estudio se realizó en Brazil y consistió en la determinación de una serie de minerales en muestras de huevo, entre ellos sodio y potasio. En este caso los autores concluyen que el método implementado es idóneo y que la espectrofotometría de absorción atómica es una técnica sensible, reproducible, simple y económica. Además, estos autores realizaron estudios similares en otras matrices, por ejemplo, analizaron en muestras de chocolate sodio, potasio, calcio, zinc y hierro (14).
La espectrofotometría de absorción atómica también se ha aplicado en el estudio de muestras de biodiesel, Lyra et al (15) analizaron sodio, potasio, calcio y magnesio en esta matriz, cuantificando el contenido de estos cationes por la técnica indicada. Retomando la aplicación de la espectrofotometría de absorción atómica en el análisis de alimentos Valverde & Silva (16) analizaron el contenido de sodio en cereales, carnes, lácteos, verduras, entre otros. Al desarrollar estos estudios se buscaba evaluar el aporte nutricional y la seguridad de los alimentos en relación con su contenido de sodio; esta investigación se realizó en Sede Rodrigo Facio de la Universidad de Costa Rica. En nuestro país la técnica también se ha aplicado en el análisis de agua potable, por ejemplo, Bolaños (17) determinó la concentración de diferentes cationes entre ellos el sodio y potasio en el cantón de Grecia.
Además, se han realizado estudios comparativos, en los cuales la muestra analizada se trata mediantes diferentes metodologías y se cuantifica el contenido de sodio aplicando diferentes técnicas. Por ejemplo, Ploegaerts et al (18) realizaron un estudio en Bélgica en el cual analizó el contenido de sodio en muestras de alimentos tratadas de tres maneras diferentes y la cuantificación la realizó aplicando cuatro técnicas, entre ellas la espectrometría de absorción atómica. Según los resultados obtenidos los autores concluyen que de las técnicas espectrométricas utilizadas, la de absorción atómica es la mejor opción.
En la industria farmacéutica la aplicación de la espectroscopia atómica ha aumentado en los últimos años, debido a la necesidad de analizar diferentes elementos como metales y metaloides (19). Por lo que técnicas como la espectrofotometría de absorción atómica se utilizan en la cuantificación de metales en diferentes etapas del proceso de fabricación del medicamento y en el producto terminado.
Fundamento teórico
Los fluidos que circulan por el cuerpo humano contienen electrolitos, éstos son elementos o minerales que al estar disueltos se disocian en iones y transportan una carga eléctrica (20). A nivel biológico, los electrolitos de mayor abundancia son sodio, potasio, calcio, magnesio, cloruro, etc. (21). El sodio y el potasio son elementos químicos indispensables para los seres vivos, ambos cationes pertenecen al grupo de los metales alcalinos y son abundantes en la corteza terrestre 2,8 % (Na) y 2,6 % (K) (22).
El sodio está presente en el líquido extracelular del organismo, este elemento cumple diferentes funciones, dentro de las cuales se puede mencionar la transmisión de los impulsos nerviosos, la regulación del equilibrio ácido base en los tejidos, también participa en la absorción de la glucosa y el transporte de otros nutrientes a través de la membrana celular (23). Además, se encarga de regular la presión osmótica de los fluidos extracelulares y el agua en los tejidos, esta función la realiza en conjunto con otros cationes, principalmente el potasio. La absorción del sodio se da rápidamente a nivel intestinal, la concentración normal de dicho elemento en la sangre oscila 135 y 145 mEq/L (23).
En el cuerpo humano el 95 % del sodio ingerido es absorbido por el intestino delgado, siendo la principal fuente la sal de mesa o NaCl, la cual contiene 40% de sodio (5). La ingesta diaria recomendada para este catión es de entre 1,1 - 3,3 g. Si se consume sodio en exceso se puede presentar hipertensión arterial (HTA), este es el factor de riesgo más importante en el desarrollo de enfermedades cardiovasculares y accidentes cerebrovasculares (24). En caso contrario, un déficit de sodio (principalmente por la sudoración excesiva y diarrea) se genera hipotensión, debilidad y fatiga.
Por otro lado, en cuanto al potasio, éste es el catión más abundante y de mayor importancia en el líquido intracelular, desempeñando funciones en la síntesis de proteínas y glucógeno, así como en procesos enzimáticos necesarios para la producción de energía a nivel celular, además, es clave en el equilibrio ácido-base, la conducción de impulsos eléctricos, contracciones musculares y el mantenimiento del ritmo cardíaco normal (20). La concentración normal de potasio varía entre 3,5 y 5,0 meq/L; este nutriente debe ser consumido diariamente ya que no existen reservas del mismo en el organismo. La ingesta recomendada de potasio es de 1,9-5,6 g diarios.
La concentración de sodio y potasio en el organismo se ve afectada por la pérdida brusca de agua y solutos, con la que se genera un desequilibrio a nivel intracelular, extracelular e intersticial; desequilibrio que produce alteraciones en el funcionamiento y metabolismo del cuerpo humano, a este cuadro clínico se le denomina deshidratación (25). Al perder solutos durante el proceso de deshidratación se producen en el organismo trastornos a nivel electrolítico. Los trastornos electrolíticos se presentan cuando ocurre un desequilibrio entre la cantidad de agua y electrolitos que entran y salen del organismo. Dentro de las principales alteraciones electrolíticas se pueden señalar las relacionadas con el ion sodio y el ion potasio.
El principal trastorno electrolítico asociado al sodio es la hiponatremia, la cual corresponde a la disminución de concentración del sodio en sangre, caracterizada por concentraciones menores a 135 mEq/L (26). Esta condición puede ser causada por diferentes mecanismos como lo son, una ingestión deficiente de sodio, una excesiva pérdida del mismo (renal o extra renal) o la retención excesiva de agua. Algunos de los síntomas que se generan como consecuencia de un déficit de este elemento son, dolor de cabeza, letargo, irritabilidad, espasticidad, convulsiones, etc. (27).
El fenómeno contrario a la hiponatremia se denomina hipernatremia y se presenta cuando la concentración de sodio supera los 150 mEq/L (28). Esta es provocada por un déficit de agua en relación al sodio; sus síntomas por lo general son neurológicos, donde es habitual que se presente un estado de letargia, debilidad e irritabilidad, y posteriormente los movimientos anormales, convulsiones, el coma y la muerte (28). Se puede generar por la pérdida de fluidos hipotónicos (renales o extra renales) o por un exceso de sodio provocado por dificultades para su eliminación.
El déficit de potasio en el organismo se presenta cuando la concentración plasmática de este elemento es muy inferior de 3,5 mmol/L, a este cuadro clínico se le denomina hipopotasemia (29). Por lo general, se presentan síntomas hasta que el nivel de potasio llega a 2,5 mmol/L y, cuando los niveles caen por debajo de 2 mmol/L se evidencia debilidad muscular. La pérdida de potasio se puede presentar por diferentes vías, por ejemplo, renales, digestivas, cutáneas, etc. (30).
En caso contrario si hay exceso de potasio en el organismo se denomina hiperpotasemia, esta condición se produce cuando la concentración de potasio supera los 5,5 mEq/L (30). Se considera el más grave trastorno electrolítico, debido a que puede ocasionar en minutos arritmias ventriculares fatales.
Los trastornos electrolíticos anteriormente descritos se puede tratar mediante el suministro de sales orales de rehidratación. Estas corresponden a una mezcla seca de sales empacadas para utilizarse en dosis diarias generalmente, su formulación incluye cloruro de sodio, cloruro de potasio, carbonato sódico hidrogenado y glucosa (anhidra) (31). En ocasiones se puede sustituir el carbonato sódico hidrogenado por citrato de sodio y utilizar glucosa monohidrato en lugar de glucosa anhidra.
A nivel fisiológico el funcionamiento de la rehidratación oral se basa en el transporte acoplado de sodio y glucosa a través del epitelio intestinal (32). Estas formulaciones se utilizan en el tratamiento de los trastornos electrolíticos y la deshidratación producidas principalmente por diarreas agudas o vómitos severos. El uso de estas formulaciones se inició en 1968 cuando se suministraron a poblaciones que sufrían de diarrea por cólera (33); su uso es promovido por la Organización Mundial de la Salud (OMS) y el Fondo para la Infancia de las Naciones Unidas (UNICEF) (32). Específicamente, la OMS y la UNICEF establecen características deseadas respecto a la composición de las sales orales de rehidratación, dichas características son señaladas en el cuadro 1 .
Cuadro 1 Composición recomendada para las sales de rehidratación oral según la OMS y la UNICEF.
| Componente | Rango concentración (mmol/L) |
| Glucosa | No superior de 111 |
| Sodio | 60-90 |
| Potasio | 15-25 |
| Citrato | 8-12 |
| Cloruro | 50-80 |
| Osmolaridad | 200 -310 |
Fuente: OMS. (34).
La concentración de sodio en estas formulaciones ha sido ampliamente cuestionada a lo largo del tiempo. Principalmente se discute sobre la seguridad de aquellas sales de rehidratación oral que contienen 90 mmol/L de sodio, si bien existe evidencia de que estas son eficientes y seguras para el tratamiento de la deshidratación; si se produce un exceso en su consumo o un mal suministro de las mismas puede dar lugar a una hipernatremia (8). Por lo que, con el objetivo de mejorar su eficiencia y seguridad las investigaciones más recientes se han enfocado en soluciones de osmolaridad reducida (32). En estas se utilizan concentraciones de sodio entre 60-65 mEq/L y glucosa entre 75-90 mmol/L. Es debido a la relevancia biología del sodio y el potasio, que el contenido de estos en medicamentos debe ser evaluado rigurosamente.
Al igual que todos medicamentos, las sales orales de rehidratación deben someterse a un proceso de control de calidad que permita confirmar la seguridad de las mismas. Según la USP 39 (31) a este producto se le deben realizar pruebas de identificación y valoración promedio para sodio, potasio, cloruros, bicarbonato y citrato. Para el análisis de sodio y potasio la monografía específica menciona que su cuantificación se debe realizar mediante un fotómetro de llama, midiendo la emisión del sodio a 589 nm y la del potasio a 766 nm.
Además de la fotometría de llama existen otras técnicas analíticas aplicables a la determinación de sodio y potasio en diferentes matrices, dentro de las cuales se puede mencionar la cromatografía de intercambio iónico y espectroscopia de absorción atómica; esta última de interés para este trabajo, y lo respalda Dávila (35) con su estudio en leguminosas y Pavón (36) con lo investigado en variedades de frijol.
La espectroscopia de absorción atómica es una técnica basada en la medición de la absorbancia electrones de átomos o iones metálicos (37). Esta técnica se basa en la medición de la absorbancia proveniente de los electrones de átomos o iones metálicos; el corazón de esta técnica se encuentra en la atomización de la muestra. Es aplicada en la determinación cualitativa y cuantitativa de, aproximadamente 70 elementos, particularmente metálicos; la sensibilidad típica de los métodos atómicos va de partes por millón (ppm) a partes por billón (ppb). Además, este método se caracteriza por ser rápido, cómodo y por la notable selectividad del instrumento.
Los avances tecnológicos permiten realizar la cuantificación de un mismo analito mediante diferentes técnicas, aplicando así diferentes metodologías. Cuando se utiliza un método no oficial para realizar un análisis es de suma importancia verificar que éste sea idóneo, para lo cual se realiza un proceso de validación.
Mediante la validación de la metodología analítica se recopila evidencia documentada, la cual permite garantizar que los resultados obtenidos a partir de un procedimiento analítico son precisos y exactos. Para cumplir con lo anterior se evalúan diferentes parámetros, dentro de los cuales se puede mencionar la linealidad, precisión (repetibilidad y precisión intermedia), exactitud y otros.
Metodología
Se establecieron como base los métodos oficiales de la AOAC (38) y la USP 39 (31) (2016) para la cuantificación de sodio y potasio respectivamente. Para la determinación de potasio se tomó como base la metodología descrita en la monografía del gluconato de potasio según la USP (por fotometría de llama), y para el sodio se utilizó el método 977.29 de la AOAC (38) para determinación del metal en electrolitos, el cual se debía acondicionar a los productos de interés. El análisis se realizó utilizando un espectrofotómetro de absorción atómica marca GBS, modelo Savant AA, A7254, utilizando una llama de aire (oxidante)-acetileno (combustible), una lámpara de cátodo hueco de sodio (·=589) y potasio (·=766 nm).
Optimización de parámetros experimentales: consistió en determinar el intervalo de concentraciones donde se presentaba una linealidad adecuada (r2 > 0,995) entre la absorbancia y la concentración de los analitos en estudio. Para esto se realizaron curvas de calibración de 0,5 μg/ml a 2,0 μg/ml (para ambos cationes), se midió la misma curva tres veces para ver la variación entre los datos obtenidos y se midió en diferentes días. Además, se determinó el procedimiento para la preparación idónea de la muestra, para esto se compararon los resultados obtenidos al preparar la muestra de dos formas: primero, la muestra se trabajó mezclando el contenido de tres sobres, morterizando hasta polvo fino el material, y se pesó (5 pesadas en balanza analítica) el equivalente a 6,25 mg de sodio y 17,0 mg de potasio, cada masa se transfirió cuantitativamente a un balón aforado de 250,00; se llenó aproximadamente a – con agua desionizada y se colocó en baño ultrasónico por 15 minutos hasta lograr la disolución completa de la sal. Posteriormente se dejaron enfriar los balones y se aforaron con agua desionizada; a partir de esta solución se preparó la muestra de sodio y potasio. Para sodio se tomó una alícuota de 4,00 en un balón de 250,00 ml y para potasio una alícuota de 15,00 ml en un balón de 250,00 ml, a cada muestra se le agregó 5,00 ml del supresor de ionización (para sodio: KCl; y para potasio: NaCl) y se aforó con agua desionizada.
En un segundo tratamiento, las muestras se prepararon a partir de la reconstitución del contenido total de tres sobres. Para esto se transfirió cuantitativamente el contenido de tres sobres a un balón aforado de 500,00. Se llenó aproximadamente a – con agua desionizada y se colocó en baño ultrasónico por 15 minutos, hasta lograr la disolución completa de la sal. Posteriormente, se dejaron enfriar los balones y se aforaron con agua desionizada. De esta solución se tomó una alícuota de 2,00 ml y se llevó a un balón de 250,00 ml aforando con el mismo disolvente. A partir de esta solución se preparan las muestras de sodio y potasio. Para el sodio se tomó una alícuota de 3,00 ml y se llevó a un balón de 100,00 ml, se le adicionó 2,00 ml de KCl (Cn: 100 mg/ml) y se aforó con agua desionizada. En el caso del potasio se tomó una alícuota de 10,00 ml y se llevó a un balón de 100,00 ml, se le adicionó 2,00 ml de NaCl (Cn: 100 mg/ml) y se aforó con agua desionizada. Se comparó el porcentaje de lo etiquetado obtenido por cada método de tratamiento y la variación entre los datos.
Validación de métodos: Para la validación de la metodología se evaluó la linealidad, repetibilidad, precisión intermedia y exactitud. Linealidad: experimentalmente se prepararon tres curvas de calibración a partir de disoluciones madres independientes. Para el sodio la curva constó de seis patrones dentro del rango de 0,5 a 1,0 μg/ml y para el potasio de cinco patrones con concentraciones entre 0,5 a 1,5 μg/ml. La linealidad del sistema se evaluó con curvas de calibración preparadas a partir de un patrón primario y para la linealidad del método la curva de calibración se preparó a partir de soluciones diluidas de muestras. Se determina el método presenta buena linealidad a partir del valor del coeficiente de correlación, el cual deberá ser mayor de 0,995. Además, se evalúa la varianza entre las curvas aplicando la prueba estadística de Cochran. Repetibilidad: para evaluar la repetibilidad se utilizó el patrón de concentración intermedia de la curva de calibración (Sodio: 0,7 μg/ml y Potasio: 1,0 μg/ml). Se realizaron de manera consecutiva seis mediciones de la absorbancia de estas soluciones, preparadas de manera independiente. A los datos obtenidos se le calcula la desviación estándar relativa, cuyo valor debe ser menor o igual al 2,00%. Precisión intermedia: se realizó en el mismo laboratorio, mismo analista, mismo equipo y se varió el día de análisis. De igual manera que con la repetibilidad se utilizó el patrón de concentración intermedia de la curva de calibración (Sodio: 0,7 μg/ml y Potasio: 1,0 μg/ml). Se prepara una solución cada día de análisis. Este parámetro también se evaluó con la la desviación estándar relativa cuyo valor debe ser menor o igual al 2,00%. Exactitud: se realizó evaluando la recuperación del método, en todos los niveles de concentración utilizados en la linealidad. Se determinó la concentración obtenida para cada solución y se comparó el valor obtenido con el valor verdadero. Para su evaluación se considera que los porcentajes de recuperación obtenidos deben estar dentro del rango de 97-103 %.
Determinación de contenido en tres lotes del producto: para el sodio, se preparó una curva de calibración conformada por seis soluciones patrón, con concentraciones entre 0,5 a 1,0 μg/ml. La curva de calibración se preparó a partir una solución madre (Cn= 10 μg/ml) elaborada a partir de una solución estándar de sodio (Cn= 1000 μg/ml). A cada solución patrón se le agregaron 2,00 ml cloruro de potasio (Cn: 100 mg/ml) como supresor de ionización. Para el potasio, se utilizó una solución estándar de potasio (Cn= 1000 μg/ml) para preparar una solución madre de potasio a 25 μg/ml. A partir de esta solución se preparó una curva de calibración conformada por 5 soluciones patrón con concentraciones entre 0,5 a 1,5 μg/ml. se utilizó como supresor de ionización 2,00 ml de cloruro de sodio (Cn: 100 mg/ml). Preparación de muestras: las muestras del producto en estudio se prepararon de la siguiente forma, se transfirió cuantitativamente el contenido de tres sobres en un balón de 500,00 ml. Se llenó aproximandamente a – partes con agua desionizada y se colocó en baño ultrasónico por 15 minutos, hasta lograr la disolución completa de la sal. Posteriormente se dejaron enfriar los balones y se aforaron con agua desionizada. De esta solución se tomó una alícuota de 2,00 ml y se llevó a un balón de 250,00 ml aforando con el mismo disolvente. A partir de esta solución se preparan las muestras de sodio y potasio. Para el sodio se tomó una alícuota de 3,00 ml y se llevó a un balón de 100,00 ml, se le adicionó 2,00 ml de KCl (Cn: 100 mg/ml) y se aforó con agua desionizada. En el caso del potasio se tomó una alícuota de 10,00 ml y se llevó a un balón de 100,00 ml, se le adicionó 2,00 ml de NaCl (Cn: 100 mg/ml) y se aforó con agua desionizada. Se analizaron tres lotes del producto y por cada lote se prepararon seis muestras.
Resultados
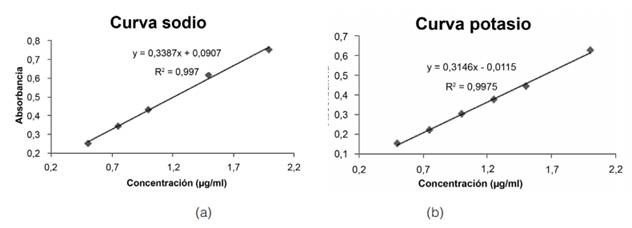
En la figura 1 se muestran dos de las curvas realizadas para determinar el rango para la concentración de trabajo. La curva “a” es para el sodio y la curva “b” para el potasio, ambas se realizaron en un rango de 0,5 μg/ml a 2 μg/ml.
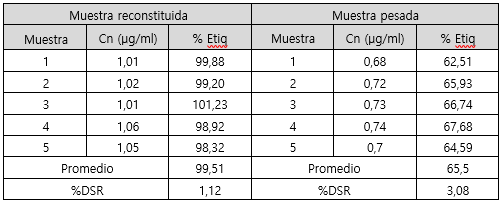
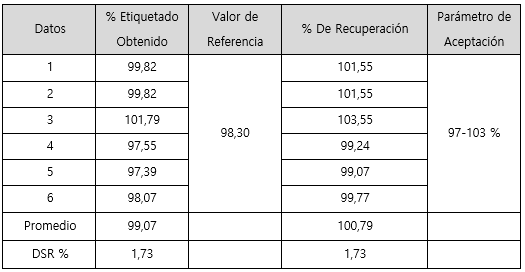
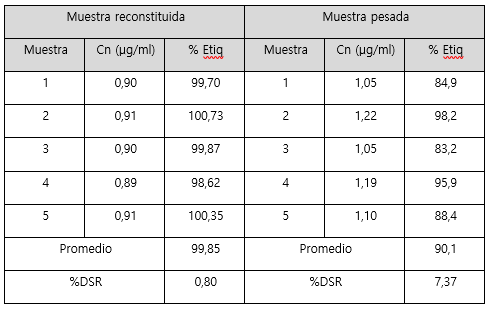
Seguidamente, se presentan los resultados en la determinación del porcentaje de lo etiquetado en un lote del producto, tratando la muestra de dos formas diferentes, mediante reconstitución total del contenido y con el peso analítico de una masa. En el cuadro 2 se muestran los resultados para sodio y en el cuadro 3 para potasio.
Cuadro 3 Resultados del porcentaje de lo etiquetado de potasio en muestras reconstituidas y en muestras pesadas.
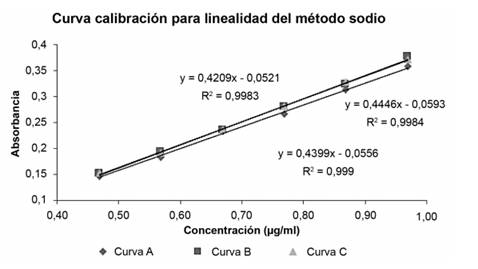
Validación del método para sodio: A continuación, se muestra en la figura 2 la superposición de las tres curvas de calibración realizadas para evaluar la linealidad de método para sodio.
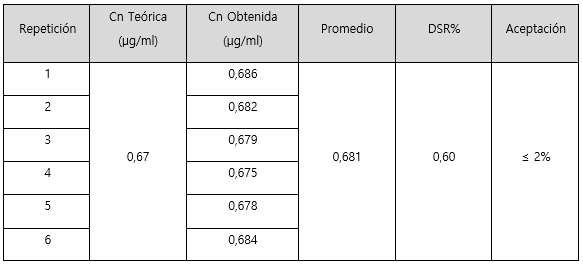
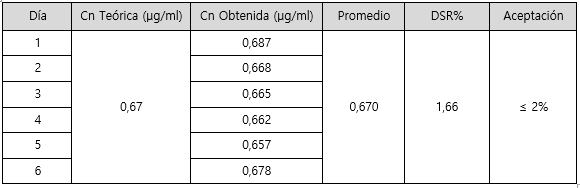
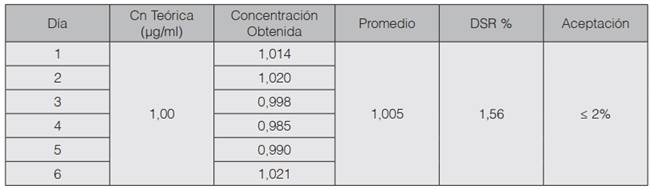
En cuanto a la repetibilidad y la precisión intermedia del método, los resultados obtenidos se muestran en los cuadros 4 y 5 respectivamente. En ambos se presenta el valor obtenido para cada medición realizada; y el promedio y la desviación estándar relativa del conjunto de datos.
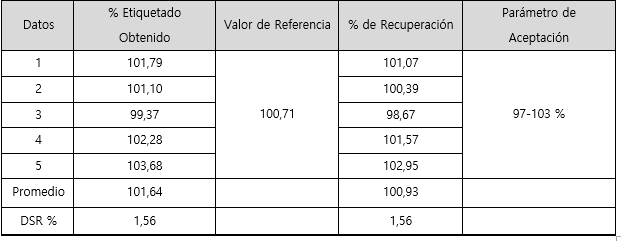
Finalmente, en el cuadro 6 se muestran los resultados obtenidos en la evaluación del parámetro de exactitud para sodio.
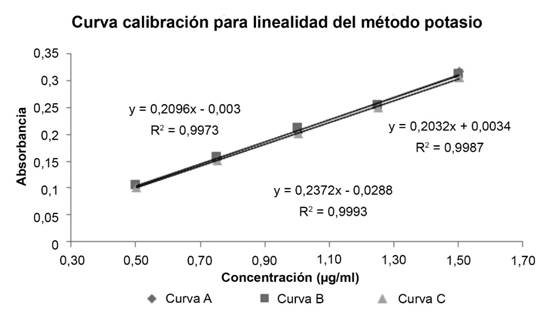
Validación del método para potasio: Continuando con la validación del método para análisis de potasio, en la figura 3 se presentan las tres curvas de calibración realizadas para la evaluación del parámetro de linealidad de método, con sus respectivas ecuaciones y coeficientes de correlación (r2).
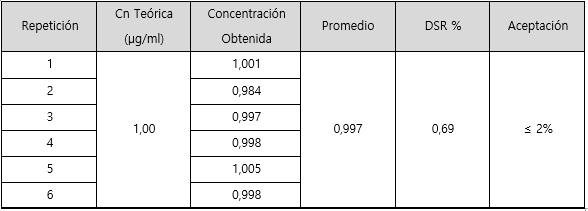
En los cuadros 7 y 8 se presentan los resultados obtenidos al evaluar la precisión del método para potasio. El cuadro 7 corresponde a los resultados del parámetro de repetibilidad y el cuadro 8 para la precisión intermedia.
Por último, en el cuadro 9 se muestran los resultados obtenidos en la evaluación del parámetro de exactitud para sodio.
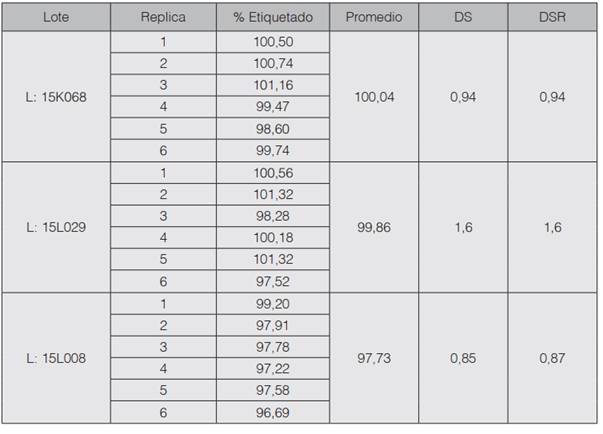
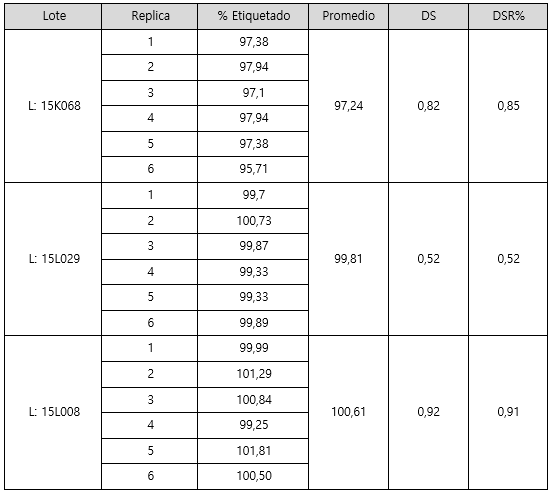
Porcentaje de lo etiquetado en tres lotes del producto: a continuación, se presentan los datos obtenidos del análisis de tres lotes del producto con los nuevos métodos adecuados por absorción atómica. Se determinó el porcentaje de lo etiquetado para sodio y potasio, el promedio, la desviación estándar y el coeficiente de variación (DRS%), en el cuadro 10 se muestran los resultados para sodio y en el cuadro 11 para potasio.
Discusión de resultados
Primeramente, según la figura 1, en el caso del sodio, se observa que la linealidad se altera a partir de concentraciones superiores a 1,0 μg/ml, ya que en estos puntos se presenta mayor desviación respecto a la línea de tendencia. Esto fue habitual en las curvas realizadas, por lo que se selecciona como rango de trabajo para sodio concentraciones entre 0,5 -1,0 μg/ml. Para el potasio, se observó que el punto cinco (Cn: 2,0 μg/ml), de la recta presenta una mayor desviación, por lo que con el objetivo de obtener una mejor linealidad se escoge trabajar con concentraciones entre 0,5 -1,5 μg/ml.
En cuanto a la forma idónea para la valoración del porcentaje de lo etiquetado para sodio y potasio respectivamente. Se puede observar en los cuadros 2 y 3, que en ambos casos se presenta mayor variación y menor porcentaje de lo etiquetado cuando la muestra se prepara a partir de una masa. En cambio, cuando se realiza la reconstitución del contenido total, la variación entre los resultados es menor y los resultados cumplen con lo especificado en la USP 39 (31) para el contenido de sodio y potasio en sales para rehidratación oral (90-110% de lo etiquetado). La diferencia entre el porcentaje de lo etiquetado obtenido mediante un peso y la reconstitución, se puede deber principalmente a que la muestra de masa tomada para preparar la muestra no era homogénea y representativa del contenido total. Por las características de cada compuesto utilizado en la formulación de la sal, el tamaño de partícula varía de forma significativa entre cada uno. Por lo que al preparar una muestra a partir de un peso no puede asegurar que se toma una muestra completamente homogénea, es decir se puede pesar más de un compuesto que de otro. Entonces, la manera idónea para preparar la muestra es mediante la reconstitución.
Seguidamente, se analizan los resultados obtenidos para la validación del método para sodio iniciando con el parámetro de linealidad. En la figura 2, se muestran las gráficas obtenidas para las tres curvas de calibración realizadas para evaluar la linealidad del método. Se puede observar que la ecuación de la recta varía en cada una de las curvas, sin embargo, aunque los valores obtenidos para la pendiente y el intercepto, aunque no son iguales presentan similitud entre sí. En relación con el coeficiente de correlación (r2), los valores obtenidos varían entre 0,9983 y 0,9990 para la linealidad del método; estos valores se consideran aceptables. Ya que el criterio de aceptación para este parámetro según la Guía del Ministerio de Salud es 0,995, por lo que se cumple adecuadamente demostrando que existe correlación significativa.
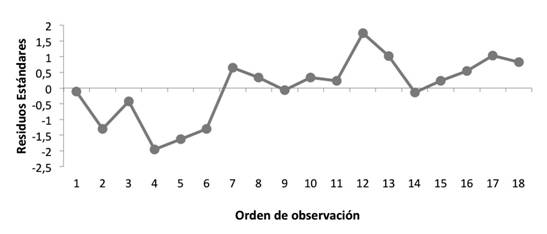
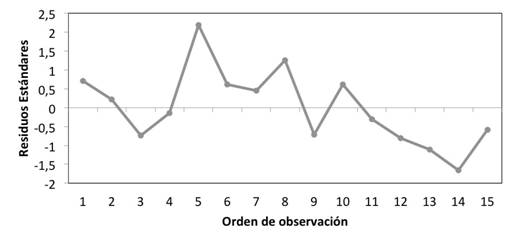
A continuación, en la figura 4 se muestra el análisis de residuos para la linealidad del método. Se puede observar una distribución aleatoria, en la cual los residuos se distribuyen tanto en la parte positiva como en la negativa de la gráfica. Además, no se observan patrones en la distribución de los residuos, lo cual es deseable.
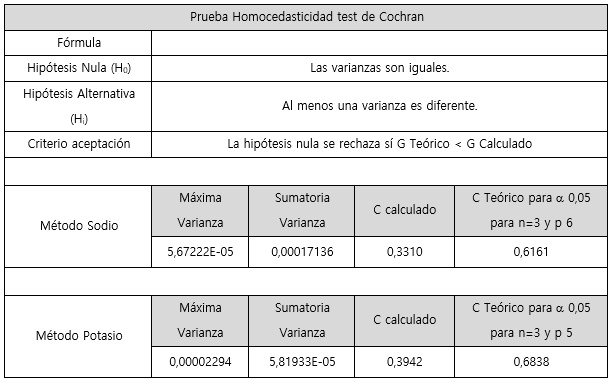
Para evaluar la varianza entre las curvas se realizó una prueba estadística de homocedasticidad, en la cual se aplicó el test de Cochran tal y como se muestra en el cuadro 12, dicha prueba indicó un comportamiento homocedástico con un α de 0,05. El valor C de Cochran calculado correspondió a 0,3468 para linealidad del método. Al comparar el valor obtenido, este es menor que el valor tabulado 0,6161 (para α 0,05 para n=3 y p 6), por lo que se acepta la hipótesis nula, la cual indica que las varianzas son iguales ya que no existe suficiente evidencia estadística para desmostar lo contrario.
Por su parte, en el cuadro 4 se muestran los resultados obtenidos para la repetibilidad del método para sodio. Se puede observar que el DSR% obtenido no supera el criterio de aceptación establecido por la Guía del Ministerio de Salud, el cual corresponde al 2%. Por lo que tanto el sistema como el método presentan una repetibilidad adecuada. De forma similar ocurre con la precisión intermedia (cuadro 5), para la cual se obtuvo un valor de 1,66 para DSR% del método. Ambos valores son menores que el criterio de aceptación 2%, por lo que se observa una precisión intermedia adecuada. Es importante reafirmar que para evaluar la precisión intermedia se modificó el día de análisis manteniendo constante el analista, equipo y el laboratorio.
Para el parámetro de exactitud los resultados obtenidos se muestran en el cuadro 6, donde se observa que el promedio del porcentaje de recuperación se encuentra dentro del rango aceptado, que es de un 97- 103 % para métodos químicos o espectrofotométricos según la USP. No obstante, evaluando los datos individualmente se puede observar como el tercer dato presentó el mayor porcentaje de recuperación, un 103,55%, el cual sobrepasa el límite superior en un 0,55 %. Se puede considerar este porcentaje como poco significativo, y por ser solo un dato el que presenta esta tendencia se establece como un error aleatorio, que no compromete significativamente la exactitud del método.
Seguidamente, en los resultados obtenidos para la validación del método de potasio, iniciando por el parámetro de linealidad. En la figura 3 se grafican las tres curvas de calibración realizadas para la evaluación de este parámetro. En cuanto al coeficiente de correlación (r2) se considera adecuado ya que los valores obtenidos son mayores que el criterio de aceptación r2= 0,995 según regulación.
La figura 5 muestra el análisis de residuos para la linealidad del método. Se observa como los residuos se distribuyen de forma aleatoria lo cual es deseable; y aunque los últimos cinco datos se mantienen en la parte inferior de la gráfica, no se puede considerar una tendencia ya que se necesitan más datos consecutivos; además, el último dato tiende a subir.
En cuanto al análisis de la varianza entre las curvas, se aplica el test de Cochran para determinar si presentan un comportamiento homocedástico, como se evidencia en el cuadro 12. La evaluación de esta prueba arrojó un valor experimental de 0,3942 para el método. Si se compara con el valor teórico 0,6838 (α 0,05 para n=3 y p 5) se puede afirmar que a un nivel de confianza del 95 % no existe suficiente evidencia estadística que permita demostrar que las varianzas son significativamente diferentes.
En cuanto a la repetibilidad y precisión intermedia del método para potasio se puede observar en los cuadros 7 y 8 que los valores de % DRS, son 0,69 para la repetibilidad y 1,56 para la precisión intermedia. A partir de estos valores se puede deducir que se cumple con el criterio de aceptación ya que no son mayores al 2%, sin embargo, la variación en los datos tiende a ser mayor al evaluar la precisión intermedia.
En el cuadro 9 se muestran los resultados obtenidos para el parámetro de exactitud. Donde queda evidenciado que el promedio obtenido para el porcentaje de recuperación 100,93 % se encuentra dentro del rango de aceptación 97-103 % para el caso de métodos químicos o espectrofotométricos. No obstante, individualmente se puede observar que el quinto dato es muy cercano al límite superior de aceptación, sin embargo, no incumple el criterio.
Para finalizar en los cuadros 10 y 11 se muestran los resultados de la determinación de sodio y potasio en tres lotes del producto en estudio. En el caso del sodio se obtuvieron valores promedio entre el rango de 97-100%; estos valores se encuentran dentro del intervalo de concentración aceptado por la farmacopea (90-110%) y presentan variabilidad aceptable ya que el DSR% en los tres lotes es menor al 2%. De igual forma los datos obtenidos en el análisis de potasio son adecuados ya que los promedios obtenidos (L1= 97,24 - L2= 99,81- L3=100,61) están dentro del rango de aceptación estipulado por la farmacopea (90-110%). Además, presentan una variación aceptable la cual no supera el 2%.
Conclusiones
La reconstitución del producto es la metodología más efectiva para la preparación de las muestras de sales de rehidratación oral; ya que por la composición de la formulación no se logra obtener un polvo completamente homogéneo que permita asegurar el uso de una masa que sea representativa del contenido.
Según las pruebas realizadas para la determinación de sodio y potasio por absorción atómica en el producto en estudio, se presenta una linealidad adecuada dentro del rango 0,5 a 1,0 μg/ml y 0,5 a 1,5 μg/ml, respectivamente. Dentro de estos rangos de concentración se obtuvieron coeficientes de correlación mayores a 0,995 por lo que se consideran adecuadas.
En los laboratorios de control de calidad de fármacos es sumamente importante que los métodos no oficiales utilizados sean validados para asegurar que son adecuados, y de esta forma garantizar que los resultados obtenidos al aplicar estas metodologías sean confiables.
Los parámetros evaluados para la validación de los métodos por Absorción Atómica para sodio y potasio en este estudio, cumplen con los criterios de aceptación, por lo que se puede concluir que la metodología implementada para la determinación de los metales en sales de rehidratación oral, brindan resultados confiables y precisos.