Introducción
En los años recientes, las microalgas se han convertido en una plataforma viable para numerosas aplicaciones biotecnológicas como la producción de biocombustibles, vitaminas, carotenoides, enzimas, farmacéuticos y proteínas recombinantes [1] . Su habilidad adaptativa para crecer en fotobiorreactores o estanques abiertos, produciendo altos rendimientos de biomasa utilizable para aplicaciones industriales han llamado la atención del sector de la investigación y desarrollo ( I+D) [2, 3] .
Para mejorar estas potencialidades, el desarrollo de la ingeniería genética de microalgas ha sido mostrado como la clave para convertirlas en microorganismos industriales [4]. Actualmente, se han identificado alrededor de 30000 especies de microalgas, pero solo se ha descrito la transformación genética de poco menos de 20 especies, muchas de ellas sin las características necesarias para ser microorganismos industriales [5].
Aunque las aplicaciones de ingeniería genética para mejorar las características de producción en microalgas se encuentran en las primeras etapas de desarrollo, se han logrado avances significativos en las herramientas de manipulación genética utilizando sistemas de microalgas modelo [6]. Se espera que estas aplicaciones puedan extenderse desde los sistemas modelo hasta microalgas de valor comercial [3].
La transformación genética de microalgas utilizando Agrobacterium tumefaciens ofrece varias ventajas incluyendo alta eficiencia, aplicación simple e integración preferencial en regiones transcripcionalmente activas [7, 8]. La transformación genética estable utilizando A. tumefaciens ha sido reportada en pocas microalgas, tan solo 6 especies han sido modificadas mediante esta técnica [5].
La microalga Chlorella sorokiniana es una alga verde de agua dulce (Chlorophyta), aislada de la región norte de Costa Rica. Se ha encontrado que esta microalga soporta considerables fluctuaciones de temperatura, pH, salinidad y ha sido cultivada de manera estable en fotobiorreactores de 700 L y estanques abiertos tipo raceway de 30000 L, localizados en diferentes regiones de Costa Rica. En consecuencia, se ha visto que cumple con los requisitos para convertirse en un microorganismo industrial [9]. En el presente estudio, se presenta el primer sistema de transformación exitoso mediado por A. tumefaciens en la microalga Chlorella sorokiniana, identificada como una especie de microalga con potencial para procesos industriales.
Materiales y Métodos
Cepa de microalga y condiciones de cultivo
La microalga costarricense Chlorella sorokiniana fue obtenida de la colección de microalgas de Centro de Investigación en Biotecnología (CIB) del Instituto Tecnológico de Costa Rica (ITCR). El cultivo fue realizado en medio BG-11. El pH fue ajustado a 6,8 y se añadió agar al 1,5 % en caso de necesitar crecimiento celular en medio semi-sólido. Los cultivos fueron mantenidos a 23 + 1 °C, bajo luz fluorescente blanca constante (200 µmolm−2s−1) con una agitación orbital media (120 rpm).
Plásmido y cepa bacteriana
El vector binario pCAMBIA 1303 (CAMBIA, Autralia) conteniendo el gen hptII (higromicina fosfotransferasa) como gen marcador antibiótico, conducido por el promotor CaMV 35S, fue utilizado en este estudio. Para la transformación de C. sorokiniana se utilizó la cepa de Agrobacterium tumefaciens LBA 4404, la cual fue mantenida en el medio Luria Broth (LB), suplementado con 50 mg L-1 de rifampicina, estreptomicina, kanamicina y espectinomicina.
Prueba de sensibilidad antibiótica
La sensibilidad de A. tumefaciens LBA 4404 ante el antibiótico ceftriaxona fue evaluada mediante la inoculación de 200 µL de cultivo de Agrobacterium (OD600 = 2,0) en 5 mL de caldo LB suplementado con concentraciones variables de ceftriaxona (0, 50, 100, 200, 500, 600, 700 y 1000 mg L-1). El crecimiento de A. tumefaciens en cada concentración fue determinado a OD600 después de dos días.
Con el fin de determinar la concentración mínima inhibitoria de higromicina B en la microalga, se sembraron 107 células de C. sorokiniana sobre medio BG-11 semi-sólido suplementado con diferentes concentraciones de higromicina B (0, 50, 60, 70, 80, 90, 100 y 125 mg L-1). Los cultivos en platos de agar fueron incubados por 2 días en oscuridad a 25°C antes de ser expuestos a la luz, y el número de colonias sobrevivientes fue evaluado después de 8 días.
El efecto del antibiótico ceftriaxona en la viabilidad de C. sorokiniana fue también determinado mediante la siembra de 107 células en medio BG-11 suplementado con diferentes concentraciones de ceftriaxona (0, 100, 200, 300, 400, 500, 600, 700, 800, 900 and 1000 mg l-1). Los cultivos fueron incubados por 2 días en oscuridad a 25°C antes de ser expuestos a la luz y el número de colonias sobrevivientes se evaluó después de 8 días.
Procedimiento de transformación
La transformación de C. sorokiniana fue realizada mediante un co-cultivo de la microalga con la cepa de A. tumefaciens LBA 4404 [7]. La bacteria A. tumefaciens conteniendo el plásmido pCAMBIA 1303 fue inoculada a partir de un stock criopreservado en 10 mL de medio LB suplementado con los respectivos antibióticos. El cultivo fue crecido durante toda la noche en un agitador orbital a 27 °C y 200 rpm, en oscuridad. Cinco mililitros de ese cultivo fueron utilizados para inocular 45 mL del mismo medio, los cuales fueron crecidos durante toda la noche a 27 °C y 200 rpm.
El cultivo bacteriano fue cosechado mediante centrifugación a 4000 rpm por 5min y fue lavado una vez con el medio de inducción (BG-11, 150 mM acetosiringona, pH 5,6). Una vez que el pellet bacteriano fue lavado, se resuspendió en el medio de inducción y fue diluido hasta una OD600 = 1,5. El cultivo bacteriano fue incubado a 25 °C durante 4 horas a 100 rpm para la activar los genes vir.
Paralelamente, 107 células de C. sorokiniana fueron sembradas por extensión sobre placas de agar BG-11 (pH 5,5) 2 días antes de la transformación. Los cultivos fueron incubados a 25 °C, bajo luz fluorescente constante.
El día de la transformación, las placas con el cultivo de microalgas fueron cosechadas con 1 mL del medio de inducción. La suspensión de microalgas fue centrifugada a 5000 rpm durante 5 min, el sobrenadante fue descartado. El pellet de microalgas fue resuspendido en 200 µL de cultivo de Agrobacterium. La suspensión fue incubada a 25 °C durante 30 min con agitación media.
Después del tiempo de incubación, 200 mL de la suspensión fueron sembrados por extensión sobre placas de agar con medio de inducción. El co-cultivo se extendió por 3 días a 24 °C en oscuridad. Al finalizar el periodo de co-cultivo, las células se cosecharon con 5 mL de medio BG-11 suplementado con 700 mg L-1 de ceftriaxona y fueron incubadas en oscuridad a 25 °C y 120 rpm por 2 días con el objetivo de eliminar las células de Agrobacterium.
Al término del periodo post co-cultivo, 100 µL de la suspensión fue sembrada en el medio selectivo que contenía BG-11 (pH 5,5) suplementado con 700 mg L-1 de ceftriaxona y 125 mg L-1 de higromicina B. Los cultivos fueron incubados en oscuridad a 25 °C por 2 días antes de ser expuestos a la luz. El crecimiento microalgal fue analizado después de 15 días.
Análisis de las colonias transformadas mediante PCR
Se aplicó la reacción de PCR para confirmar la transformación de las colonias de Chlorella, utilizando los imprimadores específicos para el gen de resistencia a la higromicina; htp (HF-5’- GATGTTGGCGACCTCGTATT-3’; y HR-5’-GTGTCACGTTGCAAGACCTG3’).
La reacción de PCR fue llevada a cabo en un volumen total de 20 μL que contenían 2 μL Buffer Dream Taq 10X, 1 μL dNTPs (2mM), 0,5 μL de cada imprimador (10 μM), 0,1 μL de DreamTaq DNA Polymerase (5U mL-1) y 15,9 μL de agua libre de nucleasas con una colonia de Chlorella como ADN molde en un termociclador (Applied Biosystems® Veriti®). Se utilizó el siguiente perfil térmico para todas las reacciones: 10 min de desnaturalización a 94°C para degradar la pared celular e inactivar las nucleasas, seguido de 36 ciclos de 94 °C por 1 min, 60 °C por 1 min y 72 °C por 1 min, con una extensión final por 10 min a 72°C. Los productos de PCR fueron analizados en una electroforesis en gel de agarosa al 1,5%.
Resultados y discusión
Se determinó que la concentración más baja de higromicina B que inhibe completamente el crecimiento de 107 células de C. sorokiniana es de 100 mg L-1 (Cuadro 1). La concentración obtenida es cinco veces mayor a la reportada por Jungmoo et al. [10] y Cha et al [7]; la cual fue de 20 mg L-1 de higromicina para la selección de líneas transgénicas de Chlorella vulgaris en medio BG-11 y medio FCM respectivamente. Sin embargo, Sanitha et al. [1] informó que la cepa de C. sorokiniana SRM06 fue la única microalga, de entre nueve, que fue resistente a una concentración de higromicina de 25 mg L-1. Estos resultados suponen que C. sorokiniana tiene una alta tolerancia a los antibióticos aminoglucósidos como la higromicina, lo cual es respaldado por Yi-yun y Chang-hai [11], quienes señalan que Chlorella sp. es relativamente sensible a la higromicina.
Cuadro 1 Sensibilidad de C. sorokiniana y A. tumefaciens ante la higromicina B y la ceftriaxona.
| Cepas usadas en este estudio | [84]Higromicina 0 -90 mg L-1 | [85]Higromicina 100 -125 mg L-1 | [86]Ceftriaxona 0 -600 mg L-1 | [87]Ceftriaxona 600-1000 mg L-1 |
|---|---|---|---|---|
| C. sorokiniana | [90]Resistente | [91]Sensitivo | [92]Resistente | [93]Resistente |
| A. tumefaciens | [96]- | [97]- | [98]Resistente | [99]Sensitivo |
-Concentración no probada.
El crecimiento de A. tumefaciens LBA 4404 fue suprimido a una concentración de ceftriaxona de 700 mg L-1. Proporciones similares de este antibiótico fueron necesitadas por Yarizade et al. [12] y Aram et al.[13] para inhibir el crecimiento de la misma cepa después de procesos de transformación en tejidos vegetales de tomate, trigo y la lechuga. No existen reportes sobre el uso de la ceftriaxona posterior al co-cultivo de A. tumefaciens y microalgas. Nuestro trabajo evidencia por primera vez el uso de este antibiótico como un agente eficaz para inhibir el crecimiento de A. tumefacienes LBA 4404 en co-cultivo con microalgas utilizando medio BG-11. Esto representa una mejora para los procesos de transformación de microalgas, demostrando que la ceftriaxona es una alternativa a antibióticos de mayor costo antes reportados como la cefotaxima [7] .
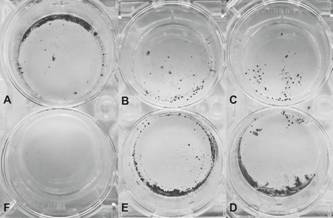
Figura 1 Crecimiento de colonias de C. sorokiniana transformadas en medio selectivo. A-D. Microalgas transformadas. F. Control negativo.
Los resultados obtenidos en este estudio muestran que las altas concentraciones de ceftriaxona (1000 mg L-1) no afectan ni inhiben el crecimiento de la microalga Chlorella sorokiniana. No existen reportes a cerca del efecto de la ceftriaxona sobre la fisiología o crecimiento de las microalgas, sin embargo, no ha demostrado toxicidad en tejidos vegetales [14, 15].
La Figura 1 muestra las colonias transgénicas de C. sorokiniana obtenidas mediante el proceso de transformación por co-cultivo con A. tumefaciens. El presente trabajo reporta el primer evento de transformación de una C. sorokiniana nativa utilizando esta técnica. Un factor de éxito clave en este estudio fue la adición de un tiempo de recuperación post co-cultivo, que resultó ser beneficioso para el proceso de transformación, ya que condujo a un aumento en el crecimiento de colonias resistentes a la higromicina en el medio selectivo.
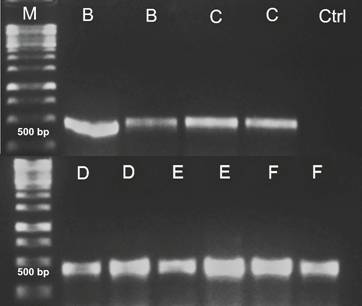
Figura 2 Productos de PCR de colonias de C. sorokiniana transformadas. M. GeneRuler 1 kb DNA Ladder. B-F. Colonias transformadas elegidas al azar que muestran el amplicón del gen hptII (400 pb). Ctrl. Control negativo.
La microalga C. sorokiniana transgénica mostró crecimiento tal como el control positivo sembrado en medio sin higromicina, mientras que el control negativo (microalgas sin exposición a las bacterias) no mostró crecimiento alguno. Otros autores utilizaron un tiempo de recuperación posterior al co-cultivo en la transformación de Tetraselmis chuii y Chlorella vulgaris, para obtener mayores tasas de transformación [5],[7]. Por lo tanto, añadir un período post co-cultivo (> 2 días) demuestra ser adecuado para recuperar la integridad de las células de microalgas y lograr una eliminación total de bacterias.
Otros factores determinantes como la densidad celular bacteriana, la concentración de microalgas, el pH del medio de inducción, la temperatura del co-cultivo, así como el uso y concentración de acetosiringona no habían sido optimizados para la transformación de C. sorokiniana. Los resultados obtenidos en nuestro trabajo demuestran que una densidad bacteriana de OD600 = 1.5, 3 días de co-cultivo a 24°C en medio BG-11 (pH 5.6), 150 mM de acetosiringona y dos días de recuperación post co-cultivo son las condiciones óptimas para la transformación de C. sorokiniana.
La Figura 2 muestra el resultado de una PCR directa realizada a colonias transgénicas de C. sorokiniana con el fin de identificar el gen htp. Los productos de PCR positivos confirman la transformación, debido a que se identifica claramente un fragmento de 400 pb. De esta manera, se confirma molecularmente la integración de los genes del pCAMBIA 1303 en el ADN nuclear de Chlorella sorokiniana.
Conclusiones
En la presente investigación, la expresión del gen de resistencia a la higromicina bajo el control del promotor CaMV35S permitió optimizar la transformación genética de la microalga C. sorokiniana, lo que mejorará el rendimiento de la transformación y expresión de genes heterólogos en esta microalga. La transformación estable de las microalgas se encuentra aún en sus primeras etapas de desarrollo y tiene un largo camino por recorrer. Muchas barreras como la inestabilidad de la expresión de los transgénes o el silenciamiento genético deben continuar investigándose con el objetivo de desarrollar una microalga con el potencial de convertirse en un microorganismo industrial.














