Introducción
Varias especies de Vaccinium son valiosas por sus frutos comestibles y por ser una excelente fuente de nutrientes que promueven la salud, contienen fibras dietéticas, antioxidantes (vitamina C, betacaroteno, ácido fólico, antocianinas), presentan agentes antifúngicos, como antocianósidos y ácido benzoico. Los frutos se consumen como productos frescos o procesados, tales como congelados, enlatados, líquidos, concentrados y productos secos, como conservas, dulces, jaleas, jugos, jarabes, helados, pastas, así como suplementos nutricionales y productos farmacéuticos [1]. En las últimas décadas se ha presentado un aumento en la demanda de arándanos y los frutos han alcanzado precios atractivos en el mercado, lo que ha estimulado el incremento en el área de cultivo en todo el mundo. Con el fin de satisfacer la creciente demanda de plántulas de arándano, se recomienda la micropropagación como el enfoque más apropiado para disponer de altos volúmenes de material de siembra élite, para satisfacer la demanda de los productores y la siembra a gran escala [2]. La micropropagación de materiales, variedades e híbridos, de este género en varias especies especialmente V. corymbosum está bien documentada, pero se afirma que la habilidad de regeneración in vitro es altamente dependiente del genotipo y por lo tanto, es necesario hacer algunas modificaciones en el protocolo para los diferentes cultivares [2, 1, 3, 4]. En Costa Rica, el arándano es una de las especies silvestres cuya domesticación ha despertado gran interés, ya que es horticulturalmente promisorio y está bien adaptado a zonas altas. El arándano nativo, Vaccinium consanguineum, presenta altos contenidos de antioxidantes al igual que otras especies de este género [5]. Este material nativo ha sido establecido asépticamente, observándose una lenta brotación y desarrollo de sus yemas latentes, aún en presencia de reguladores de crecimientos [6]. No existen reportes adicionales de la domesticación de V. consanguineum, ni tampoco de su cultivo in vitro.
El presente proyecto tuvo como objetivo desarrollar investigación conducente a establecer un protocolo para la multiplicación y enraizamiento de los brotes obtenidos de explantes de V. consanguineum producidos in vitro, con el fin de contar, a mediano plazo, con una metodología para la producción masiva y disponer de material de siembra para promover su cultivo e incentivar la diversificación de la actividad agrícola, principalmente en zonas altas, vulnerables o erosionadas por la intensiva explotación hortícola.
Materiales y Métodos
Recolecta
Una vez alcanzado el objetivo de contar con un protocolo de desinfección y establecimiento in vitro [6], se realizaron giras periódicas para la recolecta a los sitios denominados Cerro Buena Vista, localizado en Las Torres en el Cerro de la Muerte, Volcán Irazú y Volcán Turrialba. Estas recolectas permitieron disponer de suficiente germoplasma para continuar con el desarrollo del protocolo de establecimiento y multiplicación de brotes. Se recolectaron tallos jóvenes poco lignificados y fueron trasladados al laboratorio de cultivo de tejidos del Centro de Investigación en Biotecnología (CIB), para realizar el establecimiento in vitro. También fueron recolectadas estacas lignificas, plantas y frutos. Las plantas y estacas fueron sembradas en macetas en el invernadero, a los frutos se les extrajeron las semillas, las cuales fueron sembradas en sustrato estéril en el invernadero y en medio de cultivo MS simple en condiciones in vitro. Las siembras en invernadero se realizaron con el objetivo de establecer el material de interés en etapa 0 (pretratamiento de desinfección, fertilización y control fitosanitario en condiciones de invernadero), de manera que el material experimental a introducir al cultivo in vitro estuviera fácilmente disponible cerca del laboratorio de cultivo de tejidos y a la vez poder realizar algunas pruebas de propagación vegetativa como enraizamiento de estacas.
Propagación vegetativa tradicional
Se realizaron dos ensayos de propagación vegetativa tradicional. Para cada ensayo se utilizaron siete estacas semi leñosas de arándano de 5 mm de diámetro y 20 cm de largo. Las estacas fueron sumergidas en 0, 5 y 600 ppm de Ácido indolbutírico (AIB) durante 10 minutos y sembradas en sustrato de turba (Giffy®) con una cúpula plástica para la protección de la humedad. Esta se retiró una vez que el desarrollo de los brotes fue evidente.
Germinación de semillas in vitro y ex vitro
Los ensayos de germinación de semillas se realizaron utilizando los frutos maduros. Estos fueron desinfectados utilizando una solución de NaClO 3% i.a por 10 minutos y posteriormente fueron enjuagados tres veces con agua destilada estéril en la cámara de flujo laminar. Se inoculó 1 semilla por tubo de ensayo conteniendo 10 ml de medio de cultivo WPM al 50% de la concentración de sales y con 0, 1, 1,5 y 3 mgL-1 de AG3 para un total de 20 semillas por tratamiento y el ensayo se repitió dos veces. Las semillas fueron cultivadas en condiciones de luz intensa (26 μM·s-1·m-2), 22 ºC y un fotoperiodo de 16 horas. La germinación fue evaluada después de seis meses.
En condiciones ex vitro, los ensayos para la germinación de semillas se realizaron en bandejas plásticas de almácigo con sustrato de turba. Las semillas fueron extraídas del fruto y lavadas con agua corriente antes de su siembra. Cuarenta y ocho semillas por bandeja fueron sembradas y el ensayo se repitió dos veces. La germinación final fue evaluada después de seis meses y las plántulas fueron trasplantadas a macetas dos meses después.
Establecimiento invitrode estacas
En resultados obtenidos en ensayos anteriores para el establecimiento in vitro de los arándanos nativos [6], se recomendó la desinfección con una solución de cloruro de mercurio (HgCl2) al 0.175% durante 6 minutos. En esta investigación fueron evaluados otros tratamientos que no utilizaron HgCl2, sino sustancias con menor toxicidad como el Hipoclorito de sodio (NaOCl), Jabón quirúrgico, Jabón enzimático, Zero tolerance®, Oxvirid®, Peróxido de hidrógeno, adicionalmente se mantuvo la incubación en Agrimicin y benlate durante 30 min (Cuadro 1).
Posterior al tratamiento de desinfección, las estacas (explantes) fueron enjuagados tres veces con agua destilada estéril en la cámara de transferencia de flujo laminar. Mientras se realizaba la siembra en los tubos de cultivo (15 x 3 mm), los explantes se mantuvieron en una solución antioxidante de 500mg/l de ácido cítrico y 1 gL-1 de ácido ascórbico (previamente esterilizados). Inicialmente las estacas fueron sembradas en los tubos de ensayo conteniendo 10 ml del medio WPM [7] al 50% de su concentración suplementado con 3 mgL-1 BA + 500 mgL-1 carbón activado. El pH se ajustó a 5,7. En cada introducción y establecimiento in vitro se sembraron 40 estacas con tres repeticiones en cada introducción.
Los tubos conteniendo los explantes fueron colocados en el cuarto de crecimiento en condiciones de oscuridad por 8 días a una temperatura de 21ºC a 22ºC. Posteriormente se mantuvieron en el mismo cuarto de crecimiento pero en luz directa (26 μM·s-1·m-2) , con un fotoperiodo de 16 horas.
Cuadro 1 Desinfección de estacas de arándano (Vaccinium consangineum) para el establecimiento in vitro.
| Tratamiento | [59]Desinfectante | [60]Concentración | [61]Tiempo de incubación |
|---|---|---|---|
| 1 | [64]Jabón quirúrgico [65] Agrimicyn® y Benlate® +Tween 20 [66] NaClO + tween 20 [67] Zero tolerance | [68]150 mlL-1 [69] 4 gL-1 [70] 3% i.a [71] 3% i.a | [72]10 min en agitación [73] 30 min en agitación [74] 10 min en agitación [75] 10 min en agitación |
| 2 | [78]Jabón quirúrgico [79] Agrimicyn y Benlate +Tween 20 ® [80] NaClO + tween 20 ® [81] Ox Virin | [82]150 mlL-1 [83] 4 gL-1 [84] 3% i.a [85] 3% i.a | [86]10 min en agitación [87] 30 min en agitación [88] 10 min en agitación [89] 10 min en agitación |
| 3 | [92]Jabón quirúrgico [93] Agrimicyn y Benlate +Tween 20 ® [94] NaClO + tween 20 ® | [95]150 mlL-1 [96] 4 gL-1 [97] 3% i.a [98] 3% i.a | [99]10 min en agitación [100] 30 min en agitación [101] 5 min en agitación [102] 10 min |
| 4 | [105]Jabón enzimático [106] Agrimicyn y Benlate +Tween 20 ® [107] NaClO + tween 20 ® | [108]5 mlL-1 [109] 4 gL-1 [110] 3% i.a | [111]10 min en agitación [112] 30 min en agitación [113] 10 min en agitación |
Brotación in vitro de estacas
Con las estacas establecidas asépticamente se evaluó el efecto de tres reguladores del crecimiento en el medio de cultivo WPM al 50% de su concentración. Se evaluó BA (0, 3, 5, 10, 15 y 20 mg/l), zeatina (Z) (0, 0,1, 0.5). La unidad experimental consistió de 1 explante por envase de cultivo con 40 repeticiones y cada experimento se repitió al menos dos veces. Las evaluaciones se realizaron semanalmente durante 14 semanas. Se evaluó el porcentaje de explantes mostrando indicios de brotación (yemas hinchadas, elongadas y brotadas).
Estimulación de la brotación por medio de choques térmicos
También se estudió la exposición del material establecido asépticamente a choques térmicos para estudiar su efecto sobre la brotación de las yemas. Fueron evaluadas temperaturas de 30 ºC durante 4 días y de 35 ºC durante 2, 3, 5 y 6 días utilizando una incubadora. También fue evaluada la incubación en cámara fría a 5ºC durante 4 y 7 días. En todos los ensayos se mantuvo un tratamiento testigo a 25ºC ± 2 (temperatura del cuarto de crecimiento). El medio de cultivo para las pruebas en altas temperaturas consistió en un WPM al 50% y con 3 mgL-1 de BAP y 30gL-1 de sacarosa. Para las pruebas en bajas temperaturas el medio fue enriquecido con 120 gL-1 de sacarosa y se evaluó también el medio de cultivo con 0,1mgl-1 de Z. Cada unidad experimental consistió de 1 explante por envase de cultivo con 80 repeticiones y cada experimento se repitió al menos dos veces. Pasados los periodos de cultivo en altas y baja temperatura, los explantes fueron cultivados en el mismo medio descrito, excepto aquellos que venían del tratamiento en frío, en el cual la sacarosa fue disminuida a 30 gl-1. La evaluación se realizó semanalmente durante 8 semanas, tomando en cuenta el número de explantes oxidados y muertos, yemas elongadas y brotados.
Posteriormente se estableció una prueba para evaluar el efecto de la exposición de los explantes a la baja temperatura por un mayor periodo (15 días a 5ºC) en el medio de cultivo que contenía 0,1 mgL-1 Z y 120 gL-1 de sacarosa. Igualmente, los explantes fueron subcultivados en el mismo medio de cultivo pero disminuyendo la sacaros a 30 gL-1. La brotación se evaluó después de 8 semanas en el cuarto de cultivo a 25ºC.
Multiplicación in vitro de brotes
Todos los brotes obtenidos en los diferentes ensayos fueron separados del explante inicial (estaca) y subcultivados en dos sistemas de cultivo: medio semisólido (WPM al 50%), enriquecido con 3 mgL-1 de BAP y el mismo medio pero líquido estacionario con puente de papel, enriquecido con 0,1 de Z, ambos con 30 gL-1 de sacarosa.
Resultados
Recolecta
Las giras de recolecta se realizaron quincenalmente. En las plantas se observaron diferentes etapas reproductivas, fisiológicas y sanitarias dependiendo de la época de la colecta, lo que tuvo un efecto en el establecimiento aséptico de los materiales, que se reflejó en los tratamientos de desinfección y brotación. Se observó que el periodo comprendido entre mayo y julio fue el más recomendable para la colecta, por la respuesta positiva de los explantes al cultivo in vitro, ya que este periodo corresponde a la fase vegetativa de las plantas.
De las plantas recolectadas para sembrar en el invernadero como fuente de material experimental para los ensayos in vitro, se observó 100% de supervivencia y adaptación a las condiciones ambientales del invernadero. Una señal de su adaptación fue que el 40% presentó floración y fructificación (Figura 1).
Propagación vegetativa tradicional
El 80% de las estacas enraizaron después de 5 meses de sembradas, sin embargo, con base en los tratamientos con el AIB, no se observaron diferencias ni en el porcentaje de enraizamiento ni en el periodo para desarrollar las raíces, incluyendo al testigo sin el regulador del crecimiento. En cuanto a la brotación de las yemas, se observó el engrosamiento y elongación de las mismas después seis meses siembra, desarrollándose los brotes 9 meses después de la siembra de las estacas (Figura 2).
Germinación de semillas in vitro y ex vitro
Se observó que el proceso de germinación de las semillas de arándano fue muy lento, tanto in vitro como ex vitro. El mayor porcentaje de germinación se observó cuando las semillas fueron expuestas a condiciones ex vitro para su germinación, observándose que la germinación de las semillas ex vitro inició después de 9 semanas de la siembra en invernadero y a los 3 meses el 24 % logró germinar (Figuras 3 y 4).
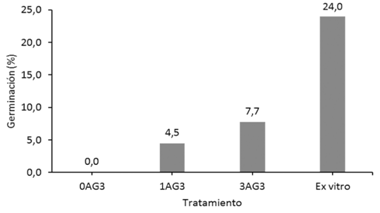
Figura 3 Germinación de semillas de arándano (Vaccinium consanguineum) in vitro con y sin la adición de ácido giberélico al medio de cultivo y ex vitro sin la adición del regulador del crecimiento.

Figura 4 Plantas germinadas a partir de semillas de arándano (Vaccinium consanguineum) después de un año de cultivo en condiciones de invernadero.
En condiciones in vitro se observaron los menores porcentajes de germinación de las semillas 0 a 7%. Se evidenció que aquellos tratamientos que contenían AG3 fueron los que mostraron respuesta y que a mayores concentraciones de este regulador se observó mayor respuesta germinativa ( figuras 3 y 5). Sin embargo, al cabo de un año, las plántulas no presentaron mayor crecimiento en medio de cultivo WPM 50% renovado cada 3 meses (Figura 5).
Establecimiento in vitro de estacas
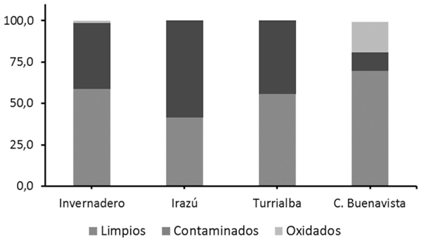
Al analizar los 4 tratamientos utilizados para la desinfección de estacas (Figura 6) se observó una diferencia entre aquellos tratamientos que utilizaron el desinfectante Zero Tolerance (Tratamiento 1) y Ox virid (Tratamiento 2), y aquellos que solamente utilizaron NaClO, jabón quirúrgico y jabón enzimático (Tratamientos 3 y 4). Los explantes desinfectados con los tratamientos con Zero tolerance y Ox virin mostraron mayor presencia de hongo y bacteria y oxidación respectivamente, que los explantes de los tratamientos 3 y 4 (Figura 6). Asimismo, se observó que manteniendo la misma composición del desinfectante, pero cambiando el jabón quirúrgico (Tratamiento 3) por el jabón enzimático (Tratamiento 4) se mejoró considerablemente el porcentaje de explantes supervivientes, ya que se redujo la contaminación y la oxidación.
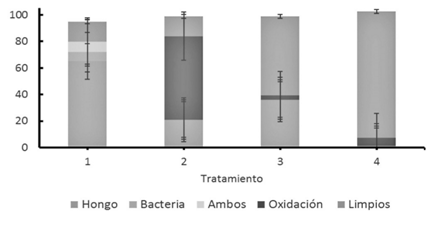
* [169] *Error Estándar
Figura 6 Efectividad de los tratamientos de desinfección en estacas de arándano (Vaccinium consangineum) para el establecimiento in vitro.
Durante las siguientes introducciones se utilizó en Tratamiento 4 para las desinfecciones y se analizó la respuesta de los explantes recolectados en diferentes sitios, con condiciones climáticas diferentes (Figura 7). Los resultados obtenidos fueron muy variables, se observó que el material del arándano proveniente del Cerro Buenavista (Las Torres) presentó los mayores porcentajes de supervivencia, asimismo el mayor porcentaje de expantes limpios. Por otra parte, los expantes provenientes tanto de invernadero como del Volcán Turrialba e Irazú no presentaron oxidación o bajos porcentajes, pero todos los explantes limpios, indistinto de la procedencia del material, permanecieron latentes sin que se observaran indicios de brotación de yemas.
Brotación in vitro de estacas
Al evaluar los diferentes reguladores del crecimiento, en varias concentraciones, se observó que la zeatina (Z) en bajas concentraciones (0,5, 1 y 3 mgL-1) indujo la brotación de yemas en porcentajes que alcanzaron 7,1, 8,9 y 11,5% respectivamente. Solamente aquellos explantes cultivados en presencia de BAP en las menores concentraciones evaluadas (3 y 5 mgL-1) indujeron brotación en 23,8% y 12% respectivamente. Los explantes cultivados en mayores concentraciones de BAP presentaron formación de callo, mostrando los puntos de crecimiento de una organogénesis indirecta (Figura 8).
Estimulación de la brotación por medio de choques térmicos
Al exponer el material establecido asépticamente a temperaturas de 35 y 30°C se observaron porcentajes de oxidación que oscilaron entre 82,4 a 51,3% y al final del periodo de evaluación todos estos explantes habían muerto.
Cuando los explantes fueron expuestos a 5°C durante 4, 7 y 15 días, los porcentajes de oxidación fueron menores, observándose valores entre 22,4% y 12,3% de oxidación y la brotación total de los explantes expuestos al frío por estos períodos fue de 20% y la calidad de estos brotes fue superior a aquellos obtenidos de explantes sin el pretratamiento en frío. Sin embargo, aún los explantes oxidados mostraron indicios de brotación a las cuatro semanas de cultivo a 25°C ± 2°C en el cuarto de crecimiento, pero murieron posteriormente (Figura 9).
La prueba de incubación en frío se repitió utilizando el mismo medio de cultivo con 120 mg.L-1 de sacarosa y 0,1 mg.L-1 de Z, ya que fue el tratamiento que presentó mayor supervivencia de los brotes, menor oxidación y mayor brotación. En este ensayo se obtuvo 25% de brotación de explantes y estos brotes fueron utilizados para las pruebas de multiplicación (Figura 10).

Figura 9 Estacas de arándano (Vaccinium consanguineum) oxidadas mostrando brotación, después de la incubación a 5°C durante 7 días y luego transferidas al cuarto de cultivo a 25°C.
Multiplicación de brotes
Los brotes obtenidos de los ensayos realizados fueron separados de la estaca y se evaluaron dos sistemas de cultivo: en medio semi sólido 3mgL-1 de BA (Figura 12) y en medio líquido estacionario con puente y 3 mgL-1 de BA o 0,1 mgL-1 de Z (Figura 11). Después de tres semanas de cultivo, el 70% de los brotes en el primer sistema mostraron oxidación, caída de hojas y muerte. Al utilizar el sistema de medio líquido con puente y 3 mgL-1 de BAP se observó que los brotes se oxidaron y murieron, confirmando que en esta investigación la adición de BAP para la multiplicación de los brotes no es efectiva. Por otra parte, aquellos brotes cultivados en presencia de Z prosperaron y disminuyó la oxidación e inclusive se observó enraizamiento en un brote en ese medio (Figura 12). A la fecha de finalización de esta investigación, la tasa de multiplicación observada a partir de los primeros brotes cultivados para la multiplicación en el medio de cultivo WPM al 50% con 30gL-1 de sacarosa y 0,1mgL-1 de Z fue de un 33,5% (figura 14).

Figura 11 Multiplicación de brotes de arándano (Vaccinium consanguineum) en medio de cultivo WPM al 50% complementado con 3 mgL-1 de BAP (Benciladenina).
Discusión
A pesar de que no hubo limitación con la disponibilidad de material, la época de recolecta fue importante en la respuesta positiva de los explantes, tanto a la desinfección como a la brotación de las yemas, coincidiendo éste con el periodo de crecimiento vegetativo de los árboles y las mayores temperaturas del año en la zona (mayo a julio). Resultados similares fueron observados por Victoriano (2010) en la especie V. corymbosum, al recolectar las estacas a introducir in vitro durante el inicio de la primavera, pasado el periodo de bajas temperaturas del invierno.
Se menciona que la propagación en invernadero de estacas de arándano se dificulta por presentar bajos porcentajes y lenta respuesta al enraizamiento, aun cuando se utilizan enraizadores [8]. Sin embargo, en los resultados observados en esta investigación las estacas mostraron un alto porcentaje de enraizamiento, con o sin enraizadores, pero al igual que con V. corymbosum, el desarrollo de raíces fue lento, lo mismo que la inducción de brotes que se utilizaron como fuente de material experimental para los ensayos in vitro.
En general, la propagación de arándanos por semillas no es muy utilizada debido a la germinación errática y al largo periodo que toma, por lo que es utilizada principalmente en programas de mejoramiento genético [9]. Las semillas de V. consanguineum también mostraron un lento proceso de germinación, tanto ex vitro como in vitro, observándose el mayor periodo de germinación en las semillas cultivadas in vitro. El ácido giberélico (GA3) se utiliza como promotor o inductor de la germinación en semillas de gran variedad de plantas y actúan fundamentalmente sobre el ARN desinhibiendo genes o activando enzimas [10]. Se ha utilizado en xerófitas [11], forestales leñosas [12], Jaltomata procumbens [13], obteniéndose en esta última especie 87% de germinación cuando se utilizó a una concentración de 250 ppm en el medio de cultivo. En esta investigación, los porcentajes de germinación de las semillas en condiciones ex vitro e in vitro, parecen indicar que las concentraciones de ácido giberélico (GA3) utilizadas in vitro no fueron las adecuadas para remplazar la necesidad de estímulos ambientales, tales como luz y temperatura [14].
Bacterias y hongos acompañan a las plantas en su ambiente natural, sin ser factores negativos sobre su desarrollo y crecimiento, sin embargo, cuando se cultivan en condiciones artificiales in vitro, se hace indispensable hacer una desinfección superficial de los tejidos a inocular, ya que el medio de cultivo proporciona un ambiente apropiado para la proliferación y colonización de éstos y compiten con los explantes por los componentes del medio de cultivo, pudiendo provocarles hasta la muerte [15]. Las desinfecciones utilizadas para el establecimiento in vitro de los materiales experimentales deben ser suficientemente fuertes para eliminar los microorganismos pero provocar el menor daño al material vegetal [16]. Durante la desinfección, los explantes sufren, en mayor o menor medida, situaciones de estrés, desecación y daños mecánicos que estimulan el metabolismo de los compuestos fenólicos [17] que son tóxicos para los tejidos vegetales, provocando cese del crecimiento, oscurecimiento de los tejidos y del medio de cultivo y en algunos casos la muerte del explante [10]. Desinfectantes como Zero tolerance y Ox virin que contienen Peróxido de hidrógeno, Ácido peracético y Ácido acético, son frecuentemente utilizados para la desinfección superficial [18, 19], sin embargo, en arándano no parecen ser recomendables, ya que no fueron efectivos para eliminar los microorganismos exógenos y provocaron oxidación y muerte de los explantes. Al substituir estos productos por jabones quirúrgico y enzimático se observó mayor porcentaje de sanidad en los explantes, siendo el enzimático el más efectivo, posiblemente por su contenido de amilasas, proteasas, lipasas y celulasas capaces de saponificar las grasas, surfactar, dispersar, suspender la suciedad y degradar cualquier materia orgánica, a diferencia de los jabones quirúrgicos que contienen clorhexidina gluconato y cloruro de cetrimonio que presentan actividad sobre ciertos virus y hongos pero no es efectivo contra esporas bacterianas [20, 21].
La etapa de multiplicación generalmente comprende dos períodos, la fase de inducción de brotes y la fase de multiplicación propiamente dicha. En investigaciones previas con V. consanguineum[6] se logró observar el hinchamiento y el inicio de la apertura de las yemas, como una señal de activación del crecimiento, pero no se logró su apertura total ni la multiplicación. Los reguladores de crecimiento y las condiciones de crecimiento juegan un papel crítico sobre la inducción y brotación de los explantes. Experiencias en la micropropagación de arándano y otras bayas muestran que la adición de reguladores de crecimiento al medio de cultivo favoreció la brotación y multiplicación y por lo general, se recomienda el uso de BAP, 2ip y Zeatina en varias concentraciones, siendo más efectivas las más bajas [22, 3, 23, 6]. El empleo de concentraciones elevadas de reguladores de crecimiento favorecen la desdiferenciación y formación de callo [10]. Al igual que en otros estudios con arándano, en esta investigación se observó que reguladores de tipo citocininas, especialmente BAP y zeatina en bajas concentraciones promovieron la brotación de las yemas y las mayores concentraciones evaluadas promovieron la formación de callo, a partir del cual se observó el inicio de organogénesis. La organogénesis indirecta es una vía de mayor proliferación de brotes pero implica mayor riesgo de variación somaclonal [10].
Los choques térmicos, tanto con altas como con bajas temperaturas son estrategias utilizadas para promover la germinación de semillas [24], la brotación de bulbos dormantes [25] la erradicación de virus en material vegetativo [26] y la brotación de yemas dormantes [27]. Como el arándano es una especie de clima templado, la entrada de las temperaturas más cálidas de la primavera promueven la brotación en algunos de los genotipos, por lo que los tratamientos con calor podrían verse prometedores con el material nativo bajo estudio, tratamiento que no resultó efectivo, causando fuerte oxidación y muerte de los explantes pretratados con calor. Por el contrario, en Rubus y varias especies de Vaccinium[28], los tratamientos con bajas temperaturas, por lo general 4ºC por periodos de hasta de 6 semanas estimularon significativamente la brotación, resultados similares a los observados en esta investigación con V. consanguineum, sin embargo, los porcentajes de brotación observados fueron menores a los obtenidos en las especies mencionadas, pero la calidad del brote obtenido fue superior a los obtenidos sin tratamiento de frío. Es posible que si el tratamiento en frío se hubiese prolongado por más de las dos semanas como recomiendan Wu et al. [27] la brotación podría haber sido mayor y es un parámetro a considerar en futuras investigaciones. La combinación de frío, alta concentración de sacarosa durante el pretratamiento en frío y la presencia de zeatina en baja concentración en el medio fue la combinación de mayor respuesta a la brotación en esta investigación.
En la actualidad existe una tendencia general a buscar sistemas que empleen medios líquidos, con el fin de reducir costos por la eliminación del gelificante y la mayor agilidad en la preparación de medios, pero esto puede traer problemas de hiperhidratación en los cultivos [29]. Cuando se trabaja con medio líquido sin un soporte, los tejidos quedan sumergidos y para una buena aireación es necesario agitarlos, por lo que se prefiere trabajar con soportes para los explantes, como espuma de plástico limpia, lana de vidrio, pequeñas bolas de vidrio y puente de papel, entre otros [30]. En esta investigación, la utilización de medio líquido con puente de papel de filtro (puente Heller) resultó en una mejora en el protocolo de micropropagación, ya que los brotes presentaron menor oxidación y mejor apariencia. La presencia de compuestos fenólicos en el medio de cultivo dificulta el establecimiento de los explantes in vitro, ya que estas sustancias son reconocidas como inhibidores del crecimiento [31]. Los efectos negativos de la oxidación en medios líquidos es menor, ya que los fenoles se diluyen con mayor facilidad en este tipo de medios, afectando en menor grado el crecimiento de los explantes, ya que no permanecen en contacto directo con el medio [32][33] sugieren la elección del medio de cultivo líquido para el establecimiento de un protocolo más sencillo, eficiente y rentable en la fase de multiplicación; ya que la exclusión del agente gelificante puede disminuir hasta en un 60 % los costos y abre la posibilidad de la automatización de la micropropagación.
Según Pereira [34] la micropropagación en especies leñosas domesticadas se utiliza de manera rutinaria; pero en especies que crecen de manera silvestre, la utilización de explantes de árboles adultos presenta algunos problemas, entre ellos contaminación, dormancia y baja respuesta morfogénica. Estas afirmaciones coinciden con los resultados obtenidos en esta investigación en la que se utilizó un arándano nativo no domesticado. Se puede agregar que superada la dormancia de este arándano nativo por medio de tratamiento de choque térmico a baja temperatura y bajas concentraciones de citocininas, se observó la brotación de las yemas pero con un lento crecimiento y desarrollo de las mismas. De acuerdo con Castro-Restrepo y Álvarez-Guzmán [35] el enraizamiento in vitro de la mayoría de especies del género Vaccinium no ha sido efectivo. En este proyecto no fue posible establecer ensayos de enraizamiento de brotes debido al lento crecimiento de la especie y a la limitante en el tiempo asignado para el desarrollo de la investigación, sin embargo, algunos de los brotes desarrollaron raíces en el medio de multiplicación.