Introducción
En los últimos años se ha venido investigando la utilidad de diversos microorganismos para el control biológico de hongos fitopatógenos, entre los cuales las especies de Trichoderma han sido ampliamente estudiadas (Hernández & Rangel, 2011). Sin embargo, también existen otros hongos que poseen alto potencial como agentes biocontroladores, entre los que se encuentra el género Gliocladium. De hecho, especies de Gliocladium y Trichoderma son agentes biocontroladores conocidos por producir un amplio rango de antibióticos (Merillón & Gopal, 2012).
Los agentes biocontroladores fúngicos (BCA, por sus siglas en inglés) pertenecen a diferentes grupos taxonómicos y existen en forma de cepas, variedades o razas, las cuales se diferencian por su potencial biocontrolador. Poseen uno o más mecanismos, como la producción de enzimas quitinolíticas y antibióticos que inhiben el crecimiento o desarrollo del patógeno, entre otros. También se caracterizan por competir por los nutrientes y evitar que su tejido huésped sea colonizado por patógenos. Muchos BCA actúan indirectamente sobre el patógeno al inducir resistencia en las plantas (Narayanasamy, 2013).
Del género Gliocladium se han utilizado cepas comerciales como biofungicidas en un amplio rango de situaciones, incluyendo la prevención y el control de enfermedades en plantas. Entre algunos de los patógenos que se controlan con este hongo se encuentran Alternaria, Botrytis, Didymella, Fusarium, Pythium, Phytophthora, Rhizoctonia y Sclerotinia (Helyer et al., 2014).
El presente trabajo se planteó con el objetivo de describir las características más relevantes del género Gliocladium, especialmente aquellas asociadas a su potencial antagónico de hongos fitopatógenos.
Generalidades taxonómicas
Gliocladium sp. pertenece al reino Fungi, filo Ascomycota, clase Sordariomycetes, orden Hypocreales. Se han descrito al menos 32 especies (Roskov et al., 2015), algunas de las más conocidas son G. penicilloides, G. virens, G. roseum y G. deliquescens (Walsh, 2010).
Aspectos morfológicos
De manera macroscópica (en un medio PDA), Gliocladium forma colonias inicialmente blancas, que pueden cambiar a tonos que varían de rosa a salmón; durante la esporulación se tornan de color verde (Ellis, 2015).
Microscópicamente, este hongo ha sido relacionado con Penicillium, ya que sus conidióforos y fiálides son similares entre sí; sin embargo, la diferencia radica en la morfología de los conidios (Walsh, 2010). Debe destacarse que el rasgo más característico del género es su distintivo conidióforo erecto densamente penicilado y con apariencia babosa (Figura 1). A pesar de que estos siempre están presentes, las especies de Gliocladium también pueden producir conidióforos verticilados ramificados que pueden confundirse con los de Verticillium sp. o Trichoderma sp. (Ezz, 2012).
En cuanto a las hifas, son hialinas y septadas, se caracterizan también por ser viscosas y transparentes (Walsh, 2010). Por su parte, las fiálides presentan ramificaciones y puntas afiladas, en las cuales se encuentran los conidios, formando grupos semejantes a una bola apretada (Situmorang et al., 2014). Los conidios son una sola célula y su forma puede variar desde ovoide hasta cilíndrica; se producen en una cabeza terminal y algunas veces en una columna suelta (Helyer et al., 2014). En la Figura 2 se observan detalles de la estructura microscópica.
En relación con el tamaño de las estructuras, específicamente para Gliocladium viride, el tamaño de los conidióforos se encuentra entre 100~225 μm × 8~10 μm y de los conidios entre 3.0~3.8 μm × 2~2.5 μm (Kim et al., 2010).
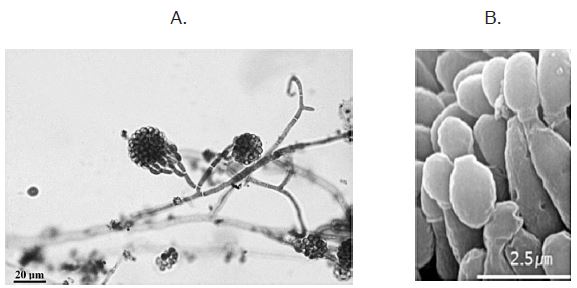
Figura 1 Morfología microscópica de Gliocladium sp. A. Conidióforo con conidios, tomado de Ellis (2015). B. Conidios, tomado de Kim et al. (2010).

Figura 2 Micrografía electrónica de Gliocladium sp. (A) Cultivo joven de Gliocladium sp. creciendo en PDA. (B) Hongo colonizando tejido de hoja. (C) Fiálides con células hifales y conidiosporos en el fondo. (D) Conidiosporas en mayor resolución. Tomado de Stinson et al. (2003).
Métodos de aislamiento, condiciones de cultivo y requerimientos nutricionales
Narayanasamy (2013) establece que entre los diferentes medios de cultivo para su aislamiento, el más eficiente para aislar tanto Gliocladium como Trichoderma de muestras de suelo es el medio Agar Papa Dextrosa modificado con Rosa Bengala, cloranfenicol y sulfato de estreptomicina, tal y como fue descrito por Vargas et al. (2009).
La temperatura y el pH son factores importantes necesarios para el desarrollo y producción de enzimas, antibióticos y toxinas involucradas en la actividad biocontroladora. De acuerdo con Arias y Piñeros (2008), un pH muy bajo puede afectar los sistemas enzimáticos y el ingreso de vitaminas esenciales y ácidos orgánicos; en cambio, un pH alto incide en la solubilidad de los metales. Por ello, consideran que un pH óptimo se encuentra en el rango de 4-6 para los hongos en general. En cuanto a temperatura, Gliocladium es activo a una temperatura de entre 5 °C y 34 °C, con la mejor actividad entre 15 °C a 25 °C. En cambio, temperaturas muy altas, mayores a 42 °C, pueden matar al hongo, las esporas y los micelios (Helyer et al., 2014).
Gliocladium sp., como cualquier hongo filamentoso, es incapaz de utilizar el carbono inorgánico, siendo la glucosa el compuesto más simple de fuente de energía, además puede aprovechar la fructosa, la manosa y la galactosa. También requiere de una fuente de nitrógeno (nitrato y/o amonio), entre otros (Arias & Piñeros, 2008). Posee una nutrición saprofita en muchos ambientes, aunque también se encuentran patógenos de hongos, incluyendo las setas comestibles como Agaricus bisporus (Helyer et al., 2014).
Agente de biocontrol
Entre las especies de Gliocladium que se han caracterizado por ser potentes agentes de control biológico, se destacan dos registrados como biofungicidas comerciales: G. catenulatum (cepa j1446) y G. virens (cepa GL-21). A partir de la germinación de esporas, Gliocladium produce hifas finas, de rápido crecimiento y apariencia vellosa, que puede entrar en contacto con el hongo patógeno. Estas estructuras pueden actuar por actividad enzimática sin penetración o por acción física, tal y como se ha demostrado con la presencia de haustorios en las puntas de las hifas del hongo Rhizoctonia solani. En este sentido, el principal método de acción observado es el enrollamiento de las hifas alrededor de las del huésped. También existe evidencia de que puede formar una relación cercana con raíces saludables de las plantas, otorgándoles protección contra ataques de hongos patógenos. Por esta razón se ha utilizado para controlar patógenos fúngicos causantes de enfermedades en plantas, como las podredumbres de raíz (Heyler et al., 2014).
La cepa TNC73 de Gliocladium sp. originalmente fue aislada como un agente biocontrolador contra el patógeno Phytophtora capsici, causante de la pudrición de fruto del chile. Aparte de quitinasas, también produce metabolitos secundarios con propiedades antimicrobianas contra las bacterias Gram positiva Bacillus subtilis y Staphylococcus aeureus. Se ha descubierto su habilidad para inhibir bacterias Gram negativas como Erwinia carotovora pv. Carotovora, causante de la enfermedad de la pudrición blanda en cultivos alimentarios como la papa. Estas características hacen de este hongo un organismo con un potencial para ser utilizado en las prácticas agrícolas sostenibles que buscan la sustitución de los químicos de origen sintético (Saputra et al., 2013).
Otros estudios han demostrado su potencial como agente inhibidor del crecimiento de patógenos asociados a leguminosas (garbanzos, lentejas y frijol negro), entre los que se mencionan Alternaria alternata, Chaetomium spp., Penicillium citrinum, Aspergillus niger, A. flavus, Rhizopus nigricans y Fusarium oxysporum. G. virens inhibe de manera significativa el crecimiento radial de dichos hongos patógenos (Agarwal et al., 2011). Asimismo, puede controlar a Rhizotocnia solani, lo mismo que a G. catenulatum y G. roseum, especies que pueden ser aisladas de los esclerocios causantes de podredumbres y la enfermedad de costras negras en una amplia variedad de cultivos, como la papa, el tomate, la soya y el kiwi (Demirci et al., 2011).
Gliocladium spp. también ha sido usado para combatir al nemátodo formador de nódulos en raíces, Meloidogyne spp., una plaga importante en muchos cultivos alrededor del mundo, tales como chile, berenjena y papa. Amin (2014) demostró que el tratamiento con diferentes concentraciones de suspensiones del conidio del hongo causa daño intenso y reducción en la densidad poblacional del nemátodo, posiblemente debido al mecanismo de colonización. También se determinó que ayuda a la planta en la inducción de resistencia sistémica ante el ataque de este nemátodo.
Patogenicidad
No hay reportes de daños causados por este hongo en cultivos. Sin embargo, algunas especies de Gliocladium han sido reconocidas como agentes de la enfermedad del moho verde, que afecta a las setas cultivadas, como A. bisporus, Lentinula edodes y Pleurotus ostreatus. Kim et al. (2010) aislaron e identificaron al género en las camas de roble; sin embargo, el rol que juega este hongo en el cultivo de setas aún no ha sido identificado.
Potencial farmacéutico
Los usos farmacéuticos que involucran a este microorganismo son muy variados, especialmente considerando la diversa cantidad de metabolitos secundarios que produce. Se ha demostrado la capacidad de Gliocladium sp. para producir taxol. El taxol es el nombre comercial del metabolito secundario (paclitaxel) producido por Taxus brevifolia y se comercializa como un tratamiento antitumoral para el control del cáncer, principalmente.
En la actualidad, la producción tradicional de este fármaco es ecológicamente insostenible, ya que requiere la maduración del árbol, que tarda hasta 20 años, para sacrificarlo con el fin de extraer el metabolito que se produce en la corteza, por lo que se han buscado otras fuentes de producción más rentables y amigables con el ambiente. Lo anterior llevó al descubrimiento de que varias especies de hongos, bacterias y actinomicetos lo producen. Estos estudios demuestran que este hongo no está solo establecido como un endófito sino que ha logrado con éxito imitar la diversidad química del hospedero, lo que podría ayudar a entender aspectos evolutivos implicados en la transferencia de genes entre el hospedero y el endófito (Sreekanth et al., 2009; Sreekanth et al., 2011).
Producción de enzimas y compuestos de interés
Fiana et al. (2013) produjeron enzimas glucoamilasas, a través de la fermentación en sustrato de fase sólida utilizando la cepa Gliocladium KE y obteniendo rendimientos de actividad enzimática de 24,22 unidades/ml al optimizar la concentración de nitrato de calcio añadida. Las glucoamilasas son enzimas de importancia industrial para procesos de degradación del almidón. A su vez, a partir de dicho género también se han obtenido enzimas con potenciales médicos. Nanda et al. (2012), produjeron la enzima uricasa, con rendimientos que alcanzaron las 84,99 unidades/ml en fermentación sumergida de G. viride. La uricasa se utiliza en el tratamiento de la hiperuricemia y la gota, ya que se encarga de la degradación del ácido úrico y es un importante componente en la ruta metabólica de la degradación de las purinas.
Por otra parte, Batista et al. (2012) lograron producir fructooligosacáridos (FOS), específicamente 6-Kestosa, en fermentación sumergida de G. virens. Dichas sustancias pueden utilizarse como suplemento alimentario ya que actúan como prebióticos, mejorando el crecimiento de las bifidobacterias. Igualmente, contribuyen en la reducción de los niveles de colesterol y triglicéridos en el plasma sanguíneo y se relacionan con una disminución en el desarrollo de tumores y las enfermedades inflamatorias del intestino; por último, al ser compuestos de difícil hidrolización para el ser humano, se convierten en una alternativa para endulzar alimentos para diabéticos, dado su nulo contenido calórico.
En 2003, Stinson et al. lograron un aislamiento de Gliocladium sp. a partir de la especie vegetal Eucryphia cordifolia, y se encontró que el hongo producía una mezcla de compuestos orgánicos volátiles (VOC, por sus siglas en inglés) letales para los patógenos de la planta, como Phytium ultimum y Verticillium dahliae. Este comportamiento de producción de COV se ha reportado principalmente en Muscodor albus, un productor de antimicrobiales volátiles bastante conocido, al que Gliocladium sp. mostró resistencia y produjo algunos de los mismos compuestos reportados para el primero, entre los que destacan: 1-butanol, 3-metil, feniletil alcohol y ácido acético, 2-feniletil éster y otros ésteres de ácido propanoico; sin embargo, el compuesto volátil principal resultó ser 1,3,5,7- ciclooctatetrano u 8-anuleno, un potente inhibidor de crecimiento fúngico (Liouane et al., 2010).
Estudios más recientes demuestran que los VOC juegan un importante papel en la señalización para los hongos en sus ambientes naturales. Muchas interacciones ecológicas están mediadas por ellos, incluyendo aquellas entre hongos y plantas, artrópodos, bacterias y otros hongos. Las diversas funciones de los COV fúngicos se pueden desarrollar para su uso en aplicaciones biotecnológicas como biocombustibles, biocontrol y micofumigación. Estos compuestos representan una nueva frontera en la bioprospección y el estudio de estos compuestos promete el descubrimiento de nuevos productos para la explotación humana (Shannon et al., 2012).
Producción de micodiésel a partir de Gliocladium
Entre las posibles sustancias que se pueden obtener a través del género Gliocladium cabe destacar su producción de hidrocarburos y su uso en la producción de biocombustibles, específicamente del llamado micodiésel. G. roseum, aislado del árbol Eucryphia cordifolia en la Patagonia, produce compuestos orgánicos volátiles de cadena media y altamente ramificados que pueden utilizarse como combustible. Entre las características más llamativas se encuentra su capacidad de utilizar celulosa como sustrato, lo que lo vuelve más atractivo dado su potencial. El perfil de hidrocarburos producidos por G. roseum contiene un alto número de compuestos que normalmente se asocian con el combustible diesel, por lo que han sido denominados “mico-diesel”. La extracción en cultivo líquido reveló la presencia de numerosos ácidos grasos y otros lípidos. Todos estos hallazgos tienen implicaciones para la producción y utilización de energía (Strobel et al., 2008). En esta misma línea han trabajado otros autores como Ahamed y Ahring (2011), quienes obtuvieron resultados de producción de hidrocarburos hasta 100 veces mayores al cocultivar tres cepas de Gliocladium sp. con Escherichia coli.
Aplicación de Gliocladium en la biorremediación
Entre los bioabsorbentes más prometedores para la eliminación de metales pesados que se han investigado durante las últimas décadas, los hongos son los que han recibido una creciente atención, debido a su gran capacidad para eliminar altas concentraciones de metales pesados en comparación con levaduras, algas e incluso bacterias. Tahir (2012) demostró mediante diversas pruebas la eficiencia de Gliocladium sp. en la absorción de metales pesados; los resultados indicaron que este era el mejor hongo resistente al cobre entre todas las especies aisladas para el experimento y se encontró que los componentes de la pared celular fueron los responsables de la absorción de este metal.
Consideraciones finales
Gliocladium sp. representa un grupo de especies fúngicas con alto potencial biotecnológico; la enorme cantidad de metabolitos que produce lo transforman en un microorganismo de interés para el descubrimiento de nuevos productos. En múltiples estudios se ha demostrado su eficiencia como un agente biológico para el control de hongos, bacterias e incluso nemátodos. A nivel ecológico, Gliocladium sp. es un importante microorganismo endófito, capaz no solo de adaptarse a vivir dentro de la planta sino de imitar con éxito su perfil químico y producir algunos de sus mismos metabolitos. La investigación sobre este microorganismo ha abarcado una diversidad de áreas, desde su uso para la producción de enzimas y compuestos de interés farmacéutico hasta la producción de lípidos para biocombustibles y la bioabsorción de metales pesados como el cobre. Este organismo ejemplifica con claridad por qué cada vez más los hongos se han vuelto importantes aliados en las industrias, con un futuro prometedor dentro de la biotecnología moderna.














