Introducción
En Costa Rica, tanto la cebolla (Allium cepa L.) como el ajo (Allium sativum) son hortalizas de importancia económica. Para el año 2013 la producción de cebolla alcanzó 1247 ha, siendo la provincia de Cartago la principal zona productora, con 1100 ha (SEPSA, 2013). A su vez, el ajo tiene una alta demanda en el país, sin embargo, su producción se ve afectada por los bajos rendimientos y la importación del producto. Se estima que la zona de Llano Grande de Cartago concentra dicha actividad, con 3 ha sembradas (Brenes & Guillén, 2014).
El hongo patógeno Sclerotium cepivorum es un habitante del suelo presente en clima templado y subtropical (Sarmiento & Monsalve, 2013). Se caracteriza por infectar las plantas del género Allium y ocasionar la enfermedad conocida como podredumbre blanca de la cebolla, generando con ello pérdidas importantes en los cultivos (Ouf et al., 2008). Este hongo tiene la capacidad de desarrollar esclerocios secundarios dentro de los esclerocios originales, generando una gran capacidad de resistencia en el suelo que puede prolongarse hasta por 20 años y que dificulta su control (Rojas et al., 2010; Astorga-Quirós et al., 2014b). El hongo invade las raíces y bulbos en forma de moho blanco y sedoso para luego formar los esclerocios. Los compuestos de azufre en los exudados favorecen la germinación de los esclerocios, ocasionando la podredumbre de la planta joven; si la planta está en estado tardío inicialmente no presenta síntomas pero sí durante su almacenamiento (Astorga-Quirós et al., 2014b).
Una de las estrategias de combate contra S. cepivorum es el uso de fungicidas, sin embargo, es una técnica poco práctica y con un considerable impacto ambiental, por lo que se han implementado otros métodos como el biocontrol (Jiménez et al., 2013). A pesar de la resistencia de los esclerocios, diversos estudios han demostrado su susceptibilidad frente a otros microorganismos (Sarmiento & Monsalve, 2013); por ejemplo, la acción antagonista in vitro de Trichoderma sp. contra S. cepivorum ha sido evaluada por varios autores (Shalaby et al., 2013; Sarmiento & Monsalve, 2013; Astorga-Quirós et al., 2014a).
Los hongos biocontroladores utilizan diversos mecanismos, tales como las enzimas quitinolíticas, antibióticos que inhiben el crecimiento de otros hongos. También se caracterizan por competir por nutrientes y evitar que su tejido huésped sea colonizado por patógenos, mientras que muchos inducen resistencia en las plantas (Narayanasamy, 2013).
Gliocladium sp. es un género perteneciente al filo Ascomycota, del que se han descrito al menos 32 especies (Roskov et al., 2015). Su potencial como biocontrolador se ha evidenciado frente a Alternaria, Botrytis, Didymella, Fusarium, Pythium, Phytophthora, Rhizoctonia y Slerotinia. El principal método de acción observado en Gliocladium es el enrollamiento de sus hifas alrededor de las del patógeno (Helyer et al., 2014).
El objetivo del presente trabajo es evaluar la capacidad antagonista in vitro del hongo biocontrolador Gliocladium sp., aislado a partir de suelo dedicado al cultivo de cebolla, sobre el hongo patógeno S. cepivorum a través del análisis del índice de inhibición radial.
Metodología
Aislamiento del biocontrolador
Gliocladium sp. se aisló a partir de una muestra de tierra proveniente de cultivos de cebolla de la provincia de Cartago, Costa Rica. Para el aislamiento se tomó como base la metodología y el medio de cultivo descrito por Vargas et al. (2009). La metodología empleada se detalla a continuación:
Se tomaron 10 g de suelo y se disolvieron en 90 ml de agua destilada (10-1), procurando realizar la mayor homogenización posible. Se realizaron diluciones seriadas hasta 10-6. Para cada dilución realizada, se inoculó 1 ml en placas de Petri con agar Rosa de Bengala (0,3 g/l cloranfenicol; 0,1 g/l estreptomicina; pH 6). Las placas se dejaron incubando a temperatura ambiente (24-25 °C) durante ocho días. Para el aislamiento únicamente se emplearon las placas que presentaban colonias separadas y bien definidas.
Se identificaron las colonias de hongos que por su apariencia y características (color y crecimiento de los micelios, entre otras) tenían probabilidades de ser de Gliocladium sp. y se subcultivaron en placas de Petri con PDA acidificado. Una vez que las colonias subcultivadas crecieron, se identificaron bajo el microscopio las que, por sus características morfológicas, efectivamente eran Gliocladium sp. y se procedió a subcultivarlas nuevamente en PDA acidificado.
Pruebas in vitro de la capacidad biocontroladora de Gliocladium sp. para S. cepivorum
La capacidad biocontroladora de la cepa de Gliocladium sp. aislada se probó de forma in vitro mediante pruebas de inhibición de crecimiento radial en cultivos duales, tomando como base la metodología propuesta por Agarwal et al. (2011). En placas de Petri (8,5 cm de diámetro) con PDA acidificado se procedió a sembrar en un extremo un disco (7 mm de diámetro) del micelio activo del biocontrolador. En las mismas placas se colocó en el otro extremo un disco del mismo tamaño con el micelio activo del patógeno. Se dejaron incubando a temperatura ambiente, aproximadamente 25 °C. En total se cultivaron 16 placas, sin contar los controles. Los controles únicamente contenían, en un extremo, un disco con el micelio activo, ya fuera del patógeno o del hongo con la supuesta actividad antagonista. El porcentaje de inhibición del crecimiento radial (PICR) se calculó con base en mediciones a los 8 y a los 15 días para las 16 placas con el fin de determinar, aparte de la capacidad biocontroladora de Gliocladium, si esta aumentaba o disminuía según el tiempo que estuvieran expuestos los dos hongos. El PICR se calculó con la siguiente fórmula:
r1
r1= diámetro de colonia control de S. cepivorum r2= diámetro de colonia de cepivorum en cultivo dual con Gliocladium.
Resultados
Aislamiento de Gliocladium sp.
Se logró obtener un cultivo puro de Gliocladium sp. después de varios subcultivos, a partir del aislamiento, utilizando una muestra de suelo dedicada al cultivo de cebolla (Figura 1).
Como se observa en la Figura 1, la especie de Gliocladium sp. que se logró aislar presenta la particularidad de que libera compuestos que tiñen el medio de cultivo (PDA) de un color rojizo. Las colonias se caracterizan por ser de color amarillo con zonas rojizas, pero estas características cambian con la edad del cultivo.
Para la identificación se examinaron sus estructuras en el microscopio. En la Figura 2 se observa el conidióforo de Gliocladium sp.
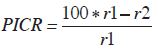
Figura 2 Características morfológicas del conidióforo que presenta la cepa aislada de Gliocladium sp. (40X).
Se observa que el conidióforo presenta fiálides ramificadas con conidios esféricos en sus puntas y aglomerados.
Pruebas in vitro de la capacidad biocontroladora de Gliocladium sp. para S. cepivorum
El PICR promedio de S. cepivorum calculado a los 8 días fue de 53,66%, mientras que a los 15 días fue de 54,20%.
Con el fin de determinar si hubo diferencia significativa o no entre los PICR calculados para los 8 y los 15 días, se realizó un análisis estadístico. Al emplearse la prueba de normalidad ShapiroWilks modificada se determinó que los datos obtenidos no presentaban un comportamiento normal (n= 32, w*= 0.90 y p= 0.01), por lo que se utilizó la prueba no paramétrica Kruskal Wallis para analizarlos, obteniéndose: H= 1.64 y p= 0.19. Estos resultados indican que no existe diferencia significativa entre los PICR calculados, es decir, el tiempo de exposición, ya sea 8 o 15 días, no ejerce un efecto directo sobre la inhibición del crecimiento del patógeno por parte de Gliocladium.
Cabe destacar que, según lo observado en las pruebas de antagonismo, la inhibición del crecimiento del patógeno se debió principalmente a la liberación de metabolitos al medio por parte del biocontrolador, presencia que se evidencia debido a que tiñeron el medio PDA de un tono rojizo (Figura 3).
Discusión
Narayanasamy (2013) indica que se han buscado métodos eficientes de aislamiento de Gliocladium sp., debido a los múltiples beneficios de este hongo como agente biocontrolador de hongos fitopatógenos. Este autor establece que el medio de aislamiento más eficiente fue el empleado en esta investigación, que consiste en el medio Agar Papa Dextrosa modificado con Rosa Bengala, cloranfenicol y sulfato de estreptomicina. Sin embargo, de acuerdo con Young et al. (2010), al no ser este medio selectivo para Gliocladium sp., se debe proceder a una identificación visual basada en características morfológicas distintivas de Gliocladium sp., tal como se realizó en su aislamiento.
Menciona Walsh (2010) que una de las características microscópicas de Gliocladium sp. es la presencia de conidióforos y fiálides semejantes a las de Penicillium; estos conidióforos son erectos y poseen ramificaciones en la parte superior. Kim et al. (2010) destacan que sus fiálides son ramificadas y al final de ellas se encuentran los conidios con morfología esférica y en grupos, formando una bola. Estas características descritas por dichos autores concuerdan con lo observado bajo el microscopio de Gliocladium sp. aislado (Figura 2). Las colonias obtenidas del aislamiento son amarillas, lo que concuerda con las características de Gliocladium roseum sp., mencionadas por Rojas (2004), cuyas colonias pueden ser blancas, amarillas o rojizas (Figura 1).
En cuanto a los resultados sobre el potencial antagonista de Gliocladium sp. sobre S. cepivorum, se observa que después de exponer al antagonista contra el patógeno durante 8 o 15 días, el biocontrolador fue capaz de inhibir el crecimiento del segundo en más de la mitad de lo que este crece normalmente cuando está en un cultivo solo.
Un agente de biocontrol puede actuar contra los agentes patógenos mediante el uso de uno o más de los siguientes mecanismos: competencia, antibiosis y parasitismo, o mediante la activación de los mecanismos de defensa de la planta hospedera (Narayanasamy, 2013). En este caso específico, el crecimiento de Gliocladium no es agresivo, por lo que se infiere que su potencial antagonista contra el agente causal de la pudrición blanca de la cebolla no se basó en colonizarlo, sino en producir una serie de enzimas y metabolitos secundarios con capacidad antifúngica (Figura 3). Con el fin de prevenir que el espacio y los nutrientes fueran colonizados por el patógeno, el antagonista pudo haber aumentado la producción de enzimas quitinolíticas o antibióticos, entre otras sustancias, que inhibieran su crecimiento y desarrollo.
Ya se ha reportado que, aparte de producir quitinasas, este hongo también produce metabolitos secundarios con propiedades antimicrobianas, y que incluso sus hifas pueden matar el hongo por actividad enzimática sin penetración (Saputra et al., 2013). El principal compuesto volátil producido por Gliocladium sp. es el 1,3,5,7-ciclo-octatetraeno, que es un efectivo inhibidor del crecimiento fúngico (Liouane et al., 2010). En 2003, Stinson et al. encontraron que el hongo producía una mezcla de compuestos orgánicos volátiles (VOC, por sus siglas en inglés) que resultaban letales para ciertos patógenos o que al menos tenían capacidad para inhibir y detener su crecimiento. Estas características hacen de Gliocladium un organismo con alto potencial para su utilización en prácticas agrícolas sostenibles para evitar o sustituir los químicos de origen sintético en el control de algunas enfermedades.
Las especies de Gliocladium y Trichoderma son agentes biocontroladores muy conocidos, a los que se les ha atribuido esta cualidad por su poderosa capacidad de producir un amplio rango de antibióticos (Merillón & Gopal, 2012). Incluso, existen dos especies de Gliocladium (catenulatum y virens) a partir de las cuales se han registrado biofungicidas comerciales (Saputra et al., 2013) que se usan en un amplio rango de situaciones, incluyendo la prevención o el control de enfermedades fúngicas en plantas (Helyer et al., 2014).
Conclusiones
En esta investigación se aisló el hongo biocontrolador Gliocladium sp. a partir de muestras de suelo dedicadas al cultivo de cebolla, y se determinó que este microorganismo es capaz de inhibir hasta en más del 50% el crecimiento normal del agente causal de la pudrición blanca en ajo y cebolla (S. cepivorum). No se encontró diferencia significativa entre el porcentaje de inhibición de crecimiento radial obtenido a partir de mediciones realizadas a los 8 y 15 días de cultivo dual y de acuerdo con las características del halo de inhibición, se presume que el mecanismo de control presentado por la cepa de Gliocladium sp. aislada es la liberación de enzimas, metabolitos y/o posiblemente una mezcla de compuestos orgánicos volátiles al medio, con capacidad para inhibir el crecimiento y desarrollo del patógeno, incluso sin necesidad de que sus hifas entren en contacto, sin embargo, se requieren mayores estudios para su comprobación.














