Introducción
El hongo Sclerotium cepivorum Berkeley causa la principal enfermedad en el mundo de las plantas del género Allium (Clarkson et al., 2006), lo que es especialmente importante en los cultivos de ajo (A. sativum) y cebolla (A. cepa). En Costa Rica, pese a existir pocos reportes de su presencia, en la realidad representa una fuente importante de pérdidas para los productores.
S. cepivorum es un hongo que produce abundante micelio, de color blanco, marrón o grisáceo. Las hifas son ramificadas y cada ramificación se divide mediante septos, a veces con conexiones tipo clamp. Normalmente no forma conidios pero establece un tipo de estructura de resistencia a la que se le da el nombre de “esclerocio” y presenta coloraciones desde pardo oscuro hasta negro, es globosa o subglobosa y de apariencia húmeda en su superficie. Los esclerocios pueden sobrevivir en el suelo hasta por 20 años sin perder su viabilidad (ColeySmith et al., 1990) y su germinación responde a los exudados de compuestos sulfatados y a los grupos tiol (Davis, 2002).
Este patógeno coloniza las raíces de sus hospederos y en estadios avanzados puede infectar completamente el bulbo, provocando una descomposición blanda del tejido, que se recubre de un micelio blanquecino. A medida que la enfermedad avanza sobre las raíces y bulbos, la planta muestra signos de marchitez, enanismo y las hojas terminan completamente necrosadas (Velásquez & Medina, 2004).
Las formas tradicionales de combatir esta enfermedad han incluido técnicas como la rotación de cultivos, el descanso de la tierra, la siembra de crucíferas y el combate químico por medio de distintas moléculas con actividad fungicida. Algunas otras técnicas de control más novedosas las constituyen el uso de abonos orgánicos tipo compost y la incorporación de material vegetal, la solarización para el tratamiento del suelo (McLean et al., 2001) y la aplicación de compuestos como el dialil-disulfuro para provocar la germinación temprana de los esclerocios (Melero et al., 2000). No obstante, algunas de estas estrategias presentan efectos variables en cuanto a la eficacia del control o dificultades técnicas para su aplicación por parte de los productores (Clarkson et al., 2006).
Otra opción consiste en el uso de control biológico con organismos antagonistas (Bellows & Fisher, 1999), como las especies del género Trichoderma. Este es un género de distribución global (Kubicek et al., 2008), de degradadores generalistas de celulosa y quitina, asociados normalmente a materia orgánica en descomposición. Sin embargo, también se reconoce su habilidad para crecer en la rizosfera (Schuster & Schmoll, 2010) y como parásito de otros hongos (Kubicek et al., 2008). Su estado perfecto, es decir, su teleomorfo, se clasifica en el género Hypocrea.
Trichoderma presenta una amplia variedad de mecanismos de control. Existen seis tipos claramente definidos que son: el micoparasitismo, la antibiosis, la competencia, la degradación enzimática, la activación de respuestas de defensa y la estimulación de la germinación y el crecimiento (Harman et al., 2004; Metcalf et al., 2004; Mukherjee et al., 2008; Schuster & Schmoll, 2010). Estos mecanismos no siempre se logran activar en condiciones naturales, debido a las variables ambientales, al tipo de sustrato en el que se desarrolla el hongo y a las interacciones con otros microorganismos (Howell, 2003).
El objetivo de esta investigación consistió en comprobar en campo el efecto antagónico de un aislamiento de T. asperellum previamente seleccionado contra S. cepivorum y compararlo con el control químico tradicional usado por los productores de ajo en Costa Rica.
Material y métodos
Las pruebas de campo se realizaron en seis parcelas en dos años diferentes en la zona de Llano Grande, en la provincia de Cartago, Costa Rica, dedicadas a la producción de cebolla y el ajo denominado “criollo”, así como a otras hortalizas. Las parcelas están ubicadas entre 1900 y 2100 metros sobre el nivel del mar (msnm). Se determinaron las variaciones en la cantidad de esclerocios presentes durante el ciclo de cultivo y la mortalidad observada bajo las dos diferentes estrategias de control de la enfermedad (T. asperellum vs. control químico tradicional).
Toma de muestras para análisis
En cada parcela se hicieron cinco muestreos, el primero de ellos para determinar el inóculo inicial presente. Los siguientes cuatro se usaron para evaluar cada 30 días la concentración de esclerocios en ambos tratamientos, durante la duración del ciclo de cultivo. Para cada muestra se tomaron 10 submuestras de 100 g de suelo a una profundidad de 0 a 15 cm y siguiendo un esquema de zigzag. Al final se obtuvieron 1000 g de muestra, que luego se mezclaron mediante agitación, se colocaron en bolsas y se rotularon.
Cuantificación del inóculo inicial de S. cepivorum en cada parcela
Para evaluar la cantidad de esclerocios de S. cepivorum presentes por gramo de suelo se utilizó la técnica de Vimard et al. (1986). Este procedimiento se repitió por quintuplicado para cada parcela y se obtuvo el promedio de las cinco repeticiones, que se dividió entre el peso de la muestra y se reportó como la concentración de esclerocios por gramo de suelo de la parcela analizada.
Pruebas en campo: tratamiento con Trichoderma y tratamiento con control químico
Se escogió un diseño de bloques completos al azar (DBCA) por las variaciones en el inóculo inicial de cada parcela. Para esto, cada parcela experimental se consideró como un bloque (seis bloques en total). En cada bloque se prepararon eras (unidades experimentales) de 3,3 m de largo, 1 m de ancho y 0,3 m de altura separadas por un canal de 0,5 m de ancho y 0,3 m de profundidad. En cada bloque se hicieron dos unidades experimentales (una para cada tratamiento). En estos bloques se probaron dos tratamientos. El 1 (T1) correspondió a la utilización de una cepa previamente seleccionada de T. asperellum como único fungicida y el 2 (T2) al manejo tradicional empleado por los productores locales, que consistía de mezclas en partes iguales de los siguientes fungicidas: Cobrethane® 61WP (oxicloruro de cobre,), Vitavax® 40WP (Ftalamida-Carboxin-Captan) y Zetarán® 76WP (Ziram), Folicur® 25WP y Silvacur Combi® 25WP (Tebuconazole).
La preparación del terreno y las eras se hizo de la misma manera para ambos tratamientos. La densidad de siembra fue de 1500 kg/ha, con bulbos de primera calidad; se marcaron surcos a lo largo de las eras y se colocaron los ajos a una distancia recomendada de 10 cm entre planta y de 30 cm entre hileras, para un total de 110 plantas por unidad experimental en cada bloque. Los dientes se sembraron con el ápice hacia arriba. A lo largo del ciclo de cultivo se usaron los mismos agroquímicos, además, el manejo agronómico fue similar.
Durante todo el período del cultivo (cuatro meses) se determinó la concentración de esclerocios usando la metodología descrita por Vimard et al. (1986). Se contaron los esclerocios por triplicado en cada unidad experimental durante cada mes y se registró la mortalidad total de plantas por el ataque de S. cepivorum para cada tratamiento. Los datos de concentración de esclerocios se analizaron mediante pruebas de normalidad y análisis de varianza para un DBCA.
Resultados y discusión
Cuantificación del inóculo inicial de S. cepivorum en cada parcela
Los resultados de la cuantificación inicial de esclerocios por gramo de suelo de cada parcela por año se observan en el Cuadro 1. Para el primer año, la parcela 2 presentó la mayor concentración y la 3 la menor. Para el segundo año, la parcela 6 fue la más alta y la 5 la más baja. Este inóculo representa la cantidad inicial de los principales propágulos del hongo (APS, 2014).
Según Ponce et al. (2008), en estudios de la pudrición blanca en cebolla en México, los inóculos del valor de 0,02 se consideran de baja intensidad o concentración y los de 0,05 de mediana intensidad. Tomando esto como parámetro, las parcelas 1 y 3 tenían un inóculo inicial bajo y la 2 uno intermedio.
Cuadro 1 Inóculo inicial de esclerocios por gramo de suelo para las seis parcelas experimentales.
| Parcela | Esclerocios/g | Intensidad del inóculo |
| 1 | 0,02 | Baja |
| 2 | 0,04 | Mediana |
| 3 | 0,01 | Baja |
| 4 | 0,10 | Alta |
| 5 | 0,05 | Mediana |
| 6 | 0,25 | Alta |
Es necesario indicar que en el caso de la pudrición blanca, el hecho de que un inóculo sea catalogado como de baja o intermedia intensidad no excluye que cause grandes pérdidas en la cosecha, por las altas tasas de incidencia de la enfermedad. Crowe et al. (1979) encontraron que una densidad de inóculo de 0,001 a 0,01 puede llevar a niveles de incidencia del 10 al 85% del cultivo; mientras que concentraciones de 0,01 a 0,1 pueden alcanzar del 85 al 100% de infección. Otros autores (Ponce et al., 2008) reportaron incidencias de enfermedad del 51,93% para inóculos de 0,02 esclerocios/g (baja intensidad) y del 62,75% para inóculos de 0,05 esclerocios/g (mediana intensidad).
Las divergencias encontradas en el inóculo inicial en cada parcela se pueden atribuir principalmente al manejo agronómico de cada productor y a las características físicas, químicas y biológicas del terreno (Rivera, 2011). Esto incluye factores básicos como: los cultivos sembrados con anterioridad, los agroquímicos usados y su persistencia en el suelo, las prácticas culturales, como la rotación de cultivos y la incorporación de rastrojos u otras formas de materia orgánica, el tipo y la estructura del suelo, la pendiente y el manejo del riego (Ponce et al., 2008; Velásquez & Medina, 2004) .
Algunas de las prácticas acostumbradas por los agricultores tienen distintos niveles de repercusión para el establecimiento exitoso del patógeno. El uso de materia orgánica en forma de abonos orgánicos y residuos precomposteados de otros cultivos ha sido probado como una práctica que contribuye a la disminución de la concentración de esclerocios en los cultivos de ajo y cebolla (Coventry et al., 2005, Clarkson et al., 2006; Ulacio, 2011).
Por otro lado, existen prácticas inadecuadas que suprimen las poblaciones de microorganismos benéficos, como son las aplicaciones innecesarias de agroquímicos, la sobredosificación de productos y el uso excesivo de fertilizantes sintéticos en forma de sales solubles y granulados, lo que se observó en las parcelas 2 y 6. Estas prácticas favorecen el incremento a largo plazo de los esclerocios, ante la ausencia de mecanismos de competencia (Delgadillo et al., 2002).
Pruebas en campo: tratamiento Trichoderma y tratamiento con control químico
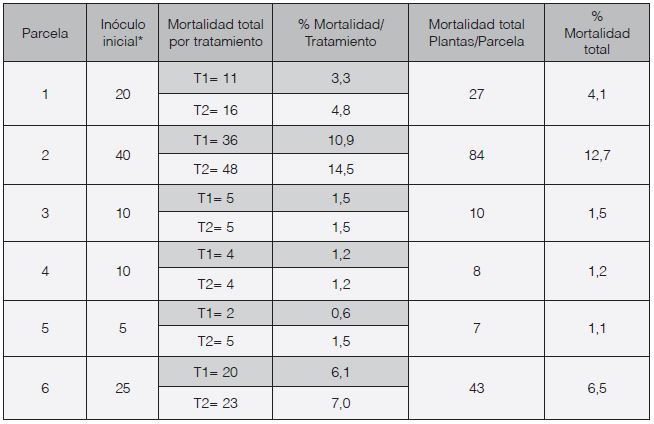
En la parcela 3, bajo el tratamiento T1 se logró reducir el conteo de esclerocios al final del ciclo de cultivo, en comparación con el inóculo inicial (día 0), mientras que en la parcela 6 se obtuvo una reducción bajo ambos tratamientos. Es importante destacar que en cuatro de las seis parcelas, al final del ciclo de cultivo se obtuvieron mejores resultados con el tratamiento de Trichoderma (T1). En las otras dos, la concentración de esclerocios por gramo fue la misma para ambos tratamientos (Cuadro 2, Figura 1 y Figura 2).
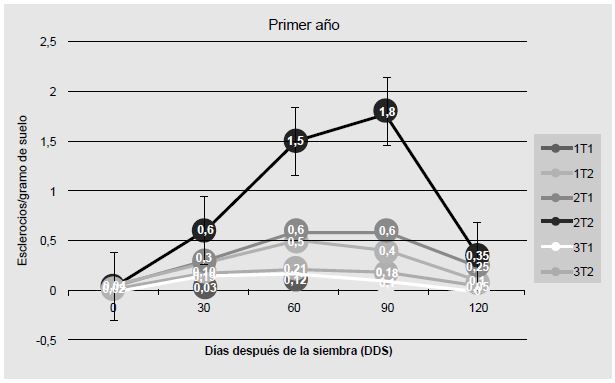
Figura 1 Concentración de esclerocios en cada parcela y bajo cada tratamiento (F: parcela; T1: tratamiento con Trichoderma, T2: tratamiento con químicos) a lo largo del ciclo de cultivo de 120 días. Año 1.
Cuadro 2 Comportamiento de la cantidad promedio de esclerocios/g de suelo a lo largo del ciclo de cultivo para las parcelas tratadas con Trichoderma (T1) y de manera convencional (T2).
| Número de parcela | TRATAMIENTO 1 Días después de la siembra | ||||
|---|---|---|---|---|---|
| 0 | 30 | 60 | 90 | 120 | |
| Promedio esclerocios por gramo de suelo | |||||
| 1 | 0,0200 | 0,0300 | 0,1200 | 0,1000 | 0,1000 |
| 2 | 0,0400 | 0,3000 | 0,6000 | 0,6000 | 0,2500 |
| 3 | 0,0100 | 0,1500 | 0,1800 | 0,1000 | 0.0001 |
| 4 | 0,1000 | 0,0500 | 0,1000 | 0,1000 | 0,1500 |
| 5 | 0.0500 | 0,3000 | 0,3500 | 0,1500 | 0,0500 |
| 6 | 0,2500 | 0,1500 | 0,4000 | 0,1500 | 0.0001 |
Lo anterior evidencia el potencial que posee la cepa de T. asperellum evaluada, como antagonista. Esto concuerda con numerosos autores que investigan este biocontrolador (Harman et al., 2004).
Las mayores concentraciones de esclerocios se dieron entre los 60 y 90 días. Los niveles más altos correspondieron a las etapas de formación y engrosamiento de los bulbos, lo que concuerda con lo encontrado por Ponce et al. (2008). También coincide con el momento en que se da el completo desarrollo del micelio del patógeno, que prefiere utilizar los bulbos como sitio principal de la infección, y con la formación de los esclerocios.
Se observó en cuatro parcelas que el tratamiento correspondiente al uso de fungicidas en los dos primeros meses presentó una mayor producción de esclerocios del patógeno y posteriormente provocó una caída drástica en los conteos. Por el contrario, el tratamiento con Trichoderma no presentó grandes aumentos en la concentración de esclerocios ni causó un descenso tan pronunciado como los fungicidas químicos (Figura 1 y Figura 2). Lo anterior demuestra su capacidad para el control de poblaciones de este patógeno de una forma menos agresiva que el tratamiento químico, lo que tiene repercusiones en el ecosistema del suelo, el ambiente y la salud humana y animal (McLean et al., 2001; Melero et al., 2000).
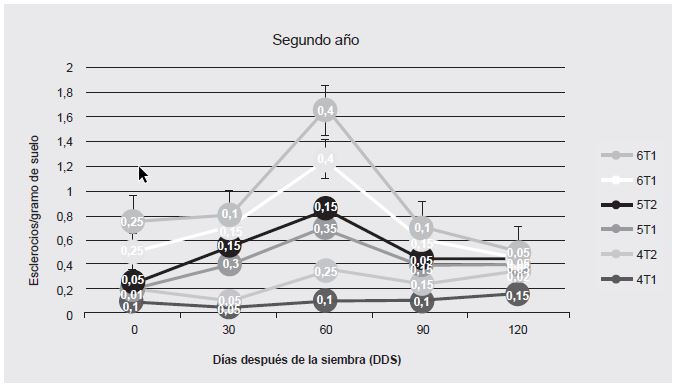
Figura 2 Concentración de esclerocios en cada parcela y bajo cada tratamiento (#: parcela; T1: tratamiento con Trichoderma, T2: tratamiento con químicos) a lo largo del ciclo de cultivo de 120 días. Año 2.
Los cambios en la concentración fueron más equilibrados en los conteos bajo el efecto del antagonismo biológico, aunque la cantidad final de esclerocios al término del ciclo de cultivo fue prácticamente la misma en ambos tratamientos. Este tipo de observaciones, producto de las interacciones entre el tratamiento y la cantidad de esclerocios, pueden dar indicaciones para el diseño y la evaluación de estrategias de control integrado de la enfermedad.
Para el análisis estadístico durante todo el ciclo de cultivo en los seis bloques y bajo los dos tratamientos, se realizó una comprobación de la normalidad de los datos mediante sus residuos, a través de la prueba Ryan-Joiner, y se obtuvo que no siguen el supuesto de una distribución normal (p= 0,01). Por este motivo, los datos se transformaron mediante Box-Cox y se comprobó su normalidad (p= 0.081).
El análisis de varianza posterior (Cuadro 3) demostró que no existieron diferencias entre la cantidad de esclerocios contados en cada uno de los tratamientos (p= 0.069), pero sí entre los conteos de los bloques (p= 0.000) y los días después de la siembra (p= 0.007).
Los resultados mostraron que las diferencias establecidas son influenciadas por el bloque (parcela) del que provenían, lo que se relaciona directamente con el inóculo inicial encontrado. Las propiedades internas de los esclerocios de S. cepivorum, como son la formación de estructuras secundarias y la latencia constitutiva y la exógena, juegan un papel fundamental en los factores de diseminación y en el aumento de la cantidad de los mismos al final de la cosecha (Coley et al., 1990). Lo anterior cobra importancia cuando se considera la interacción del tipo de tratamiento con los bloques (parcelas) y el nivel de inóculo inicial de cada uno. Y coincide con lo encontrado por otros autores (Metcalf et al., 2004; Rojas et al., 2010; Ulacio et al., 2003; Clarkson et al., 2006). El día 60 sobresale por la mayor producción de esclerocios, lo que coincide con el inicio de la formación de la cabeza del ajo, proceso que involucra la producción de mayor cantidad de nutrientes y sustancias que favorecen el crecimiento del patógeno.
Cuadro 3 Factores incluidos en el ANDEVA y comparación de medias realizadas con la prueba de Tukey.
| Factores analizados | |||||
|---|---|---|---|---|---|
| Bloque | Esclerocios/g de suelo | DDS | Esclerocios/g de suelo | Tratamiento | Esclerocios/g de suelo |
| A | 0.169 b1 | 0 | 0.078 b | Trichoderma | 0.565 a |
| B | 0.608 a | 30 | 0.196 ab | Químico | 0.636 a |
| C | 0.107 b | 60 | 0.396 a | - | - |
| D | 0.125 b | 90 | 0.323 ab | - | - |
| E | 0.135 b | 120 | 0.112 b | - | - |
| F | 0.185 b | - | - | - | - |
1Los valores con la misma letra en cada columna no difieren en la prueba de Tukey (p < 0.05).
En todas las parcelas y en cada mes evaluado, el tratamiento con Trichoderma siempre presentó conteos iguales o menores de esclerocios que el tratamiento con fungicidas químicos, lo que da una indicación de su efectividad. Los resultados obtenidos en la evaluación de la mortalidad por parcela y por tratamiento se presentan en el Cuadro 4. El análisis confirmó la efectividad de Trichoderma como tratamiento alternativo, al presentar un desempeño estadísticamente igual que el tratamiento químico utilizado.
En relación con la mortalidad, es importante hacer notar que el tratamiento 1 (con Trichoderma) siempre fue el que presentó igual o menor mortalidad en todas las parcelas. El porcentaje de mortalidad total es un factor importante que se puede relacionar con el inóculo inicial presente en esa parcela. Existe una relación lógica, marcada por el modelo de infección monocíclica, que determina que a mayor inóculo inicial, mayor debe ser la infección (x= QRt) (APS, 2014). En este caso, las concentraciones iniciales de inóculo de 10 esclerocios/g provocaron una pérdida de 1,5% del total de las plantas. Las densidades de inóculo inicial de 20 esclerocios/g causaron una mortalidad del 4,1%, y conteos de 40 esclerocios/g produjeron una mortalidad total del 12,7% de las plantas. La relación descrita pone de manifiesto la importancia de un manejo adecuado del inóculo inicial de cada parcela, con el fin de reducir las pérdidas totales que se pueden asociar a dicho nivel de infestación, lo que también ha sido confirmado en muchas investigaciones (Delgadillo et al., 2002; Crowe et al., 1979; Ponce et al., 2008).
Conclusiones
Se determinó que Trichoderma es una alternativa viable para el control del hongo Sclerotium cepivorum, ya que en el campo mostró una eficacia similar a los controles químicos más usados; esto se constató por el conteo de esclerocios y la mortalidad durante el cultivo.
Asimismo, se confirmó la importancia que tiene la cuantificación del inóculo inicial sobre el desarrollo de la enfermedad y la mortalidad asociada. Este aspecto se considera una herramienta valiosa para lograr una adecuada planificación por parte del productor y las autoridades sanitarias.
El uso de microorganismos como método alternativo para la sustitución de plaguicidas permite disminuir el impacto negativo de la agricultura sobre el ambiente y contribuir con su sostenibilidad, además de proporcionar métodos de cultivo más seguros para la salud de los trabajadores. Estas prácticas no solo se deben incentivar, sino también potenciar por medio de la investigación, para asegurar un óptimo control por parte de los microorganismos de las enfermedades a tratar y obtener los mejores resultados. En el caso de S. cepivorum, para su combate es fundamental determinar los tiempos de mayor producción de los propágulos, con el fin de enfocar las estrategias de control.
El uso de biocontroladores podría resultar en una disminución de costos para los productores de países que dispongan de producciones artesanales o industriales de microorganismos de alta calidad y precio moderado.